

Rivastigmine Milan

Pergunte a um médico sobre a prescrição de Rivastigmine Milan

Como usar Rivastigmine Milan
Folheto informativo para o utilizador
Rivastigmina Mylan, 4,6 mg/24 h, sistema transdérmico, adesivo
Rivastigmina Mylan, 9,5 mg/24 h, sistema transdérmico, adesivo
Rivastigmina
Antes de utilizar o medicamento, deve ler atentamente o conteúdo do folheto, pois contém informações importantes para o paciente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outras pessoas, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Rivastigmina Mylan e para que é utilizado
- 2. Informações importantes antes de utilizar o medicamento Rivastigmina Mylan
- 3. Como utilizar o medicamento Rivastigmina Mylan
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Rivastigmina Mylan
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Rivastigmina Mylan e para que é utilizado
A substância ativa do medicamento Rivastigmina Mylan é a rivastigmina.
A rivastigmina pertence a um grupo de substâncias conhecidas como inibidores da colinesterase. Em pacientes
com demência do tipo Alzheimer, há uma diminuição do número de células nervosas
no cérebro, o que causa uma diminuição da concentração de acetilcolina produzida por elas, sendo
um neurotransmissor (substância que permite a comunicação entre as células nervosas). A ação da rivastigmina
consiste em bloquear as enzimas que causam a degradação da acetilcolina: a acetilcolinesterase e a butirilcolinesterase. Bloqueando a ação dessas enzimas, a rivastigmina
permite aumentar a concentração de acetilcolina no cérebro, o que ajuda a aliviar os sintomas da doença
de Alzheimer.
O medicamento Rivastigmina Mylan é utilizado no tratamento de pacientes adultos com demência leve a moderada
do tipo Alzheimer, uma doença cerebral progressiva que afeta gradualmente a memória, as capacidades intelectuais e o comportamento.
2. Informações importantes antes de utilizar o medicamento Rivastigmina Mylan
Quando não utilizar o medicamento Rivastigmina Mylan
- se o paciente tiver alergia à rivastigmina (substância ativa do medicamento Rivastigmina Mylan) ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6);
- se o paciente tiver reação alérgica a medicamentos semelhantes (derivados da carbamamina);
- se o paciente tiver reação cutânea que ultrapassa a área da pele ocupada pelo adesivo, se a reação local se agravar (por exemplo, aparecerem bolhas, agravamento da inflamação da pele, inchaço) ou se essas alterações não desaparecerem dentro de 48 horas após a remoção do adesivo.
Se alguma dessas situações se aplicar ao paciente, deve informar o médico e não deve aplicar o adesivo Rivastigmina Mylan.
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Rivastigmina Mylan, deve discutir com o médico ou
farmacêutico se:
- o paciente tiver doenças cardíacas, como ritmo irregular ou lento, prolongamento do intervalo QT, prolongamento do intervalo QT na família, torsade de pointes, ou baixo nível de potássio ou magnésio no sangue;
- o paciente tiver insuficiência cardíaca;
- o paciente teve um ataque cardíaco no passado;
- o paciente tiver ou já teve baixo nível de potássio ou magnésio no sangue;
- o paciente teve um úlcera ativo no estômago;
- o paciente tiver ou já teve dificuldades para urinar;
- o paciente tiver ou já teve convulsões;
- o paciente tiver ou já teve asma ou doença respiratória grave;
- o paciente tiver tremores musculares;
- o paciente tiver baixo peso;
- o paciente tiver reações gastrointestinais, como náuseas (enjoo), vômitos e diarreia. O paciente pode desidratar (perder muito líquido), se os vômitos ou diarreia persistirem por um longo período;
- o paciente tiver distúrbios da função hepática.
Se alguma dessas situações se aplicar ao paciente, pode ser necessária uma observação mais cuidadosa do paciente pelo médico durante o tratamento com este medicamento.
Crianças e adolescentes
O medicamento Rivastigmina Mylan não é adequado para o tratamento da doença de Alzheimer em crianças e adolescentes.
Interacções com outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o paciente planeja tomar, incluindo os que são vendidos sem receita.
O medicamento Rivastigmina Mylan pode potencializar a ação de alguns medicamentos que reduzem a pressão arterial, como os "beta-bloqueadores", como o atenolol, "antagonistas dos canais de cálcio", como a amlodipina, nifedipina, "medicamentos antiarrítmicos", como o sotalol, amiodarona, glicosídeos digitálicos e pilocarpina (usada no tratamento do glaucoma). Isso pode levar a desmaios.
Deve ter cuidado ao utilizar o medicamento Rivastigmina Mylan com outros medicamentos que possam afetar o ritmo cardíaco ou o sistema de condução cardíaca (prolongamento do intervalo QT).
Se o paciente estiver tomando algum dos seguintes medicamentos, o médico pode realizar exames cardíacos regulares para garantir que o coração esteja funcionando corretamente:
- medicamentos usados no tratamento de distúrbios psiquiátricos, conhecidos como "medicamentos antipsicóticos", como a clorpromazina, levpromazina, sulpirida, amisulprida, tiaprida, veraliprida, pimozida, haloperidol, droperidol,
- cisaprida (usada no tratamento da dispepsia),
- citalopram (usado no tratamento da depressão),
- difemanil (usado no tratamento da úlcera péptica),
- halofantrina (usada no tratamento da malária),
- mizolastina (usada no tratamento da alergia),
- metadona (medicamento para aliviar a dor, também usado em pessoas dependentes de heroína),
- eritromicina i.v., pentamidina, moxifloxacina (antibióticos).
O medicamento Rivastigmina Mylan pode afetar a ação de medicamentos anticolinérgicos, alguns dos quais são usados para aliviar espasmos estomacais (por exemplo, dicicloverina), no tratamento da doença de Parkinson (por exemplo, amantadina), no tratamento da hiperatividade da bexiga (por exemplo, oxibutinina, tolterodina) ou na prevenção da doença do movimento (por exemplo, difenidramina, escopolamina ou meclizina).
Não deve usar o sistema transdérmico de Rivastigmina Mylan ao mesmo tempo que o metoclopramida (medicamento usado para aliviar ou prevenir náuseas e vômitos).
A ingestão concomitante desses dois medicamentos pode causar distúrbios, como rigidez dos membros e tremores das mãos.
Se o paciente for submeter a uma operação durante o tratamento com o medicamento Rivastigmina Mylan, deve informar o médico, pois pode ser necessário interromper o tratamento, pois o medicamento pode potencializar a ação de alguns relaxantes musculares administrados durante a anestesia.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de utilizar este medicamento.
Se a paciente estiver grávida, deve ser feita uma avaliação dos benefícios do tratamento com o medicamento Rivastigmina Mylan em relação aos possíveis efeitos do medicamento no feto. O medicamento Rivastigmina Mylan não deve ser utilizado durante a gravidez, a menos que seja absolutamente necessário.
Durante o tratamento com o medicamento Rivastigmina Mylan, não deve amamentar.
Condução de veículos e operação de máquinas
O médico informará o paciente se o seu estado permite a condução de veículos e a operação de máquinas. O medicamento Rivastigmina Mylan pode causar desmaios ou confusão intensa. Se o paciente se sentir fraco ou desorientado, não deve conduzir veículos, operar máquinas ou realizar outras tarefas que exijam concentração.
3. Como utilizar o medicamento Rivastigmina Mylan
Este medicamento deve ser utilizado sempre exatamente como prescrito pelo médico ou farmacêutico. Em caso de dúvidas, deve consultar o médico ou farmacêutico.
ATENÇÃO:
- Antes de aplicar UM NOVO adesivo, o adesivo anterior deve ser removido.
- Deve utilizar apenas UM adesivo de Rivastigmina Mylan por dia.
- Não deve cortar o adesivo em pedaços menores.
- Deve pressionar firmemente o adesivo com a palma da mão e segurar por pelo menos
30 segundos.
- Deve evitar tocar os olhos após aplicar o adesivo.
Como iniciar o tratamento
O médico informará o paciente sobre quais adesivos de Rivastigmina Mylan são mais adequados para o seu caso.
- O tratamento geralmente começa com o medicamento Rivastigmina Mylan 4,6 mg/24 h.
- A dose diária recomendada de Rivastigmina Mylan é de 9,5 mg/24 h. Se o estado do paciente não melhorar após pelo menos 6 meses, o médico pode considerar aumentar a dose para 13,3 mg/24 h (não é possível obter uma dose de 13,3 mg/24 h com este produto). Em caso de doenças que requeiram uma dose tão alta, deve consultar o farmacêutico.
- Deve aplicar apenas um adesivo de cada vez e deve trocá-lo por um novo a cada 24 horas.
Durante o tratamento, o médico pode ajustar a dose do medicamento de acordo com as necessidades do paciente.
Se o paciente não aplicou o adesivo por três dias ou mais, não deve aplicar o próximo adesivo até consultar o médico, pois pode estar mais propenso a efeitos não desejados. O tratamento pode ser retomado com a mesma dose, se a interrupção do tratamento não exceder três dias. Caso contrário, o médico pode recomendar continuar o tratamento com uma dose de 4,6 mg/24 h de Rivastigmina Mylan.
Onde aplicar o adesivo de Rivastigmina Mylan
- Antes de aplicar o adesivo, deve garantir que a pele no local de aplicação esteja limpa, seca e sem pelos, livre de pó, óleos, cremes hidratantes ou líquidos que possam impedir a aderência do adesivo, livre de cortes, erupções e (ou) irritações,
- Deve remover cuidadosamente todos os adesivos aplicados antes de aplicar um novo.A aplicação de vários adesivos na pele pode expor o paciente a uma dose excessiva de medicamento, o que pode ser perigoso.
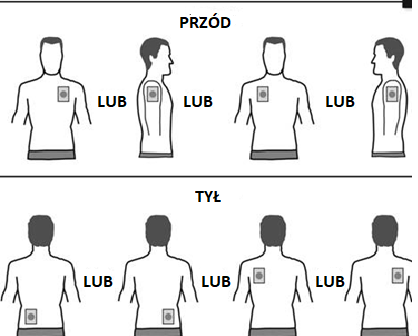
- Deve aplicar UM adesivo por dia em APENAS UM dos seguintes locais, como mostrado nas figuras:
- parte superior do braço esquerdo ouparte superior do braço direito
- parte superior do tórax à esquerda ouà direita (deve evitar aplicar adesivos no seio)
- parte superior das costas à esquerda ouà direita
- parte inferior das costas à esquerda ouà direita
Ao fim de 24 horas, deve remover o adesivo antigo antes de aplicar UM NOVO adesivo em APENAS UM dos locais mostrados.
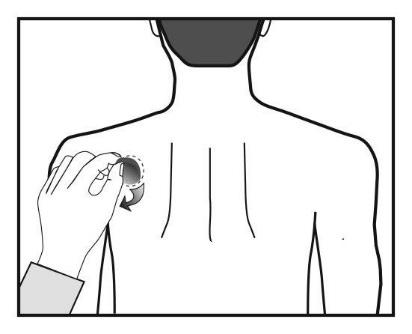
Ao trocar o adesivo, deve remover o adesivo do dia anterior antes de aplicar um novo adesivo em um local diferente (por exemplo, um dia no lado direito do corpo, e no dia seguinte, no lado esquerdo, um dia no tórax ou na parte superior do corpo, e no dia seguinte, na parte inferior das costas). Não deve aplicar o adesivo no mesmo local antes de decorridos 14 dias.
Como o paciente deve aplicar os adesivos de Rivastigmina Mylan
O medicamento Rivastigmina Mylan é um adesivo fino, marrom-claro, feito de material plástico, que é aplicado na pele. Cada adesivo está em uma embalagem de proteção selada. Não deve abrir a embalagem ou remover o adesivo da embalagem até o momento de aplicá-lo na pele.
Deve remover cuidadosamente o adesivo antes de aplicar um novo.
Pacientes que estão iniciando o tratamento (pela primeira vez) e
pacientes que estão retomando o tratamento com rivastigmina após uma interrupção,
devem começar com as etapas mostradas na segunda
figura.
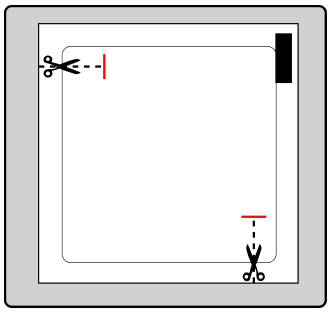
Cada adesivo está em uma embalagem de proteção selada. A embalagem deve ser aberta apenas antes de usar o adesivo.
Deve cortar a embalagem nos dois locais indicados pelas tesouras, mas não além da linha indicada. Deve perfurar a embalagem para abri-la. Não deve cortar a embalagem ao longo de toda a sua extensão, para evitar danificar o adesivo.
Deve remover o adesivo da embalagem.
Deve remover a proteção (de cor carne) da parte superior do adesivo
e jogá-la fora.
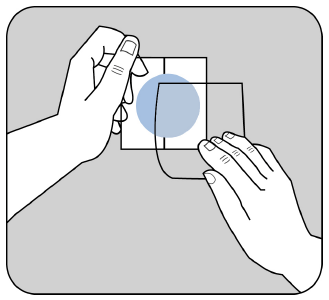
A face adesiva do adesivo é protegida por uma camada de proteção.
Deve remover uma parte da camada de proteção, sem tocar a face adesiva do adesivo.
Deve aplicar a face adesiva do adesivo na parte superior ou inferior das costas, na parte superior do braço ou no tórax,
e, em seguida, remover a segunda parte da camada de proteção.
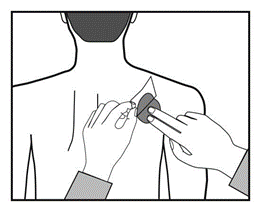
Deve pressionar firmemente o adesivo com a palma da mão por pelo menos 30 segundos,
certificando-se de que as bordas estão bem aderidas à pele.
Agora pode assinar o adesivo com um marcador, por exemplo, com o nome do dia da semana.
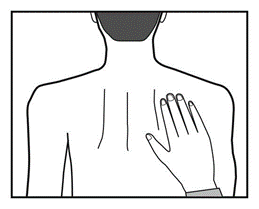
Deve usar o adesivo continuamente até o momento de trocá-lo por um novo. O paciente pode experimentar diferentes locais de aplicação do novo adesivo (escolhendo entre os locais indicados acima), para escolher o local mais conveniente e menos propenso a ser danificado pela roupa.
Como o paciente deve remover o adesivo de Rivastigmina Mylan
Deve puxar suavemente uma borda do adesivo e remover o adesivo da pele lentamente. Se houver resíduos de adesivo na pele, pode removê-los lavando a área com água morna e sabonete suave ou óleo infantil. Não deve usar álcool ou outros solventes (removedor de esmalte, etc.).
Lavagem das mãos
Após remover ou aplicar o adesivo, deve lavar as mãos com água e sabonete. Em caso de contato do medicamento com os olhos ou vermelhidão ocular após o contato com o adesivo, deve enxaguar os olhos com muita água e, se os sintomas não desaparecerem, deve consultar o médico.
O paciente pode usar os adesivos de Rivastigmina Mylan durante o banho, natação ou exposição ao sol?
- O banho, natação ou chuveiro não devem afetar a ação do adesivo. Deve garantir que o adesivo não se solte durante essas atividades.
- Não deve expor o adesivo a fontes externas de calor por um longo período (por exemplo, exposição excessiva ao sol, sauna, solário).
O que fazer se o adesivo se soltar
Se o adesivo se soltar, deve aplicar um novo adesivo para o resto do dia e, em seguida, trocá-lo no dia seguinte, como de costume.
Quando e por quanto tempo o paciente deve usar os adesivos de Rivastigmina Mylan
- Para que o tratamento seja eficaz, deve aplicar um novo adesivo todos os dias, preferencialmente no mesmo horário todos os dias.
- Deve aplicar apenas um adesivo de Rivastigmina Mylan de cada vez e trocá-lo por um novo a cada 24 horas.
Uso de dose maior do que a recomendada de Rivastigmina Mylan
Se o paciente aplicar acidentalmente mais de um adesivo, deve remover todos os adesivos,
e, em seguida, informar o médico sobre a aplicação acidental de mais de um adesivo. O paciente
pode precisar de atendimento médico.
Em alguns pacientes que aplicaram acidentalmente uma dose excessiva de rivastigmina, ocorreram
redução do tamanho das pupilas (miose), vermelhidão da pele e sensação de calor (ondas de calor), dor abdominal, náuseas, vômitos, diarreia, batimento cardíaco lento, dificuldades respiratórias súbitas (broncoespasmo), produção aumentada de muco, suor aumentado, perda de controle das funções corporais, choro, pressão arterial baixa, salivação aumentada, tontura, tremores, dor de cabeça, sonolência, confusão, pressão arterial alta, alucinações e falta de energia. Em casos graves, foram observados fraqueza muscular, espasmos musculares, convulsões e parada ou redução da respiração.
Omissão da dose de Rivastigmina Mylan
Se o paciente esquecer de aplicar o adesivo, deve imediatamenteaplicá-lo. O próximo adesivo pode ser aplicado no horário usual do dia seguinte. Não deve aplicar dois adesivos para compensar a dose omitida.
Interrupção do tratamento com Rivastigmina Mylan
Se o paciente interromper o tratamento, deve informar o médico ou farmacêutico.
Se o paciente não aplicar o adesivo por três dias ou mais, não deve aplicar um novo adesivo antes de consultar o médico, pois é mais provável que ocorram efeitos não desejados.
Se tiver mais alguma dúvida sobre o uso deste medicamento, deve consultar o médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Os efeitos não desejados ocorrem com mais frequência no início do tratamento ou durante o período de aumento da dose. Os efeitos não desejados geralmente desaparecem lentamente, à medida que o organismo se adapta ao tratamento.
Se ocorrer algum dos efeitos não desejados listados a seguir, deve remover o adesivo e informar imediatamente o médico, pois esses efeitos podem ser graves:
- convulsões
- alterações no ritmo cardíaco, que podem ser observadas como batimento cardíaco muito rápido ou sensação de batimentos cardíacos perdidos
- úlceras gástricas (o paciente pode ter dor abdominal e vômitos que contenham sangue fresco ou pareçam conter borras de café)
- pancreatite - os sintomas são dor forte na parte superior do abdômen, frequentemente com náuseas ou vômitos
- sensação intensa de confusão, que pode estar associada à visão, audição ou percepção de coisas que não existem (alucinações), perda de contato com a realidade (delírios) e aumento ou diminuição da atividade (delirium)
- distúrbios da função hepática (o paciente pode ter icterícia, olhos amarelados, urina escura anormal ou náuseas de causa desconhecida, vômitos, fadiga e perda de apetite)
Outros efeitos não desejados:
Comuns(podem afetar 1 em 10 pacientes):
- dor de cabeça
- falta ou perda de apetite, perda de peso
- sensação de ansiedade, depressão, tontura
- desmaios
- náuseas, vômitos, diarreia, dispepsia/azia, dor abdominal
- agitação, fadiga, fraqueza geral, febre
- erupções cutâneas e reações alérgicas cutâneas, como reações semelhantes ao eczema, vermelhidão, coceira, inchaço e irritação
- infecção urinária (pode ocorrer dor ao urinar ou urinar com mais frequência do que o normal)
- incontinência urinária (incapacidade de segurar a urina)
Menos comuns(podem afetar 1 em 100 pacientes):
- problemas cardíacos, como batimento cardíaco lento
- desidratação (perda excessiva de líquidos)
- agitação (nível alto de atividade, ansiedade)
- agressividade
Raros(podem afetar 1 em 1000 pacientes):
- desmaios
Muito raros(podem afetar 1 em 10 000 pacientes):
- rigidez dos membros ou pernas, agitação, espasmos musculares, tremores, como tremores das mãos
Frequência não conhecida(frequência não pode ser estimada com base nos dados disponíveis):
- reação alérgica, como bolhas ou inflamação da pele, coceira, urticária ou vermelhidão
- agravamento dos sintomas da doença de Parkinson - como tremores, rigidez, sonolência e arrastar os pés
- batimento cardíaco rápido
- pressão arterial alta
- alterações nos resultados dos exames de função hepática
- sensação de ansiedade
- visão ou audição de coisas que não existem (alucinações)
- pesadelos
Outros efeitos não desejados observados com a rivastigmina em forma de cápsulas ou solução oral, que podem ocorrer com os adesivos:
Comuns(podem afetar 1 em 10 pacientes):
- mau estado geral
- sensação de confusão
- suor aumentado
Raros(podem afetar 1 em 1000 pacientes):
- úlcera intestinal
- dor no peito - pode ser causada por espasmo dos vasos coronários
Muito raros(podem afetar 1 em 10 000 pacientes):
- sangramento gastrointestinal - manifestado como sangue nas fezes ou vômitos
Frequência não conhecida(frequência não pode ser estimada com base nos dados disponíveis):
- vômitos violentos, que podem levar à ruptura do esôfago
Notificação de efeitos não desejados
Se ocorrer algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Medicamentos do Ministério da Saúde
Al. Jerozolimskie 181C
02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
site na internet: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização. A notificação de efeitos não desejados permite coletar mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Rivastigmina Mylan
Deve conservar o medicamento em um local seguro e fora do alcance das crianças.
Não deve usar este medicamento após o prazo de validade impresso na embalagem e no sachê após "Prazo de validade (EXP)". O prazo de validade é o último dia do mês indicado.
Não há recomendações especiais para a conservação do produto.
Antes de usar o adesivo, deve conservá-lo no sachê.
Não deve usar o adesivo se estiver danificado ou tiver sinais de abertura.
Após remover o adesivo, deve dobrá-lo ao meio com a face adesiva para dentro e pressioná-lo firmemente. Deve colocar o adesivo usado no sachê e, em seguida, jogá-lo fora em um local inacessível às crianças. Após remover o adesivo, não deve tocar os olhos com os dedos antes de lavá-los com água e sabonete.
Não deve jogar os medicamentos no esgoto ou em lixeiras domésticas. Deve perguntar ao farmacêutico como eliminar os medicamentos que não são mais necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Rivastigmina Mylan
- A substância ativa do medicamento é a rivastigmina.
- Rivastigmina Mylan 4,6 mg/24 h sistemas transdérmicos: cada adesivo libera 4,6 mg de rivastigmina em 24 horas. O adesivo tem uma área de 4,6 cm e contém 6,9 mg de rivastigmina.
- Rivastigmina Mylan 9,5 mg/24 h sistemas transdérmicos: cada adesivo libera 9,5 mg de rivastigmina em 24 horas. O adesivo tem uma área de 9,2 cm e contém 13,8 mg de rivastigmina.
- Os outros componentes são: Copolímero de acrilato de 2-etilhexilo e acetato de vinila Poliisobuteno de massa molar média Poliisobuteno de massa molar alta Dióxido de silício anidro Parafina líquida leve
Camada externa:
Poliéster/liga termoplástica/Alumínio revestido com poliéster
Camada de proteção (removível):
Poliéster revestido com polímero fluorado
Tinta laranja
Como é o medicamento Rivastigmina Mylan e o que contém a embalagem
Cada sistema transdérmico é um adesivo fino. Na camada externa, clara, que cobre o adesivo, há uma inscrição impressa com tinta laranja:
- “RIV-TDS 4.6 mg/24 h”
- “RIV-TDS 9.5 mg/24 h”
Cada adesivo está em um sachê individual selado. Os adesivos estão disponíveis em embalagens contendo 7 ou 30 sachês, bem como em embalagens coletivas contendo 60 ou 90 sachês. Nem todos os tamanhos de embalagem precisam estar disponíveis.
Titular da autorização de comercialização
Viatris Limited
Damastown Industrial Park
Mulhuddart, Dublin 15
DUBLIN
Irlanda
Fabricante
McDermott Laboratories Ltd. T/A Gerard Laboratories T/A Mylan Dublin
35/36 Baldoyle Industrial Estate
Grange Road, Dublin 13
Irlanda
Mylan Hungary Kft
H-2900 Komárom
Mylan utca 1
Hungria
Luye Pharma AG
Am Windfeld 35, 83714 Miesbach,
Alemanha
Para obter mais informações sobre o medicamento e seus nomes nos países membros do Espaço Econômico Europeu, deve consultar o representante do titular da autorização de comercialização:
Viatris Healthcare, Lda.
Tel: +48 22 546 64 00
Data da última atualização do folheto: maio de 2024
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorLuye Pharma AG McDermott Laboratories Limited t/a Gerard Laboratories t/a Mylan Dublin Mylan Hungary Kft.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Rivastigmine MilanForma farmacêutica: Sistema, 4,6 mg/24 hSubstância ativa: rivastigmineFabricante: Luye Pharma AGRequer receita médicaForma farmacêutica: Sistema, 9,5 mg/24 hSubstância ativa: rivastigmineFabricante: Luye Pharma AGRequer receita médicaForma farmacêutica: Sistema, 4,6 mg/24 hSubstância ativa: rivastigmineRequer receita médica
Alternativas a Rivastigmine Milan noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Rivastigmine Milan em Испания
Alternativa a Rivastigmine Milan em Украина
Médicos online para Rivastigmine Milan
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Rivastigmine Milan – sujeita a avaliação médica e regras locais.











