
Ondansetron Bluefish

Pergunte a um médico sobre a prescrição de Ondansetron Bluefish

Como usar Ondansetron Bluefish
Folheto informativo para o utilizador
Ondansetron Bluefish, 4 mg comprimidos bucodispersíveis
Ondansetron Bluefish, 8 mg comprimidos bucodispersíveis
Ondansetron
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Ondansetron Bluefish e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Ondansetron Bluefish
- 3. Como tomar o medicamento Ondansetron Bluefish
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Ondansetron Bluefish
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Ondansetron Bluefish e para que é utilizado
O medicamento Ondansetron Bluefish é apresentado sob a forma de comprimido bucodispersível que se dissolve rapidamente após a colocação na língua. O medicamento Ondansetron Bluefish contém ondansetron, que pertence a um grupo de medicamentos que inibem o enjoo e os vómitos, conhecidos como medicamentos antieméticos.
- -no tratamento do enjoo e dos vómitos induzidos por quimioterapia citotóxica em crianças e adultos;
- -na prevenção do enjoo e dos vómitos no período pós-operatório em crianças e adultos;
- -no tratamento do enjoo e dos vómitos induzidos por radioterapia em adultos.
Se o paciente tiver dúvidas sobre por que este medicamento lhe foi prescrito, deve contactar o médico.
2. Informações importantes antes de tomar o medicamento Ondansetron Bluefish
Quando não tomar o medicamento Ondansetron Bluefish
- se o paciente for alérgico ao ondansetron ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6);
- se o paciente estiver a tomar apomorfina (utilizada no tratamento da doença de Parkinson).
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Ondansetron Bluefish, deve discutir com o médico, farmacêutico ou enfermeiro
- se a paciente estiver grávida ou planeia engravidar em breve;
- se a paciente estiver a amamentar;
- se o paciente tiver doença hepática;
- se o paciente tiver intestino obstruído ou se o paciente apresentar constipação severa;
- em crianças com menos de 2 anos ou com área de superfície corporal inferior a 0,6 m
Interacções com outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar, como fenitoína, carbamazepina, rifampicina, tramadol.
Gravidez e amamentação
Não deve tomar o medicamento Ondansetron Bluefish durante o primeiro trimestre da gravidez. Isto porque o medicamento Ondansetron Bluefish pode aumentar ligeiramente o risco de ocorrência de fissura labial e/ou palatina [abertura ou fenda no lábio superior e/ou palato]. Se a paciente estiver grávida, suspeitar de gravidez ou planeia engravidar, antes de tomar o medicamento Ondansetron Bluefish, deve consultar o médico ou farmacêutico. Se a paciente for uma mulher em idade fértil, pode ser aconselhada a usar uma contracepção eficaz.
Condução de veículos e utilização de máquinas
O medicamento Ondansetron Bluefish não afeta a capacidade de conduzir veículos ou utilizar máquinas.
O medicamento Ondansetron Bluefish contém aspartamo, glucose, maltodextrina, sorbitol, dióxido de enxofre
e sódio
O medicamento Ondansetron Bluefish contém aspartamo (E 951). O medicamento contém 0,88 mg de aspartamo em cada comprimido bucodispersível de 4 mg e 1,76 mg de aspartamo em cada comprimido bucodispersível de 8 mg. O aspartamo é uma fonte de fenilalanina. Pode ser prejudicial para pacientes com fenilcetonúria. É uma doença genética rara, na qual a fenilalanina se acumula no organismo devido à sua eliminação anormal.
O medicamento Ondansetron Bluefish contém sorbitol (E 420). O medicamento contém 8,4 mg de sorbitol em cada comprimido bucodispersível de 4 mg e 16,9 mg de sorbitol em cada comprimido bucodispersível de 8 mg.
O medicamento Ondansetron Bluefish contém glucose e maltodextrina. Se o paciente tiver intolerância a certains açúcares, deve contactar o médico antes de tomar este medicamento. Pode afetar negativamente os dentes.
O medicamento Ondansetron Bluefish contém dióxido de enxofre (E 220). O medicamento pode causar, raramente, reacções graves de hipersensibilidade e broncoespasmo.
O medicamento Ondansetron Bluefish contém sódio. O medicamento contém menos de 1 mmol (23 mg) de sódio por comprimido bucodispersível, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar o medicamento Ondansetron Bluefish
Este medicamento deve ser sempre utilizado de acordo com as recomendações do médico. Em caso de dúvidas, deve contactar o médico ou farmacêutico.
Após o início do tratamento:
A ação do medicamento Ondansetron Bluefish deve começar dentro de 1 ou 2 horas após a administração da dose.
Se o paciente apresentar enjoo dentro de uma hora após a administração da dose do medicamento, deve tomar novamente a mesma dose. Se o enjoo ocorrer mais de uma hora após a administração do medicamento, não deve tomar mais comprimidos do que o recomendado no folheto. Se o enjoo persistir, deve contactar o médico.
Tratamento e prevenção do enjoo e dos vómitos induzidos por quimioterapia ou radioterapia:
Adultos:
8 mg 1 a 2 horas antes do início da quimioterapia ou radioterapia, e subsequentemente 8 mg a cada 12 horas durante 5 dias. O médico pode recomendar a administração da primeira dose por injeção.
Pacientes idosos:
A posologia é a mesma que a dos adultos.
Uso em crianças (a partir de 2 anos de idade) e jovens (<18 anos):< h4>
A dose é determinada individualmente e depende do tamanho/área de superfície corporal da criança. Não deve ser utilizado o medicamento Ondansetron Bluefish em crianças com área de superfície corporal inferior a 0,6 m
Crianças com mais de 6 meses e jovens
- Normalmente, a dose utilizada é de até 4 mg duas vezes ao dia
- O medicamento pode ser administrado durante 5 dias
Tratamento e prevenção do enjoo e dos vómitos no período pós-operatório:
Adultos, tratamento e prevenção:
16 mg 1 hora antes da cirurgia ou alternativamente 8 mg 1 hora antes da anestesia, e subsequentemente duas doses adicionais de 8 mg em intervalos de 8 horas. O médico pode recomendar a administração da primeira dose por injeção.
Pacientes idosos, tratamento e prevenção:
A experiência com o uso de ondansetrona em pacientes idosos é limitada.
O ondansetron é bem tolerado por pacientes idosos que recebem quimioterapia (ver acima).
Pacientes com disfunção hepática ligeira ou moderada:
A dose diária total não deve exceder 8 mg.
Pacientes com metabolismo lento da esparteína e da debrisoquina:
Não é necessária a alteração da dose ou da frequência de administração do medicamento.
Os comprimidos devem ser tomados da seguinte forma:
Não deve remover os comprimidos do medicamento Ondansetron Bluefish do blister ou perfurar a folha até o momento de tomar o medicamento.
É importante não empurrar o comprimido para fora do seu compartimento para evitar quebrá-lo (Fig. A).
Em cada blister, os comprimidos estão separados uns dos outros por uma perfuração.
Deve separar o compartimento com um comprimido ao longo da perfuração (Fig.1).
Deve remover cuidadosamente a folha de proteção.
A folha de proteção deve ser removida do canto marcado com uma seta (Fig.2 e 3).
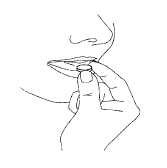
Deve remover o comprimido do pacote com as mãos secas e colocá-lo na língua (Fig. 4).
Quando o comprimido se dissolver, pode engoli-lo com um pouco de água.
Fig. A.
Fig. 1.
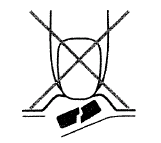
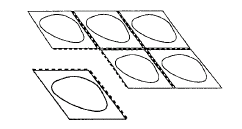
Fig. 2.
Fig. 3.
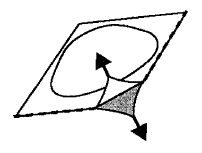
Fig. 4.
Uso de dose maior do que a recomendada do medicamento Ondansetron Bluefish
Se o paciente adulto ou criança tomar uma dose maior do que a recomendada do medicamento Ondansetron Bluefish, deve contactar imediatamente o médico ou ir ao hospital.
Deve levar o pacote do medicamento com si.
Omissão da dose do medicamento Ondansetron Bluefish
Não deve tomar uma dose dupla para compensar a dose omitida.
Se o paciente esquecer uma dose do medicamento e apresentar enjoo e vómitos, deve tomar o medicamento Ondansetron Bluefish o mais rápido possível e tomar as doses subsequentes como antes.
Se o paciente esquecer uma dose do medicamento e não apresentar enjoo e vómitos, deve tomar a próxima dose como indicado no folheto.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não em todos os pacientes.
Alguns pacientes podem ser alérgicos a certos medicamentos.
Se algum dos efeitos não desejados listados abaixo ocorrer logo após a administração do medicamento Ondansetron Bluefish, deve interromper o tratamento e contactar imediatamente o médico:
- Respiração súbita e dor ou sensação de pressão no peito
- Edema de pálpebras, face, lábios, boca ou língua
- Erupção cutânea - manchas vermelhas ou urticária (pápulas na pele) em qualquer parte do corpo
- Choque
Outros efeitos não desejados possíveis:
Muito frequentes(podem ocorrer em mais de 1 em 10 pessoas)
- Dor de cabeça.
Frequentes(podem ocorrer em até 1 em 10 pessoas)
- Constipação.
- Sensação de calor ou rubor.
Pouco frequentes(podem ocorrer em até 1 em 100 pessoas)
- Distúrbios do ritmo cardíaco, dor no peito com ou sem depressão do segmento ST, bradicardia.
- Aumento assintomático da atividade das enzimas hepáticas.
- Foram observados convulsões, distúrbios do movimento, incluindo sintomas extrapiramidais, como reações distônicas, crises de olhar forçado com rotação dos globos oculares e distúrbios dos movimentos voluntários sem efeito clinicamente significativo no paciente.
- Soluço.
- Hipotensão.
Raros(podem ocorrer em até 1 em 1000 pessoas)
- Reações de hipersensibilidade imediata, por vezes graves, incluindo reações anafiláticas.
- Tontura durante a administração intravenosa, que na maioria dos casos pode ser prevenida ou revertida prolongando o tempo de infusão.
- Distúrbios visuais transitórios (por exemplo, visão turva) durante a administração intravenosa.
Muito raros(podem ocorrer em até 1 em 10 000 pessoas)
- -Perda transitória da visão, principalmente durante a administração intravenosa.
Na maioria dos casos, a cegueira reverteu dentro de 20 minutos.
A maioria dos pacientes estava a receber quimioterapia, incluindo cisplatina.
Em alguns casos, a perda transitória da visão foi descrita como de origem coroidal.
O aroma de morango contém dióxido de enxofre (E220), que pode causar, raramente, reações graves de hipersensibilidade e broncoespasmo.
Se algum efeito não desejado se agravar ou ocorrer algum efeito não desejado não mencionado neste folheto, deve informar o médico ou farmacêutico.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro.
Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde, IP, Rua Luís Pastor de Macedo, n.º 3, r/c, 1500-385 Lisboa, Tel.: +351 21 798 73 00, Fax: +351 21 798 73 99, Site: https://www.infarmed.pt
Os efeitos não desejados também podem ser notificados ao titular da autorização de introdução no mercado.
A notificação de efeitos não desejados pode ajudar a recolher mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Ondansetron Bluefish
Deve conservar o medicamento em local não visível e inacessível às crianças.
Deve conservar o medicamento no pacote original para protegê-lo da luz.
Deve conservar o medicamento a uma temperatura inferior a 30°C.
Não deve utilizar este medicamento após o prazo de validade impresso na caixa ou na folha após "Prazo de validade" ou "EXP".
O prazo de validade é o último dia do mês indicado.
Não deve utilizar este medicamento se houver sinais de deterioração, como descoloração ou quebra dos comprimidos.
Os medicamentos não devem ser eliminados na canalização ou em contentores de lixo doméstico.
Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são utilizados.
Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Ondansetron Bluefish
- -A substância ativa do medicamento é ondansetron.Cada comprimido bucodispersível contém 4 mg ou 8 mg de ondansetron.
- -Os outros componentes são aspartamo (E 951), crospovidona tipo B, estearato de magnésio, celulose microcristalina, Pharmaburst TM C1 (contendo manitol (E 421), sorbitol (E 420), crospovidona (tipo A) e dióxido de silício coloidal hidratado), aroma de morango [(contendo glucose, maltodextrina de milho, maltodextrina de batata, goma arábica (2,3%) e dióxido de enxofre (E 220)], fumarato de sódio.
Como é o medicamento Ondansetron Bluefish e que conteúdo tem o pacote
Comprimidos bucodispersíveis.
Ondansetron Bluefish 4 mg e 8 mg são apresentados sob a forma de comprimidos brancos, planos, redondos com bordos obliquos.
Ondansetron Bluefish está disponível em pacotes contendo 6 x 1, 10 x 1, 14 x 1, 20 x 1, 30 x 1, 50 x 1, 60 x 1, 100 x 1 comprimidos em blisters unitários OPA/Alumínio/PVC/Alumínio.
Nem todos os tamanhos de pacotes podem estar disponíveis.
Titular da autorização de introdução no mercado
Bluefish Pharmaceuticals AB
P.O. Box 49013
100 28 Estocolmo
Suécia
Fabricante
Bluefish Pharmaceuticals AB
Gävlegatan 22
113 30 Estocolmo
Suécia
Sofarimex Industria Química e Farmacêutica S.A.
Av. das Indústrias- Alto do Colaride
Cacém, 2735-213
Portugal
O folheto para o paciente para pessoas cegas e com baixa visão será produzido em outros formatos a pedido.
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia sob as seguintes denominações:
| País Membro | Nome do medicamento |
| Dinamarca | Ondansetron Bluefish 4 mg/ 8 mg smeltetabletter |
| Finlândia | Ondansetron Bluefish 4 mg/ 8 mg tabletti, suussa hajoava |
| Finlândia | Ondansetron Bluefish 4 mg/ 8 mg munsönderfallande tabletter |
| Espanha | Ondansetron Bluefish 4 mg/ 8 mg comprimidos bucodispersibles EFG |
| Alemanha | Ondansetron Bluefish 4 mg/ 8 mg schmelztabletten |
| Noruega | Ondansetron Bluefish 4 mg/ 8 mg smeltetabletter |
| Polónia | Ondansetron Bluefish |
| Suécia | Ondansetron Bluefish 4 mg/ 8 mg munsönderfallande tabletter |
| Reino Unido | Ondansetron 4 mg/ 8 mg orodispersible tablets |
Data da última revisão do folheto:24.11.2020
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBluefish Pharmaceuticals AB Sofarimex Industria Quimica e Farmaceutica S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Ondansetron BluefishForma farmacêutica: Comprimidos, 8 mgSubstância ativa: ondansetronFabricante: Egis Pharmaceuticals PLCRequer receita médicaForma farmacêutica: Solução, 2 mg/mlSubstância ativa: ondansetronRequer receita médicaForma farmacêutica: Solução, 4 mgSubstância ativa: ondansetronRequer receita médica
Alternativas a Ondansetron Bluefish noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Ondansetron Bluefish em Espanha
Alternativa a Ondansetron Bluefish em Ukraine
Médicos online para Ondansetron Bluefish
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Ondansetron Bluefish – sujeita a avaliação médica e regras locais.














