
Como usar Okteva
Folheto informativo: informação para o doente
Okteva, 10 mg, pó e solvente para suspensão para injeção de libertação prolongada
de libertação prolongada
Okteva, 20 mg, pó e solvente para suspensão para injeção de libertação prolongada
Okteva, 30 mg, pó e solvente para suspensão para injeção de libertação prolongada
octreotida
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si. Não o deve dar a outros. O medicamento pode ser prejudicial ao outro, mesmo que os sintomas da sua doença sejam iguais.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Okteva e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Okteva
- 3. Como tomar o medicamento Okteva
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Okteva
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Okteva e para que é utilizado
O medicamento Okteva é um derivado sintético da somatostatina, uma substância que ocorre no organismo humano e que inibe a ação de certos hormônios, como o hormônio do crescimento. O medicamento Okteva actua mais fortemente do que a somatostatina e o seu efeito dura mais tempo.
O medicamento Okteva é utilizado
- no tratamento da acromegalia, uma doença na qual o organismo produz demasiado hormônio do crescimento. Em pessoas saudáveis, o hormônio do crescimento afecta o crescimento dos tecidos, órgãos e ossos. Uma quantidade excessiva de hormônio do crescimento pode causar o aumento do tamanho dos ossos e tecidos, especialmente das mãos e pés. O Okteva alivia significativamente os sintomas da acromegalia, que incluem dores de cabeça, transpiração excessiva, formigamento nas mãos e pés, fadiga e dores nas articulações. Na maioria dos casos, a produção excessiva de hormônio do crescimento é causada pelo aumento da glândula pituitária (adenoma pituitário); o tratamento com o medicamento Okteva pode reduzir o tamanho do adenoma.
O medicamento Okteva é utilizado no tratamento de doentes com acromegalia:
- que não podem ser tratados com outros tipos de tratamento para a acromegalia (cirurgia ou radioterapia) ou que não respondem a esses tratamentos;
- após radioterapia, durante o período de transição, antes de o tratamento com radioterapia ter um efeito completo;
- para aliviar os sintomas associados à produção excessiva de certos hormônios e outras substâncias semelhantes pelo estômago, intestinos e pâncreas; A produção excessiva de hormônios e outras substâncias naturais pode ser causada por certas doenças raras do estômago, intestinos ou pâncreas. Isso perturba o equilíbrio hormonal natural do organismo e é a causa de muitos sintomas, como rubor facial, diarreia, baixa pressão arterial, erupções cutâneas e perda de peso. O tratamento com o medicamento Okteva ajuda a aliviar esses sintomas:
- no tratamento de tumores neuroendócrinos localizados nos intestinos (por exemplo, no apêndice, intestino delgado ou cólon); Os tumores neuroendócrinos são tumores raros localizados em diferentes partes do organismo. O medicamento Okteva também é utilizado para inibir o crescimento desses tumores, se estiverem localizados nos intestinos (por exemplo, no apêndice, intestino delgado ou cólon);
- no tratamento de tumores pituitários que produzem demasiado hormônio tireotrópico (TSH); Uma quantidade excessiva de hormônio tireotrópico (TSH) pode causar hipertireoidismo. O medicamento Okteva é utilizado em doentes com tumores pituitários que produzem demasiado hormônio tireotrópico (TSH):
- quando outros tipos de tratamento (cirurgia ou radioterapia) não são apropriados ou não são eficazes;
- após radioterapia, durante o período de transição, antes de o tratamento com radioterapia ter um efeito completo.
2. Informações importantes antes de tomar o medicamento Okteva
Deve seguir todas as instruções do médico. Podem ser diferentes das informações contidas neste folheto.
Deve ler as seguintes informações antes de tomar o medicamento Okteva.
Quando não tomar o medicamento Okteva:
- se o doente tiver alergia à octreotida ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Precauções e advertências
Antes de começar a tomar o medicamento Okteva, deve discutir com o médico:
- se o doente souber que tem ou teve pedras nos rins no passado; ou se ocorrerem complicações, como febre, calafrios, dor abdominal ou icterícia; deve informar o médico, pois o tratamento prolongado com o medicamento Okteva pode causar a formação de pedras nos rins. O médico pode prescrever controles regulares da vesícula biliar;
- se o doente tiver diabetes, pois o medicamento Okteva pode afectar os níveis de açúcar no sangue. Se o doente tiver diabetes, os níveis de açúcar no sangue devem ser controlados regularmente;
- se o doente tiver tido níveis baixos de vitamina B no passado, o médico pode prescrever controles regulares dos níveis de vitamina B.
Exames e controles
Se o doente estiver a tomar o medicamento Okteva por um longo período, o médico pode prescrever controles regulares da função da tiróide.
O médico vai controlar a função do fígado do doente.
O médico pode prescrever a verificação da actividade das enzimas pancreáticas.
Crianças
A experiência com o uso do medicamento Okteva em crianças é limitada.
Okteva e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar actualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Em geral, é possível continuar a tomar outros medicamentos durante o tratamento com o medicamento Okteva.
No entanto, foi relatado que o Okteva afecta a ação de certos medicamentos, como a cimetidina, ciclosporina, bromocriptina, quinidina e terfenadina.
Se o doente estiver a tomar um medicamento para reduzir a pressão arterial (por exemplo, um betabloqueador ou um antagonista do cálcio) ou um medicamento para manter o equilíbrio de líquidos e eletrólitos, o médico pode ajustar a dose.
Em doentes com diabetes, pode ser necessário ajustar a dose de insulina pelo médico.
Se o doente estiver a receber tratamento com oxsodotrotida de lutécio (Lu), terapia radiofarmacêutica, o médico pode interromper e/ou ajustar o tratamento com o medicamento Okteva por um curto período de tempo.
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar ter um filho, deve consultar o médico antes de tomar este medicamento.
O medicamento Okteva só deve ser utilizado durante a gravidez se estritamente necessário.
Condução de veículos e utilização de máquinas
O medicamento Okteva não tem ou tem um efeito insignificante na capacidade de conduzir veículos ou utilizar máquinas. No entanto, certos efeitos não desejados que podem ocorrer durante o tratamento com o medicamento Okteva, como dores de cabeça e fadiga, podem reduzir a capacidade do doente de conduzir veículos ou utilizar máquinas de forma segura.
O medicamento Okteva contém sódio
O medicamento Okteva contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, é essencialmente "livre de sódio".
3. Como tomar o medicamento Okteva
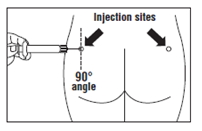
O medicamento Okteva deve ser administrado exclusivamente por injeção intramuscular no quadril.
Durante o tratamento prolongado, as injeções devem ser feitas alternadamente em cada quadril.
Uso de uma dose maior do que a recomendada do medicamento Okteva
Após a sobredose do medicamento Okteva, não foram relatados efeitos adversos graves.
Os sintomas de sobredose incluem: ondas de calor, micção frequente, fadiga, depressão, ansiedade e falta de concentração.
Se o doente suspeitar que ocorreu uma sobredose e apresentar algum desses sintomas, deve informar imediatamente o médico.
Omissão de uma dose do medicamento Okteva
Se a injeção não for administrada no prazo previsto, deve ser feita o mais rápido possível, e depois o tratamento deve ser retomado como antes. A administração de uma dose alguns dias depois não é prejudicial, mas pode causar uma recorrência temporária dos sintomas da doença até que o esquema de tratamento seja retomado.
Interrupção do tratamento com o medicamento Okteva
Após a interrupção do tratamento com o medicamento Okteva, os sintomas da doença podem recorrer. Por isso, não deve interromper o tratamento com o medicamento Okteva sem antes consultar o médico.
Se tiver mais alguma dúvida sobre o uso deste medicamento, deve consultar o médico, enfermeiro ou farmacêutico.
4. Efeitos não desejados
Como todos os medicamentos, o medicamento Okteva pode causar efeitos não desejados, embora não ocorram em todos os doentes.
Certos efeitos não desejados podem ser graves. Deve informar imediatamente o médico se o doente apresentar algum dos seguintes sintomas:
Muito frequentes(podem afectar mais de 1 em cada 10 doentes):
- Cálculos biliares que causam dor nas costas
- Níveis elevados de açúcar no sangue
Frequentes(podem afectar até 1 em cada 10 doentes):
- Hipotireoidismo (baixa actividade da tiróide) que afecta o ritmo cardíaco, apetite ou ganho de peso; fadiga, sensação de frio ou inchaço no pescoço
- Alterações nos resultados dos testes da função da tiróide
- Colecistite; os sintomas podem incluir dor no lado direito do abdómen, febre, náuseas, icterícia
- Níveis baixos de açúcar no sangue
- Intolerância à glucose
- Bradicardia (frequência cardíaca lenta)
Pouco frequentes(podem afectar até 1 em cada 100 doentes):
- Sede, produção reduzida de urina, urina escura, pele seca e vermelha
- Taquicardia (frequência cardíaca rápida)
Outros efeitos não desejados graves
- Reacções de hipersensibilidade (alergia), incluindo erupções cutâneas
- Reacção alérgica (anafilaxia), que pode causar dificuldades em engolir ou respirar, inchaço e formigamento, com possível queda da pressão arterial e tonturas ou perda de consciência.
- Pancreatite; os sintomas podem incluir dor abdominal súbita, náuseas, vómitos, diarreia
- Hepatite; os sintomas podem incluir icterícia, náuseas, vómitos, falta de apetite, mal-estar geral, coceira, urina clara
- Arritmia cardíaca
- Baixa contagem de plaquetas; pode causar sangramento ou hematomas.
Se o doente apresentar algum desses sintomas, deve informar imediatamente o médico.
Outros efeitos não desejados:
Se o doente apresentar algum dos seguintes efeitos não desejados, deve informar o médico, farmacêutico ou enfermeiro. Estes efeitos são geralmente leves e tendem a desaparecer à medida que o tratamento progride.
Muito frequentes(podem afectar mais de 1 em cada 10 doentes):
- Diarréia
- Dor abdominal
- Náuseas
- Constipação
- Flatulência
- Dor de cabeça
- Dor no local da injeção.
Frequentes(podem afectar até 1 em cada 10 doentes):
- Disconforto abdominal após as refeições (dispepsia)
- Vómitos
- Sensação de plenitude abdominal
- Fezes oleosas
- Fezes soltas
- Descoloração das fezes
- Tonturas
- Falta de apetite
- Alterações nos resultados dos testes da função do fígado
- Alopecia
- Dificuldade respiratória
- Fraqueza
Se ocorrerem efeitos não desejados, deve informar o médico, enfermeiro ou farmacêutico.
Notificação de efeitos não desejados
Se ocorrerem efeitos não desejados, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados directamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde:
Rua [inserir rua]
1200-453 Lisboa
Telefone: [inserir telefone]
Fax: [inserir fax]
Site da Internet: [inserir site]
Os efeitos não desejados também podem ser notificados ao titular da autorização de introdução no mercado.
5. Como conservar o medicamento Okteva
O medicamento deve ser conservado fora do alcance e da vista das crianças.
Conservar na embalagem original para proteger da luz.
Conservar no frigorífico (2°C – 8°C). Não congelar.
No dia da administração da injeção, o medicamento Okteva pode ser conservado a uma temperatura inferior a 25°C.
Não conservar o medicamento Okteva após a reconstituição. A suspensão preparada deve ser utilizada imediatamente.
Não utilizar este medicamento após o prazo de validade impresso na etiqueta e embalagem após "EXP" e "Data de validade (EXP)". A data de validade é o último dia do mês indicado.
Não utilizar este medicamento se verificar a presença de partículas estranhas ou alteração da cor.
Os medicamentos não devem ser eliminados na canalização ou em contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não necessita. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Okteva
- A substância activa do medicamento é a octreotida. Cada frasco contém 10 mg, 20 mg ou 30 mg de octreotida (na forma de octreotida acetato).
- Os outros componentes são: no pó (frasco): copolímero de ácido D,L-láctico e glicólico (55:45) e manitol (E 421). no solvente (ampola): carmelose sódica, manitol (E 421), poloxâmero 188 e água para injeções.
Como é o medicamento Okteva e que embalagens estão disponíveis
Okteva 10 mg
Cada embalagem contém: 1 frasco de vidro contendo 10 mg de octreotida fechado com uma tampa de borracha e um selo de alumínio com uma tampa azul escuro de tipo flip-off, 1 ampola contendo 2 ml de solvente, 1 agulha segura para injeções e 1 conector de frasco ou,
3 frascos de vidro contendo 10 mg de octreotida, 3 ampolas contendo 2 ml de solvente, 3 agulhas seguras para injeções e 3 conectores de frasco.
Okteva 20 mg
Cada embalagem contém: 1 frasco de vidro contendo 20 mg de octreotida fechado com uma tampa de borracha e um selo de alumínio com uma tampa laranja de tipo flip-off, 1 ampola contendo 2 ml de solvente, 1 agulha segura para injeções e 1 conector de frasco ou,
3 frascos de vidro contendo 20 mg de octreotida, 3 ampolas contendo 2 ml de solvente, 3 agulhas seguras para injeções e 3 conectores de frasco.
Okteva 30 mg
Cada embalagem contém: 1 frasco de vidro contendo 30 mg de octreotida fechado com uma tampa de borracha e um selo de alumínio com uma tampa vermelha escura de tipo flip-off, 1 ampola contendo 2 ml de solvente, 1 agulha segura para injeções e 1 conector de frasco ou,
3 frascos de vidro contendo 30 mg de octreotida, 3 ampolas contendo 2 ml de solvente, 3 agulhas seguras para injeções e 3 conectores de frasco.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de introdução no mercado e fabricante
Titular da autorização de introdução no mercado
Teva B.V.
Swensweg 5
2031 GA Haarlem
Países Baixos
Fabricante
PLIVA HRVATSKA d.o.o. (PLIVA CROATIA Ltd.)
Prilaz baruna Filipovića 25
Zagreb 10000
Croácia
Merckle GmbH,
Ludwig-Merckle-Str. 3
Blaubeuren
89143
Alemanha
Pharmathen International S.A
Parque Industrial Sapes
Prefeitura de Rodopi, Bloco n.º 5
Rodopi 69300
Grécia
Para obter informações mais detalhadas sobre o medicamento e seus nomes em outros países membros da Área Económica Europeia, deve contactar o representante do titular da autorização de introdução no mercado:
Teva Pharmaceuticals Portugal, Rua [inserir rua], [inserir localidade], [inserir código postal], telefone [inserir telefone].
Data da última revisão do folheto:fevereiro de 2024.
Informações destinadas apenas a profissionais de saúde:
Qual a quantidade de medicamento Okteva a utilizar
Acromegalia
Recomenda-se iniciar o tratamento com uma dose de 20 mg do medicamento Okteva administrada a cada 4 semanas durante 3 meses. Os doentes que tomam octreotida por via subcutânea podem iniciar o tratamento com o medicamento Okteva no dia seguinte à última administração subcutânea de octreotida. Depois, a dose do medicamento deve ser ajustada com base nos níveis de hormônio do crescimento (GH) e fator de crescimento semelhante à insulina 1/somatomedina C (IGF-1) e nos sintomas clínicos.
Em doentes que, após 3 meses, os sintomas clínicos e os parâmetros bioquímicos (GH; IGF-1) não estão completamente controlados (níveis de GH ainda são superiores a 2,5 microgramas/l), a dose do medicamento pode ser aumentada para 30 mg a cada 4 semanas. Se, após mais 3 meses, os parâmetros GH, IGF-1 e/ou outros sintomas ainda não estiverem adequadamente controlados com a dose de 30 mg, a dose pode ser aumentada para 40 mg a cada 4 semanas.
Em doentes que mantêm níveis de GH consistentemente abaixo de 1 micrograma/l, e níveis de IGF-1 na amostra de sangue normalizados, e nos quais os sintomas mais rápidos da acromegalia recuaram após 3 meses de tratamento com a dose de 20 mg, pode ser utilizada uma dose de 10 mg do medicamento Okteva a cada 4 semanas. No entanto, especialmente neste grupo de doentes, é recomendável um monitorização rigorosa da eficácia do tratamento através da determinação dos níveis de GH e IGF-1 na amostra de sangue e da avaliação dos sintomas clínicos objectivos e subjectivos durante o tratamento com esta dose baixa do medicamento Okteva.
Em doentes que estão a receber uma dose estabelecida do medicamento Okteva, deve ser determinado o nível de GH e IGF-1 a cada 6 meses.
Tumores hormonais ativos do estômago, intestinos e pâncreas
- Tratamento de doentes com sintomas associados a tumores neuroendócrinos hormonais ativos do estômago, intestinos e pâncreas
Recomenda-se iniciar o tratamento com uma dose de 20 mg do medicamento Okteva administrada a cada 4 semanas.
Os doentes que tomam octreotida por via subcutânea devem continuar a tomar a dose previamente eficaz durante 2 semanas após a primeira injeção do medicamento Okteva.
Em doentes que, após 3 meses de tratamento, apresentam uma redução satisfatória dos sintomas e uma melhoria dos parâmetros biológicos, pode ser reduzida a dose do medicamento Okteva para 10 mg a cada 4 semanas.
Em doentes que, após 3 meses de tratamento, apresentam apenas uma redução parcial dos sintomas, pode ser aumentada a dose do medicamento Okteva para 30 mg a cada 4 semanas.
Nos dias em que, apesar do tratamento com o medicamento Okteva, os sintomas associados a tumores do estômago, intestinos e pâncreas são agravados, é recomendável administrar uma dose adicional de octreotida por via subcutânea na dose utilizada antes da introdução do medicamento Okteva. Isso pode ocorrer especialmente durante os primeiros 2 meses de tratamento, antes de ser atingido o nível terapêutico da octreotida.
- Tratamento de doentes com tumores neuroendócrinos avançados originados na parte média do intestino delgado ou de localização desconhecida, nos quais se excluiu a localização primária na parte média do intestino delgado
A dose recomendada do medicamento Okteva é de 30 mg, administrada a cada 4 semanas. O tratamento com o medicamento Okteva para inibir o crescimento do tumor deve ser continuado na ausência de progressão do tumor.
- Tratamento de adenomas que secretam TSH
Deve ser iniciado o tratamento com uma dose de 20 mg do medicamento Okteva administrada a cada 4 semanas e continuado durante 3 meses antes de um possível ajuste da dose. Depois, a dose pode ser ajustada com base na secreção de TSH e hormônio da tiróide.
Instruções para a preparação e administração da injeção intramuscular do medicamento Okteva
Kit:
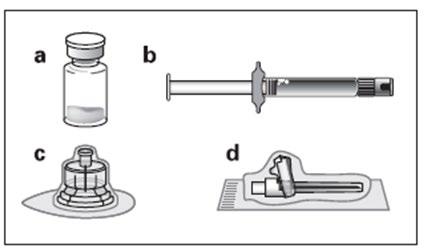
aUm frasco contendo o medicamento Okteva na forma de pó
bUma ampola contendo o solvente para a suspensão
cUm conector de frasco para a reconstituição do medicamento
dUma agulha segura para injeções
Deve seguir as instruções abaixo para reconstituir correctamente o medicamento Okteva antes de administrar a injeção intramuscular profunda no quadril.
Para a reconstituição correcta do medicamento Okteva, são cruciais 3 requisitos.
A não observância destes requisitos pode levar a uma administração incorrecta do medicamento.
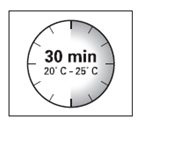
- O kit de injeção deve atingir a temperatura ambiente.Deve retirar o kit de injeção do frigorífico e, antes da reconstituição, deixá-lo durante pelo menos 30 minutos a uma temperatura ambiente, mas não por mais de 24 horas.
- Após a adição do solvente, deve deixar o frasco durante 5 minutos para garantir a completa dissolução do pó.
- Após a dissolução, deve agitar o frasco com força moderadadurante pelo menos 30 segundos para formar uma suspensão homogénea.A suspensão do medicamento Okteva deve ser preparada imediatamenteantes da administração.
O medicamento Okteva só pode ser administrado por pessoal médico treinado.
Passo 1
- Retirar o kit de injeção do medicamento Okteva do frigorífico onde foi armazenado.
ATENÇÃO: É muito importante começar o processo de reconstituição apenas quando o kit de injeção tenha atingido a temperatura ambiente.
Deve deixar o kit em temperatura ambiente durante pelo menos 30 minutos antes da reconstituição, mas não por mais de 24 horas.
horas.
Nota: O kit de injeção pode ser colocado novamente no frigorífico se necessário.
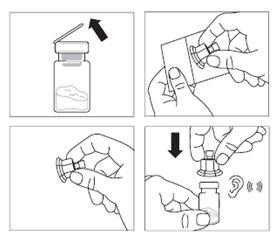
Passo 2
- Retirar a tampa de plástico do frasco e limpar a tampa de borracha do frasco com um algodão embebido em álcool.
- Retirar a folha que cobre a embalagem do conector de frasco, retirar o conector de frasco da embalagem, segurando-o entre o conector branco de Luer e a argola. NÃO TOCAR NAS PONTAS DO CONECTOR EM NENHUM PONTO.
- Colocar o frasco sobre uma superfície plana. Colocar o conector de frasco sobre o frasco e empurrá-lo até o fim, de modo a que se encaixe com um som audível.
- Limpar a ponta do conector de frasco com um algodão embebido em álcool.
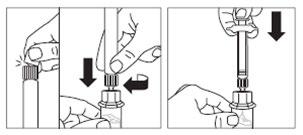
Passo 3
- Retirar a cobertura da ponta da ampola que contém o solvente e aparafusar a ampola ao conector de frasco.
- Empurrar lentamente o êmbolo até o fim para que todo o solvente seja injetado no frasco.
Passo 4
ATENÇÃO: É muito importante deixar o frasco
por 5 minutos,para garantir a completa dissolução do pó.
Nota: O êmbolo pode ser empurrado de volta para cima devido à pressão no frasco. Nesta fase, deve
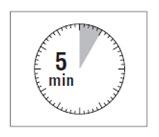
preparar o doente para a injeção.
Passo 5
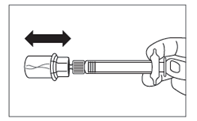
- Após o tempo necessário para a dissolução, deve verificar se o êmbolo está completamente empurrado para o fundo da ampola.
ATENÇÃO:Segurando o êmbolo empurrado para o fundo com força moderada, agite o frasco suavementedurante pelo menos 30 segundos para formar uma suspensão homogénea(suspensão leitosa homogénea). Se parte do pó não se dissolver,repita o agitar suave durante mais 30 segundos.
Passo 6
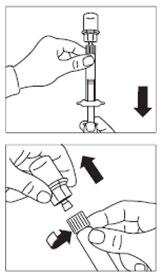
- Virar a ampola com o frasco para baixo e, puxando lentamente o êmbolo, aspirar todo o conteúdo do frasco para a ampola.
- Desaparafusar a ampola do conector de frasco.
Passo 7
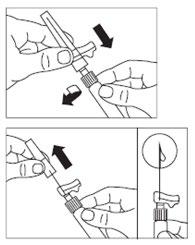
- Preparar o local da injeção, limpando-o com um algodão embebido em álcool.
- Aparafusar a agulha segura para injeções à ampola.
- Se a administração imediata não for possível, agite novamente a ampola suavemente para obter uma suspensão leitosa homogénea logo antes da administração.
- Retirar a cobertura da agulha com um movimento direto para cima.
- Bater suavemente com os dedos na ampola para fazer com que as bolhas de ar visíveis subam, e depois removê-las da ampola. Prossiga imediatamentepara o ponto Passo 8. Qualquer atraso pode causar a formação de um sedimento.
Passo 8
- O medicamento Okteva deve ser administrado
exclusivamente por injeção intramuscular profunda no quadril, NUNCA por via intravenosa.
- Introduzir toda a agulha no quadril esquerdo ou direito a um ângulo de 90 ° em relação à superfície da pele.
- Empurrar lentamente o êmbolo da ampola para garantir que a agulha não esteja num vaso sanguíneo (mudar a posição da agulha se estiver num vaso sanguíneo).
- Empurrar lentamente e com pressão constante o êmbolo até que a ampola esteja vazia. Retirar a agulha do local da injeção e activar a cobertura de protecção da agulha (conforme as instruções no ponto Passo 9).
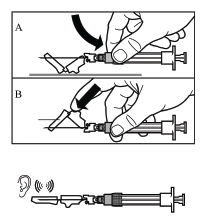
Passo 9
- Activar a cobertura de protecção da agulha utilizando um dos seguintes métodos:
- empurrar a parte dobrável da cobertura contra uma superfície dura (desenho A)
- ou pressionar a parte dobrável da cobertura com o dedo (desenho B).
- A activação correcta será confirmada por um som audível.
- Nota: Deve registar o local da injeção na ficha do doente, alterando-o todos os meses.
- A ampola deve ser eliminada imediatamente (num contentor apropriado para objetos pontiagudos).
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorMerckle GmbH Pharmathen International S.A. PLIVA Hrvatska d.o.o. (PLIVA Croatia Ltd.)
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a OktevaForma farmacêutica: Pó, 20 mgSubstância ativa: octreotideRequer receita médicaForma farmacêutica: Pó, 30 mgSubstância ativa: octreotideRequer receita médicaForma farmacêutica: Pó, 30 mgSubstância ativa: octreotideRequer receita médica
Alternativas a Okteva noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Okteva em Espanha
Alternativa a Okteva em Ukraine
Médicos online para Okteva
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Okteva – sujeita a avaliação médica e regras locais.






