
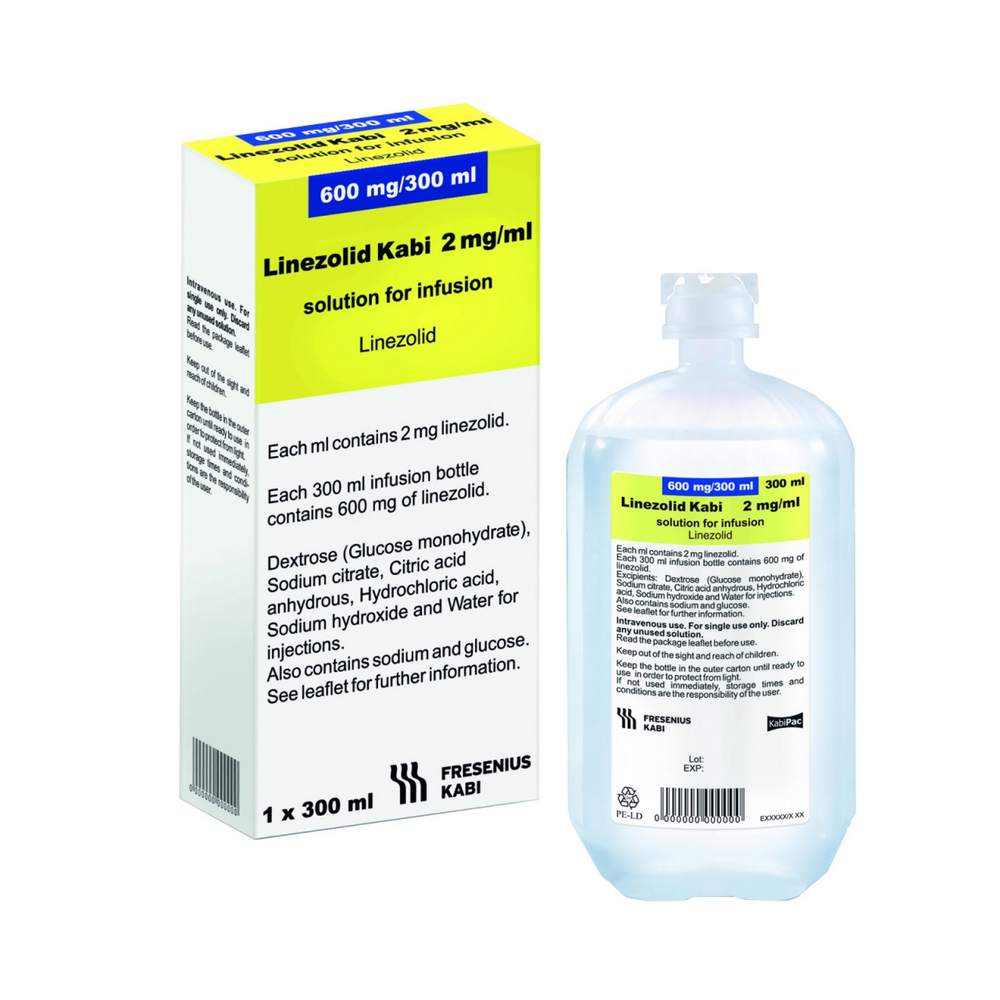
Linezolid Kabi

Pergunte a um médico sobre a prescrição de Linezolid Kabi

Como usar Linezolid Kabi
Folheto de informação para o utilizador
Linezolida Kabi, 2 mg/mL, solução para infusão
Linezolida
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
Deve conservar este folheto, para que possa relê-lo se necessário.
Em caso de dúvidas, deve consultar um médico ou enfermeiro.
Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou enfermeiro. Ver secção 4.
Índice do folheto
- 1. O que é o Linezolida Kabi e para que é utilizado
- 2. Informações importantes antes de tomar o Linezolida Kabi
- 3. Como tomar o Linezolida Kabi
- 4. Efeitos não desejados
- 5. Como conservar o Linezolida Kabi
- 6. Conteúdo do pacote e outras informações
1. O que é o Linezolida Kabi e para que é utilizado
O Linezolida Kabi é um antibiótico do grupo dos oxazolidinonas, que inibem o crescimento de certas bactérias (microrganismos) que causam infecções. É utilizado no tratamento de pneumonia e de certas infecções da pele e tecidos subcutâneos. O médico decidirá se o Linezolida Kabi é adequado para tratar a infecção diagnosticada no doente.
2. Informações importantes antes de tomar o Linezolida Kabi
Quando não tomar o Linezolida Kabi
Se o doente for alérgico ao linezolida ou a qualquer um dos outros componentes deste medicamento (listados na secção 6).
Se o doente estiver a tomar ou tiver tomado nos últimos 2 semanas qualquer um dos medicamentos do grupo conhecido como inibidores da monoamina oxidase (inibidores da MAO, por exemplo, fenelzina, isocarboxazida, selegilina, moclóbemida). Estes medicamentos podem ser utilizados no tratamento da depressão ou da doença de Parkinson.
Se a doente estiver a amamentar. O linezolida passa para o leite materno e pode ter um efeito prejudicial no bebê.
Precauções e advertências
Deve consultar um médico ou farmacêutico antes de tomar o Linezolida Kabi.
O Linezolida Kabi pode não ser o medicamento adequado para o doente que responda "Sim" a qualquer uma das seguintes perguntas. Nesse caso, deve informar o médico, que examinará o estado geral de saúde e a pressão arterial do doente antes de iniciar o tratamento e as controlará durante o tratamento ou pode decidir prescrever um tratamento mais adequado.
Se o doente tiver dúvidas sobre se as seguintes questões o afetam, deve perguntar ao médico.
Tem o doente hipertensão arterial e está a tomar medicamentos para isso ou não?
Tem o doente hipertireoidismo?
Tem o doente um tumor da glândula adrenal (feocromocitoma) ou síndrome de carcinoides (causada por tumores do sistema hormonal, caracterizada por diarreia, ondas de calor, respiração sibilante)?
Tem o doente mania, distúrbios esquizoafetivos, estados de desorientação ou outros distúrbios psiquiátricos?
Tem o doente hiponatremia (baixo nível de sódio no sangue) ou está a tomar medicamentos que diminuem o nível de sódio no sangue, por exemplo, certos diuréticos (também conhecidos como "medicamentos diuréticos"), como a hidroclorotiazida?
Está o doente a tomar qualquer medicamento opiáceo?
A tomada de certos medicamentos, incluindo medicamentos antidepressivos e opiáceos, juntamente com o linezolida, pode causar a ocorrência de síndrome serotoninérgica - um estado potencialmente ameaçador da vida (ver secção 2 "Linezolida Kabi e outros medicamentos" e secção 4).
Quando ter cuidado ao tomar o Linezolida Kabi
Antes de iniciar o tratamento com o Linezolida Kabi, deve informar o médico se o doente apresenta as seguintes situações:
Idade avançada;
Facilidade de formação de hematomas e tendência para sangramentos;
Anemia (baixo nível de glóbulos vermelhos);
Susceptibilidade a infecções;
História de convulsões;
Distúrbios da função hepática ou renal, especialmente em doentes submetidos a diálise;
Diarreia.
Deve informar imediatamente o médico se, durante o tratamento com o Linezolida Kabi, o doente apresentar:
Distúrbios da visão, como visão turva, alterações na percepção das cores, dificuldade em detectar detalhes ou redução do campo de visão;
Perda de sensação nas mãos ou pés ou sensação de formigamento ou picada nas mãos ou pés;
Durante ou após o tratamento com antibióticos, incluindo o Linezolida Kabi, o doente pode apresentar diarreia. Se for grave ou persistente, ou se houver sangue ou muco nas fezes, deve interromper imediatamente o tratamento com o Linezolida Kabi e consultar um médico. Não deve tomar medicamentos que inibam ou retardam os movimentos intestinais;
Náuseas ou vômitos recorrentes, dor abdominal ou respiração acelerada;
Dor muscular de causa desconhecida, sensibilidade ou fraqueza muscular e (ou) urina escura. Pode ser um sinal de um estado grave chamado rabdomiólise (destruição muscular), que pode levar a danos renais;
Náuseas e mal-estar, incluindo fraqueza muscular, dor de cabeça, confusão e distúrbios da memória, que podem ser sinais de hiponatremia (baixo nível de sódio no sangue).
Linezolida Kabi e outros medicamentos
O Linezolida Kabi pode, por vezes, interagir com outros medicamentos e, como consequência, causar efeitos não desejados, como alterações da pressão arterial, temperatura corporal ou ritmo cardíaco.
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente.
Se, nos últimos 2 semanas, o doente tiver tomado ou estiver a tomaros seguintes medicamentos, deveinformar o médico, pois não devetomar o Linezolida Kabi se estiver a tomar esses medicamentos atualmente ou recentemente (ver também secção 2 "Quando não tomar o Linezolida Kabi"):
Inibidores da monoamina oxidase (inibidores da MAO, por exemplo, fenelzina, isocarboxazida, selegilina, moclóbemida). Estes medicamentos podem ser utilizados no tratamento da depressão ou da doença de Parkinson.
Se o doente estiver a tomar os seguintes medicamentos, também deve informar o médico. O médico pode decidir manter a prescrição do Linezolida Kabi, mas será necessário controlar o estado geral de saúde e a pressão arterial do doente antes de iniciar e durante o tratamento. Em outros casos, o médico pode decidir prescrever um tratamento mais adequado.
Medicamentos que diminuem a congestão nasal, utilizados no tratamento de resfriados e gripe, que contenham pseudoefedrina ou fenilpropanolamina.
Alguns medicamentos utilizados no tratamento de asma, por exemplo, salbutamol, terbutalina, fenoterol.
Alguns medicamentos antidepressivos do grupo dos tricíclicos ou inibidores seletivos da recaptação da serotonina (ISRS), por exemplo, amitriptilina, citalopram, clomipramina, dozulepina, doksepina, fluoxetina, fluvoxamina, imipramina, lofepramina, paroxetina, sertralina.
Medicamentos utilizados no tratamento de enxaqueca, por exemplo, sumatriptano, zolmitriptano.
Medicamentos utilizados no tratamento de reações alérgicas graves, por exemplo, adrenalina (epinefrina).
Medicamentos que aumentam a pressão arterial, por exemplo, noradrenalina (norepinefrina), dopamina, dobutamina.
Opiáceos, por exemplo, petidina, utilizados no tratamento de dores de intensidade moderada a grave.
Medicamentos utilizados no tratamento de distúrbios de ansiedade, por exemplo, buspirona.
Medicamentos que inibem a coagulação do sangue, por exemplo, varfarina.
Antibiótico chamado rifampicina.
Linezolida Kabi com alimentos, bebidas e álcool
O Linezolida Kabi pode ser tomado antes, durante ou após as refeições.
Deve evitar consumir quantidades excessivas de queijos maduros, extratos de levedura ou produtos à base de soja (por exemplo, molho de soja) e beber álcool, especialmente cerveja e vinho, pois o medicamento pode reagir com uma substância chamada tiramina, que ocorre naturalmente em alguns alimentos, causando um aumento da pressão arterial.
Se, após comer ou beber, o doente apresentar dor de cabeça latejante, deve consultar imediatamente um médico ou farmacêutico.
Gravidez, amamentação e fertilidade
O efeito do Linezolida Kabi em mulheres grávidas não é conhecido. Por isso, não deve tomar este medicamento durante a gravidez, a menos que o médico o prescreva. Se a doente estiver grávida ou amamentando, achar que pode estar grávida ou planejar ter um bebê, deve consultar um médico ou farmacêutico antes de tomar este medicamento.
Não deve amamentar enquanto estiver a tomar o Linezolida Kabi, pois o linezolida passa para o leite materno e pode ter um efeito prejudicial no bebê.
Condução de veículos e utilização de máquinas
O Linezolida Kabi pode causar tonturas e distúrbios da visão. Se esses sintomas ocorrerem, não deve conduzir veículos ou operar máquinas. Deve lembrar que o mal-estar afeta a capacidade de conduzir veículos e operar máquinas.
Linezolida Kabi contém glicose
Cada mL do medicamento Linezolida Kabi contém 45,7 mg de glicose (13,7 g de glicose em cada bolsa ou frasco).
Deve ser considerado em doentes com diabetes.
Linezolida Kabi contém sódio
Cada mL do medicamento Linezolida Kabi contém 0,38 mg de sódio (principal componente do sal de cozinha) (114 mg de sódio em cada bolsa ou frasco). Isso corresponde a 5,7% da dose diária máxima recomendada de sódio na dieta para adultos em caso de uma bolsa/frasco de infusão.
Deve ser considerado em doentes que controlam o teor de sódio na dieta.
3. Como tomar o Linezolida Kabi
Este medicamento deve ser sempre tomado de acordo com as instruções do médico. Em caso de dúvidas sobre a tomada do medicamento, deve consultar um médico ou farmacêutico.
Doentes adultos
O medicamento é administrado por infusão (gotejamento) por um médico ou profissional de saúde qualificado.
A dose recomendada para doentes adultos (com 18 anos ou mais) é de 300 mL de solução (600 mg de linezolida) duas vezes ao dia, administrada diretamente na corrente sanguínea (por via intravenosa) em infusão, durante 30 a 120 minutos.
Se o doente estiver a fazer diálise, deve receber o Linezolida Kabi após a diálise.
O tempo de tratamento é geralmente de 10 a 14 dias, mas pode durar até 28 dias. A eficácia e segurança do uso deste medicamento por um período superior a 28 dias não foram estabelecidas. O médico decidirá a duração do tratamento.
Durante o tratamento com o Linezolida Kabi, o médico deve prescrever exames de sangue regulares para controlar o número de glóbulos.
Se o Linezolida Kabi for utilizado por mais de 28 dias, o médico deve prescrever um exame de visão do doente.
Uso em crianças e adolescentes
O Linezolida Kabi não é geralmente utilizado em crianças e adolescentes (com menos de 18 anos).
Uso de dose maior do que a recomendada do Linezolida Kabi
Se o doente tem medo de ter tomado uma dose maior do que a recomendada do Linezolida Kabi, deve informar imediatamente um médico ou enfermeiro.
Omissão de uma dose do Linezolida Kabi
O medicamento é administrado sob controle estrito, por isso é pouco provável que se esqueça de uma dose. Se o doente achar que esqueceu uma dose, deve informar imediatamente um médico ou enfermeiro. Não deve tomar uma dose dupla para compensar a dose esquecida.
4. Efeitos não desejados
Como qualquer medicamento, o Linezolida Kabi pode causar efeitos não desejados, embora não ocorram em todos os doentes.
Deve informar imediatamente um médico, enfermeiro ou farmacêuticose, durante o tratamento com o Linezolida Kabi, o doente notar a ocorrência de qualquer um dos seguintes efeitos não desejados.
Efeitos não desejados graves (frequência de ocorrência entre parênteses) do Linezolida Kabi:
Distúrbios graves da pele (não muito frequentes), inchaço, especialmente na face e pescoço (não muito frequentes), respiração sibilante e (ou) dificuldade em respirar (raros). Pode ser um sinal de reação alérgica e pode ser necessário interromper o tratamento com o Linezolida Kabi. Reações da pele, como: erupção cutânea elevada e violeta devido à inflamação dos vasos sanguíneos (raros), úlceras vermelhas e descamação da pele (dermatite) (não muito frequentes), erupção cutânea (frequente), coceira (frequente);
Distúrbios da visão (não muito frequentes), como visão turva (não muito frequente), alterações na percepção das cores (frequência desconhecida), dificuldade em detectar detalhes (frequência desconhecida), ou redução do campo de visão (raros);
Diarreia grave com sangue e (ou) muco nas fezes (colite associada a antibióticos, incluindo colite pseudomembranosa), que pode levar a complicações ameaçadoras da vida (não muito frequente);
Náuseas ou vômitos recorrentes, dores abdominais ou respiração acelerada (raros);
Síndrome serotoninérgica (frequência desconhecida): deve informar o médico se, durante a tomada de medicamentos antidepressivos do grupo dos ISRS ou opiáceos (ver secção 2), ocorrerem sintomas como agitação, confusão, alucinações, rigidez, tremores, distúrbios da coordenação, convulsões, batimentos cardíacos acelerados, problemas respiratórios graves e diarreia (sugestivos de síndrome serotoninérgica) (ver secção 2);
Sangramentos ou hematomas de causa desconhecida, que podem ser devido a alterações no número de glóbulos, afetando a coagulação do sangue ou levando a anemia (frequente);
Alterações no número de certos glóbulos, que podem afetar a capacidade de combater infecções (não muito frequentes), sintomas de infecção incluem: febre (frequente), dor de garganta (não muito frequente), úlceras na boca (não muito frequente), fadiga (não muito frequente);
Rabdomiólise (raros): sintomas objetivos e subjetivos incluem dor muscular de causa desconhecida, sensibilidade ou fraqueza muscular e (ou) urina escura. Pode ser um sinal de um estado grave chamado rabdomiólise (destruição muscular), que pode levar a danos renais;
Pancreatite (não muito frequente);
Convulsões (não muito frequentes);
Ataques de falta de sangue no cérebro (não muito frequentes);
"Zumbido" nos ouvidos (zumbido).
Outros efeitos não desejados
Efeitos não desejados frequentes (podem afetar até 1 em cada 10 doentes):
Infecções fúngicas, especialmente da vagina ou candidíase na boca;
Dor de cabeça;
Sabor metálico na boca;
Diarreia, náuseas ou vômitos;
Alterações nos resultados de certos exames de sangue, incluindo medições de proteínas, sais ou enzimas, utilizados para avaliar a função renal ou hepática e o nível de açúcar no sangue;
Distúrbios do sono;
Aumento da pressão arterial;
Anemia (baixo nível de glóbulos vermelhos);
Tonturas;
Dor abdominal localizada ou generalizada;
Prisão de ventre;
Dispepsia;
Dor localizada;
Redução do número de plaquetas.
Efeitos não desejados não muito frequentes (podem afetar até 1 em cada 100 doentes):
Estado inflamado da vagina e área genital nas mulheres;
Sensação de formigamento ou dormência;
Inchaço, dor ou alteração da cor da língua;
Secura na boca;
Dor no local da infusão;
Inflamação dos vasos sanguíneos (incluindo no local da infusão);
Necessidade de urinar com mais frequência;
Calafrios;
Sensação de aumento da sede;
Sudorese excessiva;
Hiponatremia (baixo nível de sódio no sangue);
Insuficiência renal;
Inchaço;
Dor no local da infusão;
Aumento do nível de creatinina;
Dor de estômago;
Alterações no ritmo cardíaco (por exemplo, ritmo cardíaco acelerado);
Redução do número de glóbulos;
Fraqueza e (ou) alterações sensoriais.
Efeitos não desejados raros (podem afetar até 1 em cada 1.000 doentes):
Mancha superficial nos dentes, que desaparece após uma limpeza dentária profissional (remoção manual de tártaro).
Foram também relatados os seguintes efeitos (frequência desconhecida: não pode ser estimada com base nos dados disponíveis):
Alopecia (perda de cabelo).
Notificação de efeitos não desejados
Se ocorrerem qualquer efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Instituto Nacional de Farmácia e Medicamentos
Rua Alexandre Herculano, 46
1250-008 Lisboa
Telefone: +351 21 792 53 00
Fax: +351 21 792 53 99
Sítio da Internet: https://www.infarmed.pt/
Os efeitos não desejados também podem ser notificados ao titular da autorização de introdução no mercado.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar o Linezolida Kabi
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Bolsa freeflex
Não deve tomar o medicamento após o prazo de validade impresso na caixa, bolsa exterior e bolsa com: "VALIDO ATÉ:". O prazo de validade é o último dia do mês indicado.
O pessoal de saúde deve garantir que o Linezolida Kabi não seja utilizado após o prazo de validade impresso na bolsa e que o medicamento seja administrado imediatamente após a abertura da bolsa. O profissional de saúde que administra o medicamento deve verificar a solução antes de usá-la, pois apenas soluções transparentes e isentas de partículas sólidas visíveis podem ser utilizadas. O profissional de saúde que administra o medicamento deve garantir que, até ao momento da administração, a solução seja conservada corretamente, ou seja, na caixa e na bolsa exterior, para proteger da luz e em local não visível e inacessível a crianças.
Frasco KabiPac
Não deve tomar o medicamento após o prazo de validade impresso na caixa e frasco com: "VALIDO ATÉ:". O prazo de validade é o último dia do mês indicado.
O pessoal de saúde deve garantir que o Linezolida Kabi não seja utilizado após o prazo de validade impresso no frasco e que o medicamento seja administrado imediatamente após a retirada da caixa de cartão. O profissional de saúde que administra o medicamento deve verificar a solução antes de usá-la, pois apenas soluções transparentes e isentas de partículas sólidas visíveis podem ser utilizadas. O profissional de saúde que administra o medicamento deve garantir que, até ao momento da administração, a solução seja conservada corretamente, ou seja, na caixa de cartão, para proteger da luz e em local não visível e inacessível a crianças.
Após a abertura
Foi demonstrada a estabilidade química e física do medicamento pronto para uso durante 24 horas a 2-8°C e 25°C.
Por razões microbiológicas, o medicamento deve ser utilizado imediatamente, a menos que o método de abertura exclua o risco de contaminação microbiológica. Se o medicamento não for utilizado imediatamente, o tempo e as condições de conservação durante o uso são da responsabilidade do utilizador.
Os medicamentos não devem ser jogados na canalização ou nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o Linezolida Kabi
O princípio ativo do medicamento é o linezolida. Cada mL da solução contém 2 mg de linezolida.
Os outros componentes são: glicose monohidratada (um tipo de açúcar), citrato de sódio, ácido cítrico, ácido clorídrico 1 M (para ajustar o pH), hidróxido de sódio 1 M (para ajustar o pH) e água para injeção.
Como é o Linezolida Kabi e que conteúdo tem o pacote
Bolsa freeflex
O Linezolida Kabi é uma solução transparente, isenta de partículas sólidas, incolor ou amarela, em bolsa de infusão ( freeflex), contendo 300 mL de solução (600 mg de linezolida), colocada em bolsa exterior.
As bolsas são fornecidas em caixas de cartão que contêm 10, 30 ou 50 bolsas.
Frasco KabiPac
O Linezolida Kabi é uma solução transparente, isenta de partículas sólidas, incolor ou ligeiramente amarela, em frasco, contendo 300 mL de solução (600 mg de linezolida).
Cada frasco é embalado em caixa de cartão separada e, em seguida, em caixas de cartão externas que contêm 10, 30 ou 50 frascos.
Nem todos os tamanhos de embalagem precisam estar disponíveis.
Titular da autorização de introdução no mercado
Fresenius Kabi Portugal, Unipessoal, Lda.
Rua da Cêrca, 3200-201 Coimbra
Fabricante
HP Halden Pharma AS
Svinesundsveien 80
NO-1788 Halden
Noruega
Fresenius Kabi Portugal, Unipessoal, Lda.
Rua da Cêrca, 3200-201 Coimbra
Para obter informações mais detalhadas sobre este medicamento, deve contactar o titular da autorização de introdução no mercado:
Fresenius Kabi Portugal, Unipessoal, Lda.
Rua da Cêrca, 3200-201 Coimbra
Este medicamento está autorizado nos estados-membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) sob as seguintes denominações:
Alemanha
Linezolid Fresenius Kabi 2 mg/mL Infusionslösung
Linezolid Kabi 2 mg/mL Infusionslösung
Bélgica
Linezolid Fresenius Kabi 2 mg/mL, oplossing voor infusie
Bulgária
Linezolid Kabi 2 mg/mL инфузионен разтвор
Chipre
Linezolid Kabi 2 mg/mL
Croácia
Linezolid Kabi 2 mg/mL otopina za infuziju
Dinamarca
Linezolid Fresenius Kabi 2 mg/mL
Eslováquia
Linezolid Kabi 2 mg/mL
Eslovênia
Linezolid Kabi 2 mg/mL raztopina za infundiranje
Espanha
Linezolid Kabi 2 mg/mL solución para perfusión
Estónia
Linezolid Fresenius Kabi 2 mg/mL
Finlândia
Linezolid Kabi 2 mg/mL
França
Linezolide Kabi 2 mg/mL, solution pour perfusion
Grécia
Linezolid Kabi 2 mg/mL
Hungria
Linezolid Fresenius Kabi 2 mg/mL oldatos infúzió
Irlanda
Linezolid 2 mg/mL solution for infusion
Itália
Linezolid Kabi 2 mg/mL
Letónia
Linezolid Kabi 2 mg/mL
Lituânia
Linezolid Kabi 2 mg/mL
Luxemburgo
Linezolid Kabi 2 mg/mL Infusionslösung
Malta
Linezolid Kabi 2 mg/mL
Países Baixos
Linezolid Fresenius Kabi 2 mg/mL, oplossing voor infusie
Polónia
Linezolid Kabi 2 mg/mL
Portugal
Linezolida Kabi 2 mg/mL
Reino Unido
Linezolid 2 mg/mL solution for infusion
República Checa
Linezolid Kabi 2 mg/mL
Roménia
Linezolid Kabi 2 mg/mL soluţie perfuzabilă
Suécia
Linezolid Fresenius Kabi 2 mg/mL
Data da última revisão do folheto:20/03/2025
------------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Linezolida Kabi, 2 mg/mL, solução para infusão
Linezolida
IMPORTANTE: antes de prescrever este medicamento, deve ler a Caracterização do Medicamento (CM).
O linezolida não é eficaz no tratamento de infecções causadas por bactérias Gram-negativas. Se for confirmado ou suspeitado que a infecção é causada por bactérias Gram-negativas, deve ser prescrito um tratamento adequado contra essas bactérias.
Aparência
Bolsa freeflex
Para uso único, pronto para administração, isento de látex, bolsa de infusão ( freeflex)
com película multilayer de poliolefina, colocada em bolsa exterior com película de poliéster/polipropileno/alumínio. A bolsa contém 300 mL de solução e é colocada em caixa de cartão. Cada caixa de cartão contém 10, 30 ou 50 bolsas de infusão.
Solução isentona, transparente, isenta de partículas sólidas, incolor ou amarela, do medicamento Linezolida Kabi, que contém 2 mg/mL de linezolida. Os outros componentes são: glicose monohidratada, citrato de sódio, ácido cítrico anidro, ácido clorídrico 1 M (para ajustar o pH), hidróxido de sódio 1 M (para ajustar o pH) e água para injeção.
Frasco KabiPac
Para uso único, pronto para administração, frasco de LDPE (KabiPac) com tampa que contém uma membrana de borracha que permite a introdução da agulha. O frasco contém 300 mL de solução e é colocado em caixa de cartão para proteger da luz.
As caixas de cartão externas contêm 10, 30 ou 50 frascos (cada frasco é embalado em caixa de cartão separada).
Solução isentona, transparente, isenta de partículas sólidas, incolor ou ligeiramente amarela, do medicamento Linezolida Kabi, que contém 2 mg/mL de linezolida. Os outros componentes são: glicose monohidratada, citrato de sódio, ácido cítrico anidro, ácido clorídrico 1 M (para ajustar o pH), hidróxido de sódio 1 M (para ajustar o pH) e água para injeção.
Posologia e modo de administração
O tratamento com o linezolida deve ser iniciado apenas em ambiente hospitalar e após consulta a um especialista adequado, por exemplo, um microbiologista ou um especialista em doenças infecciosas.
Em doentes que iniciaram o tratamento com o medicamento por via parenteral, pode ser feita a transição para uma das formas orais, se clinicamente apropriado. Nesse caso, não é necessária a modificação da dose, pois a biodisponibilidade do linezolida após administração oral é de aproximadamente 100%.
A solução para infusão deve ser administrada em infusão que dura de 30 a 120 minutos.
As doses recomendadas de linezolida devem ser administradas por via intravenosa, duas vezes ao dia.
Dosagem e duração do tratamento recomendados para doentes adultos
A duração do tratamento depende do tipo de microrganismo, localização e gravidade da infecção, bem como da resposta clínica do doente ao tratamento.
As recomendações seguintes para a duração do tratamento são consistentes com as utilizadas nos estudos clínicos. Em alguns tipos de infecções, um tratamento mais curto pode ser suficiente, mas não há dados de estudos clínicos sobre isso.
A duração máxima do tratamento é de 28 dias. A segurança e eficácia do uso do linezolida por um período superior a 28 dias não foram estabelecidas. O médico decidirá a duração do tratamento.
Nas infecções com bacteriemia associada, não há necessidade de aumentar a dose ou prolongar a duração do tratamento.
As doses recomendadas para a solução para infusão são as seguintes:
| Infecção | Dosagem | Duração do tratamento |
| Pneumonia hospitalar | 600 mg 2 vezes ao dia | 10-14 dias consecutivos |
| Pneumonia extrahospitalar | ||
| Infecções cutâneas e tecidos moles complicadas | 600 mg 2 vezes ao dia |
Crianças e adolescentes
A segurança e eficácia do uso do linezolida em crianças e adolescentes (com menos de 18 anos) não foram estabelecidas. Os dados disponíveis são descritos nas secções 4.8, 5.1 e 5.2 da CM, mas não é possível estabelecer a dosagem recomendada.
Doentes idosos
Não é necessária a modificação da dose.
Distúrbios da função renal
Não é necessária a modificação da dose.
Distúrbios graves da função renal (ou seja, clearance de creatinina <30 ml min)< em>
Não é necessária a modificação da dose. Devido ao significado clínico desconhecido do aumento da exposição (até 10 vezes) aos dois principais metabólitos do linezolida em doentes com insuficiência renal grave, o medicamento deve ser utilizado com cautela nesses doentes e apenas nos que a benefício potencial supera o risco teórico.
Como aproximadamente 30% da dose de linezolida é eliminada do organismo durante uma hemodiálise de 3 horas, em doentes submetidos a diálise, o medicamento deve ser administrado após as diálises. A hemodiálise também leva à eliminação parcial dos principais metabólitos do linezolida do organismo, mas os níveis ainda são significativamente mais altos após as diálises do que nos doentes com função renal normal ou com insuficiência renal ligeira a moderada. Portanto, em doentes submetidos a diálise com insuficiência renal grave, o linezolida deve ser utilizado com cautela e apenas se o benefício potencial superar o risco teórico.
Até ao momento, não há dados sobre o uso do linezolida em doentes submetidos a diálise ambulatorial contínua de peritônio (DACP) ou outros métodos de tratamento da insuficiência renal que não a hemodiálise.
Insuficiência renal ligeira ou moderada (ou seja, grau A ou B na escala de Child-Pugh)
Não é necessária a modificação da dose.
Insuficiência renal grave (ou seja, grau C na escala de Child-Pugh)
Devido ao facto de o linezolida ser metabolizado por processos não enzimáticos, é provável que a disfunção hepática não afete significativamente o seu metabolismo. Portanto, não é recomendada a modificação da dose. No entanto, devido à experiência clínica limitada em doentes com insuficiência hepática grave, o linezolida deve ser utilizado com cautela e apenas se o benefício potencial superar o risco teórico (ver secções 4.4 e 5.2 da CM).
Contraindicações
Hipersensibilidade ao princípio ativo ou a qualquer um dos excipientes.
O linezolida não deve ser utilizado em doentes que estejam a tomar qualquer inibidor da monoamina oxidase do tipo A ou B (por exemplo, fenelzina, isocarboxazida, selegilina, moclóbemida) ou nos 2 semanas seguintes à interrupção da administração de qualquer medicamento deste grupo.
O linezolida não deve ser administrado a doentes com as seguintes doenças subjacentes ou que estejam a tomar os seguintes tipos de medicamentos, a menos que seja possível uma monitorização e vigilância rigorosa da pressão arterial do doente:
Doentes com hipertensão arterial não tratada, feocromocitoma, síndrome de carcinoides, hipertireoidismo, depressão bipolar, distúrbios esquizoafetivos, estados de desorientação aguda;
Doentes que estejam a tomar qualquer um dos seguintes medicamentos: inibidores da recaptação de serotonina, antidepressivos tricíclicos, agonistas dos receptores da serotonina 5-HT (triptanas), medicamentos com efeito simpaticomimético direto ou indireto (incluindo broncodilatadores, pseudoefedrina e fenilpropanolamina), medicamentos que aumentam a pressão arterial (por exemplo, epinefrina, norepinefrina), medicamentos com efeito dopaminérgico (por exemplo, dopamina, dobutamina), petidina ou buspirona.
Antes de iniciar o tratamento com o linezolida, deve interromper a amamentação e não amamentar durante o tratamento (ver secção 4.6 da CM).
Precauções e advertências especiais de utilização
Inibição da medula óssea
Em pacientes tratados com linezolida, foi observada inibição da medula óssea (incluindo anemia, leucopenia, pancitopenia e trombocitopenia). Em casos em que a relação causal foi conhecida, após a interrupção do tratamento com linezolida, os valores alterados dos parâmetros hematológicos retornaram aos valores basais. Parece que o risco de ocorrência desses efeitos está relacionado à duração do tratamento. Em pacientes idosos, o risco de distúrbios hematológicos durante o tratamento com linezolida é maior do que em pacientes mais jovens.
A trombocitopenia pode ocorrer com mais frequência em pacientes com insuficiência renal grave, independentemente de estarem ou não em diálise, e em pacientes com disfunção hepática moderada a grave. Portanto, a contagem de células sanguíneas deve ser rigorosamente controlada:
em pacientes com anemia, granulocitopenia ou trombocitopenia pré-existentes;
em pacientes que estão tomando medicamentos que podem diminuir a concentração de hemoglobina, a contagem de células sanguíneas ou afetar a contagem ou a função das plaquetas;
em pacientes com insuficiência renal grave ou disfunção hepática moderada a grave;
em pacientes que estão tomando linezolida por mais de 10-14 dias.
A linezolida pode ser administrada a esses pacientes apenas se for possível um controle rigoroso da concentração de hemoglobina, da contagem de células sanguíneas e das plaquetas.
Se ocorrer uma inibição significativa da medula óssea durante o tratamento com linezolida, o medicamento deve ser descontinuado, a menos que a administração do medicamento seja absolutamente necessária. Nesse caso, os parâmetros de morfologia sanguínea devem ser rigorosamente controlados e medidas apropriadas devem ser tomadas.
Além disso, é recomendado que os pacientes que estão tomando linezolida sejam submetidos a um exame de sangue completo semanalmente (com determinação da concentração de hemoglobina, contagem de plaquetas e contagem de leucócitos com esfregaço), independentemente do resultado inicial da morfologia sanguínea.
Em estudos que incluíram o uso de linezolida por motivos humanitários antes da aprovação, foi relatada uma frequência aumentada de anemia grave em pacientes que tomaram linezolida por mais de 28 dias. Nesses pacientes, a transfusão de sangue foi mais frequentemente necessária. Casos de anemia que requereram transfusão de sangue também foram relatados após a aprovação da linezolida, mais frequentemente após o uso do medicamento por mais de 28 dias.
Após a aprovação da linezolida, foram relatados casos de anemia sideroblástica.
A maioria dos pacientes que apresentaram os primeiros sintomas recebeu linezolida por mais de 28 dias. Na maioria dos pacientes, a anemia (tratada ou não) foi completamente ou parcialmente revertida após a interrupção do tratamento com linezolida.
Mortalidade variável no estudo clínico em pacientes com infecções sanguíneas causadas por bactérias Gram-positivas relacionadas ao uso de cateteres venosos
Em um estudo clínico aberto, em pacientes graves que receberam linezolida com infecções relacionadas ao uso de cateteres venosos, foi observada uma maior mortalidade do que em pacientes tratados com vancomicina, dicloxacilina ou oxacilina [78/363 (21,5%) versus 58/363 (16,0%)].
O principal fator que influenciou a mortalidade foi a ocorrência de infecção por bactérias Gram-positivas no início do tratamento. As taxas de mortalidade foram semelhantes em pacientes com infecção causada apenas por bactérias Gram-positivas (razão de chances 0,96; intervalo de confiança de 95%: 0,58-1,59), mas foram significativamente maiores (p=0,0162) no grupo de pacientes que receberam linezolida com qualquer outro patógeno ou sem patógeno no início do tratamento (razão de chances 2,48; intervalo de confiança de 95%: 1,38-4,46).
A maior discrepância ocorreu durante o tratamento e nos 7 dias após a interrupção do tratamento. Durante o estudo, um maior número de pacientes no grupo que recebeu linezolida desenvolveu infecção por microrganismos Gram-negativos e mais pacientes morreram devido a infecções causadas por bactérias Gram-negativas e infecções mistas. Portanto, em infecções cutâneas e de tecidos moles complicadas, a linezolida pode ser usada em pacientes com infecção concomitante por bactérias Gram-negativas suspeitada ou confirmada, apenas se não houver outras opções de tratamento disponíveis. Nesses casos, é necessário iniciar o tratamento concomitante contra bactérias Gram-negativas.
Diarréia e colite associadas à antibioticoterapia
Durante o uso de quase todos os medicamentos antibacterianos, incluindo a linezolida, foram relatados casos de diarréia e colite associados à antibioticoterapia, incluindo colite pseudomembranosa e diarréia associada à infecção por Clostridioides difficile. Essa complicação pode variar de diarréia leve a colite que pode ser fatal. Portanto, é importante considerar esse diagnóstico em pacientes que desenvolvem diarréia aguda durante ou após a interrupção do tratamento com linezolida. Se se suspeitar ou confirmar que a diarréia ou colite está relacionada à antibioticoterapia, é recomendado interromper o uso do medicamento antibacteriano, incluindo a linezolida, e iniciar o tratamento apropriado imediatamente. Nesse caso, é contraindicado o uso de medicamentos que inibem a peristalse intestinal.
Acidose láctica
Foram relatados casos de acidose láctica durante o uso de linezolida. Em pacientes que desenvolvem sintomas objetivos e subjetivos de acidose metabólica, incluindo náuseas ou vômitos recorrentes, dor abdominal, baixa concentração de bicarbonato ou hiperventilação, é necessária uma intervenção médica imediata. Se ocorrer acidose láctica, antes de continuar o tratamento, é necessário avaliar a relação risco-benefício.
Distúrbios mitocondriais
A linezolida inibe a síntese de proteínas mitocondriais, o que pode causar efeitos colaterais como acidose metabólica, anemia e neuropatia (do nervo óptico e periférica). Esses efeitos colaterais ocorrem com mais frequência se o medicamento for usado por mais de 28 dias.
Síndrome serotoninérgica
Foram relatados casos de síndrome serotoninérgica associados ao uso concomitante de linezolida e medicamentos com ação serotoninérgica, incluindo antidepressivos que são inibidores seletivos da recaptação de serotonina (ISRS) e opioides (ver seção 4.5 do RCP). Portanto, o uso concomitante de linezolida com medicamentos serotoninérgicos é contraindicado (ver seção 4.3 do RCP), a menos que seja necessário. Nesse caso, é necessário monitorar cuidadosamente se o paciente não apresenta sintomas subjetivos e objetivos de síndrome serotoninérgica, como alterações da função cognitiva, febre muito alta, aumento dos reflexos e falta de coordenação motora. Se esses sintomas ocorrerem, o médico deve considerar interromper o uso de um ou ambos os medicamentos. Após a interrupção do uso do medicamento serotoninérgico, podem ocorrer sintomas de abstinência.
Rabdomiólise
Foram relatados casos de rabdomiólise associados ao uso de linezolida. A linezolida deve ser usada com cautela em pacientes com fatores de risco para rabdomiólise. Se ocorrerem sintomas objetivos ou subjetivos de rabdomiólise, é necessário interromper o uso da linezolida e iniciar o tratamento apropriado.
Hiponatremia e síndrome de secreção inadequada de hormônio antidiurético (SIADH)
Em alguns pacientes que receberam linezolida, foram observados casos de hiponatremia e (ou) SIADH. Em pacientes que têm risco de hiponatremia, por exemplo, pacientes idosos ou que estão tomando medicamentos que podem diminuir a concentração de sódio no sangue (como diuréticos tiazídicos, como hidroclorotiazida), é recomendado monitorar regularmente a concentração de sódio no soro.
Neuropatia periférica e neuropatia do nervo óptico
Foram relatados casos de neuropatia periférica e neuropatia do nervo óptico em pacientes que receberam linezolida, sometimes progredindo para perda de visão. Esses relatos foram principalmente em pacientes que receberam tratamento por mais de 28 dias.
É recomendado que todos os pacientes sejam aconselhados a relatar sintomas de deterioração da visão, como alteração da acuidade visual, alteração da visão das cores, visão turva ou déficits no campo visual. Nesses casos, é recomendado que o paciente seja encaminhado para um exame oftalmológico imediatamente. Se o paciente estiver recebendo linezolida por mais de 28 dias, é recomendado monitorar regularmente a função do nervo óptico.
Se ocorrer neuropatia periférica ou neuropatia do nervo óptico, o tratamento com linezolida deve ser condicionado à avaliação do risco.
O risco aumentado de neuropatia durante o uso de linezolida pode ocorrer em pacientes com tuberculose, que estão tomando ou recentemente tomaram medicamentos antimicobacterianos.
Convulsões
Foram relatados casos de convulsões em pacientes que receberam linezolida. Na maioria desses casos, havia história de convulsões ou fatores de risco para convulsões. O médico deve perguntar ao paciente se ele já teve convulsões no passado.
Inibidores da monoamina oxidase
A linezolida é um inibidor reversível e não seletivo da monoamina oxidase (IMAO), mas nas doses usadas para tratar infecções, não tem efeito antidepressivo. Existem apenas dados limitados de estudos sobre interações medicamentosas e segurança do uso de linezolida em pacientes com outras doenças e (ou) que estão tomando medicamentos que podem aumentar o risco associado à inibição da MAO. Nesse caso, não é recomendado usar linezolida, a menos que seja possível um monitoramento e controle rigorosos do estado do paciente.
Consumo de alimentos ricos em tiramina
É recomendado informar o paciente que, durante o uso de linezolida, é necessário limitar o consumo de alimentos ricos em tiramina.
Superinfecções
Nos estudos clínicos, não foi avaliado o efeito do uso de linezolida na flora bacteriana fisiológica.
O uso de antibióticos pode, às vezes, causar um crescimento excessivo de microrganismos resistentes. Por exemplo, durante um estudo clínico, em aproximadamente 3% dos pacientes que receberam doses recomendadas de linezolida, ocorreu candidíase associada ao uso do medicamento. Se ocorrer uma superinfecção durante o uso de linezolida, é necessário iniciar o tratamento apropriado.
Grupos especiais de pacientes
Em pacientes com insuficiência renal grave, a linezolida deve ser usada com cautela e apenas se o benefício esperado superar o risco teórico (ver seções 4.2 e 5.2 do RCP).
Em pacientes com insuficiência hepática grave, a linezolida deve ser usada apenas se o benefício esperado superar o risco teórico.
Distúrbios da fertilidade
O uso de linezolida levou a uma diminuição transitória da fertilidade e induziu uma morfologia anormal de espermatozoides em ratos machos adultos expostos à linezolida em níveis semelhantes aos encontrados em humanos. O efeito da linezolida no sistema reprodutor masculino em humanos é desconhecido.
Estudos clínicos
Não foi estabelecida a segurança ou eficácia do uso de linezolida por mais de 28 dias.
Estudos clínicos controlados não incluíram pacientes com pé diabético, úlceras, lesões isquêmicas, queimaduras graves ou gangrena. Portanto, a experiência com o uso de linezolida nesses casos é limitada.
Excipientes
Glicose
1 mL de solução contém 45,7 mg de glicose (ou seja, 13,7 g em 300 mL de solução). Isso deve ser considerado em pacientes com diabetes ou outras condições associadas à intolerância à glicose.
Sódio
1 mL de solução também contém 0,38 mg de sódio (ou seja, 114 mg em 300 mL de solução), o que corresponde a 0,02% da dose diária máxima recomendada de 2 g de sódio para adultos pela OMS. Isso deve ser considerado
em pacientes que controlam a ingestão de sódio na dieta.
A linezolida em forma de solução para infusão pode ser preparada para administração com soluções que contenham sódio (ver seções 4.2, 6.2 e 6.6) e isso deve ser considerado em relação ao teor total de sódio que será administrado ao paciente, de todas as fontes.
Interações medicamentosas
Inibidores da monoamina oxidase
A linezolida é um inibidor reversível e não seletivo da monoamina oxidase (IMAO). Os dados de estudos sobre interações medicamentosas e segurança do uso de linezolida em pacientes que estão tomando medicamentos que podem inibir a MAO são limitados. Nesse caso, não é recomendado usar linezolida, a menos que seja possível um monitoramento e controle rigorosos do estado do paciente.
Interações que podem aumentar a pressão arterial
Em voluntários saudáveis, a linezolida aumentou a pressão arterial sistólica em resposta à pseudoefedrina e à fenilpropanolamina. O uso concomitante de linezolida e pseudoefedrina ou fenilpropanolamina resultou em um aumento da pressão arterial sistólica de 30-40 mmHg, em comparação com um aumento de 11-15 mmHg quando se usou apenas a linezolida, 14-18 mmHg quando se usou apenas a pseudoefedrina ou fenilpropanolamina e 8-11 mmHg quando se usou placebo. Não foram realizados estudos semelhantes em pacientes com hipertensão arterial. É recomendado ajustar gradualmente a dose de medicamentos vasoconstritores, incluindo medicamentos que atuam nos receptores dopaminérgicos, durante o uso concomitante com linezolida.
Interações serotoninérgicas
Em voluntários saudáveis, foram estudadas as interações entre a linezolida e a dextrometorfano. A dextrometorfano (duas doses de 20 mg com intervalo de 4 horas) foi administrada concomitantemente com a linezolida ou sem ela.
Em indivíduos saudáveis que receberam a linezolida e a dextrometorfano, não foram observados sintomas de síndrome serotoninérgica (ou seja, confusão, delírio, agitação, tremores, rubor, sudorese excessiva, febre alta).
Experiências após a aprovação da linezolida: foi relatado um caso de sintomas semelhantes à síndrome serotoninérgica após a administração concomitante de linezolida e dextrometorfano. Os sintomas desapareceram após a interrupção de ambos os medicamentos.
Durante o uso da linezolida na prática clínica com medicamentos serotoninérgicos, incluindo antidepressivos, como ISRS e opioides, foram relatados casos de síndrome serotoninérgica. Portanto, o uso concomitante desses medicamentos é contraindicado (ver seção 4.3 do RCP). O procedimento para pacientes que necessitam de uso concomitante de linezolida e medicamentos serotoninérgicos foi descrito na seção: Precauções e advertências especiais de utilização.
Consumo de alimentos ricos em tiramina
Não foi observado um aumento significativo da pressão arterial em pacientes que receberam a linezolida e tiramina em doses menores que 100 mg. Isso sugere que apenas é necessário evitar o consumo excessivo de alimentos e bebidas com alto teor de tiramina (por exemplo, queijos maduros, extratos de levedura, bebidas alcoólicas não destiladas e produtos obtidos por fermentação de sementes de soja, como molho de soja).
Medicamentos metabolizados pelo citocromo P450
A linezolida não é metabolizada de forma detectável pelo sistema enzimático do citocromo P450 (CYP) e não inibe a atividade de nenhum dos isoenzimas do CYP de importância clínica (1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Da mesma forma, a linezolida não induz os isoenzimas do citocromo P450 em ratos. Portanto, é provável que não ocorram interações com outros medicamentos relacionadas ao CYP450 durante o uso da linezolida.
Rifampicina
O efeito da rifampicina na farmacocinética da linezolida foi avaliado em um estudo com voluntários, 16 homens saudáveis, que receberam 600 mg de linezolida duas vezes ao dia por 2,5 dias ou linezolida com 600 mg de rifampicina uma vez ao dia por 8 dias. A rifampicina reduziu os valores de C e AUC da linezolida em média 21% [IC de 95%: 15, 27] e 32% [IC de 95%: 27, 37], respectivamente. O mecanismo dessa interação e sua importância clínica são desconhecidos.
Varfarina
Se, durante o tratamento com linezolida, após a alcançar a concentração estável, for iniciada a administração de varfarina, ocorre uma redução de 10% nos valores médios do INR (índice internacional normalizado) e 5% na área sob a curva (AUC) para o INR. Não há dados suficientes de pacientes que receberam concomitantemente linezolida e varfarina para avaliar a importância clínica desses resultados.
Efeitos sobre a fertilidade, gravidez e amamentação
Gravidez
Existem dados limitados sobre o uso da linezolida em mulheres grávidas. Estudos em animais mostraram um efeito tóxico da linezolida na reprodução. Existe um risco durante o uso do medicamento em humanos.
A linezolida não deve ser usada durante a gravidez, a menos que o benefício esperado supere o risco teórico.
Amamentação
Os resultados dos estudos em animais sugerem que a linezolida pode ser excretada no leite humano e, portanto, a amamentação deve ser interrompida antes do início do tratamento com linezolida e não deve ser realizada durante o tratamento.
Fertilidade
Nos estudos em animais, a linezolida causou uma diminuição da fertilidade.
Efeitos sobre a capacidade de conduzir veículos e operar máquinas
É recomendado advertir o paciente que, durante o tratamento com linezolida, podem ocorrer tonturas ou distúrbios da visão e que, nesse caso, não deve dirigir veículos ou operar máquinas.
Efeitos colaterais
A tabela abaixo lista os efeitos colaterais relacionados ao uso da linezolida, com frequência baseada em dados de estudos clínicos realizados em mais de 6.000 pacientes adultos que receberam a linezolida nas doses recomendadas por mais de 28 dias. Os efeitos colaterais mais frequentemente relatados foram: diarréia (8,9%), náuseas (6,9%), vômitos (4,3%) e dor de cabeça (4,2%).
Os efeitos colaterais mais frequentemente relatados que levaram à interrupção do tratamento foram: dor de cabeça, diarréia, náuseas e vômitos. Aproximadamente 3% dos pacientes interromperam o tratamento devido a efeitos colaterais relacionados ao medicamento.
Efeitos colaterais adicionais relatados após a aprovação do medicamento estão listados na tabela abaixo e são descritos como "frequência desconhecida", pois sua frequência não pode ser determinada com base nos dados disponíveis.
Durante o tratamento com linezolida, foram observados e relatados os seguintes efeitos colaterais com as seguintes frequências: muito frequentes (≥1/10), frequentes (≥1/100 a <1>
| Classificação de sistemas e órgãos | Frequente (≥1/100 a <1> | Pouco frequente (≥1/1.000 a <1> | Raro (≥1/10.000 a <1> | Frequência desconhecida (frequência não pode ser determinada com base nos dados disponíveis) |
| Infecções e infestações | candidíase, candidíase oral, candidíase vaginal, infecções fúngicas | colite associada à antibioticoterapia, incluindo colite pseudomembranosa*, colite | ||
| Distúrbios do sangue e do sistema linfático | trombocitopenia*, anemia*† | pancitopenia*, leucopenia*, neutropenia, eosinofilia | anemia sideroblástica* | inibição da medula óssea* |
| Distúrbios do sistema imunológico | anafilaxia | |||
| Distúrbios do metabolismo e da nutrição | hiponatremia | acidose láctica* | ||
| Distúrbios psiquiátricos | insônia | |||
| Distúrbios do sistema nervoso | dor de cabeça, distúrbios do paladar (sabor metálico), tonturas | convulsões*, neuropatia periférica*, parestesia | síndrome serotoninérgica** | |
| Distúrbios oculares | neuropatia do nervo óptico*, | alterações no campo visual* | neurite do nervo óptico*, |
| visão turva* | perda de visão*, alteração da acuidade visual*, alteração da visão das cores* | |||
| Distúrbios do ouvido e do labirinto | zumbido | |||
| Distúrbios cardíacos | distúrbios do ritmo cardíaco (taquicardia) | |||
| Distúrbios vasculares | hipertensão arterial | episódios transitórios de isquemia, flebite, tromboflebite | ||
| Distúrbios gastrointestinais | diarréia, náuseas, vômitos, dor abdominal localizada ou generalizada, constipação, dispepsia | pancreatite, gastrite, flatulência, secura bucal, estomatite, diarreia | descoloração superficial dos dentes | |
| Distúrbios hepáticos e biliares | resultados anormais de testes de função hepática, aumento da atividade da aspartato aminotransferase, alanina aminotransferase e fosfatase alcalina | aumento da bilirrubina total | ||
| Distúrbios da pele e do tecido subcutâneo | prurido, erupção cutânea | angioedema, urticária, eritema multiforme, dermatite, hiperidrose | síndrome de Stevens-Johnson#, necrólise epidérmica tóxica#, vasculite por hipersensibilidade | alopecia |
| Distúrbios musculoesqueléticos e do tecido conjuntivo | rabdomiólise* | |||
| Distúrbios renais e urinários | aumento da creatinina sérica | insuficiência renal, poliúria, aumento da ureia sérica | ||
| Distúrbios do sistema reprodutor e da mama | disfunções vaginais e vulvovaginais |
| Distúrbios gerais e condições no local de administração | febre, dor localizada | calafrios, fadiga, febre, dor no local de injeção, aumento da sede | ||
| Exames diagnósticos | Química: aumento da atividade da lactato desidrogenase, creatina quinase, lipase, amilase ou glicose pós-prandial; diminuição da concentração de proteína total, albumina, sódio ou cálcio; aumento ou diminuição da concentração de potássio ou bicarbonato; Hematologia: aumento da contagem de neutrófilos ou eosinófilos, diminuição da concentração de hemoglobina, hematócrito ou contagem de eritrócitos, aumento ou diminuição da contagem de plaquetas ou leucócitos | Química: aumento da concentração de sódio ou cálcio, diminuição da glicose pós-prandial, aumento ou diminuição da concentração de cloruros; Hematologia: aumento da contagem de reticulócitos, diminuição da contagem de neutrófilos |
*
Ver Precauções e advertências especiais de utilização no RCP.
** Ver Contraindicações e Interações medicamentosas no RCP.
A frequência de ocorrência dos efeitos colaterais foi estimada usando a "regra dos três" de Hanley (em inglês, "The Rule of Three")
†
Ver abaixo.
Os seguintes efeitos colaterais relacionados ao uso da linezolida foram considerados graves em casos raros: dor abdominal localizada, episódios transitórios de isquemia, hipertensão arterial.
† Nos estudos clínicos controlados, durante os quais a linezolida foi administrada por até 28 dias, a anemia foi observada em 2% dos pacientes. Nos estudos que incluíram o uso da linezolida por motivos humanitários antes da aprovação, em pacientes com infecções que ameaçam a vida e doenças concomitantes, a anemia desenvolveu-se em 2,5% (33/1326) dos pacientes tratados com linezolida por ≤28 dias e em 12,3% (53/430) dos pacientes tratados por >28 dias.
Anemia grave relacionada ao medicamento que exigiu transfusão de sangue ocorreu em 9% (3/33) dos pacientes tratados por ≤28 dias e em 15% (8/53) dos pacientes tratados por >28 dias.
Crianças e adolescentes
Dados de segurança do uso da linezolida provenientes de estudos clínicos com mais de 500 crianças e adolescentes (de 0 a 17 anos) não indicam que o perfil de segurança nessa população seja diferente do perfil de segurança em pacientes adultos.
Notificação de suspeitas de efeitos colaterais
Após a aprovação do medicamento, é importante notificar suspeitas de efeitos colaterais. Isso permite o monitoramento contínuo da relação benefício-risco do medicamento. Profissionais de saúde devem notificar qualquer suspeita de efeitos colaterais por meio do Departamento de Monitoramento de Efeitos Colaterais de Medicamentos da Agência Nacional de Vigilância Sanitária.
Endereço: Rua São Paulo, 1001, São Paulo, SP, CEP 01330-100
Telefone: +55 11 3203 2300
Fax: +55 11 3203 2301
Site: https://www.anvisa.gov.br/
Efeitos colaterais também podem ser notificados ao titular do registro do medicamento.
Superdose
Não há um antídoto específico.
Não foi relatado nenhum caso de superdose de linezolida. No entanto, as informações abaixo podem ser úteis no manejo de uma superdose.
É recomendado o uso de tratamento de suporte e manutenção das funções vitais. Aproximadamente 30% da dose de linezolida é eliminada do organismo durante uma hemodiálise de 3 horas; no entanto, não há dados sobre a eliminação da linezolida por diálise peritoneal ou hemoperfusão.
Preparo do medicamento para uso
Para uso único.
Bolsa freeflex
Antes da administração, retire a folha externa, verifique se não há pequenas vazamentos apertando firmemente a bolsa. Se a bolsa estiver vazando, não use o medicamento, pois pode não ser estéril. Verifique a solução antes da administração. Use apenas solução transparente e livre de partículas sólidas. Não use bolsas em série. Descarte qualquer resíduo de medicamento ou embalagem de acordo com as regulamentações locais. Não conecte bolsas com conteúdo parcialmente usado.
Frasco KabiPac
Retire o frasco da caixa de papelão antes da administração. Verifique a solução antes da administração. Use apenas solução transparente e livre de partículas sólidas. Não use frascos em série. Descarte qualquer resíduo de medicamento ou embalagem de acordo com as regulamentações locais. Não conecte frascos com conteúdo parcialmente usado.
A linezolida Kabi, 2 mg/mL, solução para infusão, é compatível com as seguintes soluções: 50 mg/mL (5%) solução de glicose para infusão intravenosa; 9 mg/mL (0,9%) solução de cloreto de sódio para infusão intravenosa; solução de Ringer com lactato para injeção (solução de Hartmann para injeção).
Incompatibilidades farmacêuticas
Não adicione outros medicamentos à solução. Se a linezolida for administrada concomitantemente com outros medicamentos, cada medicamento deve ser administrado separadamente, de acordo com as recomendações para seu uso. Se a mesma linha de infusão for usada para administrar vários medicamentos em sequência, a linha deve ser completamente lavada com uma solução compatível para infusão antes e após a administração da linezolida.
A linezolida é fisicamente incompatível com os seguintes medicamentos: anfotericina B, clorpromazina, diazepam, pentamidina, eritromicina, fenitoína e sulfametoxazol com trimetoprima. Além disso, é incompatível quimicamente com a solução de ceftriaxona sódica.
Prazo de validade
Foi demonstrada a estabilidade química e física da solução pronta para uso por 24 horas a 2-8°C e 25°C. Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente, a menos que o método de abertura exclua o risco de contaminação microbiológica. Se o medicamento não for usado imediatamente, o tempo e as condições de armazenamento durante o uso são de responsabilidade do usuário.
Precauções especiais de armazenamento
Bolsa freeflex
Armazenar no embalagem original (bolsa externa e caixa de papelão) para proteger da luz.
Frascos KabiPac
Até o momento do uso, armazenar no caixa de papelão para proteger da luz.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorFresenius Kabi Polska Sp. z o.o. HP Halden Pharma AS
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Linezolid KabiForma farmacêutica: Solução, 2 mg/mlSubstância ativa: linezolidFabricante: Zakłady Farmaceutyczne POLPHARMA S.A.Não requer receita médicaForma farmacêutica: Solução, 2 mg/mlSubstância ativa: linezolidNão requer receita médicaForma farmacêutica: Comprimidos, 600 mgSubstância ativa: linezolidFabricante: Krka, d.d., Novo mesto TAD Pharma GmbHRequer receita médica
Alternativas a Linezolid Kabi noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Linezolid Kabi em Espanha
Alternativa a Linezolid Kabi em Ukraine
Médicos online para Linezolid Kabi
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Linezolid Kabi – sujeita a avaliação médica e regras locais.














