
Duosol zauieraiomci 4 mmol/l potasu
Pergunte a um médico sobre a prescrição de Duosol zauieraiomci 4 mmol/l potasu

Como usar Duosol zauieraiomci 4 mmol/l potasu
Folheto informativo para o doente: informação para o paciente
Duosol contendo 4 mmol/l de potássio, solução para hemofiltração
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém
informações importantes para o doente
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não listado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Duosol contendo 4 mmol/l de potássio e para que é usado
- 2. Informações importantes antes de usar o medicamento Duosol contendo 4 mmol/l de potássio
- 3. Como usar o medicamento Duosol contendo 4 mmol/l de potássio
- 4. Efeitos não desejados
- 5. Como armazenar o medicamento Duosol contendo 4 mmol/l de potássio
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Duosol contendo 4 mmol/l de potássio e para que é usado
O Duosol contendo 4 mmol/l de potássio é uma solução para hemofiltração. Este medicamento é destinado a doentes com insuficiência renal aguda, nos quais os rins não conseguem remover os produtos do metabolismo do sangue. O processo de hemofiltração contínua consiste na remoção do organismo dos produtos do metabolismo que, em condições normais, são excretados pelos rins. A solução equilibra o balanço de líquidos e fornece suplementos de sais (eletrólitos) perdidos.
2. Informações importantes antes de usar o medicamento Duosol contendo 4 mmol/l de potássio
O medicamento Duosol contendo 4 mmol/l de potássio não deve ser usado se:
- o doente tiver níveis de potássio no sangue anormalmente altos (hiperpotassemia);
- o doente tiver níveis de ácidos no sangue anormalmente baixos (alcalose metabólica).
A hemofiltração não deve ser usada nos seguintes casos:
- insuficiência renal combinada com processos metabólicos intensos (hipercatabolismo); nesse caso, os produtos do metabolismo acumulados não podem ser removidos por hemofiltração por um período prolongado;
- fluxo sanguíneo insuficiente do acesso venoso;
- qualquer condição que aumente o risco de sangramento, pois o doente está a receber medicamentos que impedem a formação de coágulos (anticoagulação sistémica).
Precauções e advertências
Antes de iniciar o uso do medicamento Duosol contendo 4 mmol/l de potássio, deve discutir com o médico ou farmacêutico.
Antes e durante a hemofiltração, deve monitorizar a pressão arterial, o balanço de líquidos, o balanço de sais (eletrólitos), o balanço ácido-base e a função renal. Deve verificar regularmente os níveis de açúcar e fosfatos no sangue.
Antes e durante a hemofiltração, deve também monitorizar os níveis de potássio no sangue.
Interacções com outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
A concentração de outros medicamentos no sangue pode diminuir durante a hemofiltração e o médico terá isso em consideração.
Ao usar doses apropriadas da solução para hemofiltração e monitorizar cuidadosamente, pode evitar interacções com outros medicamentos.
Serão consideradas as seguintes interacções:
- Infusões administradas no contexto de cuidados intensivos podem alterar a composição do sangue e o estado de líquidos do doente.
- Os efeitos tóxicos de alguns medicamentos usados no tratamento da fraqueza cardíaca (medicamentos que contêm digital) podem não ser aparentes quando os níveis de potássio ou magnésio são demasiado altos ou os níveis de cálcio são demasiado baixos. Se esses níveis forem corrigidos pela hemofiltração, podem ocorrer efeitos tóxicos e causar, por exemplo, distúrbios do ritmo cardíaco. Se o doente tiver níveis baixos de potássio ou níveis altos de cálcio no sangue, a digital pode ter um efeito tóxico em doses mais baixas do que as usualmente usadas no tratamento.
- A administração de vitamina D e medicamentos que contêm cálcio pode aumentar o risco de níveis altos de cálcio no sangue (hipercalcemia).
- A administração adicional de bicarbonato de sódio pode aumentar o risco de níveis baixos de ácidos no sangue (alcalose metabólica).
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar ter um filho, deve consultar um médico ou farmacêutico antes de receber este medicamento.
Não há dados sobre o uso de soluções para hemofiltração em mulheres grávidas. No entanto, como todos os componentes deste medicamento são substâncias naturais que apenas substituem as mesmas substâncias perdidas pelo organismo durante a hemofiltração, não se espera que haja riscos para o feto durante a gravidez e amamentação e não se espera que haja impacto na fertilidade.
Condução de veículos e utilização de máquinas
Este medicamento é geralmente administrado a doentes imobilizados no hospital ou na unidade de diálise. Isso exclui a condução de veículos e a utilização de máquinas.
3. Como usar o medicamento Duosol contendo 4 mmol/l de potássio
Este medicamento será administrado ao doente apenas sob supervisão de um médico com experiência em técnicas de hemofiltração.
O médico decidirá a dose apropriada para o doente, considerando o estado clínico, o peso corporal e as condições metabólicas. A menos que seja recomendado de outra forma, em doentes de todas as idades, recomenda-se uma velocidade de filtração de 20-25 ml/kg de peso corporal por hora, para garantir a eliminação das substâncias que normalmente são excretadas na urina.
Ao doente é administrada uma solução pronta para uso para hemofiltração através de tubos do aparelho de hemofiltração (circuito extracorpóreo) com uma bomba de infusão.
O tratamento da insuficiência renal aguda é realizado por um período limitado e termina quando a função renal é restaurada.
Uso de uma dose maior do que a recomendada do medicamento Duosol contendo 4 mmol/l de potássio
Após a administração das doses recomendadas deste medicamento, não foram relatados casos que ameacem a vida. Se necessário, a administração pode ser interrompida a qualquer momento.
Um equilíbrio inadequado de líquidos pode levar à presença de demasiado ou demasiado pouco líquido no organismo (sobrecarga de líquidos ou desidratação). Essas condições são caracterizadas por alterações na pressão arterial ou frequência cardíaca.
Pode ocorrer uma sobredose de bicarbonato de sódio se for administrada uma quantidade excessiva da solução para hemofiltração. Isso pode levar a níveis baixos de ácidos no sangue (alcalose metabólica), menor quantidade de cálcio dissolvido no sangue (diminuição da concentração de cálcio ionizado) ou espasmos musculares (tetania).
A sobredose pode causar insuficiência cardíaca congestiva e (ou) congestão pulmonar e pode causar alterações no balanço de sais (eletrólitos) e no balanço ácido-base.
O médico decidirá o tratamento apropriado.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar um médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não em todos os doentes.
Não foram relatados efeitos não desejados associados ao uso deste medicamento, mas são possíveis os seguintes efeitos não desejados. A frequência desses efeitos não desejados é desconhecida (não pode ser estimada com base nos dados disponíveis):
Excesso ou falta de líquido no organismo (sobrecarga de líquidos ou desidratação), níveis anormais de sais (eletrólitos), níveis baixos de fosfato no sangue (hipofosfatemia), níveis altos de açúcar no sangue (hiperglicemia), níveis baixos de ácidos no sangue (alcalose metabólica), pressão arterial muito alta ou muito baixa (hipertensão, hipotensão), náuseas, vômitos e espasmos musculares.
Notificação de efeitos não desejados
Após a autorização do medicamento, é importante notificar suspeitas de efeitos não desejados. Isso permite o monitoramento contínuo da relação benefício-risco do medicamento.
Os profissionais de saúde devem notificar qualquer suspeita de efeito não desejado através do Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Reguladora de Medicamentos, Produtos Médicos e Produtos Biocidas, Al. Jerozolimskie 181C, 02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
site da internet: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do uso deste medicamento.
5. Como armazenar o medicamento Duosol contendo 4 mmol/l de potássio
O medicamento deve ser armazenado em local não visível e inacessível a crianças.
Não use este medicamento após a data de validade impressa no saco e na caixa após:
“Data de validade”. A data de validade é o último dia do mês indicado.
Condições de armazenamento
Não armazenar a uma temperatura superior a 25°C. Não armazenar no refrigerador ou congelar.
Condições de armazenamento após a preparação da solução pronta para uso
O produto misturado deve ser usado imediatamente. O produto misturado mantém a estabilidade física e química por 24 horas a 25°C.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Duosol contendo 4 mmol/l de potássio
| Substâncias ativas: | Câmara menor Solução de eletrólitos | Câmara maior Solução de bicarbonato | ||
| 555 ml contém | por 1000 ml | 4445 ml contém | por 1000 ml | |
| cloreto de sódio | 2,34 g | 4,21 g | 27,47 g | 6,18 g |
| cloreto de potássio | 1,49 g | 2,68 g | ||
| cloreto de cálcio di-hidratado | 1,10 g | 1,98 g | ||
| cloreto de magnésio hexa-hidratado | 0,51 g | 0,91 g | ||
| glicose mono-hidratada que corresponde a glicose anidra | 5,49 g 5,0 g | 9,90 g 9,0 g | ||
| bicarbonato de sódio | 15,96 g | 3,59 g | ||
| Eletrólitos: | [mmol/ câmara] | [mmol/l] | [mmol/ câmara] | [mmol/l] |
| Na+ | 40,0 | 72 | 660 | 149 |
| K+ | 20,0 | 36,0 | ||
| Ca2+ | 7,5 | 13,5 | ||
| Mg2+ | 2,5 | 4,5 | ||
| Cl- | 95,0 | 171 | 470 | 106 |
| HCO3- | 190 |
| ||
| osmolalidade teórica [mOsm/l] | 347 | 297 | ||
Composição da solução pronta para uso para hemofiltração após mistura:
1000 ml da solução pronta para uso para hemofiltração contém [mmol/l]:
Na
140
K 4,0
Ca
1,5
Mg
0,5
Cl
113
HCO3
35,0
glicose anidra
5,6 (que corresponde a 1,0 g)
osmolalidade teórica [mOsm/l]
300
pH
7,0-8,0
Outros componentes são:
Solução de eletrólitos (câmara menor)
ácido clorídrico 25% (para ajustar o pH), água para injeção
Solução de bicarbonato (câmara maior)
dióxido de carbono (para ajustar o pH), água para injeção
Como é o medicamento Duosol contendo 4 mmol/l de potássio e o que a embalagem contém
Solução para hemofiltração
Líquido transparente e incolor, sem partículas visíveis
Este medicamento é fornecido em um saco de duas câmaras. Ao misturar as duas soluções após a abertura da divisória entre as câmaras, obtém-se a solução pronta para uso para hemofiltração.
2 sacos de 5000 ml (sacos de duas câmaras, 4445 ml e 555 ml) em uma caixa de cartão.
Titular da autorização de comercialização e fabricante
- B. Braun Avitum AG Schwarzenberger Weg 73-79 34212 Melsungen Alemanha
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia sob os seguintes nomes:
República Checa:
Duosol s 4 mmol/l draslíku
Grécia:
Duosol com 4 mmol/l potássio Διάλυμα αιμοδιήθησης
Estônia:
Duosol koos 4 mmol/l kaaliumiga, hemofiltratsioonilahus
Finlândia:
Duosol cum 4 mmol/l Kalium hemofiltraationeste
Itália:
Duosol com 4 mmol/l de potássio solução para hemofiltragem
Letônia:
Duosol ar 4 mmol/l kālija šķīdums hemofiltrācijai
Lituânia:
Duosol K 4 hemofiltracijos tirpalas
Alemanha, Luxemburgo:
Duosol com 4 mmol/l potássio Hämofiltrationslösung
Polônia:
Duosol contendo 4 mmol/l potássio
Eslovênia:
Duosol s 4 mmol/l kalija raztopina za hemofiltracijo
Espanha:
Priosol com 4 mmol/l de potássio solução para hemofiltragem
Países Baixos:
Duosol com 4 mmol/l potássio, solução para hemofiltragem
Reino Unido:
Duosol com 4 mmol/l potássio solução para hemofiltragem
Data da última atualização do folheto: 05.05.2023
---------------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Instruções para a preparação da solução pronta para uso para hemofiltração
Antes de usar, deve submeter o recipiente e a solução a um controle visual. A solução para hemofiltração só pode ser usada se o recipiente (embalagem externa de proteção e saco de duas câmaras), a divisória entre as câmaras e as conexões estiverem intactos e não danificados, e a solução for transparente, incolor e livre de partículas visíveis.
A embalagem externa de proteção deve ser removida imediatamente antes do uso.
- 1. Remover a embalagem externa de proteção.
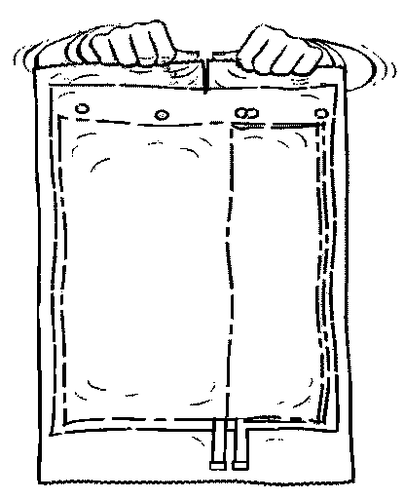
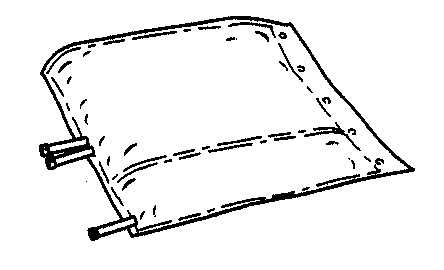
- 2. Esticar o saco e colocá-lo em uma superfície plana e limpa.
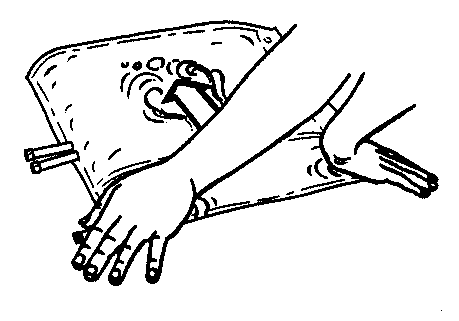
- 3. Pressionar a câmara menor do saco com as duas mãos, de modo a abrir completamente a divisória entre as câmaras ao longo de toda a sua extensão.
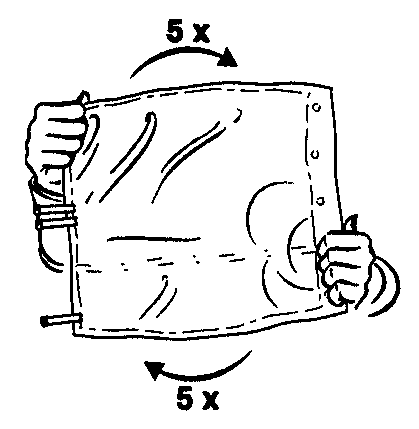
- 4. Garantir a mistura completa do conteúdo, girando o saco cinco vezes em ambos os sentidos.
Administração da solução pronta para uso para hemofiltragem
A solução para hemofiltragem deve ser aquecida aproximadamente à temperatura corporal com um aquecedor integrado ou externo. Em nenhum caso deve ser administrada a solução se estiver abaixo da temperatura ambiente.
Durante o uso deste medicamento, foram observados, em casos raros, a formação de um precipitado branco de carbonato de cálcio nos tubos, especialmente perto da bomba e do dispositivo de aquecimento. Por isso, durante a hemofiltragem, deve ser controlado visualmente o líquido nos tubos de infusão a cada 30 minutos, para garantir que a solução nos tubos é transparente e livre de precipitação.
Precipitações também podem ocorrer com um atraso significativo após o início do tratamento. Se forem observadas precipitações, deve-se substituir imediatamente a solução e os tubos de infusão e monitorizar cuidadosamente o doente.
Para uso único. O conteúdo não utilizado da solução e quaisquer recipientes danificados devem ser descartados.
- País de registo
- Requer receita médicaNão
- Fabricante
- ImportadorB. Braun Avitum AG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Duosol zauieraiomci 4 mmol/l potasuForma farmacêutica: Solução, 9 mg/mlSubstância ativa: sodium chlorideRequer receita médicaForma farmacêutica: Solução, 100 mg/mlSubstância ativa: dextranFabricante: Fresenius Kabi Italia S.r.L.Não requer receita médicaForma farmacêutica: Concentrado, -Substância ativa: electrolytes in combination with other drugsFabricante: Fresenius Kabi Norge ASNão requer receita médica
Alternativas a Duosol zauieraiomci 4 mmol/l potasu noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Duosol zauieraiomci 4 mmol/l potasu em Україна
Alternativa a Duosol zauieraiomci 4 mmol/l potasu em Іспанія
Médicos online para Duosol zauieraiomci 4 mmol/l potasu
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Duosol zauieraiomci 4 mmol/l potasu – sujeita a avaliação médica e regras locais.














