

Biofuroksim

Pergunte a um médico sobre a prescrição de Biofuroksim

Como usar Biofuroksim
Folheto informativo para o utilizador
Biofuroxima
250 mg, 500 mg, 750 mg
pó de preparação de solução ou suspensão para injeção
Cefuroxima
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou a enfermeira.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou a enfermeira. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Biofuroxima e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Biofuroxima
- 3. Como tomar o medicamento Biofuroxima
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Biofuroxima
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Biofuroxima e para que é utilizado
A Biofuroxima é um antibiótico utilizado em adultos e crianças. O medicamento actua destruindo as bactérias que causam infecções. Pertence a um grupo de medicamentos chamados cefalosporinas.
A Biofuroxima é utilizada para tratar infecções:
- pulmonares ou do tórax,
- do trato urinário,
- da pele e tecidos moles,
- abdominais.
A Biofuroxima também é utilizada:
- para prevenir infecções durante operações.
2. Informações importantes antes de tomar o medicamento Biofuroxima
Quando não tomar o medicamento Biofuroxima:
- se o doente for alérgico a antibióticos cefalosporínicosou a qualquer um dos outros componentes do medicamento Biofuroxima (listados no ponto 6);
- se o doente já teve uma reação alérgica grave (hipersensibilidade) a qualquer outro tipo de antibiótico beta-lactâmico (penicilinas, monobactamas ou carbapenemas);
- se o doente já teve uma erupção cutânea grave ou descamação da pele, bolhas e (ou) úlceras na boca após tratamento com cefuroxima ou outros antibióticos do grupo das cefalosporinas.
➔
Se o doente achar que se aplica a alguma das situações acima, deve dizer ao médico
antesde começar a tomar o medicamento Biofuroxima. O doente não pode
tomar o medicamento Biofuroxima.
Precauções e advertências
Durante o tratamento com o medicamento Biofuroxima, deve prestar atenção a sintomas como
reações alérgicas e distúrbios gastrointestinais (por exemplo, diarreia). Isso reduz o risco de complicações (ver "Sintomas a que deve prestar atenção" no ponto 4). Se o doente já teve alguma reação alérgica a outros antibióticos, como a penicilina, pode ser alérgico à Biofuroxima.
Foram relatados casos de reações cutâneas graves com cefuroxima, como síndrome de Stevens-Johnson, necrólise tóxica epidermal e reação medicamentosa com eosinofilia e sintomas sistémicos (DRESS, do inglês drug reaction with eosinophilia and systemic symptoms). Se o doente notar algum dos sintomas relacionados com reações cutâneas graves descritas no ponto 4, deve procurar imediatamente um médico.
Exames de sangue e urina
A Biofuroxima pode afetar os resultados dos exames que detectam açúcar na urina ou no sangue e do exame de sangue chamado teste de Coombs. Se o doente for submetido a tais exames, deve:
➔
dizer à pessoa que colher a amostra para exameque está a tomar o medicamento Biofuroxima.
Biofuroxima e outros medicamentos
Deve dizer ao médico todos os medicamentos que está a tomar atualmente ou recentemente, bem como os medicamentos que planeia tomar. Isso inclui medicamentos que são vendidos sem receita.
Alguns medicamentos podem afetar a ação do medicamento Biofuroxima ou aumentar o risco de efeitos não desejados. Incluem:
- antibióticos do grupo chamado aminoglicosídeos,
- comprimidos diuréticos(diuréticos), por exemplo, furosemida,
- probenecida,
- medicamentos orais anticoagulantes(anticoagulantes). ➔ Se isso se aplicar ao doente, deve dizer ao médico. Durante o tratamento com o medicamento Biofuroxima, pode ser necessário realizar um controlo adicional do funcionamento dos rins no doente.
Gravidez, amamentação e fertilidade
Deve informar o médico antes de tomar o medicamento Biofuroxima:
- se a paciente está grávida, suspeita que possa estar grávida ou planeia engravidar,
- se a paciente está a amamentar.
O médico avaliará se os benefícios para a paciente, resultantes da utilização do medicamento Biofuroxima durante a gravidez e amamentação, superam os riscos para o bebê.
Condução de veículos e utilização de máquinas
O doente não deve conduzir veículos ou operar máquinas se não se sentir bem.
O medicamento Biofuroxima contém sódio
Biofuroxima, 250 mg
O medicamento contém 14 mg de sódio (principal componente do sal de cozinha) em cada frasco. Isso corresponde a 0,7%
da dose diária máxima recomendada de sódio na dieta para adultos.
Biofuroxima, 500 mg
O medicamento contém 28 mg de sódio (principal componente do sal de cozinha) em cada frasco. Isso corresponde a 1,4%
da dose diária máxima recomendada de sódio na dieta para adultos.
Biofuroxima, 750 mg
O medicamento contém 42 mg de sódio (principal componente do sal de cozinha) em cada frasco. Isso corresponde a 2,1%
da dose diária máxima recomendada de sódio na dieta para adultos.
Preparação do medicamento para administração - ver ponto: “Informações destinadas apenas ao pessoal médico qualificado” no final do folheto. Ao calcular o conteúdo total de sódio na solução preparada do medicamento, deve ter em conta o sódio proveniente do diluente. Para obter informações precisas sobre o conteúdo de sódio na solução utilizada para diluir o medicamento, deve consultar o folheto do paciente do diluente utilizado.
Deve ter isso em consideração em doentes que controlam o conteúdo de sódio na dieta.
3. Como tomar o medicamento Biofuroxima
A Biofuroxima é geralmente administrada por um médico ou enfermeira. Pode ser administrada
em gotejamento(infusão intravenosa) ou como injeçãoadministrada diretamente na veia ou
intramuscularmente.
Dose habitualmente utilizada
O médico decidirá a dose adequada do medicamento Biofuroxima para o doente, tendo em conta
a gravidade e o tipo de infecção, a tomada de outros antibióticos pelo doente, o seu peso, idade e funcionamento dos rins.
Recém-nascidos e lactentes (com idade entre 0-3 semanas)
Para cada quilograma de peso do lactenteadministra-se uma dose de 30 a 100 mg do medicamento Biofuroxima
por dia, dividida em duas ou três doses.
Lactentes (com idade superior a 3 semanas) e crianças
Para cada quilograma de peso do lactente ou criançaadministra-se uma dose de 30 a 100 mg do medicamento Biofuroxima
por dia, dividida em três ou quatro doses.
Adultos e jovens
De 750 mg a 1,5 g do medicamento Biofuroxima, duas, três ou quatro vezes por dia. Não mais de 6 g por dia.
Doentes com rins doentes
Se o doente tiver rins doentes, o médico pode alterar a dose do medicamento.
➔
Se isso se aplicar ao doente, deve dizer ao médico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Sintomas a que deve prestar atenção
Em um pequeno número de pessoas que tomam o medicamento Biofuroxima, foi relatada uma reação alérgica ou
uma reação cutânea potencialmente grave. Os sintomas podem ser os seguintes.
- Erupção cutânea generalizada, febre alta e linfonodos aumentados(síndrome de DRESS ou síndrome de hipersensibilidade ao medicamento).
- Dor no peitorelacionada com uma reação alérgica, que pode ser um sinal de ataque cardíaco
causado por alergia (síndrome de Kounis).
- Reação alérgica grave. Os sintomas incluem: erupção cutânea elevada, coceira e inchaço, por vezes na face ou lábios, que pode dificultar a respiração.
- Erupção cutânea, que pode transformar-se em bolhase parecer anéis pequenos(mancha escura no centro cercada por uma borda mais clara com um anel escuro ao redor da borda).
- Lesões cutâneas generalizadas, com bolhas e descamação da pele. (Pode ser um sinal de síndrome de Stevens-Johnson ou necrólise tóxica epidermal - doença de Lyell).
- Infecções fúngicas. Medicamentos como a Biofuroxima podem causar, raramente, um crescimento excessivo de leveduras ( Candida) no organismo, o que pode levar a uma infecção fúngica (por exemplo, candidíase). O risco de ocorrer este efeito não desejado é maior se o medicamento Biofuroxima for utilizado por um longo período.
➔
Se o doente apresentar algum dos sintomas acima, deve contactar imediatamente um médico ou enfermeira.
Efeitos não desejados frequentes(ocorrem em menos de 1 em cada 10 doentes):
- dor no local da injeção, inchaço e vermelhidão ao longo da veia.
- Se o doente apresentar algum desses efeitos não desejados, deve dizer ao médico.
Efeitos não desejados frequentes que podem ser detectados em exames de sangue:
- aumento da actividade de substâncias (enzimas) produzidas no fígado,
- mudança no número de glóbulos brancos (neutropenia ou eosinofilia),
- diminuição do número de glóbulos vermelhos (anemia).
Efeitos não desejados não muito frequentes(ocorrem em menos de 1 em cada 100 doentes):
- erupção cutânea, urticária,
- diarreia, náuseas, dor abdominal. ➔ Se o doente apresentar algum desses efeitos não desejados, deve dizer ao médico.
Efeitos não desejados não muito frequentes que podem ser detectados em exames de sangue:
- diminuição do número de glóbulos brancos (leucopenia),
- aumento da concentração de bilirrubina (substância produzida pelo fígado),
- resultado positivo do teste de Coombs.
Outros efeitos não desejados
Outros efeitos não desejados ocorrem em um número muito pequeno de doentes, mas a frequência exata não é conhecida (a frequência não pode ser determinada com base nos dados disponíveis):
- infecção fúngica,
- febre alta,
- reações alérgicas (hipersensibilidade),
- inflamação do intestino grosso (colite), que pode causar diarreia, geralmente com sangue e muco, dores abdominais,
- inflamação dos rins e vasos sanguíneos,
- destruição rápida de glóbulos vermelhos (anemia hemolítica),
- erupção cutânea, que pode transformar-se em bolhas e parecer anéis pequenos (mancha escura no centro cercada por uma borda mais clara com um anel escuro ao redor da borda).
➔
Se o doente apresentar algum dos efeitos não desejados acima, deve dizer ao médico.
Efeitos não desejados que podem ser detectados em exames de sangue:
- diminuição do número de plaquetas (células que participam na coagulação do sangue - trombocitopenia),
- aumento da concentração de azoto ureico e creatinina no sangue.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve dizer ao médico ou farmacêutico. Os efeitos não desejados podem ser notificados directamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Instituto Nacional de Farmácia e Medicamentos
Av. do Brasil, 53
1749-004 Lisboa
Telefone: +351 21 798 7000
Fax: +351 21 798 7055
Sítio da Internet: https://www.infarmed.pt/
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Biofuroxima
Manter o medicamento fora do alcance e da vista das crianças.
O medicamento deve ser conservado a uma temperatura inferior a 25 ºC, sem exposição à luz.
Após reconstituição, a solução mantém a estabilidade durante 24 horas a uma temperatura entre 2 ºC e 8 ºC.
Não utilizar este medicamento após o prazo de validade impresso na embalagem. O prazo de validade é o último dia do mês indicado.
A indicação na embalagem após a abreviatura EXP significa prazo de validade e após a abreviatura Lote significa número do lote.
Os medicamentos não devem ser eliminados na canalização ou nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não necessita. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Biofuroxima
- A substância ativa do medicamento é a cefuroxima. Cada frasco contém 250 mg, 500 mg ou 750 mg de cefuroxima (na forma de sal sódico). O medicamento não contém substâncias auxiliares.
Como é o medicamento Biofuroxima e que conteúdo tem a embalagem
O medicamento tem a forma de pó branco ou quase branco, cristalino, em frasco de vidro contendo, respectivamente, 250 mg, 500 mg ou 750 mg de pó. Os frascos são fechados com um rolha de borracha e protegidos por uma cápsula de alumínio ou uma cápsula de alumínio com uma tampa e embalados em caixas de cartão.
A embalagem contém 1 ou 10 frascos.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
LABORATÓRIO EDOL - PRODUTOS FARMACÊUTICOS, S.A.
Rua João de Deus, 21
1200-470 Lisboa
Telefone: +351 21 351 95 00
Fabricante
MYLAN S.A.S.
117, Avenue de Genève
69740 Genas
FRANÇA
Data da última revisão do folheto: ----------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico qualificado:
Instruções para a reconstituição
Tabela 1. Volumes de água a adicionar e concentrações da solução úteis quando for necessário utilizar doses fracionadas.
| Tamanho do frasco | Via de administração | Volume de água a adicionar | Concentração aproximada de cefuroxima** |
| 250 mg | intramuscular | 1 ml | 216 mg/ml |
| intravenosa | pelo menos 2 ml | 116 mg/ml | |
| 500 mg | intramuscular | 2 ml | 216 mg/ml |
| intravenosa | 4 ml | 116 mg/ml | |
| 750 mg | intramuscular | 3 ml | 216 mg/ml |
| injeção intravenosa | pelo menos 6 ml | 116 mg/ml | |
| infusão intravenosa | pelo menos 6 ml | 116 mg/ml |
** O volume da solução de cefuroxima obtida no diluente aumenta devido ao coeficiente de deslocamento da fase da substância ativa, da qual resultam as concentrações apresentadas (mg/ml).
Compatibilidade
A cefuroxima sódica (5 mg/ml) em solução de 5% em volume ou 10% em volume de xilitol para injeção pode ser conservada durante 24 horas a 25ºC.
A cefuroxima sódica é compatível com soluções aquosas que contenham não mais de 1% de cloridrato de lidocaína.
A cefuroxima sódica é compatível com os seguintes fluidos para infusão, com os quais a actividade é mantida durante 24 horas à temperatura ambiente:
solução de 0,9% em volume de cloreto de sódio
solução de 5% de glicose para injeção
solução de 0,18% em volume de cloreto de sódio com 4% de solução de glicose para injeção
solução de 5% de glicose e 0,9% de solução de cloreto de sódio para injeção
solução de 5% de glicose e 0,45% de solução de cloreto de sódio para injeção
solução de 5% de glicose e 0,225% de solução de cloreto de sódio para injeção
solução de 10% de glicose para injeção
solução de 10% de xarope de açúcar invertido em água para injeção
solução de Ringer para injeção
solução de Ringer lactato para injeção
solução de lactato de sódio para injeção (M/6)
solução de lactato de sódio multicomponente para injeção (solução de Hartmann).
A estabilidade da cefuroxima sódica em solução de 0,9% em volume de cloreto de sódio para injeção e em solução de 5% de glicose para injeção não é afectada pela presença de sal sódico de fosfato de hidrocortisona.
A cefuroxima sódica também é compatível durante 24 horas à temperatura ambiente se for adicionada a uma solução para infusão intravenosa que contenha:
heparina (10 ou 50 unidades/ml) em solução de 0,9% em volume de cloreto de sódio para injeção;
cloruro de potássio (10 ou 40 mEq/l) em solução de 0,9% em volume de cloreto de sódio para injeção.
Qualquer medicamento não utilizado ou resíduos deve ser eliminado de acordo com os requisitos locais.
Preparação da solução para injeção rápida
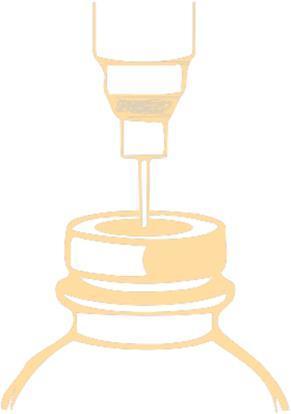
Perfurar o rolha com uma agulha e injetar no frasco o volume recomendado de diluente. Para perfurar o rolha, deve utilizar uma agulha com diâmetro não superior a 0,8 mm. A agulha deve ser inserida no campo centralmente definido a um ângulo de 90°, de acordo com o esquema abaixo:
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorZakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w Duchnicach
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a BiofuroksimForma farmacêutica: Pó, 50 mgSubstância ativa: cefuroximeFabricante: Biopharma S.r.L. Laboratoires TheaRequer receita médicaForma farmacêutica: Pó, 1.5 gSubstância ativa: cefuroximeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequer receita médicaForma farmacêutica: Pó, 500 mgSubstância ativa: cefuroximeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequer receita médica
Alternativas a Biofuroksim noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Biofuroksim em Espanha
Alternativa a Biofuroksim em Ukraine
Médicos online para Biofuroksim
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Biofuroksim – sujeita a avaliação médica e regras locais.














