

Aprokam

Pergunte a um médico sobre a prescrição de Aprokam

Como usar Aprokam
Folheto informativo para o doente
APROKAM, 50 mg, pó de cefuroxima para solução injetável
Cefuroxima
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é APROKAM e para que é utilizado
- 2. Informações importantes antes de tomar APROKAM
- 3. Como tomar APROKAM
- 4. Efeitos não desejados
- 5. Como conservar APROKAM
- 6. Conteúdo da embalagem e outras informações
1. O que é APROKAM e para que é utilizado
- APROKAM contém a substância ativa cefuroxima (na forma de cefuroxima sódica), que pertence a um grupo de antibióticos chamados cefalosporinas. Os antibióticos são utilizados para matar bactérias ou "microrganismos patogénicos" que causam infecções.
- Este medicamento será utilizado quando o doente for submetido a uma operação de catarata (opacidade do cristalino).
- O cirurgião oftalmologista administrará este medicamento por injeção no olho no final da operação de catarata para prevenir a infecção do olho.
2. Informações importantes antes de tomar APROKAM
Quando não tomar APROKAM
- Se o doente for alérgico à cefuroxima ou a qualquer um dos antibióticos do grupo das cefalosporinas.
Precauções e advertências
Antes de tomar APROKAM, deve informar o médico, farmacêutico ou enfermeiro:
- se o doente for alérgico a outros antibióticos, como a penicilina,
- se o doente tiver risco de infecção causada por bactérias chamadas Staphylococcus aureus resistente à meticilina,
- se o doente tiver risco de infecção grave,
- se o doente tiver catarata complicada,
- se estiver planeada uma operação combinada de olho,
- se o doente tiver doença grave da tiróide.
APROKAM é administrado exclusivamente por injeção no olho (injeção na câmara anterior do olho).
APROKAM deve ser administrado em condições assépticas (ambiente limpo e livre de microrganismos) durante a operação de catarata.
Cada frasco de APROKAM é destinado a um único doente.
APROKAM e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Gravidez e amamentação
- se a doente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
- APROKAM será administrado à doente apenas se os benefícios superarem os riscos potenciais.
APROKAM contém sódio
O medicamento contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar APROKAM
- As injeções de APROKAM serão administradas pelo cirurgião oftalmologista no final da operação de catarata.
- APROKAM é fornecido na forma de pó estéril (asseptico) e antes da administração é dissolvido em solução de cloreto de sódio para injeção.
Uso de dose maior do que a recomendada ou menor do que a recomendada de APROKAM
O medicamento será geralmente administrado por pessoal médico.
Em caso de dúvidas adicionais sobre a administração deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, APROKAM pode causar efeitos não desejados, embora não ocorram em todos.
O seguinte efeito não desejado ocorre muito raramente (pode afetar até 1 em 10.000 pessoas):
- Reação alérgica grave, que causa dificuldade em respirar ou tontura.
O seguinte efeito não desejado é relatado com frequência "desconhecida" (frequência não pode ser determinada com base nos dados disponíveis):
- Edema da mácula (visão não nítida ou ondulada no centro do campo de visão ou perto dele).
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas, Al. Jerozolimskie 181C, 02-222 Varsóvia,
telefone: +48 22 49 21 301, fax: +48 22 49 21 309.
e-mail: [email protected]
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar APROKAM
O medicamento deve ser conservado em local não visível e inacessível a crianças
Não usar APROKAM após o prazo de validade impresso na caixa e rótulo do frasco após EXP. O prazo de validade é o último dia do mês indicado.
Conservar a uma temperatura abaixo de 25°C. Conservar o frasco na embalagem exterior para proteger da luz.
Exclusivamente para uso único.
Após a preparação da solução: o produto deve ser usado imediatamente.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém APROKAM
A substância ativa do medicamento é cefuroxima (na forma de cefuroxima sódica).
Cada frasco contém 50 mg de cefuroxima.
Após a preparação da solução, 0,1 ml da solução contém 1 mg de cefuroxima.
O medicamento não contém outros componentes.
Como é APROKAM e o que contém a embalagem
APROKAM tem a forma de pó branco a quase branco para solução injetável, fornecido em frascos de vidro.
Uma embalagem contém dez ou vinte frascos ou dez frascos com dez agulhas estéreis com filtro de 5 micrómetros. Nem todos os tamanhos de embalagem precisam estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização:
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
França
Fabricante:
BIOPHARMA S.R.L.
Via Delle Gerbere, 22/30 (loc. S. PALOMBA)
00134 ROMA (RM)
Itália
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
França
Este medicamento é autorizado para comercialização nos países membros da Área Económica Europeia sob as seguintes denominações:
Áustria, Bélgica, República Checa, Dinamarca, Finlândia, França, Alemanha, Itália, Islândia, Luxemburgo, Países Baixos, Noruega, Polónia, Portugal, Roménia, Eslováquia, Eslovénia, Suécia, Reino Unido ..................................................................... APROKAM
Chipre, Grécia, Espanha ............................................................................................... PROKAM
Irlanda ............................................................................................... APROK
Data da última atualização do folheto: 07-08-2019
Para obter informações mais detalhadas, deve consultar o representante do titular da autorização de comercialização:
Thea Polska Sp. z o.o.
ul. Cicha 7
00-353 Varsóvia
www.thea.pl
Informações destinadas exclusivamente ao pessoal médico especializado:
Incompatibilidades farmacêuticas
Não foram descritas incompatibilidades com os produtos mais comuns utilizados durante a operação de catarata. Não misturar este medicamento com outros medicamentos, excepto aqueles mencionados abaixo [cloreto de sódio a 9 mg/ml (0,9%) solução para injeção].
Como preparar e administrar APROKAM
O frasco de uso único é exclusivamente para administração na câmara anterior do olho.
APROKAM deve ser administrado após a preparação da solução, na forma de injeção na câmara anterior do olho pelo cirurgião oftalmologista, em condições assépticas recomendadas durante a operação de catarata.
A solução preparada deve ser verificada visualmente e deve ser utilizada apenas se for incolor a amarelado e não tiver partículas visíveis.
O produto deve ser utilizado imediatamente após a preparação da solução e não deve ser reutilizado.
A dose recomendada de cefuroxima é de 1 mg em 0,1 ml de cloreto de sódio (solução para injeção) a 9 mg/ml (0,9%).
NÃO INJETAR DOSE MAIOR DO QUE A RECOMENDADA.
Os frascos são exclusivamente para uso único
Cada frasco é destinado a um único doente. Deve colar a etiqueta do frasco na documentação do doente.
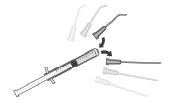
Para preparar APROKAM para administração na câmara anterior do olho, deve seguir as seguintes instruções:   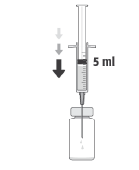 | |
Deve desinfetar  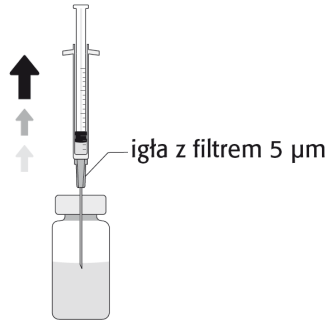 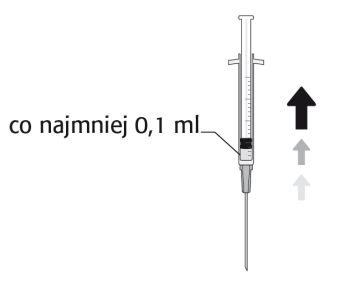 |
|
 |
|
Após o uso, deve eliminar o resto da solução preparada. Não deve armazenar o resto da solução preparada para reutilização. 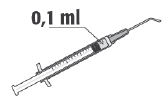 | |
Todos os resíduos do medicamento ou seus dejetos devem ser eliminados de acordo com as regulamentações locais. As agulhas usadas devem ser colocadas em um recipiente para resíduos médicos perfurantes.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBiopharma S.r.L. Laboratoires Thea
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a AprokamForma farmacêutica: Pó, 1.5 gSubstância ativa: cefuroximeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequer receita médicaForma farmacêutica: Pó, 250 mgSubstância ativa: cefuroximeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequer receita médicaForma farmacêutica: Pó, 500 mgSubstância ativa: cefuroximeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequer receita médica
Alternativas a Aprokam noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Aprokam em Espanha
Alternativa a Aprokam em Ukraine
Médicos online para Aprokam
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Aprokam – sujeita a avaliação médica e regras locais.














