

Vaxigrip

Zapytaj lekarza o receptę na Vaxigrip

Jak stosować Vaxigrip
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA
Vaxigrip, zawiesina do wstrzykiwań w ampułko-strzykawce
Trójwalentna szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta dorosłego lub dziecka.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Szczepionkę tę przepisano ściśle określonej osobie. Nie należy jej przekazywać innym.
- Jeśli u pacjenta dorosłego lub dziecka wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest Vaxigrip i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem szczepionki Vaxigrip
- 3. Jak stosować szczepionkę Vaxigrip
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać szczepionkę Vaxigrip
- 6. Zawartość opakowania i inne informacje
1. Co to jest Vaxigrip i w jakim celu się go stosuje
Vaxigrip jest szczepionką.
Ta szczepionka podawana osobom dorosłym i dzieciom od ukończenia 6. miesiąca życia pomaga
chronić przed zachorowaniem na grypę.
Po podaniu szczepionki Vaxigrip układ odpornościowy (naturalny system obronny organizmu)
wytwarza własną ochronę przed chorobą (przeciwciała). Szczepionka podawana w czasie ciąży
pomaga chronić kobiety w ciąży, jak również dziecko od urodzenia do wieku poniżej 6 miesięcy,
przenosząc ochronę z matki na dziecko w czasie ciąży (patrz także punkty 2 i 3).
Żaden ze składników szczepionki nie może wywołać grypy.
Zastosowanie szczepionki Vaxigrip powinno być zgodne z oficjalnymi zaleceniami.
Grypa jest chorobą, która może się szybko rozprzestrzeniać i jest wywoływana przez wiele różnych
szczepów wirusa, które mogą zmieniać się każdego roku. Z powodu tej możliwej corocznej zmiany
krążących szczepów, jak również z uwagi na okres utrzymywania się ochrony zapewnionej przez
szczepionkę, zalecane jest wykonanie szczepienia każdego roku. Największe ryzyko zachorowania na
grypę występuje podczas zimnych miesięcy między październikiem a marcem. W przypadku osób
dorosłych i dzieci, które nie zostały zaszczepione jesienią, jest nadal uzasadnione, aby zaszczepić się
w okresie do wiosny, ponieważ do tego czasu istnieje ryzyko zachorowania na grypę. Lekarz będzie w
stanie zalecić najlepszy czas do zaszczepienia się.
Szczepionka Vaxigrip przeznaczona jest do ochrony osób dorosłych i dzieci przed trzema szczepami
wirusa zawartymi w szczepionce, po około 2-3 tygodniach po szczepieniu.
Ponieważ okres wylęgania dla grypy wynosi kilka dni, w przypadku ekspozycji dorosłego lub dziecka
na wirus grypy bezpośrednio przed lub po szczepieniu, nadal możliwe jest zachorowanie.
Szczepionka nie chroni przed przeziębieniem, mimo że niektóre jego objawy są podobne do grypy.
2. Informacje ważne przed zastosowaniem szczepionki Vaxigrip
Należy poinformować lekarza lub farmaceutę, jeżeli którekolwiek z poniższych stwierdzeń dotyczy
osoby dorosłej lub dziecka, którym ma zostać podana szczepionka Vaxigrip. Jeśli cokolwiek jest
niezrozumiałe, należy poprosić lekarza lub farmaceutę o wyjaśnienie.
Kiedy nie stosować szczepionki Vaxigrip
- Jeśli pacjent dorosły lub dziecko ma uczulenie na:
- Substancje czynne, lub
- Którykolwiek z pozostałych składników tej szczepionki (wymienionych w punkcie 6), lub
- Którykolwiek składnik, który może być obecny w bardzo małych ilościach, taki jak pozostałość jaja (albumina jaja kurzego, białka kurze), neomycyna, formaldehyd lub octoxynol-9.
Ostrzeżenia i środki ostrożności
Przed zastosowaniem szczepionki Vaxigrip należy porozmawiać z lekarzem, farmaceutą lub
pielęgniarką.
Przed szczepieniem należy poinformować lekarza, jeśli u pacjenta dorosłego lub dziecka występują:
- Osłabienie odpowiedzi immunologicznej (spowodowane niedoborem odporności lub przyjmowaniem leków wpływających na układ odpornościowy),
- Krwawienia lub łatwość powstawania siniaków. Jeśli u pacjenta dorosłego lub dziecka stwierdzono ostrą chorobę przebiegającą z gorączką, szczepienie powinno być odroczone do czasu ustąpienia gorączki. Lekarz zadecyduje, czy pacjent dorosły lub dziecko powinni przyjąć szczepionkę. Omdlenie może wystąpić (zwłaszcza u młodzieży) po, lub nawet przed, jakimkolwiek wkłuciem igły. Dlatego należy poinformować lekarza lub pielęgniarkę, jeśli pacjent lub jego dziecko doświadczyło omdleń przy poprzednich wstrzyknięciach.
Tak jak w przypadku każdej szczepionki, szczepionka Vaxigrip może nie zapewnić pełnej ochrony
wszystkim zaszczepionym osobom.
Nie wszystkie dzieci w wieku poniżej 6 miesięcy, urodzone przez kobiety zaszczepione podczas ciąży,
będą chronione.
Dzieci
Stosowanie szczepionki Vaxigrip nie jest zalecane u dzieci w wieku poniżej 6 miesięcy.
Szczepionka Vaxigrip a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach lub szczepionkach stosowanych
przez pacjenta dorosłego lub dziecko obecnie lub ostatnio, a także o lekach lub szczepionkach, które
planują stosować.
- Szczepionka Vaxigrip może być podawana jednocześnie z innymi szczepionkami, lecz w różne kończyny.
- W przypadku stosowania leków lub terapii obniżających odporność, takich jak kortykosteroidy, leki cytotoksyczne lub radioterapia, odpowiedź immunologiczna na szczepienie może być osłabiona.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży, powinna poradzić się
lekarza lub farmaceuty przed zastosowaniem tej szczepionki.
Szczepionka Vaxigrip może być podana we wszystkich okresach ciąży.
Szczepionka Vaxigrip może być stosowana podczas karmienia piersią.
Lekarz / farmaceuta decyduje o możliwości podania szczepionki Vaxigrip.
Prowadzenie pojazdów i obsługiwanie maszyn
Szczepionka Vaxigrip nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia
pojazdów i obsługiwania maszyn.
Szczepionka Vaxigrip zawiera potas i sód
Ten lek zawiera mniej niż 1 mmol potasu (39 mg) i mniej niż 1 mmol sodu (23 mg) na dawkę, to
znaczy lek uznaje się za „wolny od potasu” i „wolny od sodu”.
3. Jak stosować szczepionkę Vaxigrip
Dawkowanie
Dorośli otrzymują jedną dawkę 0,5 ml.
Stosowanie u dzieci i młodzieży
Dzieci od ukończenia 6. miesiąca życia do ukończenia 17. roku życia otrzymują jedną dawkę 0,5 ml.
Dzieciom poniżej 9. roku życia, które uprzednio nie były szczepione przeciw grypie, należy podać
drugą dawkę 0,5 ml po upływie co najmniej 4 tygodni.
W przypadku kobiet w ciąży jedna dawka 0,5 ml podana w czasie ciąży może chronić dziecko od
urodzenia do wieku poniżej 6 miesięcy. W celu uzyskania dalszych informacji należy zwrócić się do
lekarza lub farmaceuty.
Jak przyjmować szczepionkę Vaxigrip
Lekarz lub pielęgniarka poda zalecaną dawkę szczepionki jako wstrzyknięcie do mięśnia lub pod
skórę.
Zastosowanie większej niż zalecana dawki szczepionki Vaxigrip
W niektórych przypadkach przypadkowo podano większą dawkę niż zalecana.
W tych przypadkach, gdy zgłaszano działania niepożądane, były one zgodne z tym, co opisano po
podaniu zalecanej dawki (patrz punkt 4).
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tej szczepionki należy
zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, ta szczepionka może powodować działania niepożądane, chociaż nie u każdego one
wystąpią.
Należy natychmiast skontaktować się z lekarzem lub pracownikiem opieki zdrowia, lub udać się do
najbliższej izby przyjęć, jeśli wystąpi reakcja alergiczna.
Reakcje alergiczne
Mogą wystąpić bezpośrednio po podaniu szczepionki i mogą zagrażać życiu.
Objawy mogą obejmować:
- wysypkę, swędzenie (świąd), trudności z oddychaniem, duszności, opuchnięcie (obrzęk) twarzy, warg, gardła lub języka, niskie ciśnienie krwi, przyspieszenie bicia serca i słabe tętno, zimną, wilgotną skórę, zawroty głowy, osłabienie lub omdlenie (reakcja anafilaktyczna, obrzęk naczynioruchowy, wstrząs).
Inne objawy mogą obejmować:
- obszary swędzącej, zaczerwienionej, opuchniętej (obrzękniętej) i popękanej skóry (atopowe zapalenie
skóry), nagłe zaczerwienienie skóry, uderzenia gorąca, krew w białku oka (przekrwienie oka),
zaczerwienienie i podrażnienie oka (zapalenie spojówek), podrażnienie gardła, ból gardła, podrażnienie
wewnątrz nosa, katar, kichanie, zatkany nos, zatoki lub gardło, drętwienie lub uczucie mrowienia w
jamie ustnej (parestezje w jamie ustnej), wysypkę w jamie ustnej (wykwity na błonie śluzowej jamy
ustnej), astmę.
Te reakcje alergiczne zostały zgłoszone jako występujące niezbyt często (mogą dotyczyć do 1 na 100
osób) lub rzadko (mogą dotyczyć do 1 na 1000 osób).
Dodatkowe działania niepożądane u dorosłych i osób starszych
Bardzo często (mogą dotyczyć więcej niż 1 na 10 osób):
- Ból głowy, ból mięśni, ogólne złe samopoczucie , ból w miejscu wstrzyknięcia.
Często (mogą dotyczyć do 1 na 10 osób):
- Gorączka , dreszcze, reakcje w miejscu wstrzyknięcia: zaczerwienienie (rumień), stwardnienie, opuchnięcie.
Niezbyt często (mogą dotyczyć do 1 na 100 osób):
- Powiększenie węzłów chłonnych w okolicy szyi, pachy lub pachwiny (limfadenopatia) , nietypowe osłabienie , uczucie zmęczenia, senność , zawroty głowy , nadmierna potliwość , ból stawów , biegunka, uczucie mdłości (nudności), reakcje w miejscu wstrzyknięcia: siniaki (zasinienie), swędzenie, ucieplenie, dyskomfort.
Rzadko (mogą dotyczyć do 1 na 1000 osób):
- Uczucie drętwienia lub mrowienia (parestezje), wymioty, zmniejszenie łaknienia, objawy grypopodobne.
- Osłabienie czucia (niedoczulica), ból brzucha, alergia w miejscu wstrzyknięcia: obserwowano tylko u osób dorosłych.
- Złuszczanie skóry w miejscu wstrzyknięcia: obserwowano tylko u osób dorosłych.
Dodatkowe działania niepożądane występujące u dzieci w wieku od 3 do 17 lat
Bardzo często (mogą dotyczyć więcej niż 1 na 10 osób):
- Ból głowy, ból mięśni, ogólne złe samopoczucie, dreszcze, reakcje w miejscu wstrzyknięcia: ból, zaczerwienienie, opuchnięcie, stwardnienie .
Często (mogą wystąpić rzadziej niż u 1 na 10 osób):
- Gorączka, siniak (zasinienie) w miejscu wstrzyknięcia. Niezbyt często (mogą dotyczyć do 1 na 100 osób):
- Uczucie zmęczenia, zawroty głowy, biegunka, reakcje w miejscu wstrzyknięcia: swędzenie, ucieplenie.
- Powiększenie węzłów chłonnych w okolicy szyi, pachy lub pachwiny, ból brzucha, wymioty, niepokój, marudzenie, ból stawów, płacz: obserwowano tylko u dzieci w wieku od 3 do 8 lat.
- zmniejszenie liczby określonych rodzajów komórek we krwi zwanych płytkami krwi; ich niewielka liczba może powodować nadmierne powstawanie siniaków lub krwawienie (małopłytkowość): obserwowano tylko u jednego dziecka w wieku 3 lat.
- Nietypowe osłabienie, dyskomfort w miejscu wstrzyknięcia: obserwowano tylko u dzieci w wieku od 9 do 17 lat.
Dodatkowe działania niepożądane zgłaszane u dzieci od ukończenia 6. miesiąca życia do ukończenia 35. miesiąca życia
Bardzo często (mogą dotyczyć więcej niż 1 na 10 osób):
- Drażliwość , wymioty ból mięśni ogólne złe samopoczucie gorączka, zmniejszenie łaknienia reakcje w miejscu wstrzyknięcia: tkliwość, zaczerwienienie.
- Nietypowy płacz, senność: obserwowano tylko u dzieci poniżej 24. miesięcy.
- Ból głowy: obserwowano tylko u dzieci po ukończeniu 24. miesiąca życia.
Często (mogą wystąpić rzadziej niż u 1 na 10 osób):
- Biegunka, reakcje w miejscu wstrzyknięcia: stwardnienie, zasinienie, opuchnięcie.
- Dreszcze: obserwowano tylko u dzieci po ukończeniu 24. miesiąca życia. Rzadko (mogą dotyczyć do 1 na 1000 osób):
- Objawy grypopodobne, reakcje w miejscu wstrzyknięcia: swędzenie, wysypka. U dzieci w wieku od ukończenia 6. miesiąca życia do 8 lat, które otrzymują 2 dawki, działania niepożądane po pierwszej i po drugiej dawce są podobne. Mniej działań niepożądanych może wystąpić po podaniu drugiej dawki u dzieci w wieku od ukończenia 6. miesiąca do ukończenia 35. miesiąca życia. Większość działań niepożądanych występowała zwykle w ciągu 3 dni po szczepieniu i ustępowały bez leczenia w ciągu 1 do 3 dni od wystąpienia. Nasilenie większości tych działań niepożądanych było łagodne do umiarkowanego.
Częstość występowania następujących działań niepożądanych jest nieznana (nie może być określona
na podstawie dostępnych danych) w całej populacji, z wyjątkiem populacji, dla której dane działanie
niepożądane wymieniono powyżej:
- Powiększenie węzłów chłonnych w okolicy szyi, pachy lub pachwiny.
- Uczucie drętwienia lub mrowienia (parestezje), ból odczuwalny wzdłuż nerwów (neuralgia) , napady (drgawki), zaburzenia neurologiczne, które mogą powodować sztywność karku, dezorientacja, drętwienie, ból i osłabienia kończyn, utrata równowagi, utrata odruchów, porażenie części lub całego ciała (zapalenie mózgu i rdzenia, zapalenie nerwu , zespół Guillaina-Barre’go ).
- Zapalenie naczyń krwionośnych, które może prowadzić do wysypek skórnych oraz w bardzo rzadkich przypadkach do przejściowych zaburzeń czynności nerek.
- Tymczasowe zmniejszenie liczby określonych rodzajów komórek we krwi zwanych płytkami krwi; ich niewielka liczba może powodować nadmierne powstawanie siniaków lub krwawienie (przejściowa trombocytopenia).
Zgłaszanie działań niepożądanych
Jeśli u pacjenta dorosłego lub dziecka wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie
objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub
pielęgniarce. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać szczepionkę Vaxigrip
Szczepionkę należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tej szczepionki po upływie terminu ważności zamieszczonego na etykiecie i opakowaniu
po „Termin ważności (EXP)”. Termin ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać w lodówce (2 C–8 C). Nie zamrażać. Przechowywać ampułko-strzykawkę
w opakowaniu zewnętrznym w celu ochrony przed światłem.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera szczepionka Vaxigrip
Substancjami czynnymi są: Wirus grypy (inaktywowany, rozszczepiony) następujących szczepów*:
A/Victoria/4897/2022 (H1N1)pdm09-podobny szczep (A/Victoria/4897/2022, IVR-238)
............................................................................................................. 15 mikrogramów HA**
A/Croatia/10136RV/2023 (H3N2)-podobny szczep (A/Croatia/10136RV/2023, X-425A)
............................................................................................................. 15 mikrogramów HA**
B/Austria/1359417/2021-podobny szczep (B/Michigan/01/2021, typ dziki)
............................................................................................................. 15 mikrogramów HA**
w dawce 0,5 ml
*namnożony w zarodkach kurzych pochodzących ze zdrowych stad
**hemaglutynina
Szczepionka jest zgodna z zaleceniami Światowej Organizacji Zdrowia (World Health Organization,
WHO) dla półkuli północnej oraz z zaleceniami Unii Europejskiej na sezon 2025/2026.
Pozostałe składniki to: roztwór buforowy zawierający sodu chlorek, potasu chlorek, disodu fosforan
dwuwodny, potasu diwodorofosforan, woda do wstrzykiwań.
Niektóre składniki takie jak jaja (albumina jaja kurzego, białka kurze), neomycyna, formaldehyd lub
octoxynol-9 mogą być obecne w bardzo małych ilościach (patrz punkt 2).
Jak wygląda szczepionka Vaxigrip i co zawiera opakowanie
Po delikatnym wstrząśnięciu szczepionka jest bezbarwną, opalizującą cieczą.
Szczepionka Vaxigrip jest zawiesiną do wstrzykiwań w ampułko-strzykawce po 0,5 ml, z dołączoną
igłą, z osobną igłą lub bez igły lub z osobną igłą w osłonie zabezpieczającej, w opakowaniu po 1 lub
10, całość w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w
obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly, Francja
Wytwórca:
Sanofi Winthrop Industrie, 1541 avenue Marcel Mérieux, 69280 Marcy l'Etoile, Francja
Sanofi Winthrop Industrie, Voie de l’Institut - Parc Industriel d'Incarville, B.P. 101, 27100 Val de
Reuil, Francja
Sanofi-Aventis Zrt., Budynek Dc5, Campona Utca 1, Budapest XXII,1225, Węgry
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
| Państwo członkowskie | Nazwa |
| Austria, Belgia, Bułgaria, Chorwacja, Czechy, Dania, Estonia, Finlandia, Francja, Hiszpania, Holandia, Irlandia, Islandia, Litwa, Luksemburg, Łotwa, Malta, Niemcy, Norwegia, Polska, Portugalia, Rumunia, Słowacja, Słowenia, Szwecja, Węgry, Włochy | Vaxigrip |
| Cypr, Grecja | Vaxigrip TIV |
Data ostatniej aktualizacji ulotki:czerwiec 2025
Inne źródła informacji
Aktualnie zatwierdzone informacje o tym produkcie są dostępne
nh.info.sanofi
---------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Tak jak przy wszystkich szczepionkach podawanych we wstrzyknięciach, konieczne jest zapewnienie
właściwego leczenia i nadzoru medycznego na wypadek wystąpienia reakcji anafilaktycznej po
podaniu szczepionki.
Przed podaniem szczepionka powinna osiągnąć temperaturę pokojową.
Wstrząsnąć przed użyciem. Sprawdzić wzrokowo przed podaniem.
Szczepionki nie należy stosować w przypadku obecności cząstek stałych w zawiesinie.
Szczepionki nie należy mieszać z innymi produktami leczniczymi w tej samej strzykawce.
Szczepionki nie wolno wstrzykiwać bezpośrednio do naczyń krwionośnych.
Patrz również punkt 3. Jak stosować szczepionkę Vaxigrip
| Instrukcja dotycząca użycia igły w osłonie zabezpieczającej z ampułko-strzykawką z końcówką Luer | |
| Lock: | |
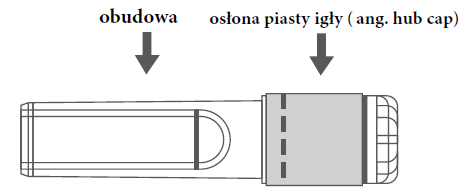 | |
| Rycina A: Igła w osłonie zabezpieczającej (w obudowie) | Rycina B: Elementy osłony zabezpieczającej igłę (przygotowane do użycia)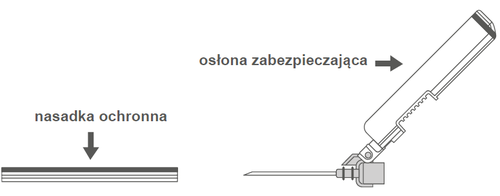 |
| Krok 1: Aby zamocować igłę do strzykawki należy zdjąć osłonę piasty igły (ang. hub cap), aby odsłonić piastę igły i delikatnie wkręcić igłę w adapter Luer Lock strzykawki, aż do wyczucia lekkiego oporu. | |
Krok 2: Zdjąć obudowę igły. Igła jest zabezpieczona osłoną zabezpieczającą i nasadką ochronną.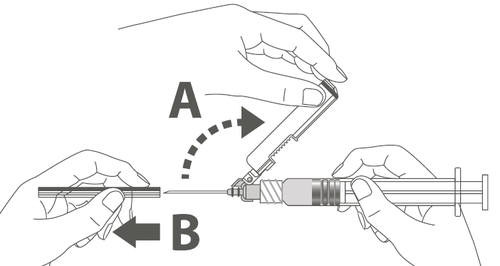 | |
| Krok 3: A: Odsunąć osłonę zabezpieczającą od igły w kierunku korpusu strzykawki pod pokazanym kątem. B: Zdjąć nasadkę ochronną. | 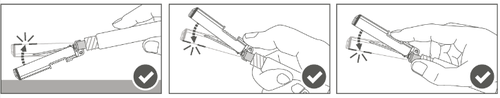 |
| Krok 4: Po wstrzyknięciu zablokować (aktywować) osłonę zabezpieczającą, stosując jedną z trzech (3) przedstawionych technik obsługi jedną ręką: aktywacja na płaskiej powierzchni, kciukiem lub palcem wskazującym. Uwaga: Aktywacja jest potwierdzona słyszalnym i (lub) wyczuwalnym “kliknięciem”. | |
| Krok 5: Sprawdzić wzrokowo działanie osłony zabezpieczającej. Osłona zabezpieczająca powinna być całkowicie zablokowana (aktywowana), jak pokazano na rysunku C. Rysunek D pokazuje, że osłona zabezpieczająca NIE jest całkowicie zablokowna (nie jest aktywowana). | 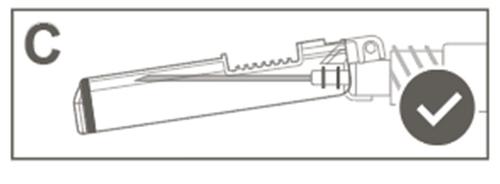 |
Ostrzeżenie: Nie należy próbować odblokować (dezaktywować) urządzenia zabezpieczającego poprzez wypychanie igły z osłony zabezpieczającej.>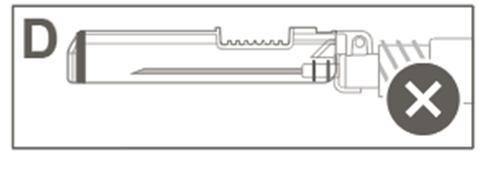 | |
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi
przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- ImporterSanofi Winthrop Industrie Sanofi Winthrop Industrie Sanofi-Aventis Zrt.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki VaxigripPostać farmaceutyczna: Zawiesina, 60 mcg HA/szczep, 1 dawka (0,7 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga receptyPostać farmaceutyczna: Zawiesina, 60 mcg HA/szczep, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga receptyPostać farmaceutyczna: Zawiesina, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga recepty
Odpowiedniki Vaxigrip w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Vaxigrip – Hiszpania
Odpowiednik Vaxigrip – Ukraina
Lekarze online w sprawie Vaxigrip
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Vaxigrip – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














