
Fluarix Tetra

Zapytaj lekarza o receptę na Fluarix Tetra

Jak stosować Fluarix Tetra
Ulotka dołączona do opakowania: informacja dla użytkownika
Fluarix Tetra, zawiesina do wstrzykiwań w ampułko-strzykawce
Szczepionka przeciw grypie (rozszczepiony wirion, inaktywowana)
Treść tej ulotki została sformułowana zgodnie z założeniem, że będzie ona czytana przez osobę otrzymującą
szczepionkę. Ponieważ jednak szczepionka ta może być podawana dorosłym i dzieciom, jest możliwe, że
z treścią ulotki zapoznawać się będzie rodzic lub opiekun dziecka.
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Szczepionka ta została przepisana ściśle określonej osobie. Nie należy jej przekazywać innym.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest szczepionka Fluarix Tetra i w jakim celu się ją stosuje
- 2. Informacje ważne przed zastosowaniem szczepionki Fluarix Tetra
- 3. Jak stosować szczepionkę Fluarix Tetra
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać szczepionkę Fluarix Tetra
- 6. Zawartość opakowania i inne informacje
1. Co to jest szczepionka Fluarix Tetra i w jakim celu się ją stosuje
Fluarix Tetra jest szczepionką. Szczepionka pomaga chronić zaszczepione osoby przed zachorowaniem na
grypę, co jest szczególnie istotne u osób narażonych w wysokim stopniu na powikłania pogrypowe.
Stosowanie szczepionki Fluarix Tetra powinno być oparte na lokalnych zaleceniach.
Po podaniu szczepionki Fluarix Tetra, układ immunologiczny osoby zaszczepionej (naturalny układ obronny
organizmu) wytworzy własną ochronę przed chorobą (przeciwciała). Żaden ze składników szczepionki nie
powoduje zachorowania na grypę.
Grypa jest chorobą, która może szerzyć się szybko. Powodują ją różne szczepy wirusa, które mogą zmieniać
się co roku. Dlatego może być konieczne coroczne szczepienie. Największe ryzyko zachorowania na grypę
występuje w zimnych miesiącach roku, pomiędzy październikiem a marcem. W przypadku osób, które nie
zostały zaszczepione jesienią należy rozważyć szczepienie w późniejszym okresie (aż do wiosny), ponieważ
do tego czasu istnieje zagrożenie zarażeniem grypą. Lekarz poinformuje o tym, kiedy powinno zostać
przeprowadzone szczepienie. Fluarix Tetra chroni przed czterema szczepami wirusa, które są w nim zawarte.
Działanie ochronne szczepionki rozpoczyna się od około 2 do 3 tygodni po szczepieniu.
Okres wylęgania grypy wynosi kilka dni, tak więc jeżeli narażenie na wirus grypy wystąpi tuż przed lub zaraz
po szczepieniu, może dojść do zachorowania pomimo przyjęcia szczepionki.
Szczepionka nie chroni przed przeziębieniem, mimo że niektóre z jego objawów są takie same jak objawy
grypy.
2. Informacje ważne przed zastosowaniem szczepionki Fluarix Tetra
Należy poinformować lekarza lub farmaceutę, jeżeli którekolwiek z poniższych stwierdzeń dotyczy osoby,
której ma zostać podana szczepionka Fluarix Tetra. Jeżeli konieczne są dodatkowe wyjaśnienia, należy
zapytać lekarza lub farmaceutę.
Kiedy nie stosować szczepionki Fluarix Tetra:
- Jeśli pacjent ma uczulenie na substancje czynne lub którykolwiek z pozostałych składników tej szczepionki (wymienionych w punkcie 6) lub na którykolwiek składnik, który może być obecny w bardzo małych ilościach, taki jak pozostałości jaja kurzego (albumina jaja kurzego lub białko kurze), formaldehyd, gentamycyny siarczan lub dezoksycholan sodu.
- jeśli u pacjenta występuje choroba przebiegająca z wysoką gorączką lub ostra infekcja, szczepienie należy odłożyć do chwili, kiedy pacjent poczuje się lepiej.
Ostrzeżenia i środki ostrożności:
Przed podaniem szczepionki Fluarix Tetra należy skonsultować się z lekarzem:
- Jeśli u pacjenta występuje osłabienie odpowiedzi immunologicznej (spowodowane niedoborem odporności lub przyjmowaniem leków wpływających na układ immunologiczny),
- jeśli u pacjenta w ciągu kilku dni po szczepieniu planuje się wykonanie badania krwi, ponieważ obserwowano fałszywie dodatnie wyniki badań krwi u osób, które były niedawno szczepione,
- jeśli pacjent ma problemy z krzepliwością krwi lub tendencję do tworzenia się siniaków.
Lekarz zdecyduje, czy pacjent może być zaszczepiony.
Po lub nawet przed podaniem każdej szczepionki w postaci wstrzyknięcia może dojść do omdlenia
(szczególnie u nastolatków). W związku z tym należy poinformować lekarza lub pielęgniarkę, jeżeli
u pacjenta kiedyś wystąpiło omdlenie podczas podawania zastrzyku.
Tak jak w przypadku każdej szczepionki, Fluarix Tetra może nie w pełni chronić wszystkie zaszczepione
osoby.
Szczepionka Fluarix Tetra a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych obecnie lub ostatnio,
a także o lekach, które pacjent planuje stosować.
Fluarix Tetra można podawać jednocześnie z innymi szczepionkami, jednak każda szczepionka powinna być
podana w inną kończynę.
Ciąża, karmienie piersią i wpływ na płodność
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć dziecko,
powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tej szczepionki.
Lekarz lub farmaceuta zdecydują czy pacjentka może przyjąć szczepionkę Fluarix Tetra. Należy skonsultować
się z lekarzem lub farmaceutą przed zastosowaniem tej szczepionki.
Prowadzenie pojazdów i obsługiwanie maszyn
Szczepionka Fluarix Tetra nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
i obsługiwania maszyn.
Fluarix Tetra zawiera sód
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, więc może być uznany za wolny od
sodu.
Fluarix Tetra zawiera potas
Ten produkt leczniczy zawiera mniej niż 1 mmol potasu (39 mg) na dawkę, więc może być uznany za wolny
od potasu.
3. Jak stosować szczepionkę Fluarix Tetra
Dawkowanie
Osoby dorosłe otrzymują jedną dawkę 0,5 ml.
Stosowanie u dzieci:
Dzieci od ukończenia 6. miesiąca życia otrzymują jedną dawkę 0,5 ml.
Dzieciom poniżej 9 lat, które nie były uprzednio szczepione na grypę, należy podać drugą dawkę po upływie
co najmniej 4 tygodni po pierwszej dawce.
Jak należy podawać szczepionkę
Lekarz poda odpowiednią dawkę szczepionki poprzez wstrzyknięcie domięśniowe.
W przypadku dodatkowych pytań dotyczących stosowania szczepionki, należy zwrócić się do lekarza lub
farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, szczepionka ta może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
W badaniach klinicznych obserwowano następujące działania niepożądane.
Działania niepożądane, które wystąpiły u dzieci w wieku od 6 do 36 miesięcy
Bardzo często(mogą występować częściej niż 1 na 10 dawek szczepionki): utrata apetytu, drażliwość,
senność, ból i/lub zaczerwienienie w miejscu podania.
Często(mogą występować nie częściej niż 1 na 10 dawek szczepionki): gorączka, obrzęk w miejscu podania.
Działania niepożądane, które wystąpiły u dzieci w wieku od 3 do 6 lat
Bardzo często(mogą występować częściej niż 1 na 10 dawek szczepionki): ból i/lub zaczerwienienie
i/lub obrzęk w miejscu podania, drażliwość.
Często(mogą występować nie częściej niż 1 na 10 dawek szczepionki): utrata apetytu, senność, gorączka.
Niezbyt często(mogą występować nie częściej niż 1 na 100 dawek szczepionki): wysypka, świąd w miejscu
podania.
Działania niepożądane, które wystąpiły u dzieci w wieku od 6 do 18 lat
Bardzo często(mogą występować częściej niż 1 na 10 dawek szczepionki): ból mięśni, ból i/lub
zaczerwienienie i/lub obrzęk w miejscu podania, zmęczenie.
Często(mogą występować nie częściej niż 1 na 10 dawek szczepionki): nudności, biegunka, wymioty, ból
brzucha, ból głowy, ból stawów, dreszcze, gorączka.
Niezbyt często(mogą występować nie częściej niż 1 na 100 dawek szczepionki): wysypka, świąd w miejscu
podania.
Działania niepożądane, które wystąpiły u osób dorosłych w wieku 18 lat i starszych
Bardzo często(mogą występować częściej niż 1 na 10 dawek szczepionki): ból w miejscu podania,
zmęczenie, ból mięśni (mialgia).
Często(mogą występować nie częściej niż 1 na 10 dawek szczepionki): ból głowy, nudności, biegunka,
wymioty, ból brzucha, ból stawów (artralgia), gorączka, dreszcze, zaczerwienienie i/lub obrzęk w miejscu
podania.
Niezbyt często(mogą występować nie częściej niż 1 na 100 dawek szczepionki): siniaki, świąd w okolicach
podania szczepionki, zawroty głowy.
Poza powyższymi, działania niepożądane które wystąpiły podczas badań klinicznych u pacjentów w wieku
od 3 lat, u których stosowano Fluarix (szczepionkę trzywalentną), obejmowały:
Często(mogą występować nie częściej niż 1 na 10 dawek szczepionki): stwardnienie (induracja) wokół
miejsca podania szczepionki, potliwość.
Powyższe reakcje ustępują zwykle po 1-2 dniach bez dodatkowego leczenia.
Poza powyższymi działaniami niepożądanymi, odnotowano następujące działania niepożądane występujące
po zastosowaniu szczepionek Fluarix i Fluarix Tetra.
Rzadko(mogą występować nie częściej niż 1 na 1 000 dawek szczepionki):
- reakcje alergiczne:
- prowadzące do stanów wymagających nagłej pomocy lekarskiej w związku z niewydolnością układu krążenia, prowadzącą do spadku dopływu krwi do różnych narządów (wstrząs),
- obrzęk, szczególnie widoczny w obrębie głowy i szyi, obejmujący twarz, usta, język, gardło lub inne części ciała (obrzęk naczynioruchowy);
- reakcje skórne, które mogą się rozprzestrzeniać na całym ciele, takie jak swędzenie (świąd, pokrzywka) oraz zaczerwienienie (rumień),
- zmiany neurologiczne, mogące skutkować uczuciem sztywności karku, zagubieniem, odrętwieniem, bólem i osłabieniem kończyn, utratą równowagi, utratą odruchów, paraliżem części lub całości ciała (zapalenie mózgu i rdzenia kręgowego, zapalenie nerwów, zespół Guillain-Barré),
- tymczasowy obrzęk szyjnych, pachowych lub pachwinowych węzłów chłonnych (przejściowa limfadenopatia),
- objawy grypopodobne, ogólne złe samopoczucie.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w
ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu
Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie
181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, Strona
internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać szczepionkę Fluarix Tetra
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku tekturowym po: EXP.
Termin ważności oznacza ostatni dzień podanego miesiąca.
Skrót „Lot” oznacza numer serii produktu.
Przechowywać w lodówce (2˚C – 8˚C).
Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Leków nie należy wyrzucać do kanalizacji lub domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera Fluarix Tetra:
Substancją czynną jest:rozszczepiony, inaktywowany wirus grypy pochodzący z następujących
szczepów*:
A/Victoria/4897/2022 (H1N1)pdm09–podobny szczep (A/Victoria/4897/2022, IVR-238)
15 mikrogramów HA**
A/Thailand/8/2022 (H3N2)-podobny szczep (A/Thailand/8/2022, IVR-237)
15 mikrogramów HA**
B/Austria/1359417/2021–podobny szczep (B/Austria/1359417/2021, BVR-26)
15 mikrogramów HA**
B/Phuket/3073/2013–podobny szczep (B/Phuket/3073/2013, szczep dziki)
15 mikrogramów HA**
w dawce 0,5 ml
* namnażane w zarodkach kurzych pochodzących ze zdrowych stad
** hemaglutynina
Ta szczepionka odpowiada zaleceniom Światowej Organizacji Zdrowia (WHO) (dla Półkuli Północnej) i Unii
Europejskiej na sezon 2024/2025.
Inne składniki szczepionki to: sodu chlorek, disodu fosforan dwunastowodny, potasu
diwodorofosforan, potasu chlorek, magnezu chlorek sześciowodny, α -tokoferylu wodorobursztynian,
polisorbat 80, oktoksynol 10 i woda do wstrzykiwań.
Jak wygląda szczepionka Fluarix Tetra i co zawiera opakowanie
Fluarix Tetra jest zawiesiną do wstrzykiwań w ampułko-strzykawce.
Fluarix Tetra jest dostępny w postaci 1-dawkowej ampułko-strzykawki, z igłami dołączonymi do opakowania
lub bez igieł, w opakowaniach po 1 i 10 sztuk.
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny: Wytwórca:
GlaxoSmithKline Biologicals S.A.
GlaxoSmithKline Biologicals
Rue de l’Institut 89
Filia SmithKline Beecham Pharma GmbH&Co. KG
1330 Rixensart
Zirkusstrasse 40
Belgia
01069 Drezno
Niemcy
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru
Gospodarczego pod następującymi nazwami:
| Państwo członkowskie | Nazwa |
| Austria, Bułgaria, Chorwacja, Cypr, Czechy, Dania, Estonia, Finlandia, Grecja, Węgry, Islandia, Irlandia, Włochy, Łotwa, Litwa, Malta, Holandia, Norwegia, Polska, Portugalia, Hiszpania, Słowacja, Słowenia, Szwecja | Fluarix Tetra |
| Belgia, Luksemburg | Alpharix-Tetra |
| Francja | FluarixTetra |
| Niemcy | Influsplit Tetra |
Data ostatniej aktualizacji ulotki: lipiec 2024
Inne źródła informacji
Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Urzędu Rejestracji Produktów
Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
---------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone są wyłącznie dla fachowego personelu medycznego:
Podobnie jak w przypadku wszystkich szczepionek podawanych w postaci wstrzyknięć, należy zapewnić
możliwość właściwego natychmiastowego leczenia i odpowiednią opiekę medyczną na wypadek wystąpienia
reakcji anafilaktycznych po podaniu szczepionki.
Szczepienie powinno zostać wykonane domięśniowo.
Fluarix Tetra w żadnym wypadku nie powinien być podawany donaczyniowo.
Fluarix Tetra może zostać podany w tym samym czasie z innymi szczepionkami. Szczepienie powinno być
wykonane w oddzielne kończyny.
Przed podaniem szczepionka powinna osiągnąć temperaturę pokojową.
Szczepionkę należy wstrząsnąć przed użyciem. Szczepionkę należy ocenić wzrokowo przed podaniem.
Instrukcje dotyczące ampułko-strzykawki
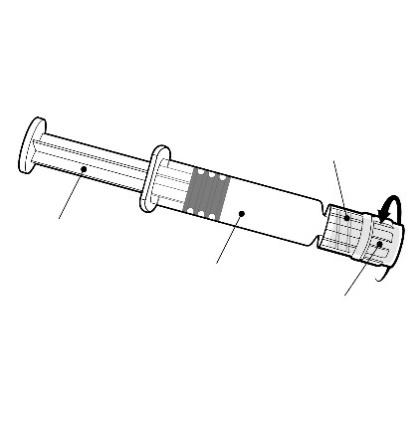
Należy trzymać ampułko-strzykawkę za
korpus, a nie za tłok.
Adapter typu Luer Lock
Należy odkręcić nasadkę ampułko-strzykawki
poprzez przekręcenie jej w kierunku
przeciwnym do ruchu wskazówek zegara.
Tłok
Korpus
Nasadka
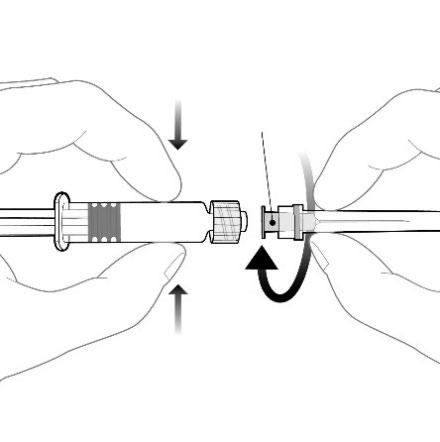
Należy przymocować igłę do
ampułko-strzykawki poprzez przyłączenie
nasadki igły do adaptera Luer Lock (ang. Luer
Lock Adaptor, LLA) i obrócenie jej ćwierć
obrotu w kierunku zgodnym z ruchem
wskazówek zegara, do chwili aż poczuje się
zablokowanie igły.
Nie wolno wyciągać tłoka z korpusu
ampułko-strzykawki. Jeśli tak się stanie,
nie należy podawać szczepionki.
Nasadka igły
Usuwanie
Wszelkie resztki niewykorzystanego produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterGlaxoSmithKline Biologicals Filia SmithKline BeechamPharma GmbH & Co. KG
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Fluarix TetraPostać farmaceutyczna: Zawiesina, 60 mcg HA/szczep, 1 dawka (0,7 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga receptyPostać farmaceutyczna: Zawiesina, 60 mcg HA/szczep, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga receptyPostać farmaceutyczna: Zawiesina, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga recepty
Odpowiedniki Fluarix Tetra w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Fluarix Tetra – Spain
Odpowiednik Fluarix Tetra – Ukraine
Lekarze online w sprawie Fluarix Tetra
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Fluarix Tetra – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














