VAXIGRIP SUSPENSION INYECTABLE EN JERINGA PRECARGADA

Cómo usar VAXIGRIP SUSPENSION INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Vaxigrip suspensión inyectable en jeringa precargada
Vacuna antigripal trivalente (virus fraccionados, inactivados)
Lea todo el prospecto detenidamente antes de que usted o su hijo sean vacunados porque contiene información importante para usted o su hijo.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Esta vacuna se le ha recetado solamente a usted o a su hijo y no debe dársela a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si usted o su hijo experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Vaxigrip y para qué se utiliza
- Qué necesita saber antes de que usted o su hijo empiecen a usar Vaxigrip
- Cómo usar Vaxigrip
- Posibles efectos adversos
- Conservación de Vaxigrip
- Contenido del envase e información adicional
1. Qué es Vaxigrip y para qué se utiliza
Vaxigrip es una vacuna.
Esta vacuna se le administra a usted o a su hijo desde los 6 meses de edad, está indicada para protegerle a usted o a su hijo frente a la gripe.
Cuando se inyecta a una persona la vacuna Vaxigrip, el sistema inmunológico (el sistema de las defensas naturales del cuerpo) producirá protección (anticuerpos) frente a la infección. Cuando se administra la vacuna durante el embarazo, además de proteger a la mujer embarazada también protege a su bebé desde el nacimiento hasta los 6 meses de edad a través de la trasmisión de la protección de la madre al bebé durante el embarazo (ver también las secciones 2 y 3).
Ninguno de los componentes de la vacuna puede causar gripe.
El uso de Vaxigrip se debe basar en las recomendaciones oficiales.
La gripe es una enfermedad que se puede extender rápidamente y es causada por diferentes tipos de cepas que pueden cambiar cada año. Debido a este cambio potencial en las cepas circulantes cada año, así como la duración de la protección prevista por la vacuna, la vacunación se recomienda todos los años. Hay mayor riesgo de contagiarse de gripe durante los meses de frío entre octubre y marzo. Si usted o su hijo no se vacunaron en otoño es posible vacunarse hasta la primavera ya que usted o su hijo corren el riesgo de infectarse por la gripe durante ese periodo. Su médico podrá recomendarle la mejor fecha para vacunarse.
El objetivo de Vaxigrip es protegerle a usted o a su hijo frente a las tres cepas del virus contenido en la vacuna después de unas 2 a 3 semanas de la inyección.
Además, el periodo de incubación de la gripe es de unos días, de modo que si usted o su hijo se exponen a la gripe inmediatamente antes o después de la vacunación podría desarrollar la enfermedad.
La vacuna no le protegerá a usted o su hijo frente al resfriado común, incluso si algunos de los síntomas son similares a la gripe.
2. Qué necesita saber antes de empezar a usar Vaxigrip
Para asegurarse de que Vaxigrip es adecuado para usted o su hijo, es importante que consulte a su médico o farmacéutico si alguno de los puntos descritos a continuación le afectan a usted o a su hijo. Si hay algo que usted no entiende, consulte a su médico o farmacéutico para que se lo aclare.
No use Vaxigrip
- Si usted o su hijo son alérgicos a:
- Los principios activos, o
- A cualquiera de los demás componentes de esta vacuna (enumerados en la sección 6), o
- A cualquiera de los componentes que pueden estar presentes en cantidades mínimas, como huevos (ovoalbúmina o proteínas de pollo), neomicina, formaldehído u octoxinol-9.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Vaxigrip.
Consulte a su médico antes de vacunarse si usted o su hijo tienen:
- Una respuesta inmunológica debilitada (inmunodeficiencia o tratamiento con medicamentos que afecten al sistema inmunológico),
- Problemas de sangrado o se producen hematomas con facilidad.
Si usted o su hijo tienen una enfermedad aguda con fiebre, la vacunación se debe posponer hasta que la fiebre haya desaparecido.
Su médico decidirá si usted o su hijo deben recibir la vacuna.
Antes o después de cualquier inyección, podría producirse un desmayo (especialmente en los adolescentes), por lo que debe informar a su médico o enfermero si usted o su hijo se han desmayado en anteriores ocasiones tras la administración de una inyección.
Como todas las vacunas, Vaxigrip puede no proteger totalmente a todas las personas que se vacunan.
No todos los bebés menores de 6 meses de edad nacidos de mujeres embarazadas vacunadas durante el embarazo estarán protegidos.
Niños
No se recomienda el uso de Vaxigrip en niños menores de 6 meses de edad.
Uso de Vaxigripconotros medicamentos
Informe a su médico o farmacéutico si usted o su hijo están utilizando, han utilizado recientemente o pudieran tener que utilizar cualquier otro medicamento o vacuna.
- Vaxigrip se puede administrar al mismo tiempo que otras vacunas en diferentes sitios de inyección.
- La respuesta inmunológica puede disminuir en el caso de tratamientos inmunosupresores, tales como los corticoesteroides, los medicamentos citotóxicos o la radioterapia.
Embarazo ylactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada, consulte a su médico o farmacéutico antes de utilizar esta vacuna.
Vaxigrip se puede utilizar en todas las fases del embarazo.
Vaxigrip se puede usar durante el periodo de lactancia.
Su médico/farmacéutico podrá decidir si usted debe ser vacunado con Vaxigrip.
Conducción y uso de máquinas
Vaxigrip tiene una influencia nula o insignificante sobre la capacidad de conducir y usar máquinas.
Vaxigrip contiene potasio y sodio
Este medicamento contiene menos de 1 mmol de potasio (39 mg) y menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente "exento de potasio" y "exento de sodio".
3. Cómo usar Vaxigrip
Posología
Adultos: 1 dosis de 0,5 ml.
Uso en niños y en adolescentes
Los niños desde los 6 meses a los 17 años de edad reciben una dosis de 0,5 ml.
Si su hijo es menor de 9 años de edad y no ha sido previamente vacunado frente a la gripe, se debe administrar una segunda dosis de 0,5 ml después de un intervalo de al menos 4 semanas.
Si está embarazada, una dosis de 0,5 ml administrada durante el embarazo puede proteger a su bebé desde el nacimiento hasta los 6 meses de edad. Para mayor información pregunte a su médico o farmacéutico.
Cómo se administra Vaxigrip
Su médico o enfermero le administrará la dosis recomendada de la vacuna con una inyección en el músculo o bajo la piel.
Si usted o su hijo reciben más Vaxigrip del que deberían
En algunos casos, se administró involuntariamente más dosis de la recomendada.
En estos casos, cuando se notificaron acontecimientos adversos, estos estaban en línea con los descritos tras la administración de la dosis recomendada (ver sección 4).
Si usted tiene cualquier duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Si experimenta una reacción alérgica, póngase en contacto inmediatamente con su médico o profesional sanitario o diríjase inmediatamente al servicio de urgencias del hospital más cercano.
Reacciones alérgicas
Se pueden producir inmediatamente después de la administración de la vacuna y pueden ser amenazantes para la vida.
Los síntomas pueden incluir:
- erupción cutánea, picor, dificultad para respirar, falta de aliento, hinchazón de la cara, labios, garganta, o lengua, presión arterial baja, frecuencia cardiaca rápida y pulso débil, piel fría y pegajosa, mareos, debilidad o desfallecimiento (reacción anafiláctica, angioedema, shock).
- Otros síntomas pueden incluir:
- zonas de picor, enrojecimiento, hinchazón y agrietamiento de la piel (dermatitis atópica), rubor, sofoco, sangre en la parte blanca del ojo (hiperemia ocular), enrojecimiento e irritación del ojo (conjuntivitis), irritación de garganta, dolor de garganta, irritación en el interior de la nariz, goteo nasal, estornudos, congestión nasal, de los senos nasales o de la garganta, entumecimiento o sensación de pinchazos en la boca (parestesia oral), erupción en la boca (erupción de la mucosa oral), asma.
Estas reacciones alérgicas fueron notificadas como poco frecuentes (pueden afectar hasta 1 de cada 100 personas) a raras (pueden afectar hasta 1 de cada 1 000 personas).
Efectos adversos adicionales en adultos y personas mayores
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- Dolor de cabeza, dolor muscular, malestar general (malestar) (1), dolor en el lugar de la inyección.
(1) Frecuente en personas mayores
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Fiebre (2), escalofríos, reacciones en el lugar de inyección: enrojecimiento (eritema), dureza (induración), hinchazón.
(2) Poco frecuente en personas mayores
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Hinchazón de los ganglios del cuello, la axila o la ingle (linfadenopatía) (3), debilidad inusual (3), cansancio, somnolencia (4), mareos (4), aumento de la sudoración (hiperhidrosis) (3), dolor articular (3), diarrea, sensación de enfermedad (náuseas), reacciones en el lugar de inyección: hematomas, picor, calor y malestar.
(3) Rara en personas mayores (4) Rara en adultos
Raras (pueden afectar hasta 1 de cada 1 000 personas):
- Entumecimiento o sensación de pinchazos (parestesia), vómitos, disminución del apetito, enfermedad similar a la gripe.
- Disminución de la sensibilidad (hipoestesia), dolor abdominal, alergia en el lugar de inyección: solo observados en adultos.
- Descamación de la piel (exfoliación) en el lugar de la inyección: solo observados en personas mayores.
Efectos adversos adicionales en niños de entre 3 y 17 años de edad
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- Dolor de cabeza, dolor muscular, malestar general, escalofríos, reacciones en el lugar de inyección: dolor, enrojecimiento, hinchazón, dureza (5).
(5) Frecuente en niños de 9 a 17 años de edad
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Fiebre, hematoma en el lugar de la inyección.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Cansancio, mareos, diarrea, reacciones en el lugar de inyección: picor, calor.
- Inflamación de los ganglios del cuello, axilas o ingles, dolor abdominal, vómitos, inquietud, gemidos, dolor articular, llanto: solo se observa en niños de 3 a 8 años de edad.
- Reducción del número de ciertos tipos de partículas en la sangre llamadas plaquetas; un número bajo de estas puede provocar hematomas o hemorragias excesivas (trombocitopenia): solo observados en un niño de 3 años de edad.
- Debilidad inusual, molestias en el lugar de inyección: solo observados en niños de 9 a 17 años de edad.
Efectos adversos adicionales en niños entre 6 y 35 meses de edad
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- Irritabilidad (6), vómitos (7), dolor muscular (8), malestar general (8), fiebre, disminución del apetito (6), reacciones en el lugar de inyección; sensibilidad, enrojecimiento.
- Llanto anormal, somnolencia: solo observados en niños menores de 24 meses de edad.
- Dolor de cabeza: solo observado en niños a partir de los 24 meses de edad.
(6) Rara en niños de 24 a 35 meses de edad
(7) Poco frecuente en niños de 24 a 35 meses de edad
(8) Rara en niños de 6 a 23 meses de edad
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Diarrea, reacciones en el lugar de inyección: endurecimiento, hematoma, hinchazón.
- Escalofríos: solo observado en niños a partir de los 24 meses de edad.
Raras (pueden afectar hasta 1 de cada 1 000 personas):
- Enfermedad de tipo gripal, reacciones en el lugar de inyección: picor, erupción.
En niños de 6 meses a 8 años de edad que reciben 2 dosis, los efectos adversos son similares tanto después de la primera dosis como después de la segunda dosis. Algunos efectos adversos pueden ocurrir después de la administración de la segunda dosis en niños de 6 meses a 35 meses de edad.
La mayoría de los efectos adversos se produjeron generalmente en los 3 días posteriores a la vacunación y remitieron en el plazo de 1 a 3 días sin tratamiento. La intensidad de la mayoría de estos efectos adversos fue de leve a moderada.
Se desconoce la frecuencia de los siguientes efectos adversos (no puede estimarse a partir de los datos disponibles) en toda la población, excepto en la población para la que se indica más arriba el efecto adverso:
- Inflamación de las glándulas del cuello, axilas o ingles.
- Entumecimiento o sensación de pinchazos (parestesia), dolor situado en la vía nerviosa (neuralgia) (9), ataques (convulsiones), trastornos neurológicos que pueden provocar rigidez de cuello, confusión, entumecimiento, dolor y debilidad de las extremidades, pérdida de equilibrio, pérdida de reflejos, parálisis de una parte o de todo el cuerpo (encefalomielitis, neuritis (9), Síndrome de Guillain-Barré (9)).
- Inflamación de los vasos sanguíneos (vasculitis) que puede dar lugar a erupciones cutáneas y, en casos muy raros, a problemas renales temporales.
- Reducción temporal del número de ciertos tipos de partículas en la sangre denominadas plaquetas; un número bajo de estas puede provocar hematomas o hemorragias excesivas (trombocitopenia transitoria).
(9) No se han notificado en niños de 6 a 35 meses de edad
Comunicación de efectos adversos
Si usted o su hijo experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Vaxigrip
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (2ºC - 8ºC). No congelar. Conservar la jeringa en el embalaje exterior para protegerla de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Vaxigrip
Los principios activos son: Virus de la gripe (fraccionados, inactivados) de las siguientes cepas*:
- Cepa similar a A/Victoria/4897/2022 (H1N1)pdm09: (IVR-238)....... 15 microgramos HA**
- Cepa similar a A/Croacia/10136RV/2023(H3N2): (X-425A)............. 15 microgramos HA**
- Cepa similar a B/Austria/1359417/2021: B/Michigan/01/2021 ..…... 15 microgramos HA**
Por dosis de 0,5 ml
- cultivados en huevos de gallina embrionados procedentes de pollos sanos
** hemaglutinina
Esta vacuna cumple con las recomendaciones de la Organización Mundial de la Salud (Hemisferio Norte) y la decisión de la Unión Europea para la campaña 2025-2026.
Los demás componentes son: una solución tampón que contiene cloruro de sodio, hidrogenofosfato de sodio dihidrato, dihidrogenofosfato de potasio, cloruro de potasio y agua para preparaciones inyectables.
Algunos componentes tales como huevos (ovoalbúmina, proteínas de pollo), neomicina, formaldehído u octoxinol-9 pueden estar presentes en cantidades muy pequeñas (ver sección 2).
Aspecto del producto y contenido del envase
Después de agitarla cuidadosamente, la vacuna es un líquido ligeramente incoloro y opalescente.
Vaxigrip se presenta en una jeringa precargada que contiene 0,5 ml de suspensión inyectable, con aguja fija, con aguja separada o con aguja de seguridad, o sin aguja, en envases de 1 o 10. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
Francia
Responsable de la fabricación:
El fabricante responsable de la liberación de los lotes es:
Sanofi Winthrop Industrie
1541 avenue Marcel Mérieux
69280 Marcy l’Etoile
Francia
o
Sanofi Winthrop Industrie
Voie de l’Institut – Parc Industriel d’Incarville
B.P 101
27100 Val de Reuil
Francia
o
Sanofi-Aventis Zrt.
Building Dc5 - Campona Utca 1
Budapest XXII,1225
Hungría
Representante local
sanofi-aventis, S.A.
C/ Rosselló i Porcel, 21
08016 Barcelona
España
Tel: +34 93 485 94 00
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Estado Miembro | Nombre |
Austria, Bélgica, Bulgaria, Croacia, República Checa, Alemania, Dinamarca, Estonia, Finlandia, Francia, Hungría, Islandia, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Países Bajos, Noruega, Polonia, Portugal, Rumania, Suecia, Eslovenia, Eslovaquia, España | Vaxigrip |
Chipre, Grecia | Vaxigrip TIV |
Fecha de la última revisión de esteprospecto: Junio 2025
Otras fuentes de información
Puede acceder a información detallada y actualizada sobre este medicamento escaneando con su teléfono móvil (smartphone) el código QR incluido en el cartonaje. También puede acceder a esta información en la siguiente dirección de internet: https://vaxigrip-nh.info.sanofi.
--------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
Como con todas las vacunas inyectables, se debe disponer del tratamiento médico y la supervisión apropiada en el caso de que ocurra una reacción anafiláctica tras la administración de la vacuna.
La vacuna debe alcanzar la temperatura ambiente antes de su utilización.
Agitar antes de usar. Inspeccionar visualmente antes de la administración.
La vacuna no se debe utilizar si presenta partículas extrañas en la suspensión.
No se debe mezclar con otros medicamentos en la misma jeringa.
Esta vacuna no se debe inyectar directamente en ningún vaso sanguíneo.
Ver también sección 3. Cómo usar Vaxigrip.
Instrucciones de uso de la aguja de seguridad con la jeringa precargada Luer Lock:
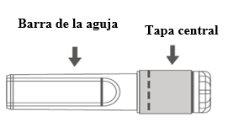
Imagen A: Aguja de seguridad (dentro de la barra) | Imagen B: Componentes de la aguja de seguridad (preparada para su uso) |
|
|
Paso 1:Para fijar la aguja a la jeringa, retire la tapa central para exponer la barra de la aguja, y girar suavemente la aguja en el adaptador Luer Lock de la jeringa hasta que note una ligera resistencia. |
Paso 2:Extraiga el protector de la aguja de seguridad. La aguja está cubierta por el dispositivo de seguridad y el protector. |
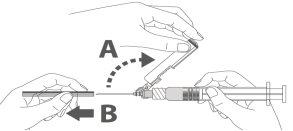
Paso 3: A:Separe el dispositivo de seguridad de la aguja hacia el cuerpo de la jeringa en el ángulo que se muestra. B:Retire el protector en linea recta. |
|
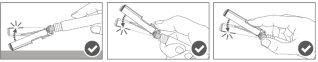
Paso 4:Una vez finalizada la inyección, bloquee (active) el dispositivo de seguridad utilizando una de las tres técnicas ilustradas (3) con una sola mano: activación con una superficie, con el pulgar o con el dedo índice. Nota: La activación se verifica mediante un "clic" audible y/o táctil. |
|
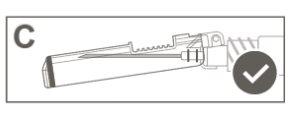
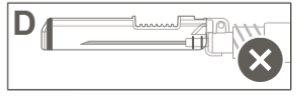
Paso 5:Inspeccionar visualmente la activación del dispositivo de seguridad. El dispositivo de seguridad debe estar completamente bloqueado (activado)como se muestra en la figura C. La figura D muestra que el dispositivo de seguridad NOestá completamente bloqueado (no activado). |
|
Precaución: No intente desbloquear (desactivar) el dispositivo de seguridad forzando la aguja fuera del dispositivo de seguridad.> |
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a VAXIGRIP SUSPENSION INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: INYECTABLE, 3,75 microgramosPrincipio activo: influenza, inactivated, split virus or surface antigenFabricante: Glaxosmithkline BiologicalsRequiere recetaForma farmacéutica: INYECTABLE, 0,5 mlPrincipio activo: influenza, inactivated, split virus or surface antigenFabricante: Sanofi Winthrop IndustrieRequiere recetaForma farmacéutica: INYECTABLE, 60 microgramos de HAPrincipio activo: influenza, inactivated, split virus or surface antigenFabricante: Sanofi Winthrop IndustrieRequiere receta
Médicos online para VAXIGRIP SUSPENSION INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de VAXIGRIP SUSPENSION INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes