
Efluelda Tetra

Zapytaj lekarza o receptę na Efluelda Tetra

Jak stosować Efluelda Tetra
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla użytkownika
Efluelda Tetra, zawiesina do wstrzykiwań w ampułko-strzykawce
Czterowalentna szczepionka przeciw grypie (rozszczepiony wirion, inaktywowana),
60 mikrogramów HA/szczep
Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie
zidentyfikowanie nowych informacji o bezpieczeństwie. Użytkownik leku też może w tym pomóc,
zgłaszając wszelkie działania niepożądane, które wystąpiły po zastosowaniu leku. Aby dowiedzieć się,
jak zgłaszać działania niepożądane – patrz punkt 4.
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta dorosłego lub dziecka.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Szczepionkę tę przepisano ściśle określonej osobie. Nie należy jej przekazywać innym.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest Efluelda Tetra i w jakim celu się ją stosuje
- 2. Informacje ważne przed zastosowaniem szczepionki Efluelda Tetra
- 3. Jak stosować szczepionkę Efluelda Tetra
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać szczepionkę Efluelda Tetra
- 6. Zawartość opakowania i inne informacje
1. Co to jest Efluelda Tetra i w jakim celu się ją stosuje
Efluelda Tetra jest szczepionką. Ta szczepionka pomaga chronić osoby w wieku 60 lat i starsze przed
grypą. Zastosowanie szczepionki Efluelda Tetra powinno opierać się na oficjalnych zaleceniach
dotyczących szczepień przeciw grypie.
Po podaniu szczepionki Efluelda Tetra układ odpornościowy (naturalny system obronny organizmu)
wytwarza własną ochronę przed chorobą (przeciwciała). Żaden ze składników szczepionki nie może
powodować grypy.
Grypa jest chorobą zakaźną układu oddechowego wywoływaną przez wirusy grypy, o nasileniu od
łagodnego do ciężkiego i może prowadzić do poważnych powikłań, takich jak zapalenie płuc, którego
konsekwencją może być hospitalizacja, a nawet zgon. Grypa jest chorobą, która może się szybko
rozprzestrzeniać i jest wywoływana przez wiele różnych szczepów wirusa, które mogą zmieniać się
każdego roku. Z powodu tej możliwej corocznej zmiany krążących szczepów jak również z uwagi na
okres utrzymywania się ochrony zapewnionej przez szczepionkę, zalecane jest wykonanie szczepienia
każdego roku. Największe ryzyko zachorowania na grypę występuje podczas zimnych miesięcy między
październikiem a marcem. W przypadku osób, które nie zostały zaszczepione jesienią, jest nadal
uzasadnione, aby zaszczepić się w okresie do wiosny, ponieważ do tego czasu istnieje ryzyko
zachorowania na grypę. Lekarz będzie w stanie zalecić najlepszy czas do zaszczepienia się.
Szczepionka Efluelda Tetra przeznaczona jest do ochrony przed czterema szczepami wirusa zawartymi
w szczepionce po około 2 do 3 tygodni po szczepieniu. Ponieważ okres wylęgania dla grypy wynosi
kilka dni, w przypadku ekspozycji na wirus grypy bezpośrednio przed lub po szczepieniu, nadal
możliwe jest zachorowanie.

Szczepionka nie chroni przed przeziębieniem, mimo że niektóre jego objawy są podobne do grypy.
2. Informacje ważne przed zastosowaniem szczepionki Efluelda Tetra
Należy poinformować lekarza lub farmaceutę, jeżeli którekolwiek z poniższych stwierdzeń dotyczy
osoby, której ma zostać podana szczepionka Efluelda Tetra. Jeśli cokolwiek jest niezrozumiałe, należy
poprosić lekarza lub farmaceutę o wyjaśnienie.
Kiedy nie stosować szczepionki Efluelda Tetra:
- Jeśli osoba ma uczulenie na:
- substancje czynne, lub
- którykolwiek z pozostałych składników tej szczepionki (wymienionych w punkcie 6), lub
- którykolwiek składnik, który może być obecny w bardzo małych ilościach, taki jak pozostałość jaja (albumina jaja kurzego, białka kurze) i formaldehyd.
Ostrzeżenia i środki ostrożności
Przed zastosowaniem szczepionki Efluelda Tetra należy porozmawiać z lekarzem, farmaceutą lub
pielęgniarką.
Przed szczepieniem należy poinformować lekarza, jeśli u pacjenta występuje:
- osłabienie odpowiedzi immunologicznej (spowodowane niedoborem odporności lub przyjmowaniem leków wpływających na układ odpornościowy),
- krwawienia lub łatwość powstawania siniaków,
- przebyty zespół Guillain-Barré (GBS) (poważne osłabienie mięśni) po otrzymaniu szczepionki przeciw grypie,
- choroba przebiegająca z wysoką lub umiarkowaną gorączką lub ostra choroba. Szczepienie należy odroczyć do czasu wyzdrowienia. Lekarz zdecyduje, czy należy przyjąć szczepionkę.
Omdlenie może wystąpić po, lub nawet przed jakimkolwiek wkłuciem igły. Dlatego należy
poinformować lekarza lub pielęgniarkę jeśli osoba doświadczyła omdleń przy poprzednich
wstrzyknięciach.
Tak jak w przypadku każdej szczepionki, Efluelda Tetra może nie zapewnić pełnej ochrony wszystkim
zaszczepionym osobom.
Należy poinformować lekarza, jeżeli u pacjenta w ciągu kilku dni po szczepieniu przeciw grypie
planowane jest badanie krwi, ze względu na zaobserwowane fałszywie dodatnie wyniki badania krwi u
niektórych pacjentów wcześniej poddanych szczepieniu.
Dzieci
Tej szczepionki nie należy stosować u dzieci. Stosowanie tej szczepionki jest zalecane u osób dorosłych
w wieku 60 lat i starszych.
Szczepionka Efluelda Tetra a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach lub szczepionkach stosowanych
przez pacjenta obecnie lub ostatnio, a także o lekach lub szczepionkach, które planuje stosować.
- W przypadku podawania szczepionki Efluelda Tetra w tym samym czasie z innymi szczepionkami, to szczepionki należy zawsze podać w różne kończyny.
- Należy zauważyć, że działania niepożądane mogą być nasilone przy jednoczesnym podawaniu szczepionek.
- W przypadku stosowania leków obniżających odporność, takich jak kortykosteroidy, leki cytotoksyczne lub radioterapii, odpowiedź immunologiczna na szczepienie może być osłabiona.
Ciąża i karmienie piersią
Szczepionka Efluelda Tetra jest wskazana do stosowania wyłącznie u osób dorosłych w wieku 60 lat i
starszych.
Jeżeli pacjentka jest w ciąży lub karmi piersią, podejrzewa, że może być w ciąży lub planuje mieć dziecko,
powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tej szczepionki. Lekarz lub farmaceuta
pomoże zdecydować, czy pacjentka powinna otrzymać szczepionkę Efluelda Tetra.
Prowadzenie pojazdów i obsługiwanie maszyn
Szczepionka Efluelda Tetra nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia
pojazdów i obsługiwania maszyn.
Szczepionka Efluelda Tetra zawiera potas i sód
Ta szczepionka zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, czyli zasadniczo jest „wolna od
sodu”.
3. Jak stosować szczepionkę Efluelda Tetra
Dorośli w wieku 60 lat i starsi otrzymują jedną dawkę 0,7 ml.
Jak przyjmować szczepionkę Efluelda Tetra
Lekarz lub pielęgniarka poda zalecaną dawkę szczepionki jako wstrzyknięcie do mięśnia lub pod skórę.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tej szczepionki należy
zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, ta szczepionka może powodować działania niepożądane, chociaż nie u każdego one
wystąpią.
Reakcje alergiczne
Należy NATYCHMIASTskontaktować się z lekarzem, jeśli u pacjenta wystąpią:
- Ciężkie reakcje alergiczne:
- mogące wymagać pomocy lekarskiej, z niskim ciśnieniem krwi, dusznością, świszczącym oddechem lub problemem z oddychaniem, szybkim tętnem i słabym pulsem, zimną, wilgotną skórą, zawrotami głowy, które mogą prowadzić do zasłabnięcia (anafilaksja [w tym obrzęk naczynioruchowy tj. obrzęk najbardziej widoczny w obrębie głowy i szyi, w tym twarzy, warg, języka, gardła lub innych części ciała, który może powodować trudności w połykaniu lub oddychaniu]).
Należy skontaktować się z lekarzem, jeśli u pacjenta wystąpią:
- Reakcje alergiczne takie jak reakcje skórne, które mogą dotyczyć całego ciała, w tym świąd, pokrzywka, wysypka. Te działania niepożądane są rzadkie (mogą dotyczyć do 1 na 1000 osób).
Inne działania niepożądane
Poniższe działania niepożądane zgłaszano u dorosłych w wieku 60 lat i starszych.
Bardzo często (mogą wystąpić u więcej niż 1 na 10 osób):
- Reakcje w miejscu wstrzyknięcia: ból, zaczerwienienie (rumień)
- Ogólne złe samopoczucie (zmęczenie), ból głowy, ból mięśni
Często (mogą wystąpić u maksymalnie 1 na 10 osób):
- Reakcje w miejscu wstrzyknięcia: opuchnięcie, zasinienie, stwardnienie
- Gorączka, dreszcze
Niezbyt często (mogą wystąpić u maksymalnie 1 na 100 osób):
- Reakcje w miejscu wstrzyknięcia: świąd
- Zmęczenie, ospałość, nudności, wymioty, biegunka
- Kaszel, osłabienie mięśni, niestrawność, zapalenie gardła (ból jamy ustnej i gardła)
Rzadko (mogą wystąpić u maksymalnie 1 na 1000 osób):
- Brak energii (osłabienie), zaczerwienienie, ból stawów, zawroty głowy pochodzenia ośrodkowego, nocne poty, wysypka, drętwienie lub uczucie mrowienia (parestezje), zapalenie nosa (nieżyt nosa), zawroty głowy (zaburzenia równowagi), nadmiar krwi w białku oka (przekrwienie oka)
- Ból kończyn
Częstość nieznana: częstość nie może być określona na podstawie dostępnych danych
- Zmniejszenie liczby określonych rodzajów komórek we krwi zwanych płytkami krwi; ich niski poziom może powodować nadmierne powstawanie siniaków lub krwawienie (małopłytkowość)
- Powiększenie węzłów chłonnych w okolicy szyi, pachy lub pachwiny (limfadenopatia)
- Zaburzenia neurologiczne, które mogą powodować sztywność szyi, dezorientację, drętwienie, ból i osłabienie kończyn, utratę równowagi, utratę odruchów, porażenie części lub całego ciała (zapalenie mózgu i rdzenia i poprzeczne zapalenie rdzenia, zapalenie nerwu barkowego, zespół Guillain-Barré), porażenie twarzy (porażenie Bella), zaburzenia widzenia spowodowane dysfunkcją nerwów wzrokowych (zapalenie nerwu wzrokowego/neuropatia), napady (drgawki, w tym drgawki gorączkowe), omdlenia wkrótce po szczepieniu
- Zapalenie naczyń krwionośnych, które może prowadzić do wysypek skórnych oraz w bardzo rzadkich przypadkach do przejściowych zaburzeń czynności nerek, rozszerzenie naczyń krwionośnych
- Ból w klatce piersiowej
- Świszczący oddech, ucisk w gardle, trudności w oddychaniu (duszność)
Większość działań niepożądanych występowało zwykle w ciągu 3 dni po szczepieniu i ustępowało w
ciągu 3 dni. Nasilenie tych działań niepożądanych było łagodne do umiarkowanego.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać szczepionkę Efluelda Tetra
Szczepionkę należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tej szczepionki po upływie terminu ważności zamieszczonego na etykiecie i opakowaniu
po „Termin ważności (EXP)”. Termin ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać w lodówce (2 C – 8 C). Nie zamrażać. Przechowywać ampułko-strzykawkę w
opakowaniu zewnętrznym w celu ochrony przed światłem.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera szczepionka Efluelda Tetra
- Substancjami czynnymi są: Wirus grypy (inaktywowany, rozszczepiony) następujących szczepów*:
A/Victoria/4897/2022 (H1N1)pdm09-podobny szczep (A/Victoria/4897/2022, IVR-238)
.............................................................................................................................. 60 mikrogramów HA**
A/Croatia/10136RV/2023 (H3N2)-podobny szczep (A/Croatia/10136RV/2023, X-425A)
.............................................................................................................................. 60 mikrogramów HA**
B/Austria/1359417/2021-podobny szczep (B/Michigan/01/2021, typ dziki)
……………………………………….. ................................................................ 60 mikrogramów HA**
B/Phuket/3073/2013-podobny szczep (B/Phuket/3073/2013, typ dziki)
….…………………………………….. .............................................................. 60 mikrogramów HA**
w dawce 0,7 ml
*
namnożony w zarodkach kurzych
**
hemaglutynina
Szczepionka jest zgodna z zaleceniami Światowej Organizacji Zdrowia ( World Health Organization,
WHO) dla półkuli północnej oraz z zaleceniami Unii Europejskiej na sezon 2025/2026.
Pozostałe składniki to: roztwór buforowy zawierający chlorek sodu, jednozasadowy fosforan sodu,
dwuzasadowy fosforan sodu, woda do wstrzykiwań i octoxynol-9 .
Niektóre składniki takie jak pozostałości jaj (albumina jaja kurzego, białka kurze) lub formaldehyd
mogą być obecne w bardzo małych ilościach (patrz punkt 2).
Jak wygląda szczepionka Efluelda Tetra i co zawiera opakowanie
Po delikatnym wstrząśnięciu szczepionka jest bezbarwną, opalizującą cieczą.
Efluelda Tetra jest zawiesiną do wstrzykiwań w ampułko-strzykawce po 0,7 ml, z igłą lub bez igły
(w opakowaniu po 1, 5 lub 10) lub z igłą w osłonie zabezpieczającej (w opakowaniu po 1 lub 10).
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i importer
Podmiot odpowiedzialny:
Sanofi Winthrop Industrie
82 Avenue Raspail
94250 Gentilly, Francja
Importer:
Sanofi Winthrop Industrie
Voie de l’Institut - Parc Industriel d'Incarville
B.P 101
27100 Val de Reuil, Francja
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
Data ostatniej aktualizacji ulotki:lipiec 2025
Inne źródła informacji
Aktualnie zatwierdzone informacje o tym produkcie są dostępne po zeskanowaniu smartfonem kodu QR
podanego na pudełku tekturowym lub pod następującym adresem URL:
https://eflueldatetra-nh.info.sanofi/
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Tak jak w przypadku wszystkich szczepionek podawanych we wstrzyknięciach, musi być zapewnione
właściwe leczenie i nadzór medyczny na wypadek wystąpienia reakcji anafilaktycznej po podaniu
szczepionki.
Przed podaniem szczepionka powinna osiągnąć temperaturę pokojową.
Wstrząsnąć przed użyciem. Sprawdzić wzrokowo przed podaniem.
Szczepionki nie należy stosować w przypadku obecności w zawiesinie cząstek stałych.
Szczepionki nie należy mieszać z innymi produktami leczniczymi w tej samej strzykawce.
Szczepionki nie wolno wstrzykiwać bezpośrednio do naczyń krwionośnych.
Patrz również punkt 3. Jak stosować szczepionkę Efluelda Tetra
| Austria, Belgia, Bułgaria, Cypr, Czechy, Niemcy, Dania, Grecja, Finlandia, Francja, Chorwacja, Węgry, Irlandia, Włochy, Łotwa, Holandia, Norwegia, Polska, Portugalia, Rumunia, Szwecja, Słowenia, Słowacja, Hiszpania | Efluelda Tetra |
| Wielka Brytania (Irlandia Północna) | Quadrivalent Influenza Vaccine (Split Virion, Inactivated) High Dose |
˂Przygotowanie do podania
Instrukcja dotycząca użycia igły w osłonie zabezpieczającej z ampułko-strzykawką z końcówką Luer
Lock:
| Rycina A: Igła w osłonie zabezpieczającej (w obudowie) | Rycina B: Elementy osłony zabezpieczającej igłę (przygotowane do użycia) |
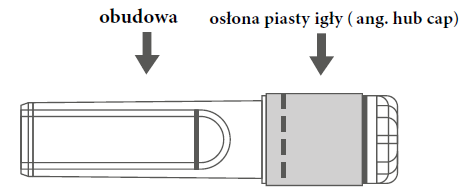 |  |
| Krok 1: Aby przymocować igłę do strzykawki, należy zdjąć osłonę piasty igły (ang. hub cap), aby odsłonić piastę igły i delikatnie wkręcić igłę w adapter Luer Lock strzykawki, aż do wyczucia lekkiego oporu. | |
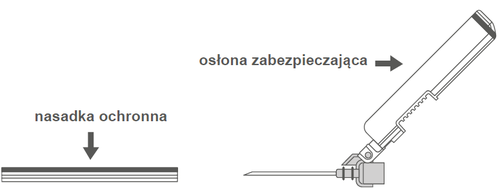
Krok 2: Zdjąć obudowę igły. Igła jest zabezpieczona osłoną zabezpieczającą i nasadką ochronną.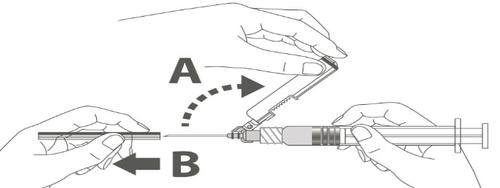 | |
| Krok 3: A: Odsunąć osłonę zabezpieczającą od igły w kierunku korpusu strzykawki pod pokazanym kątem. B: Zdjąć nasadkę ochronną. | |
| Krok 4: Po wstrzyknięciu zablokować (aktywować) osłonę zabezpieczającą, stosując jedną z trzech (3) przedstawionych technik obsługi jedną ręką: aktywacja na płaskiej powierzchni, kciukiem lub palcem wskazującym. Uwaga: Aktywacja jest potwierdzona słyszalnym i (lub) wyczuwalnym “kliknięciem”. | 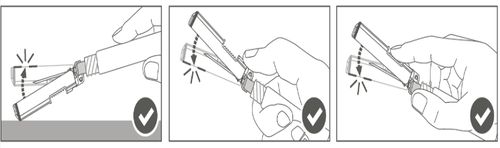 |
| Krok 5: Sprawdzić wzrokowo działanie osłony zabezpieczającej. Osłona zabezpieczająca powinna być całkowicie zablokowana (aktywowana), jak pokazano na rysunku C. Rysunek D pokazuje, że osłona zabezpieczająca NIE jest całkowicie zablokowna (nie jest aktywowana). | 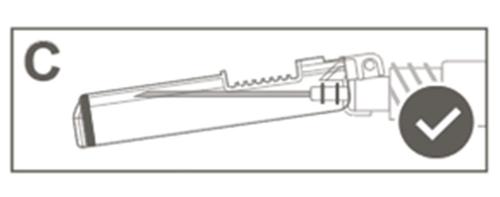 |
Ostrzeżenie: Nie należy próbować odblokować (dezaktywować) urządzenia zabezpieczającego poprzez wypychanie igły z osłony zabezpieczającej.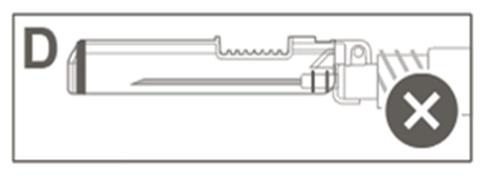 | |
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi
przepisami.>
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- ImporterSanofi Winthrop Industrie
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Efluelda TetraPostać farmaceutyczna: Zawiesina, 60 mcg HA/szczep, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga receptyPostać farmaceutyczna: Zawiesina, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga receptyPostać farmaceutyczna: Zawiesina, 1 dawka (0,5 ml)Substancja czynna: influenza, inactivated, split virus or surface antigenWymaga recepty
Odpowiedniki Efluelda Tetra w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Efluelda Tetra – Hiszpania
Odpowiednik Efluelda Tetra – Ukraina
Lekarze online w sprawie Efluelda Tetra
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Efluelda Tetra – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














