

Vagirux

Zapytaj lekarza o receptę na Vagirux

Jak stosować Vagirux
Ulotka dołączona do opakowania: informacja dla użytkownika
Uwaga! Zachowaj ulotkę! Informacja na opakowaniu bezpośrednim w języku obcym.
Vagirux, 10 mikrogramów, tabletki dopochwowe
Estradiolum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Vagirux i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Vagirux
- 3. Jak stosować lek Vagirux
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Vagirux
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Vagirux i w jakim celu się go stosuje
Lek Vagirux zawiera estradiol.
- Estradiol jest żeńskim hormonem płciowym.
- Należy do grupy hormonów zwanych estrogenami.
- Jest identyczny z estradiolem wytwarzanym przez jajniki kobiety.
Vagirux należy do grupy leków określanej jako hormonalna terapia zastępcza (HTZ) do podawania
dopochwowego.
Lek Vagirux jest stosowany w celułagodzenia objawów menopauzy występujących w pochwie,
takich jak suchość lub podrażnienie. W terminologii medycznej zjawisko to nazywa się „zanikowym
zapaleniem pochwy”. Jest ono spowodowane zmniejszeniem stężenia estrogenów w organizmie i
naturalnie występuje po menopauzie.
Lek Vagirux działa poprzezzastępowanie estrogenu, który jest wytwarzany przez jajniki kobiety.
Lek podawany jest dopochwowo, a więc hormon uwalniany jest tam, gdzie jest potrzebny. Może to
łagodzić odczucie dyskomfortu w pochwie.
2. Informacje ważne przed zastosowaniem leku Vagirux
Wywiad lekarski i regularne kontrole
Stosowanie HTZ niesie ze sobą ryzyko, które powinno być rozważone, kiedy pacjentka decyduje się
czy zastosować hormonalną terapię zastępczą lub kontynuować jej stosowanie.
Doświadczenie w leczeniu kobiet w okresie przedwczesnej menopauzy (z powodu niewydolności
jajników lub zabiegu chirurgicznego) jest ograniczone. Jeśli pacjentka przechodzi przedwczesną
menopauzę ryzyko związane ze stosowaniem HTZ może się różnić. Należy porozmawiać z lekarzem.
Przed rozpoczęciem (lub wznowieniem) stosowania HTZ lekarz powinien przeprowadzić wywiad
lekarski, w tym rodzinny. Lekarz może zdecydować o przeprowadzeniu badania np. badania piersi i
(lub) badania ginekologicznego, jeżeli będą konieczne.
Jeśli pacjentka rozpocznie stosowanie leku Vagirux, powinna przynajmniej raz w roku konsultować
się z lekarzem. Podczas wizyt kontrolnych powinna omówić z lekarzem korzyści i zagrożenia
wynikające z kontynuacji stosowania leku Vagirux.
Pacjentki powinny regularnie wykonywać badania przesiewowe piersi zgodnie z zaleceniem lekarza.
Kiedy nie stosować leku Vagirux
W przypadku wystąpienia któregokolwiek z wymienionych poniżej schorzeń lub wynikających z nich
wątpliwości należy porozmawiać z lekarzemprzed rozpoczęciem stosowania leku Vagirux.
Nie stosować leku Vagirux, jeśli u pacjentki:
- rozpoznano, występował w przeszłości lub podejrzewa się raka piersi;
- rozpoznano, występował w przeszłości lub podejrzewa się nowotwór zależny od estrogenów, np. rak endometrium (rak błony śluzowej macicy);
- stwierdzono występowanie niewyjaśnionego krwawienia z pochwy;
- stwierdzono nadmierne pogrubienie błony śluzowej macicy(przerost endometrium), które nie było leczone;
- rozpoznano lub występowały w przeszłości zakrzepy krwi w żyłach(zakrzepica), np. w kończynach dolnych (zakrzepica żył głębokich) lub płucach (zatorowość płucna);
- występuje zaburzenie krzepnięcia krwi(jak niedobór białka C, białka S lub antytrombiny);
- występuje lub wystąpiła ostatnio choroba wywołana zakrzepami krwi w tętnicach, np. zawałmięśnia sercowego, udarlub dławica piersiowa;
- rozpoznano lub występowała w przeszłości choroba wątrobyi wyniki testów wątrobowych nie wróciły do normy;
- rozpoznano rzadkie zaburzenie krwi - porfirię, która jest przekazywana rodzinnie (dziedziczona).
- stwierdzono alergięna estradiollub którykolwiek z pozostałych składników leku Vagirux (wymienionych w punkcie 6);
Jeśli którekolwiek z wyżej wymienionych schorzeń wystąpi po raz pierwszy w trakcie stosowania leku
Vagirux, należy natychmiast przerwać jego stosowanie i skontaktować się jak najszybciej z lekarzem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem leczenia należy poinformować lekarza o występowaniu obecnie lub w przeszłości
niżej wymienionych chorób, gdyż podczas stosowania leku Vagirux mogą one wystąpić ponownie lub
nasilić się. W takich przypadkach lekarz może stwierdzić konieczność częstszych kontroli.
- Mięśniaki macicy;
- Występowanie błony śluzowej macicy poza jamą macicy (endometrioza) lub nadmierny rozrost błony śluzowej macicy (hiperplazja endometrium) w przeszłości;
- Zwiększone ryzyko powstawania zakrzepów krwi (patrz „Zakrzepy krwi w żyłach (zakrzepica żył)”);
- Zwiększone ryzyko wystąpienia nowotworów zależnych od estrogenów (rak piersi u matki, siostry lub babki);
- Wysokie ciśnienie krwi;
- Choroba wątroby, np. łagodny guz wątroby;
- Cukrzyca;
- Kamica żółciowa;
- Migrena lub silne bóle głowy;
- Choroba układu immunologicznego wpływająca na wiele narządów - toczeń rumieniowaty układowy;
- Padaczka;
- Astma;
- Choroba wpływająca na błonę bębenkową i słuch - otoskleroza;
- Bardzo duże stężenie tłuszczów (triglicerydów) we krwi;
- Zatrzymanie płynów spowodowane zaburzoną czynnością serca lub nerek;
- Dziedziczny i nabyty obrzęk naczynioruchowy.
Należy przerwać stosowanie leku Vagirux i natychmiast skontaktować się z lekarzemw
przypadku wystąpienia któregokolwiek z poniżej wymienionych stanów w trakcie stosowania HTZ:
- Wystąpienie któregokolwiek ze schorzeń wymienionych w punkcie „Kiedy nie stosować leku Vagirux” powyżej;
- Żółte zabarwienie skóry i oczu (żółtaczka). Mogą to być objawy choroby wątroby;
- Obrzęk twarzy, języka i (lub) gardła i (lub) trudności w przełykaniu lub pokrzywki łącznie z trudnościami w oddychaniu, które sugerują obrzęk naczynioruchowy;
- Znaczny wzrost ciśnienia krwi (objawy to np. ból głowy, uczucie zmęczenia i zawroty głowy);
- Migrenowy ból głowy, który pojawił się po raz pierwszy;
- Jeśli pacjentka jest w ciąży;
- Jeśli u pacjentki wystąpią objawy zakrzepów krwi, takie jak:
- bolesny obrzęk i zaczerwienienie kończyn dolnych,
- nagły ból w klatce piersiowej,
- trudności w oddychaniu. Więcej informacji, patrz „Zakrzepy krwi w żyłach (zakrzepica żył)”.
Uwaga:lek Vagirux nie jest środkiem antykoncepcyjnym. Jeżeli minęło mniej niż 12 miesięcy od
momentu wystąpienia ostatniej miesiączki lub pacjentka jest w wieku poniżej 50 lat, może być
konieczne zastosowanie dodatkowej metody zapobiegania ciąży. Należy skonsultować się z lekarzem.
HTZ i rak
Nadmierne pogrubienie błony śluzowej macicy (hiperplazja endometrium) i rak błony śluzowej macicy (rak endometrium)
Stosowanie przez długi czas HTZ w postaci tabletek zawierających wyłącznie estrogen, może
zwiększyć ryzyko rozwoju raka błony śluzowej macicy (endometrium).
Nie wiadomo czy podobne ryzyko istnieje podczas powtarzanego lub przedłużanego (dłuższego niż
jeden rok) stosowania leku Vagirux. Jednak lek Vagirux w bardzo małym stopniu ulega wchłanianiu
do krwi i dlatego dodawanie progestagenu nie jest konieczne.
Krwawieniebądź plamienienie jest zwykle powodem do niepokoju, ale należy skonsultować się z
lekarzem. Może być to objaw pogrubienia endometrium.
Opisane zagrożenia dotyczą leków stosowanych w hormonalnej terapii zastępczej HTZ, które dostają
się do krwi. Lek Vagirux jest stosowany miejscowo dopochwowo i jego wchłanianie do krwi jest
bardzo małe. Jest mniej prawdopodobne, że wymienione poniżej dolegliwości nasilą się lub wystąpią
ponownie podczas stosowania leku Vagirux, jednak w przypadku wątpliwości należy skonsultować się
z lekarzem.
Rak piersi
Dane wskazują, iż stosowanie leku Vagirux nie zwiększa ryzyka wystąpienia raka piersi u kobiet,
które nigdy wcześniej na niego nie chorowały. Nie wiadomo, czy lek Vagirux może być bezpiecznie
stosowany u kobiet, które chorowały na raka piersi.
Należy regularnie badać piersi. Należy skontaktować się z lekarzem w przypadku zauważenia którejkolwiek ze zmian:
- zapadanie się skóry,
- zmiany brodawki sutkowej,
- obecność guzków, które są widoczne lub wyczuwalne.
Dodatkowo, zaleca się wykonywanie przesiewowych badań mammograficznych zgodnie z
zaleceniami lekarza.
Nowotwór jajnika
Nowotwór jajnika występuje rzadko - znacznie rzadziej, niż nowotwór piersi. Stosowanie HTZ
obejmującej tylko estrogeny wiąże się z nieznacznie zwiększonym ryzykiem nowotworu jajnika.
Porównanie
Ryzyko nowotworu jajnika zależy od wieku. Na przykład u kobiet w wieku od 50 do 54 lat, które nie
stosują HTZ, nowotwór jajnika zostanie rozpoznany w okresie 5 lat u około 2 na 2000 kobiet. U
kobiet, które przyjmowały HTZ przez 5 lat, występuje u około 3 kobiet na 2000 stosujących (tj. około
1 dodatkowy przypadek).
Wpływ HTZ na serce i krążenie
Zakrzepy krwi w żyłach (zakrzepica żył)
Ryzyko wystąpienia zakrzepów krwi w żyłachjest od 1,3- do 3-krotnie większe u kobiet stosujących
HTZ w porównaniu do niestosujących, zwłaszcza w pierwszym roku stosowania.
Powstanie zakrzepów krwi może mieć poważne konsekwencje, a jeśli przeniosą się do płuc, mogą
spowodować ból w klatce piersiowej, duszność, utratę przytomności, a nawet śmierć.
Ryzyko wystąpienia zakrzepów krwi w żyłach jest większe, jeżeli pacjentka jest w starszym wieku lub
którakolwiek z poniższych sytuacji dotyczy pacjentki. Należy poinformować lekarza jeżeli
którakolwiek z poniższych sytuacji dotyczy pacjentki:
- pacjentka nie może chodzić przez dłuższy czas z powodu poważnej operacji, urazu lub choroby (patrz także punkt 3, „Jeśli planowana jest operacja”);
- występuje znaczna nadwaga (WMC > 30 kg/m );
- występują zaburzenia zatorowo-zakrzepowe, które wymagają długotrwałego przyjmowania leków zapobiegających powstawaniu zakrzepów krwi;
- u pacjentki lub kogokolwiek z bliskiej rodziny dochodziło w przeszłości do powstawania zakrzepów krwi w kończynach dolnych, płucach lub innych narządach;
- występuje toczeń rumieniowaty układowy;
- zdiagnozowano raka.
Jeśli wystąpią objawy zakrzepów krwi, patrz „Należy przerwać stosowanie leku Vagirux i natychmiast
skontaktować się z lekarzem”.
Porównanie
U kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, liczbę przypadków zakrzepów krwi w żyłach
w ciągu 5 lat szacuje się na 4 do 7 na 1000 kobiet.
U kobiet w wieku od 50 do 59 lat stosujących wyłącznie estrogenową HTZ przez ponad 5 lat liczba
przypadków wyniesie od 5 do 8 przypadków na 1000 (tzn. 1 dodatkowy przypadek).
Choroba serca (zawał serca)
U kobiet stosujących wyłącznie estrogenową HTZ nie występuje zwiększone ryzyko rozwoju choroby
serca.
Udar
Ryzyko wystąpienia udaru jest około 1,5-krotnie większe u kobiet stosujących HTZ w porównaniu do
niestosujących. Liczba dodatkowych przypadków udaru spowodowanych stosowaniem HTZ zwiększa
się wraz z wiekiem.
Porównanie
U kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, liczbę przypadków wystąpienia udaru w
ciągu 5 lat szacuje się średnio na 8 na 1000 kobiet. Natomiast u kobiet w wieku od 50 do 59 lat, które
stosują HTZ, liczba przypadków w ciągu 5 lat wyniesie 11 na 1000 kobiet (tzn. 3 dodatkowe
przypadki).
Inne stany
HTZ nie zapobiega utracie pamięci. Ryzyko prawdopodobnej utraty pamięci może być w pewnym
stopniu większe u kobiet, które rozpoczęły stosowanie HTZ w wieku powyżej 65 lat. Należy
skonsultować się z lekarzem.
Lek Vagirux a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjentkę
obecnie lub ostatnio, również tych, które wydawane są bez recepty, lekach roślinnych lub innych
produktach naturalnych.
Prawdopodobieństwo wystąpienia interakcji z innymi lekami jest niewielkie, ponieważ lek Vagirux
stosowany jest miejscowo dopochwowo. Lek Vagirux może wpływać na inne miejscowe leczenie
stosowane dopochwowo.
Ciąża i karmienie piersią
Lek Vagirux jest przeznaczony do stosowania tylko przez kobiety w wieku pomenopauzalnym. Jeśli
pacjentka zajdzie w ciążę, należy przerwać stosowanie leku i skontaktować się z lekarzem.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie wiadomo o wpływie leku Vagirux na prowadzenie pojazdów lub obsługiwanie maszyn.
3. Jak stosować lek Vagirux
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić
się do lekarza lub farmaceuty.
Stosowanie leku
- Stosowanie leku Vagirux można rozpocząć w dowolnym dniu.
- Wyłącznie do stosowania dopochwowego. Nie należy przyjmować tabletek doustnie.
- Tabletkę dopochwową należy umieścić w pochwie za pomocą aplikatora.
„INSTRUKCJA UŻYCIA” na końcu niniejszej ulotki zawiera dokładne wskazówki. Przed
zastosowaniem leku Vagirux należy dokładnie przeczytać instrukcję.
Aplikator tabletek dopochwowych jest przeznaczony do wielokrotnego stosowania do 24 razy dla
jednej pacjentki (jedna tabletka na aplikację). Następnie należy wyrzucić aplikator wraz z odpadami
domowymi. Nie należy używać aplikatorów, które wykazują widoczne ślady uszkodzeń.
Jaką dawkę leku stosować
- Przez pierwsze 2 tygodnie należy stosować jedną tabletkę dopochwową raz na dobę.
- Następnie należy stosować jedną tabletkę dopochwową dwa razy w tygodniu. Pomiędzy kolejnymi dawkami należy zachować przerwę 3 - 4 dni.
Informacje ogólne na temat leczenia objawów menopauzy
- Lekarz określa najmniejszą dawkę leku Vagirux skuteczną w leczeniu objawów przez możliwie najkrótszy okres. Należy skonsultować się z lekarzem, jeśli zalecona dawka wydaje się za duża lub niewystarczająca.
- Leczenie należy kontynuować wyłącznie wtedy, gdy korzyści z niego płynące przewyższają ryzyko. Należy porozmawiać na ten temat z lekarzem.
Zastosowanie większej niż zalecana dawki leku Vagirux
- W przypadku przyjęcia większej dawki leku Vagirux niż zalecana, należy skontaktować się z lekarzem lub farmaceutą.
- Lek Vagirux jest przeznaczony do stosowania miejscowego, wewnątrz pochwy. Dawka estradiolu jest na tyle mała, że trzeba byłoby zastosować znaczną liczbę tabletek, aby osiągnąć dawkę zazwyczaj stosowaną w leczeniu doustnym.
Pominięcie zastosowania dawki leku Vagirux
- W razie pominięcia dawki, należy zastosować pominiętą tabletkę tak szybko, jak to możliwe.
- Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki.
Przerwanie stosowania leku Vagirux
Nie należy przerywać leczenia lekiem Vagirux bez porozumienia z lekarzem. Lekarz wyjaśni
pacjentce następstwa przerwania leczenia oraz omówi inne możliwe metody leczenia.
Jeśli planowana jest operacja
Jeśli u pacjentki planuje się wykonanie operacji, powinna ona powiedzieć chirurgowi, że stosuje lek
Vagirux. Może być konieczne przerwanie stosowania leku Vagirux na 4 do 6 tygodni przed operacją,
aby zmniejszyć ryzyko zakrzepu krwi (patrz punkt 2, „Zakrzepy krwi w żyłach (zakrzepica żył)”).
Przed ponownym rozpoczęciem stosowania leku Vagirux należy skonsultować się z lekarzem.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
U kobiet stosujących HTZ w postaci leków, które dostają się do krwi częściej zgłaszane były
następujące choroby, w porównaniu do kobiet niestosujących HTZ. Poniższe zagrożenia w mniejszym
stopniu dotyczą leków podawanych dopochwowo, takich jak lek Vagirux:
- rak jajnika;
- zakrzepy krwi w żyłach nóg lub płucach (żylna choroba zakrzepowo-zatorowa);
- udar;
- prawdopodobnie utrata pamięci, jeśli rozpoczęto stosowanie HTZ w wieku powyżej 65 lat.
W celu uzyskania dalszych informacji, patrz punkt 2, „Informacje ważne przed zastosowaniem leku
Vagirux”.
Często: może dotyczyć mniej niż 1 na 10 kobiet
- ból głowy;
- ból brzucha;
- krwawienie z pochwy, upławy lub odczuwalny dyskomfort.
Niezbyt często: może dotyczyć mniej niż 1 na 100 kobiet
- zakażenia grzybicze narządów płciowych;
- złe samopoczucie (nudności);
- wysypka;
- zwiększenie masy ciała;
- uderzenia gorąca;
- nadciśnienie tętnicze.
Bardzo rzadko: może dotyczyć mniej niż 1 na 10 000 kobiet
- biegunka;
- zatrzymanie płynów;
- nasilenie migreny;
- uogólniona nadwrażliwość (np. reakcja anafilaktyczna/wstrząs anafilaktyczny).
W trakcie leczenia estrogenami stosowanymi ogólnoustrojowo zgłaszano następujące działania niepożądane:
- kamica pęcherzyka żółciowego;
- różne zaburzenia skóry:
- odbarwienie skóry zwłaszcza twarzy lub szyi określane jako plamy ciążowe (ostuda);
- bolesne czerwonawe guzki skórne (rumień guzowaty);
- wysypka z charakterystycznym zaczerwienieniem lub bolesnością (rumień wielopostaciowy).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można
zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301,
faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Vagirux
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na opakowaniu. Termin
ważności oznacza ostatni dzień podanego miesiąca.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko. Ten lek może stwarzać zagrożenie dla środowiska wodnego.
6. Zawartość opakowania i inne informacje
Co zawiera lek Vagirux
- Substancją czynną leku jest estradiol. Każda tabletka dopochwowa zawiera estradiol półwodny co odpowiada 10 mikrogramom estradiolu.
- Pozostałe składniki to: hypromeloza, laktoza jednowodna, skrobia kukurydziana i magnezu stearynian. Otoczka tabletki: hypromeloza i makrogol.
Jak wygląda lek Vagirux i co zawiera opakowanie
Tabletki dopochwowe są białe, okrągłe, powlekane z wytłoczoną literą “E” po jednej stronie, o
średnicy około 6 mm.
Wielkości opakowań:
18 tabletek dopochwowych w blistrze z folii PVC/PVDC/Aluminium z oddzielnie zapakowanym
aplikatorem dopochwowym do wielokrotnego stosowania w folii zabezpieczającej. Całość w
tekturowym pudełku.
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do podmiotu
odpowiedzialnego lub importera równoległego.
Podmiot odpowiedzialny w Grecji, kraju eksportu:
Gedeon Richter Plc.
Gyömrői út 19-21.
H-1103 Budapeszt
Węgry
Wytwórca:
Haupt Pharma Münster GmbH
Schleebrüggenkamp 15
48159 Münster
Niemcy
Gedeon Richter Plc.
Gyömrői út 19-21.
H-1103 Budapeszt
Węgry
Importer równoległy:
InPharm Sp. z o.o.
ul. Strumykowa 28/11
03-138 Warszawa
Przepakowano w:
InPharm Sp. z o.o. Services sp. k.
ul. Chełmżyńska 249
04-458 Warszawa
Numer pozwolenia w Grecji, kraju eksportu:20658/12-03-2021
Numer pozwolenia na import równoległy:81/24
Data zatwierdzenia ulotki: 28.02.2024
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
Węgry
Vagirux 10 mikrogramm hüvelytabletta
Austria
Rewellfem 10 Mikrogramm Vaginaltabletten
Lichtenstein
Rewellfem
Czechy
Vagirux
Słowacja
Vagirux 10 mikrogramov vaginálne tablety
Dania
Rewellfem
Islandia
Rewellfem
Norwegia
Vagirux
Finlandia
Vagirux
Szwecja
Vagirux
Estonia
VAGIRUX
Łotwa
Vagirux 10 mikrogrami vaginālās tabletes
Litwa
VAGIRUX 10 mikrogramų makšties tabletės
Chorwacja
Vagirux 10 mikrograma tablete za rodnicu
Słowenia
Vagirux 10 mikrogramov vaginalne tablete
Irlandia
Vagirux
Malta
Vagirux 10 microgram vaginal tablets
Hiszpania
Vagirux 10 microgram vaginal tablets
Włochy
Vagirux
Polska
Vagirux
[Informacja o zastrzeżonym znaku towarowym]
INSTRUKCJA UŻYCIA
Jak stosować lek Vagirux
- 1. Usunąć folię zabezpieczającą aplikator. Otworzyć od strony pokazanej na rysunku.
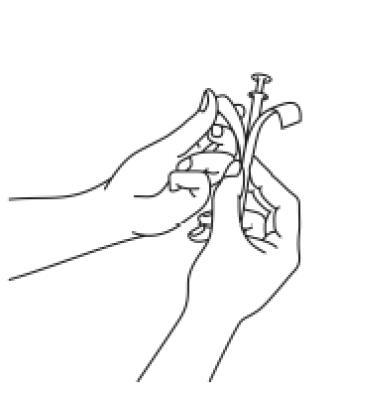
- 2. Trzymając rurkę, pociągnąć tłoczek aplikatora, aż do momentu jego zatrzymania. Wyciągnąć jedną tabletkę dopochwową z oddzielnego blistra i umieścić ją mocno w uchwycie (szeroki koniec) rurki aplikatora.
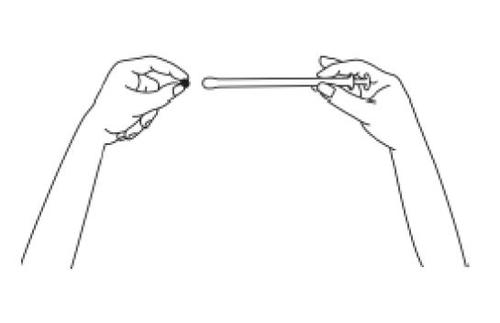
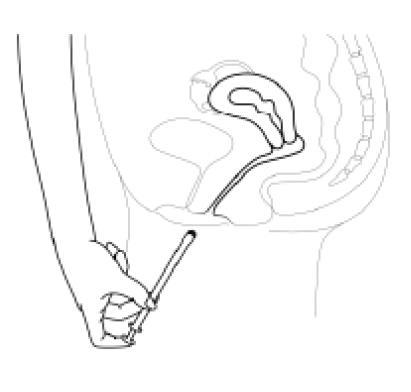
- 3. Ostrożnie wprowadzać aplikator do pochwy, aż do momentu wyczucia oporu (8–10 cm).
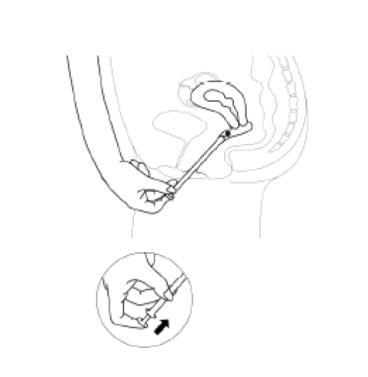
- 4. Aby uwolnić tabletkę, należy naciskać tłoczek do wyczucia oporu. Tabletka natychmiast przyklei się do ściany pochwy. Tabletce nie grozi wypadnięcie w pozycji stojącej ani podczas chodzenia.
- 5. Po każdym użyciu, przed kolejnym użyciem, należy umyć aplikator zgodnie z poniższą instrukcją czyszczenia:
- Wyciągnąć tłoczek z aplikatora.
- Wyczyścić zarówno rurkę, jak i tłoczek przy użyciu łagodnego mydła i dokładnie opłukać ciepłą wodą z kranu. Wypłukać zarówno wewnętrzną jak i zewnętrzną powierzchnię rurki.
- Jeśli to konieczne, usunąć większe ilości wody pozostałej zarówno z rurki, jak i z tłoczka, potrząsając nimi krótko.
- Wysuszyć na powietrzu zarówno rurkę, jak i tłoczek na czystej powierzchni (np. na ręczniku papierowym).
- Ponownie wprowadzić tłoczek do rurki aplikatora w celu późniejszego użycia.
- 6. Aplikatora należy używać aż do opróżnienia opakowania (18 razy), a następnie wyrzucić aplikator wraz z odpadami domowymi.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Podmiot odpowiedzialny (MAH)Gedeon Richter Plc.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki VagiruxPostać farmaceutyczna: Żel, 0,5 mgSubstancja czynna: estradiolProducent: Orion CorporationWymaga receptyPostać farmaceutyczna: Żel, 1 mgSubstancja czynna: estradiolProducent: Orion CorporationWymaga receptyPostać farmaceutyczna: Żel, 1 mg/gSubstancja czynna: estradiolWymaga recepty
Odpowiedniki Vagirux w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Vagirux – Spain
Odpowiednik Vagirux – Ukraine
Lekarze online w sprawie Vagirux
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Vagirux – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.










