
Systen Sequi

Zapytaj lekarza o receptę na Systen Sequi

Jak stosować Systen Sequi
Ulotka dołączona do opakowania: informacja dla użytkownika
SYSTEN SEQUI:
Systen 50; 3,2 mg, system transdermalny, plaster
Estradiolum
Systen Conti; 3,2 mg + 11,2 mg, system transdermalny, plaster
Estradiolum + Norethisteroni acetas
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
1 .Co to jest lek Systen Sequi i w jakim celu się go stosuje.
- 2. Informacje ważne przed zastosowaniem leku Systen Sequi.
- 3. Jak stosować lek Systen Sequi.
- 4. Możliwe działania niepożądane.
- 5. Jak przechowywać lek Systen Sequi.
- 6. Zawartość opakowania i inne informacje.
1. Co to jest lek Systen Sequi i w jakim celu się go stosuje
Każde opakowanie leku Systen Sequi zawiera 4 systemy transdermalne, plastry Systen 50 oraz 4 systemy
transdermalne, plastry Systen Conti.
Systen Sequi to lek stosowany w hormonalnej terapii zastępczej (HTZ). Jest to system transdermalny w
postaci plastra, do stosowania na skórę. Zawiera on estradiol, kobiecy hormon należący do estrogenów i
octan noretysteronu, który jest progestagenem. Estradiol zawarty w leku jest identyczny, jak hormon
naturalnie wytwarzany przez jajniki u kobiet w okresie przed menopauzą.
Lek Systen Sequi jest stosowany w celu:
złagodzenia objawów związanych z menopauzą
W czasie menopauzy zmniejsza się ilość estrogenów produkowanych w organizmie kobiety, co może
powodować takie objawy jak uczucie gorąca na twarzy, szyi i klatce piersiowej („uderzenia gorąca”),
problemy ze snem, drażliwość i depresja. Systen Sequi łagodzi wymienione objawy związane z
menopauzą. Lek Systen Sequi może zostać zalecony pacjentce tylko, gdy objawy znacznie utrudniają jej
codzienne życie.
Doświadczenie w leczeniu kobiet w wieku powyżej 65 lat jest ograniczone.
2. Informacje ważne przed zastosowaniem leku Systen Sequi
Wywiad lekarski i regularne badania lekarskie
Stosowanie HTZ niesie ze sobą ryzyko, które powinno być rozważone, kiedy pacjentka decyduje się czy
zastosować hormonalną terapię zastępczą lub kontynuować jej stosowanie.
Doświadczenie w leczeniu kobiet w okresie przedwczesnej menopauzy (z powodu niewydolności
jajników lub zabiegu chirurgicznego) jest ograniczone. Jeśli pacjentka przechodzi przedwczesną
menopauzę ryzyko związane ze stosowaniem HTZ może się różnić. Należy porozmawiać z lekarzem.
Przed rozpoczęciem (lub wznowieniem) stosowania HTZ, lekarz powinien przeprowadzić wywiad
lekarski, w tym rodzinny. Lekarz może zdecydować o przeprowadzeniu badań, w tym badania piersi i
(lub) badania ginekologicznego, jeśli są niezbędne.
Jeśli pacjentka rozpocznie stosowanie leku Systen Sequi powinna regularnie zgłaszać się na badania
lekarskie (przynajmniej raz w roku). Podczas tych badań, powinna rozważyć z lekarzem korzyści i
zagrożenia wynikające z kontynuacji stosowania leku Systen Sequi.
Pacjentka powinna regularnie przechodzić badania piersi, zgodnie z zaleceniami lekarza.
Kiedy nie stosować leku Systen Sequi:
W przypadku wystąpienia któregokolwiek z wymienionych poniżej schorzeń lub w razie wątpliwości,
należy powiedzieć o tym lekarzowiprzed zastosowaniem leku Systen Sequi.
Nie należy rozpoczynać stosowania leku Systen Sequi:
- jeśli pacjentka ma uczulenie na estradiol, octan noretysteronulub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6);
- jeśli pacjentka ma lub miała raka piersialbo istnieje jego podejrzenie;
- jeśli pacjentka ma lub jest podejrzewany nowotwór estrogenozależny(np. rak błony śluzowej macicy);
- jeśli pacjentka ma jeśli u pacjentki występuje nieleczony nadmierny rozrost błony śluzowej macicy
- hiperplazja endometrium;
- jeśli u pacjentki występują krwawienia z dróg rodnych o nieznanym pochodzeniu;
- jeśli pacjentka jest w ciąży lub karmi piersią;
- jeśli pacjentka ma lub miała kiedykolwiek choroby wątroby, a wyniki badań czynnościowych wątroby nie powróciły do wartości prawidłowych;
- jeśli pacjentka ma lub miała zakrzepy krwi w żyłach(żylna choroba zakrzepowo-zatorowa np. w żyłach kończyn dolnych (zakrzepica żył głębokich), w płucach (zatorowość płucna);
- jeśli pacjentka ma zaburzenia krzepnięcia krwi(niedobór białka C, białka S lub antytrombiny);
- jeśli pacjentka ma lub miała zaburzenia zakrzepowo- zatorowe tętnic (np. udar mózgu dławicapiersiowa zawał mięśnia sercowego);
- jeśli pacjentka ma rzadką, dziedziczną chorobę krwi - porfirię.
Jeżeli którykolwiek z wyżej wymienionych stanów pojawi się po raz pierwszy podczas stosowania leku
Systen Sequi, należy przerwać jego stosowanie i skonsultować się z lekarzem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem leczenia należy poinformować lekarza o występowaniu w przeszłości
któregokolwiek z wymienionych poniżej schorzeń, gdyż mogą one wystąpić ponownie lub nasilić się w
czasie stosowania leku Systen Sequi.
W takim przypadku lekarz może stwierdzić, że pacjentka wymaga częstszego monitorowania:
- mięśniaki macicy;
- endometrioza (występowanie fragmentów błony śluzowej trzonu macicy w miejscach nietypowych dla tej tkanki) lub hiperplazja endometrium (nadmierny rozrost błony śluzowej macicy) w przeszłości;
- zwiększone ryzyko powstania zakrzepów (patrz poniżej „Zakrzepy krwi w żyłach (żylna choroba zakrzepowo-zatorowa)”;
- zaburzenia zakrzepowo-zatorowe w wywiadzie lub obecność czynników ryzyka tych zaburzeń;
- zwiększone ryzyko nowotworów estrogenozależnych, np. rak piersi u matki, siostry lub babci;
- nadciśnienie tętnicze;
- choroby wątroby (np. gruczolak wątroby);
- cukrzyca;
- kamica żółciowa;
- migrena lub (silne) bóle głowy;
- choroba układu immunologicznego mająca wpływ na wiele narządów (toczeń rumieniowaty układowy);
- padaczka;
- astma oskrzelowa;
- otoskleroza (choroba ucha prowadząca do stopniowej utraty słuchu);
- mastopatia
- duże stężenie trójglicerydów we krwi;
- zatrzymywanie płynów spowodowane zaburzoną czynnością serca lub nerek;
- stan, w którym tarczyca nie wytwarza wystarczającej ilości hormonów tarczycy (niedoczynność tarczycy) i pacjentka stosuje terapię zastępczą hormonami tarczycy;
- dziedzicznie uwarunkowany i nabyty stan powodujący nawracające epizody obrzęku (dziedziczny i nabyty obrzęk naczynioruchowy) lub występowanie w przeszłości nagłych obrzęków rąk, twarzy , stóp, warg, oczu, języka, gardła (niedrożność dróg oddechowych) lub przewodu pokarmowego.
W przypadku wystąpienia poniższych schorzeń podczas stosowania HTZ należy przerwać stosowanie leku Systen Sequi i natychmiast skontaktować się z lekarzem:
- jeśli występuje którykolwiek ze stanów wymienionych w punkcie „Kiedy nie stosować leku Systen Sequi”;
- jeśli skóra lub białkówki oczu zżółkną (żółtaczka) co może być objawem zaburzeń czynności wątroby;
- znaczne zwiększenie ciśnienia tętniczego (objawami mogą być: ból głowy, zmęczenie i zawroty głowy);
- jeśli po raz pierwszy pojawi się ból głowy typu migrenowego;
- jeśli zostanie stwierdzona ciąża;
- jeśli wystąpi opuchnięcie twarzy, języka i (lub) gardła i (lub) trudności w przełykaniu czy pokrzywki, w połączeniu z trudnościami w oddychaniu, które sugerują obrzęk naczynioruchowy;
- jeśli wystąpią objawy zakrzepu krwi, takie jak:
- bolesny obrzęk i zaczerwienienie kończyn dolnych,
- nagły ból w klatce piersiowej,
- trudności w oddychaniu. W celu uzyskania dodatkowych informacji patrz punkt Zakrzepy krwi w żyłach (żylna chorobazakrzepowo - zatorowa).
Uwaga:Systen Sequi nie jest środkiem antykoncepcyjnym. Jeżeli minęło mniej niż 12 miesięcy od
momentu wystąpienia ostatniej miesiączki lub pacjentka jest w wieku poniżej 50 lat, może być konieczne
zastosowanie dodatkowej metody zapobiegania ciąży. Należy porozmawiać z lekarzem.
Hormonalna terapia zastępcza a rak
Nadmierny rozrost błony śluzowej macicy (hiperplazja endometrium) i rak błony śluzowej macicy (rak endometrium)
Stosowanie wyłącznie estrogenów w HTZ zwiększa ryzyko nadmiernego rozrostu błony śluzowej macicy
(hiperplazja endometrium) i raka błony śluzowej macicy (rak endometrium).
Progestagen w leku Systen Sequi pomaga zmniejszyć to dodatkowe ryzyko.
Porównanie
U kobiet w wieku od 50 do 65 lat z zachowaną macicą i niestosujących HTZ średnio u 5 na 1000 zostanie
zdiagnozowany rak endometrium.
U kobiet w wieku od 50 do 65 lat z zachowaną macicą i stosujących wyłącznie estrogeny w HTZ,
w zależności od czasu trwania leczenia i dawki przyjmowanych estrogenów u 10 do 60 na 1000 kobiet
zostanie zdiagnozowany rak endometrium (tzn. od 5 do 55 dodatkowych przypadków).
Nieregularne krwawienia
W czasie pierwszych 3 do 6 miesięcy stosowania leku Systen Sequi mogą wystąpić nieregularne
krwawienia lub pojawić się krople krwi (plamienie). Natomiast, jeżeli nieregularne krwawienie:
- utrzymuje się w czasie dłuższym niż przez pierwsze 6 miesięcy;
- wystąpi po stosowaniu leku Systen Sequi przez dłużej niż 6 miesięcy;
- utrzymuje się pomimo zaprzestania stosowania leku Systen Sequi; należy skontaktowa si z lekarzem tak szybko, jak to jest możliwe.
Rak piersi
Dane potwierdzają, że przyjmowanie hormonalnej terapii zastępczej (HTZ) w postaci skojarzenia
estrogenu i progestagenu lub samego estrogenu zwiększa ryzyko wystąpienia raka piersi. Dodatkowe
ryzyko zależy od tego, jak długo pacjentka stosuje HTZ. To dodatkowe ryzyko ujawnia się po 3 latach
stosowania HTZ. Po zakończeniu HTZ dodatkowe ryzyko będzie się z czasem zmniejszać, ale ryzyko
może się utrzymywać przez 10 lat lub dłużej, jeśli HTZ trwała ponad 5 lat.
Porównanie
W przypadku kobiet w wieku od 50 do 54 lat, które nie stosują HTZ, rak piersi zostanie rozpoznany u
średnio 13 do 17 na 1000 kobiet w okresie 5 lat.
W przypadku kobiet w wieku 50 lat, które rozpoczną pięcioletnią estrogenową HTZ, liczba zachorowań
wyniesie 16–17 na 1000 pacjentek (tj. dodatkowe 0 do 3 przypadków).
W przypadku kobiet w wieku od 50 lat, które rozpoczną pięcioletnią estrogenowo-progestagenową HTZ,
liczba zachorowań wyniesie 21 na 1000 pacjentek (tj. dodatkowe 4 do 8 przypadków).
W przypadku kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, rak piersi zostanie rozpoznany u
średnio 27 na 1000 kobiet w okresie 10 lat.
W przypadku kobiet w wieku 50 lat, które rozpoczną 10-letnią estrogenową HTZ, liczba zachorowań
wyniesie 34 na 1000 pacjentek (tj. dodatkowe 7 przypadków).
W przypadku kobiet w wieku 50 lat, które rozpoczną 10-letnią estrogenowo-progestagenową HTZ, liczba
zachorowań wyniesie 48 na 1000 pacjentek (tj. dodatkowe 21 przypadków).
Należy regularnie badać piersi. Należy skontaktować się z lekarzem w przypadku zauważenia którejkolwiek ze zmian:
- marszczenie skóry;
- zmiany brodawki sutkowej;
- jakiekolwiek zauważalne lub wyczuwalne guzki.
Dodatkowo, zaleca się udział w oferowanych programach przesiewowych badań mammograficznych.
Ważne jest, aby przed badaniem poinformować pielęgniarkę lub osobę z personelu medycznego, która
przeprowadza badanie rentgenowskie, o stosowaniu hormonalnej terapii zastępczej, ponieważ lek ten
może zwiększać gęstość piersi, co z kolei może wpłynąć na wynik badania mammograficznego. Nie
wszystkie guzki mogą zostać wykryte podczas badania mammograficznego w miejscach zwiększonej
gęstości piersi.
Rak jajnika
Rak jajnika występuje rzadziej niż rak piersi. W niektórych badaniach epidemiologicznych podczas
długotrwałego (co najmniej 5 do 10 lat) stosowaniu hormonalnej terapii zastępczej, obejmującej
wyłącznie estrogeny, u kobiet po histerektomii stwierdzano zwiększenie ryzyka rozwoju raka jajnika.
Niektóre badania w tym badanie WHI sugerują że długotrwałe stosowanie skojarzonych HTZ może
powodować podobne lub nieznacznie mniejsze ryzyko.
Hormonalna terapia zastępcza a wpływ na serce i krążenie
Zakrzepy krwi w żyłach (żylna choroba zakrzepowo-zatorowa)
Stosowanie HTZ związane jest ze zwiększeniem ryzyka wystąpienia żylnej choroby zatorowo–
zakrzepowej, tzn. zakrzepicy żył głębokich lub zatoru tętnicy płucnej.
W badaniach stwierdzono 2-3-krotny wzrost ryzyka żylnej choroby zakrzepowo zatorowej wśród kobiet,
przyjmujących hormonalną terapię zastępczą w porównaniu do grupy kobiet, które jej nie stosowały.
Występowanie tego powikłania jest bardziej prawdopodobne w pierwszym roku stosowania HTZ niż
później.
Zakrzepy krwi mogą stanowić zagrożenie i jeśli przemieszczą się do płuc, mogą powodować ból w klatce
piersiowej, duszność, utratę przytomności, a nawet śmierć.
Ryzyko zakrzepów krwi w żyłach jest większe, jeżeli pacjentka jest w starszym wieku oraz w przypadku
wystąpienia poniższych czynników. Należy poinformować lekarza, jeśli:
- pacjentka nie może chodzić przez dłuższy czas z powodu ciężkich urazów lub zabiegów chirurgicznych (patrz punkt 3. Jeśli planowana jest operacja);
- występuje otyłość (wskaźnik masy ciała - WMC >30 kg/m );
- występują zaburzenia zakrzepowo-zatorowe, które wymagają długotrwałego przyjmowania leków zapobiegających powstawaniu zakrzepów krwi;
- u kogokolwiek z bliskiej rodziny dochodziło w przeszłości do powstawania zakrzepów krwi w kończynach dolnych, płucach lub innych narządach;
- występuje toczeń rumieniowaty układowy.
Jeśli wystąpią objawy zakrzepów krwi, patrz W przypadku wystąpienia poniższych schorzeń podczas
stosowania HTZ należy przerwać stosowanie leku SystenSequi i natychmiast skontaktować się z
lekarzem.
Nie ma zgodności co do ewentualnej roli żylaków podudzi w żylnej chorobie zakrzepowo-zatorowej.
Kobiety już stosujące leczenie przeciwzakrzepowe powinny przedyskutować z lekarzem bilans korzyści i
ryzyka związanych ze stosowaniem HTZ.
Jeżeli po rozpoczęciu leczenia wystąpi np. bolesny obrzęk kończyny dolnej, nagły ból w klatce
piersiowej, duszność, które mogą być objawami żylnej choroby zatorowo-zakrzepowej, należy odstawić
lek i natychmiast zgłosić się do lekarza.
Hormonalna terapia zastępcza a choroba niedokrwienna serca
Nie ma dowodów, że HTZ zapobiega zawałowi mięśnia sercowego.
U kobiet w wieku powyżej 60 lat, które stosują estrogenowo-progestagenową HTZ ryzyko wystąpienia
choroby niedokrwiennej serca jest nieznacznie większe niż u kobiet niestosujących HTZ.
Hormonalna terapia zastępcza a udar mózgu
Ryzyko udaru mózgu jest około 1,5-krotnie większe u kobiet stosujących HTZ w porównaniu do kobiet
jej niestosujących. Liczba dodatkowych przypadków udaru spowodowanych stosowaniem HTZ będzie
się zwiększać wraz z wiekiem.
Porównanie
U kobiet w wieku od 50 do 59 lat niestosujących HTZ, średnio liczbę przypadków wystąpienia udaru
w ciągu 5 lat szacuje się na 8 na 1000 kobiet. Natomiast u kobiet w wieku od 50 do 59 lat stosujących
HTZ, liczba przypadków w ciągu 5 lat wyniesie 11 na 1000 kobiet (tzn. 3 dodatkowe przypadki).
Stany wymagające obserwacji podczas terapii estrogenowej:
- zaburzenia lub łagodna niewydolność wątroby;
- żółtaczka z zastojem żółci w wywiadzie;
- HTZ nie poprawia funkcji poznawczych. Istnieją dowody o zwiększonym ryzyku prawdopodobnego otępienia u kobiet rozpoczynających leczenie ciągłe, złożone lub wyłącznie estrogenowe w wieku powyżej 65 lat. U kobiet z zachowaną macicą stosujących niezrównoważoną terapię estrogenową stwierdzano zwiększone ryzyko hiperplazji i raka endometrium. Dlatego aby zmniejszyć ryzyko hiperplazji i raka endometrium u kobiet z zachowaną macicą zaleca się podawanie estrogenu w skojarzeniu z progestagenem jak podczas stosowania leku Systen Sequi. Systen Sequi należy przechowywać w miejscu niedostępnym dla dzieci i zwierząt.
Dzieci i młodzież
Leku Systen Sequi nie należy stosować u dzieci.
Systen Sequi a inne leki
Niektóre leki mogą wpływać na skuteczność działania leku Systen Sequi, co może prowadzić
do nieregularnych krwawień. Dotyczy to leków wymienionych poniżej:
- leki przeciwpadaczkowe (takie jak: fenobarbital, fenytoina i karbamazepina),
- leki przeciwgruźlicze (takie jak: ryfampicyna, ryfabutyna),
- leki stosowane w zakażeni u wirusem HIV (takie jak: newirapina, efawirenz,, rytonawir i nelfinawir),
- leki stosowane w leczeniu wirusowego zapalenia wątroby typu C (takie jak: telaprewir)
- produkty roślinne zawierające ziele dziurawca zwyczajnego ( Hypericum perforatum).
Hormonalna terapia zastępcza może wpływać na działanie innych leków:
- leku na padaczkę (lamotrygina), ponieważ może wpłynąć na zwiększenie częstości napadów drgawkowych.
- leków stosowanych w leczeniu wirusowego zapalenia wątroby typu C (HCV) jak schematy leczenia za pomocą ombitaswiru/parytaprewiru/rytonawiru i dazabuwiru z rybawiryną lub bez rybawiryny, za pomocą glekaprewiru/pibrentaswiru lub sofosbuwiru/welpataswiru/woksylaprewiru mogą powodować zwiększenie parametrów czynności wątroby w badaniach laboratoryjnych krwi (zwiększona aktywność enzymu wątrobowego AlAT) u kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające etynyloestradiol. Lek Systen Sequi zawiera estradiol zamiast etynyloestradiolu. Nie
wiadomo, czy zwiększona aktywność enzymu wątrobowego AlAT może wystąpić podczas stosowania
leku Systen Sequi jednocześnie z tego rodzaju schematem leczenia skojarzonego przeciwko wirusowi
HCV.
Należy powiedzieć lekarzowi o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a
także o lekach, które pacjent planuje stosować. Lekarz udzieli pacjentce stosownych wskazówek.
Testy laboratoryjne
Jeśli konieczne jest wykonanie badania krwi, należy poinformować lekarza lub personel laboratorium o
przyjmowaniu leku Systen Sequi, ponieważ lek ten może wpływać na wyniki niektórych badańnp. test
tolerancji glukozy lub badania czynnościowe tarczycy.
Ciąża i karmienie piersią
Lek Systen Sequi jest przeciwwskazany do stosowania w okresie ciąży. Jeśli podczas stosowania leku
okaże się, że pacjentka jest w ciąży, produkt należy natychmiast odstawić.
Stosowanie leku Systen Sequi jest przeciwwskazane w okresie karmienia piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie przeprowadzono badań dotyczących wpływu leku Systen Sequi na zdolność prowadzenia pojazdów
mechanicznych i obsługiwania maszyn.
3. Jak stosować lek Systen Sequi
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić się
do lekarza.
HTZ powinna być kontynuowana tylko do czasu, dopóki korzyści wynikające ze złagodzenia ciężkich
objawów przewyższają ryzyko stosowania HTZ.
Lekarz powinien przepisać pacjentce możliwie najmniejszą dawkę do stosowania przez możliwie
najkrótszy czas zapewniającą zmniejszenie objawów. Jeśli pacjentka uważa, że dawka leku jest za duża
lub za mała powinna skonsultować się z lekarzem.
Dawkowanie
Plastry Systen 50 i Systen Conti należy przyklejać na skórę tułowia poniżej talii w następującej
kolejności: najpierw kolejno dwa razy w tygodniu, co 3 lub 4 dni po jednym plastrze Systen 50 (w ciągu
2 tygodni zostaną zużyte 4 plastry Systen 50), następnie po 1 plastrze Systen Conti zmieniając je w takich
samych odstępach czasu (w ciągu kolejnych 2 tygodni zostaną zużyte 4 plastry Systen Conti). Po 4
tygodniach zużyte zostaną wszystkie plastry z danego opakowania i należy rozpocząć nowe opakowanie.
Cykl zmiany plastrów należy powtarzać bez przerw.
Przykładowo, jeśli aplikacja pierwszego plastra nastąpi w poniedziałek, należy go wymienić we czwartek,
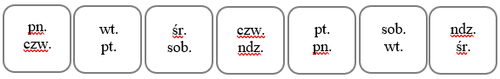
a następnie w kolejny poniedziałek. W wyznaczaniu tych dni można oprzeć się na poniższej tabeli
bazując na pierwszym dniu aplikacji plastra:
| Dzień aplikacji pierwszego plastra | Dzień wymiany plastra | Dzień kolejnej wymiany plastra | ||
| Poniedziałek | → | Czwartek | → | Poniedziałek |
| Wtorek | → | Piątek | → | Wtorek |
| Środa | → | Sobota | → | Środa |
| Czwartek | → | Niedziela | → | Czwartek |
| Piątek | → | Poniedziałek | → | Piątek |
| Sobota | → | Wtorek | → | Sobota |
Aby łatwiej zapamiętać dni wymiany plastra należy zaznaczyć ich konfigurację w odpowiednim,
przeznaczonym do tego miejscu na opakowaniu:
| Niedziela | → | Środa | → | Niedziela |
Nieprzestrzeganie opisanej kolejności stosowania plastrów Systen 50 lub Systen Conti, pomyłkowe
stosowanie jednego plastra przez okres dłuższy niż 4 dni lub pozostawienie przez jakikolwiek okres bez
przyklejonego plastra (pominięcie dawki leku), zwiększa prawdopodobieństwo wystąpienia
nieregularnych krwawień, krwawień śródcyklowych lub plamień.
W leczeniu objawów menopauzy lekarz zaleci najmniejszą skuteczną dawkę.
W przypadku częściowego lub całkowitego odklejenia się plastra przed planowaną jego zmianą należy
natychmiast przykleić nowy plaster odpowiednio Systen 50 lub Systen Conti. Jednakże należy zachować
ten sam dzień zmiany plastra.
Stosowanie leku Systen Sequi u pacjentek z zaburzeniami czynności nerek i (lub) wątroby
Brak wystarczających danych dotyczących dawkowania u pacjentek z ciężką niewydolnością wątroby lub
nerek.
Estrogeny mogą powodować zatrzymanie płynów w organizmie, dlatego pacjentki z niewydolnością
serca i nerek, w trakcie stosowanie leku Systen Sequi powinny być pod ścisłą obserwacją.
Stosowanie leku Systen Sequi u kobiet w podeszłym wieku
Brak wystarczających danych pozwalających na stosowanie leku Systen Sequi u kobiet w wieku powyżej
65 lat.
Sposób stosowania
| Plaster należy przykleić na czystą, suchą, zdrową i nieuszkodzoną skórę tułowia poniżej talii. Krem, balsam do ciała lub puder mogą oddziaływać z warstwą przylepną plastra i nie należy ich stosować w miejscu przylepienia. Leku Systen nie należy przyklejać na skórę piersi lub w ich okolicy. Miejsce, w którym przyklejany jest plaster należy zmieniać. Aby przykleić plaster w tym samym miejscu należy zachować przynajmniej jeden tydzień przerwy | 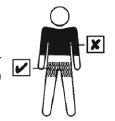 |
| Lek Systen należy użyć natychmiast po otwarciu saszetki. |  |
| Po otwarciu saszetki zawierającej plaster należy zdjąć jedną część zabezpieczającej folii. | 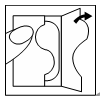 |
| Następnie unikając zagięcia, przyłożyć odsłoniętą część plastra do miejsca, w którym ma być przyklejony, od jego brzegu do środka. | 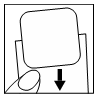 |
| Pacjentka powinna usunąć drugą część zabezpieczającej folii i przycisnąć dłonią do skóry, ponownie unikając jej zagięcia, oraz przycisnąć dłonią plaster do skóry przez co najmniej 10 sekund, ogrzewając go ciepłem dłoni do temperatury ciała, w której przylepność plastra jest najlepsza. Podczas przyklejania plastra pacjentka nie powinna bezpośrednio dotykać placami jego warstwy przylepnej. | 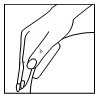 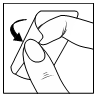 |
| Nie jest konieczne odklejanie plastra na czas kąpieli lub natrysku. Jednakże zaleca się odklejenie plastra przed korzystaniem z sauny, a po saunie natychmiast przyklejenie nowego. By usunąć plaster należy chwycić jego brzeg i delikatnie odkleić go od skóry. Po zużyciu plaster należy złożyć na pół i wyrzucić do śmietnika (nie wrzucać do toalety). Pozostałości kleju na skórze po odklejeniu plastra można usunąć wodą z mydłem lub zetrzeć palcami. |
Zastosowanie większej niż zalecana dawki leku Systen Sequi
W razie zastosowania większej niż zalecana dawki leku, należy niezwłocznie zwrócić się do lekarza lub farmaceuty.
Objawami przedawkowania jednoczesnego leczenia estrogenem i progestagenem mogą być: nudności,
krwawienia śródcyklowe, ból i tkliwość piersi, skurcze i wzdęcia brzucha. Wymienione objawy
przemijają bez specyficznego leczenia po usunięciu plastra.
Pominięcie zastosowania leku Systen Sequi
Jeśli pacjentka zapomni zmienić plaster, pominięty plaster należy przykleić tak szybko jak to możliwe.
Należy jednak zachować dotychczasowy termin zmiany plastra na nowy. Zapominanie zastosowania leku
może zwiększyć prawdopodobieństwo wystąpienia krwawień i plamień śródcyklowych.
Jeśli planowana jest operacja
Jeśli u pacjentki planuje się wykonanie operacji, powinna ona powiedzieć chirurgowi, że przyjmuje lek
Systen Sequi. Może być konieczne przerwanie stosowania leku Systen Sequi na 4 do 6 tygodni przed
operacją, aby zminimalizować ryzyko zakrzepu krwi (patrz punkt 2. Zakrzepy krwi w żyłach (żylna
choroba zakrzepowo - zatorowa). Przed ponownym rozpoczęciem stosowania leku Systen Sequi należy
skonsultować się z lekarzem.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
U kobiet stosujących HTZ występuje zwiększone ryzyko rozwoju następujących chorób, w porównaniu
do kobiet niestosujących HTZ:
- rak piersi;
- nadmierny rozrost lub rak błony śluzowej macicy (hiperplazja endometrium lub rak);
- rak jajnika;
- zakrzepy krwi w żyłach nóg lub płucach (żylna choroba zakrzepowo - zatorowa);
- choroba niedokrwienna serca;
- udar mózgu;
- prawdopodobnie otępienie jeśli rozpoczęto stosowanie HTZ w wieku powyżej 65 lat.
W celu uzyskania dalszych informacji, patrz punkt 2 „Informacje ważne przed zastosowaniem leku
Systen Sequi”.
Poniżej przedstawiono wszystkie działania niepożądane zaobserwowane w badaniach klinicznych oraz
zgłoszone po wprowadzeniu do obrotu leku Systen Sequi.
Bardzo często(mogą wystąpić u więcej niż 1 pacjentki na 10):
- rumień w miejscu podania, świąd w miejscu podania, wysypka w miejscu podania, reakcja w miejscu podania.
Często(mogą wystąpić u nie więcej niż 1 na 10 pacjentek):
- depresja, bezsenność, chwiejność emocjonalna, nerwowość;
- migrena, ból głowy;
- nadciśnienie;
- ból brzucha, zaburzenia żołądka i jelit, biegunka*, wzdęcia*, nudności;
- świąd, wysypka rumieniowa;
- ból stawów, ból pleców, ból mięśni*;
- ból piersi, bolesne miesiączkowanie, obfite krwawienie miesięczne, zaburzenia miesiączkowania;
- ból*, obrzęk, złe samopoczucie;
- zwiększenie masy ciała.
Niezbyt często(mogą wystąpić u nie więcej niż 1 na 100 pacjentek):
- drożdżyca;
- nowotwór piersi, włókniako-gruczolak piersi;
- nadwrażliwość (uczulenie);
- zmniejszone libido, zwiększone libido;
- zawroty głowy, parestezje, zaburzenia koncentracji;
- kołatanie serca;
- powiększenie piersi, hiperplazja endometrium (nadmierny rozrost błony śluzowej macicy), krwawienie z macicy;
- obrzęk uogólniony*, zmęczenie.
Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych)
- rak błony śluzowej macicy (endometrium);
- wahania nastroju;
- incydent mózgowo-naczyniowy, padaczka;
- zakrzepica żył głębokich, zakrzepica*;
- zatorowość płucna,
- wzdęcie brzucha,
- kamica żółciowa,
- wysypka*, zespół Stevens-Johnson’a,
- powiększenie piersi;
- obrzęk obwodowy*, obrzęk w miejscu podania*.
* Dodatkowe działania niepożądane zgłaszane w badaniach klinicznych leku Systen 50
(zawierającego tylko estradiol).
Inne działania niepożądane związane z doustną estrogenowo-progestagenową terapią zastępczą:
- zawroty głowy;
- żylaki;
- niestrawność, wymioty;
- ból kończyn, miastenia;
- tkliwość piersi, skurcze macicy, zakażenie pochwy;
- mięśniak macicy, torbiel jajowodu, polipy wewnątrzszyjkowe;
- zwiększenie aktywności enzymów wątrobowych - aminotransferaz - w badaniach
- choroba pęcherzyka żółciowego, żółtaczka;
- zaburzenia skóry i tkanki podskórnej: ostuda, rumień wielopostaciowy, rumień guzowaty, plamica naczyniowa, trądzik, sucha skóra, łysienie;
- prawdopodobne otępienie w wieku powyżej 65 lat;
- zespół suchego oka;
- zmiana składu łez.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w
ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu
Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Systen Sequi
Przechowywać w temperaturze do 25°C.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Zalecenie to dotyczy także zużytych plastrów.
Nie stosować leku Systen Sequi po upływie terminu ważności zamieszczonego na opakowaniu.
Termin ważności (EXP) oznacza ostatni dzień podanego miesiąca.
6. Zawartość opakowania i inne informacje
Co zawiera lek Systen Sequi
Lek Systen Sequi jest systemem transdermalnym, plastrem składającym się z:
4 systemów transdermalnych, plastrów Systen 50, z których każdy zawiera jako substancję czynną:
- 3,2 mg estradiolu (Estradiolum), w postaci estradiolu półwodnego;
4 systemów transdermalnych, plastrów Systen Conti, z których każdy zawiera jako substancje czynne:
- 3,2 mg estradiolu (Estradiolum), w postaci estradiolu półwodnego;
- 11,2 mg noretysteronu octanu (Norethisteroni acetas).
Pozostałe składniki leku to:
- Warstwa adhezyjna: kopolimer akrylowy, guma guar.
- Warstwa ochronna (warstwa zabezpieczająca zewnętrzna): poliester.
- Warstwa zabezpieczająca (do usunięcia): polietylenotereftalan.
Jak wygląda lek Systen Sequi i co zawiera opakowanie
8 systemów transdermalnych, plastrów (4 systemy transdermalne, plastry Systen 50 i 4 systemy
transdermalne, plastry Systen Conti) zamkniętych w foliowych saszetkach umieszczonych w tekturowym
pudełku.
System transdermalny, plaster Systen 50 o powierzchni 16 cm zawiera 3,2 mg estradiolu i uwalnia 50 μg
estradiolu w ciągu 24 godzin.
System transdermalny, plaster Systen Conti ma powierzchnię 16 cm i zawiera 3,2 mg estradiolu, co
odpowiada uwalnianiu nominalnie 50 μg estradiolu w ciągu 24 godzin oraz 11,2 mg noretysteronu
octanu, który uwalnia się w ilości nominalnej 170 μg w ciągu 24 godzin.
Podmiot odpowiedzialny:
Theramex Ireland Limited
3rd Floor, Kilmore House,
Park Lane, Spencer Dock,
Dublin 1
D01 YE64
Irlandia
Wytwórca:
Aesica Pharmaceuticals GmbH
Alfred-Nobel-Str. 10
40789 Monheim am Rhein
Niemcy
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do lokalnego przedstawiciela
podmiotu odpowiedzialnego pod numerem telefonu: 22 307 71 66.
Data ostatniej aktualizacji ulotki:sierpień 2025
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterAesica Pharmaceuticals GmbH
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Systen SequiPostać farmaceutyczna: Żel, 0,5 mgSubstancja czynna: estradiolProducent: Orion CorporationWymaga receptyPostać farmaceutyczna: Żel, 1 mgSubstancja czynna: estradiolProducent: Orion CorporationWymaga receptyPostać farmaceutyczna: Żel, 1 mg/gSubstancja czynna: estradiolWymaga recepty
Odpowiedniki Systen Sequi w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Systen Sequi – Hiszpania
Odpowiednik Systen Sequi – Ukraina
Lekarze online w sprawie Systen Sequi
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Systen Sequi – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.










