Jak stosować Sandostatin LAR
Ulotka dołączona do opakowania: informacja dla pacjenta
SANDOSTATIN LAR 10 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
SANDOSTATIN LAR 20 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
SANDOSTATIN LAR 30 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
oktreotyd
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeżeli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Sandostatin LAR i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Sandostatin LAR
- 3. Jak stosować lek Sandostatin LAR
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Sandostatin LAR
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Sandostatin LAR i w jakim celu się go stosuje
Sandostatin LAR jest syntetyczną pochodną somatostatyny, substancji występującej fizjologicznie
w organizmie ludzkim, która hamuje działanie niektórych hormonów, np. hormonu wzrostu. Lek Sandostatin
LAR działa silniej niż somatostatyna i jego działanie utrzymuje się dłużej.
Sandostatin LAR jest stosowany
- w leczeniu akromegalii Akromegalia jest chorobą, w której organizm wytwarza zbyt dużą ilość hormonu wzrostu. U osób zdrowych hormon wzrostu kontroluje wzrost tkanek, narządów i kości. Zbyt duża ilość hormonu wzrostu powoduje zwiększenie wymiarów kości i tkanek, zwłaszcza dłoni i stóp. Sandostatin LAR znacząco łagodzi objawy akromegalii, do których należy ból głowy, nadmierne pocenie się, drętwienie dłoni i stóp, zmęczenie i ból stawów. W większości przypadków nadmierne wytwarzanie hormonu wzrostu jest wynikiem powiększenia przysadki (gruczolak przysadki); leczenie lekiem Sandostatin LAR może zmniejszyć rozmiary gruczolaka.
Sandostatin LAR jest stosowany w leczeniu osób z akromegalią:
- u których inne rodzaje leczenia akromegalii (leczenie chirurgiczne lub radioterapia) są niewskazane lub nieskuteczne;
- po radioterapii, będących w okresie przejściowym, przed wystąpieniem całkowitego efektu działania radioterapii.
- w celu złagodzenia objawów związanych z nadmiernym wytwarzaniem pewnych specyficznych hormonów i innych substancji przez żołądek, jelita i trzustkę Nadmierne wytwarzanie hormonów i innych substancji naturalnych może być spowodowane pewnymi rzadkimi chorobami żołądka, jelit lub trzustki. Zaburza to naturalną równowagę hormonalną organizmu i jest przyczyną wielu objawów takich jak zaczerwienienie twarzy, biegunka, niskie ciśnienie krwi, wysypka i utrata masy ciała. Leczenie lekiem Sandostatin LAR pomaga kontrolować te objawy.
- w leczeniu guzów neuroendokrynnych zlokalizowanych w jelicie (np. w wyrostku robaczkowym,
jelicie cienkim lub okrężnicy)
Guzy neuroendokrynne są rzadko występującymi guzami, umiejscowionymi w różnych częściach ciała. Lek
Sandostatin LAR stosuje się również w celu hamowania wzrostu tego typu guzów zlokalizowanych w jelicie
(np. w wyrostku robaczkowym, jelicie cienkim lub okrężnicy).
- w leczeniu guzów przysadki wydzielających zbyt dużą ilość hormonu tyreotropowego (TSH) Zbyt duża ilość hormonu tyreotropowego (TSH) prowadzi do nadczynności tarczycy. Lek Sandostatin LAR jest stosowany u osób z guzami przysadki wydzielającymi zbyt dużą ilość hormonu tyreotropowego (TSH):
- gdy inne rodzaje leczenia (leczenie chirurgiczne lub radioterapia) są nieodpowiednie lub nieskuteczne;
- po radioterapii w okresie przejściowym, zanim radioterapia osiągnie pełną skuteczność.
2. Informacje ważne przed zastosowaniem leku Sandostatin LAR
Należy postępować zgodnie ze wszystkimi zaleceniami lekarza. Mogą one różnić się od informacji
zawartych w tej ulotce.
Należy zapoznać się z poniższymi informacjami przed zastosowaniem leku Sandostatin LAR.
Kiedy nie stosować leku Sandostatin LAR:
- jeśli pacjent ma uczulenie na oktreotyd lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Sandostatin LAR, należy omówić to z lekarzem:
- jeżeli pacjent wie, że ma lub miał w przeszłości kamienie żółciowe lub u pacjenta występują jakiekolwiek objawy takie jak gorączka, dreszcze, ból brzucha lub zażółcenie skóry lub oczu; należy powiedzieć o tym lekarzowi, ponieważ długotrwałe stosowanie leku Sandostatin LAR może powodować powstawanie kamieni żółciowych. Lekarz może zlecić okresową kontrolę pęcherzyka żółciowego.
- Jeśli pacjent choruje na cukrzycę, ponieważ lek Sandostatin LAR może wpływać na poziom cukru we krwi. Jeśli pacjent choruje na cukrzycę, stężenie cukru we krwi powinno być u niego regularnie kontrolowane.
- Jeśli pacjent miał w przeszłości zmniejszone stężenie witaminy B , lekarz może zlecić okresową kontrolę stężenia witaminy B .
Badania i wizyty kontrolne
Jeśli pacjent jest długotrwale leczony lekiem Sandostatin LAR, lekarz może zlecić okresową kontrolę
czynności tarczycy.
Lekarz będzie kontrolował czynność wątroby pacjenta.
Lekarz może zlecić sprawdzenie działania enzymów trzustki.
Dzieci
Doświadczenie dotyczące stosowania leku Sandostatin LAR u dzieci jest niewielkie.
Sandostatin LAR a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta obecnie
lub ostatnio, a także o lekach, które pacjent planuje przyjmować.
Podczas leczenia lekiem Sandostatin LAR można na ogół kontynuować przyjmowanie innych leków.
Zgłaszano jednak, że Sandostatin LAR wpływa na działanie pewnych leków, takich jak cymetydyna,
cyklosporyna, bromokryptyna, chinidyna i terfenadyna.
Jeśli pacjent przyjmuje lek kontrolujący ciśnienie krwi (np. antagonistę receptorów beta-adrenergicznych lub
antagonistę kanałów wapniowych), bądź lek utrzymujący równowagę wodno-elektrolitową, lekarz może
dostosować dawkowanie.
U pacjentów z cukrzycą może zajść konieczność dostosowania dawki insuliny przez lekarza.
Jeśli pacjent ma otrzymywać leczenie oksodotreotydem lutetu ( Lu), terapię radiofarmaceutyczną, lekarz
może przerwać i (lub) dostosować leczenie lekiem Sandostatin LAR na krótki okres czasu.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza przed zastosowaniem tego leku.
Lek Sandostatin LAR może być stosowany podczas ciąży tylko w razie wyraźnej konieczności.
Pacjentki w wieku rozrodczym powinny podczas leczenia stosować skuteczne metody zapobiegania ciąży.
Nie należy karmić piersią podczas stosowania leku Sandostatin LAR. Nie wiadomo, czy lek Sandostatin
LAR przenika do mleka kobiet karmiących piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Sandostatin LAR nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
i obsługiwania maszyn. Jednak pewne działania niepożądane mogące wystąpić podczas stosowania leku
Sandostatin LAR, takie jak ból głowy i zmęczenie mogą zmniejszać zdolność pacjenta do bezpiecznego
prowadzenia pojazdów i obsługiwania maszyn.
Lek Sandostatin LAR zawiera sód
Ten lek zawiera mniej niż 1 mmol (23 mg) sodu na fiolkę, to znaczy lek uznaje się za „wolny od sodu”.
3. Jak stosować lek Sandostatin LAR
Lek Sandostatin LAR należy podawać wyłącznie w postaci wstrzyknięcia domięśniowego w pośladek.
Podczas długotrwałego podawania należy wykonywać wstrzyknięcia na przemian raz w lewy, raz w prawy
pośladek.
Zastosowanie większej niż zalecana dawki leku Sandostatin LAR
Po przedawkowaniu leku Sandostatin LAR nie zgłaszano występowania reakcji zagrażających życiu.
Objawy przedawkowania to: uderzenia gorąca, częste oddawanie moczu, zmęczenie, depresja, niepokój
i brak koncentracji.
W przypadku odczucia, że doszło do przedawkowania i u pacjenta występują powyższe objawy, należy
natychmiast powiedzieć o tym lekarzowi.
Pominięcie zastosowania leku Sandostatin LAR
W przypadku, gdy wstrzyknięcie nie zostało wykonane w odpowiednim terminie, należy je wykonać jak
najszybciej, a następnie kontynuować leczenie jak poprzednio. Podanie dawki kilka dni później nie jest
szkodliwe, ale może spowodować czasowy nawrót objawów choroby do momentu powrotu do
zaplanowanego schematu leczenia.
Przerwanie stosowania leku Sandostatin LAR
Po przerwaniu leczenia lekiem Sandostatin LAR objawy choroby mogą nawrócić. Dlatego nie należy
przerywać stosowania leku Sandostatin LAR bez porozumienia z lekarzem.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się do
lekarza, pielęgniarki lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Niektóre działania niepożądane mogą być ciężkie. Należy natychmiast poinformować lekarza, jeśli u pacjenta wystąpi którykolwiek z tych objawów:
Bardzo często(mogą dotyczyć więcej niż 1 na 10 osób):
- Kamica żółciowa powodująca nagły ból pleców.
- Zbyt duże stężenie cukru we krwi.
Często(mogą dotyczyć maksymalnie 1 na 10 osób ):
- Niedoczynność tarczycy (hipotyroidyzm) wpływająca na zmiany rytmu serca, łaknienie lub zmiany masy ciała; zmęczenie, uczucie zimna lub obrzęk przedniej części szyi.
- Zmiany w wynikach testów czynności tarczycy.
- Zapalenie pęcherzyka żółciowego; objawy mogą obejmować ból w prawej górnej części brzucha, gorączkę, nudności, zażółcenie skóry i oczu (żółtaczka).
- Zbyt małe stężenie cukru we krwi.
- Zaburzona tolerancja glukozy.
- Wolna akcja serca.
Niezbyt często(mogą dotyczyć maksymalnie 1 na 100 osób ):
- Pragnienie, mała ilość wydalanego moczu, ciemne zabarwienie moczu, sucha, zaczerwieniona skóra.
- Szybka akcja serca.
Inne ciężkie działania niepożądane
- Reakcje nadwrażliwości (uczulenie), w tym wysypka skórna.
- Rodzaj reakcji alergicznej (anafilaksja), która może powodować trudności w przełykaniu lub oddychaniu, opuchliznę i mrowienie, z możliwym obniżeniem ciśnienia krwi z zawrotami głowy lub utratą przytomności.
- Zapalenie trzustki; objawy mogą obejmować nagły ból w górnej części brzucha, nudności, wymioty, biegunkę.
- Zapalenie wątroby; objawami może być zażółcenie skóry i oczu (żółtaczka), nudności, wymioty, brak apetytu, złe samopoczucie ogólne, świąd, jasne zabarwienie moczu.
- Nieregularna akcja serca.
- Mała liczba płytek krwi; może to powodować zwiększone krwawienie lub powstawanie siniaków.
Jeśli pacjent zauważy u siebie którykolwiek z wymienionych wyżej objawów, należy natychmiast
powiedzieć o tym lekarzowi.
Inne działania niepożądane:
Jeśli pacjent zauważy u siebie którekolwiek z podanych niżej działań niepożądanych, należy powiedzieć
o tym lekarzowi, farmaceucie lub pielęgniarce. Działania te są zazwyczaj łagodne i mają tendencję do
ustępowania w miarę postępu leczenia.
Bardzo często(mogą dotyczyć ponad 1 na 10 osób ):
- Biegunka.
- Bóle brzucha.
- Nudności.
- Zaparcia.
- Wzdęcia z oddawaniem gazów.
- Bóle głowy.
- Ból w miejscu wstrzyknięcia.
Często(mogą dotyczyć maksymalnie 1 na 10 osób ):
- Dyskomfort w żołądku po posiłku (niestrawność).
- Wymioty.
- Uczucie pełności w żołądku.
- Stolce tłuszczowe.
- Luźne stolce.
- Odbarwienie kału.
- Zawroty głowy.
- Utrata apetytu.
- Zmiany w wynikach testów czynnościowych wątroby.
- Łysienie.
- Duszność.
- Osłabienie.
Jeśli wystąpią jakiekolwiek objawy niepożądane, należy powiedzieć o tym lekarzowi, pielęgniarce lub
farmaceucie.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
tel.: 22 49-21-301
fax: 22 49-21-309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Sandostatin LAR
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Przechowywać w lodówce (2 C – 8 C). Nie zamrażać.
W dniu wykonania wstrzyknięcia lek Sandostatin LAR można przechowywać w temperaturze poniżej 25 C.
Nie przechowywać leku Sandostatin LAR po przygotowaniu (przygotowaną zawiesinę trzeba zużyć
natychmiast).
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i opakowaniu po „EXP”
i „Termin ważności (EXP)”. Termin ważności oznacza ostatni dzień podanego miesiąca.
Nie stosować tego leku, jeśli zauważy się obce cząstki lub zmianę barwy.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Sandostatin LAR
- Substancją czynną leku jest oktreotyd. Jedna fiolka zawiera 10 mg, 20 mg lub 30 mg oktreotydu (w postaci oktreotydu octanu).
- Pozostałe składniki to: w proszku (fiolka): poli (DL-laktydo-co-glikolid), mannitol (E 421). w rozpuszczalniku (ampułkostrzykawka): karmeloza sodowa, mannitol (E 421), poloksamer 188,
woda do wstrzykiwań.
Jak wygląda lek Sandostatin LAR i co zawiera opakowanie
Opakowanie jednostkowe zawiera jedną szklaną fiolkę 6 ml zamkniętą korkiem z gumy bromobutylowej
i aluminiowym kapslem ze zrywanym wieczkiem, zawierającą proszek do sporządzania zawiesiny do
wstrzykiwań, i jedną szklaną ampułkostrzykawkę 3 ml, zabezpieczoną dwoma korkami z gumy
chlorobutylowej (od przodu i od strony tłoka) zawierającą 2 ml rozpuszczalnika do sporządzania zawiesiny,
łącznie zapakowane w uszczelnionym blistrze wraz z łącznikiem fiolki oraz jedną bezpieczną igłą do
wstrzykiwań.
Podmiot odpowiedzialny
Novartis Poland Sp. z o.o.
ul. Marynarska 15
02-674 Warszawa
Tel. + 48 22 375 48 88
Wytwórca/Importer
Novartis Poland Sp. z o.o.
ul. Marynarska 15
02-674 Warszawa
Novartis Pharma GmbH
Jakov-Lind-Straße 5, Top 3.05
1020 Wien
Austria
Novartis Pharma NV
Medialaan 40 Bus 1
Vilvoorde, B-1800
Belgia
Novartis Healthcare A/S
Edvard Thomsens Vej 14
København S, 2300
Dania
Novartis Finland Oy
Metsäneidonkuja 10
Espoo, FI-02130
Finlandia
Novartis Pharma SAS
8-10 rue Henri Sainte-Claire Deville
92500 Rueil Malmaison
Francja
Novartis Pharma GmbH
Roonstrasse 25
90429 Nürnberg
Niemcy
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Niemcy
Novartis (HELLAS) SA
12th km National Road Athinon-Lamias
Metamorfosi Attiki, 14451
Grecja
Novartis Hungáry Kft.
Vasút u.13.
Budaörs, 2040
Węgry
Novartis Farma S.p.A.
Via Provinciale Schito 131
80058 Torre Annunziata (NA)
Włochy
Novartis Farma S.p.A.
Viale Luigi Sturzo 43
- 20154 – Milan (MI) Włochy
Novartis Farma - Produtos Farmacêuticos S.A.
Avenida Professor Doutor Cavaco Silva, n.10E, Taguspark
Porto Salvo, 2740-255
Portugalia
Novartis Farmacéutica S.A.
Gran Via de les Corts Catalanes, 764
08013 Barcelona
Hiszpania
Novartis Sverige AB
Torshamnsgatan 48
164 40 Kista
Szwecja
Novartis Pharma B.V.
Haaksbergweg 16
1101 BX Amsterdam
Holandia
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru
Gospodarczego pod następującymi nazwami:
Sandostatin LAR
Austria, Bułgaria, Chorwacja, Cypr, Czechy, Dania, Estonia,
Finlandia, Niemcy, Grecja, Węgry, Islandia, Irlandia, Łotwa,
Litwa, Malta, Norwegia, Polska, Rumunia, Słowacja, Słowenia,
Hiszpania, Szwecja
Sandostatine LAR
Belgia, Luksemburg, Holandia
Sandostatina LAR
Włochy, Portugalia
Sandostatine L.P.
Francja
Data ostatniej aktualizacji ulotki: 10/2024
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Jaką ilość leku Sandostatin LAR należy zastosować
Akromegalia
Zaleca się rozpoczęcie leczenia od podawania produktu leczniczego Sandostatin LAR w dawce 20 mg co
4 tygodnie przez 3 miesiące. Pacjenci przyjmujący produkt leczniczy Sandostatin podskórnie mogą
rozpocząć leczenie produktem Sandostatin LAR następnego dnia po ostatnim podaniu podskórnym produktu
leczniczego Sandostatin. Następnie należy dostosować dawkę leku na podstawie stężenia w surowicy
hormonu wzrostu (GH) i insulinopodobnego czynnika wzrostu 1/somatomedyny C (IGF-1) oraz objawów
klinicznych.
U pacjentów, u których po 3 miesiącach objawy kliniczne i parametry biochemiczne (GH; IGF-1) nie są
całkowicie kontrolowane (stężenia GH nadal są większe niż 2,5 mikrograma/l), dawka leku może zostać
zwiększona do 30 mg co 4 tygodnie. Jeśli po kolejnych 3 miesiącach parametry GH, IGF-1 i (lub) inne
objawy nadal nie są zadowalająco kontrolowane podczas podawania dawki 30 mg, dawka leku może zostać
zwiększona do 40 mg co 4 tygodnie.
U pacjentów, u których stężenie GH utrzymuje się stale poniżej 1 mikrograma/l, a stężenie IGF-1
w surowicy uległo normalizacji, oraz u których najszybciej ustępujące objawy przedmiotowe i podmiotowe
akromegalii cofnęły się po 3 miesiącach leczenia dawką 20 mg, można zastosować produkt leczniczy
Sandostatin LAR w dawce 10 mg co 4 tygodnie. Jednakże, szczególnie w tej grupie pacjentów, wskazane
jest ścisłe monitorowanie skuteczności leczenia przez oznaczanie stężeń GH i IGF-1 w surowicy oraz ocenę
klinicznych objawów przedmiotowych i podmiotowych podczas leczenia tą małą dawką produktu
leczniczego Sandostatin LAR.
U pacjentów otrzymujących ustaloną dawkę produktu leczniczego Sandostatin LAR należy określać stężenie
GH i IGF-1 co 6 miesięcy.
Hormonalnie czynne guzy żołądka, jelit i trzustki
- Leczenie pacjentów z objawami związanymi z hormonalnie czynnymi guzami neuroendokrynnymiżołądka, jelit i trzustkiZaleca się, rozpoczęcie leczenia od podawania produktu leczniczego Sandostatin LAR w dawce 20 mg co 4 tygodnie. Pacjenci przyjmujący podskórnie produkt leczniczy Sandostatin powinni kontynuować to leczenie w dawce uprzednio skutecznej przez 2 tygodnie po pierwszym wstrzyknięciu produktu leczniczego Sandostatin LAR.
U pacjentów, u których po 3 miesiącach leczenia wystąpiło zadowalające złagodzenie objawów i poprawa
wskaźników biologicznych, można zmniejszyć dawkę produktu leczniczego Sandostatin LAR do 10 mg co
4 tygodnie.
U pacjentów, u których po 3 miesiącach leczenia wystąpiło tylko częściowe złagodzenie objawów można
zwiększyć dawkę produktu Sandostatin LAR do 30 mg co 4 tygodnie.
W dniach, gdy mimo leczenia produktem leczniczym Sandostatin LAR, objawy związane z guzami żołądka,
jelit i trzustki są nasilone, zaleca się podać dodatkowo, podskórnie produkt leczniczy Sandostatin w dawce
stosowanej przed wprowadzeniem produktu leczniczego Sandostatin LAR. Może się to zdarzyć szczególnie
podczas pierwszych 2 miesięcy leczenia, zanim zostanie osiągnięte terapeutyczne stężenie oktreotydu.
- Leczenie pacjentów z zaawansowanymi guzami neuroendokrynnymi wywodzącymi się ze środkowejczęści prajelita lub o nieznanym ognisku pierwotnym, w przypadku których wykluczono ogniskopierwotne nieznajdujące się w środkowej części prajelitaZalecana dawka produktu leczniczego Sandostatin LAR wynosi 30 mg, podawana co 4 tygodnie. Leczenie produktem Sandostatin LAR w celu zahamowania rozwoju guza należy kontynuować w sytuacji braku progresji guza.
Leczenie gruczolaków wydzielających TSH
Leczenie produktem leczniczym Sandostatin LAR należy rozpoczynać od dawki 20 mg podawanej co
4 tygodnie i kontynuować przez 3 miesiące przed ewentualnym dostosowaniem dawki. Następnie dawkę
można dostosować w zależności od wydzielania TSH i hormonu tarczycy.
Instrukcja przygotowania i domięśniowego podania produktu leczniczego Sandostatin LAR
WYŁĄCZNIE DO GŁĘBOKIEGO WSTRZYKNIĘCIA DOMIĘŚNIOWEGO
Zestaw:
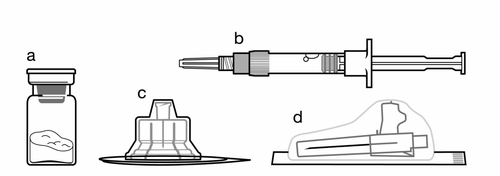
a
Jedna fiolka zawierająca produkt leczniczy Sandostatin LAR w postaci proszku
b
Jedna ampułkostrzykawka zawierająca rozpuszczalnik do sporządzenia zawiesiny
c
Jeden łącznik fiolki do odtworzenia produktu leczniczego
d
Jedna bezpieczna igła do wstrzyknięć
Należy postępować zgodnie z podaną poniżej instrukcją, aby właściwie odtworzyć produkt leczniczy
Sandostatin LAR przed wykonaniem głębokiego wstrzyknięcia domięśniowego.
Dla prawidłowego odtworzenia produktu leczniczego Sandostatin LAR krytyczne znaczenie mają 3 punkty.
Niespełnienie przedstawionych w nich wymagań może być przyczyną niewłaściwego podania leku.
- Zestaw do wstrzyknięć musi osiągnąć temperaturę pokojową.Należy wyjąć zestaw do wstrzyknięć z lodówki i przed odtworzeniem produktu leczniczego pozostawić go na minimum 30 minut w temperaturze pokojowej, jednak nie dłużej niż na 24 godziny.
- Po dodaniu rozpuszczalnika należy odstawić fiolkę na 5 minut, aby zapewnić pełne nasycenie proszkuroztworem.
- Po nasyceniu należy wstrząsać fiolką z umiarkowaną siłąw kierunku poziomym przez minimum 30 sekund do utworzenia jednolitej zawiesiny.Zawiesina produktu leczniczego Sandostatin LAR musi zostać przygotowana bezpośrednioprzed podaniem.
Produkt leczniczy Sandostatin LAR może być podawany wyłącznie przez wyszkolony personel medyczny.
Krok 1
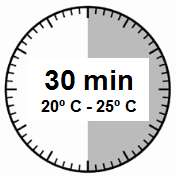
- Wyjąć zestaw do wstrzyknięć z produktem Sandostatin LAR z lodówki, w której był przechowywany.
UWAGA: Bardzo istotne jest, by rozpocząć proces odtwarzania dopiero, gdy zestaw do wstrzyknięć osiągnie temperaturę pokojową. Należy pozostawić
zestaw w temperaturze pokojowej przez minimum
30 minut przed odtworzeniem, jednak nie na dłużej niż przez 24 godziny.
Uwaga: Zestaw do wstrzyknięć można w razie potrzeby
ponownie włożyć do lodówki.
Krok 2
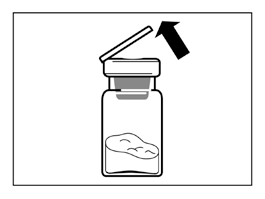
- Zdjąć z fiolki plastikową nakładkę i przetrzeć gumową zatyczkę fiolki wacikiem nasączonym alkoholem.
- Zdjąć warstwę ochronną pokrywającą opakowanie łącznika fiolki, ale NIE wyjmować łącznika fiolki z opakowania.
- Trzymając łącznik fiolki przez opakowanie, umieścić łącznik fiolki na fiolce i docisnąć do końca tak, by wsunął się na miejsce z głośnym „kliknięciem”.
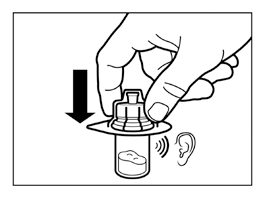
- Zdjąć opakowanie z łącznika fiolki unosząc je pionowo do góry.
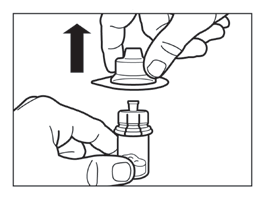
Krok 3
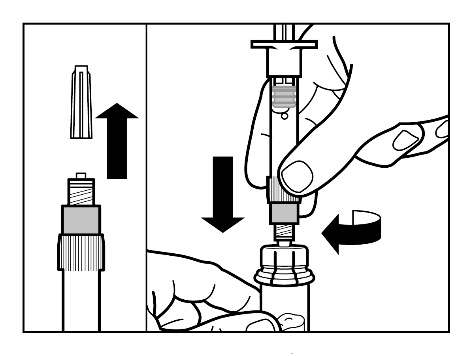
- Zdjąć kapsel z ampułkostrzykawki wypełnionej rozpuszczalnikiem i dokręcić strzykawkę do łącznika fiolki.
- Powoli opuścić tłok do samego końca, aby cały roztwór rozpuszczalnika znalazł się w fiolce.
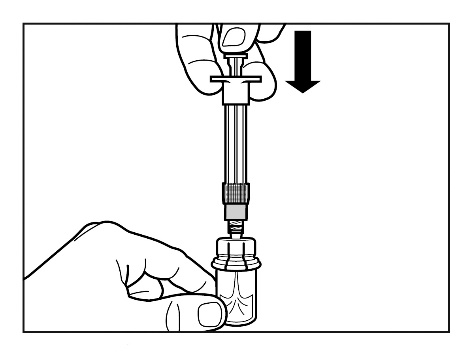
Krok 4
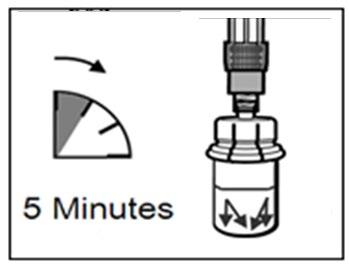
UWAGA: Bardzo istotne jest, by odstawić fiolkę na
5 minut, aby upewnić się, że proszek został w pełni
nasycony rozpuszczalnikiem.
Uwaga: W przypadku, kiedy tłok zostanie odepchnięty
z powrotem do góry, jest to sytuacja normalna,
spowodowana niewielkim nadciśnieniem w fiolce.
5 minut
- Na tym etapie należy przygotować pacjenta do wykonania wstrzyknięcia.
Krok 5
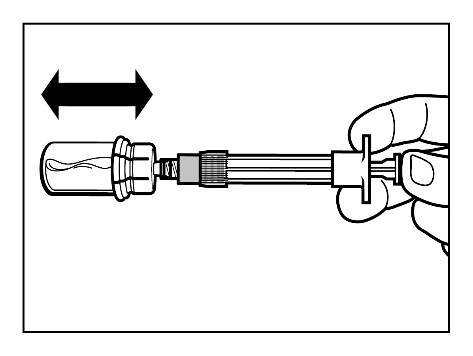
- Po nasyceniu przez roztwór całego proszku, należy sprawdzić, czy tłok jest dociśnięty w dół do samego końca strzykawki. UWAGA:Trzymając tłok dociśnięty do samego końca umiarkowaniewstrząsać fiolką w ustawieniu poziomym przezminimum30 sekund, aby cały proszek utworzył zawiesinę (jednorodna mleczna zawiesina). Jeśli częśćproszku nie połączyła się z roztworem, powtórzyćumiarkowane wstrząsanie przez kolejne 30 sekund.
Krok 6
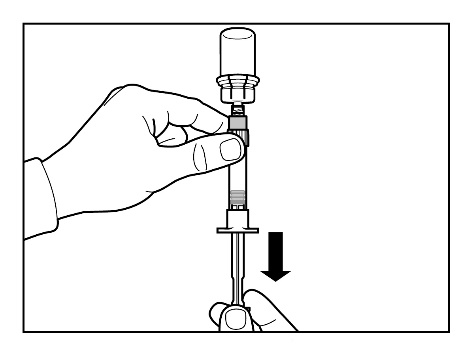
- Przygotować miejsce wstrzyknięcia przecierając je wacikiem nasączonym alkoholem.
- Odwrócić strzykawkę z fiolką dnem do góry i powoli odciągając tłok pobrać całą zawartość fiolki do strzykawki.
- Odkręcić strzykawkę od łącznika fiolki.
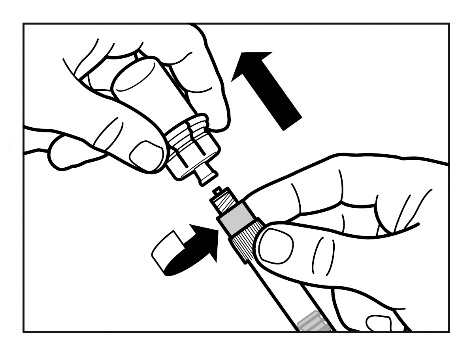
Krok 7
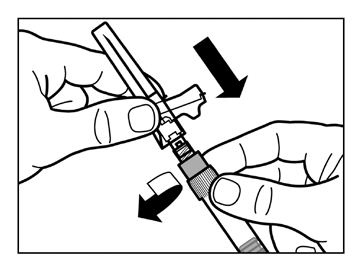
- Przykręcić bezpieczną igłę do wstrzyknięć ze strzykawką.
- Delikatnie ponownie wstrząsnąć strzykawką, aby uzyskać mleczną jednorodną zawiesinę tuż przed podaniem.
- Zdjąć nakładkę ochronną z igły prostym ruchem do góry.
- Delikatnie opukać palcami strzykawkę powodując przesunięcie widocznych pęcherzyków powietrza ku górze, a następnie usunąć je ze strzykawki. Należysprawdzić czy miejsce wstrzyknięcia nie zostałozanieczyszczone.
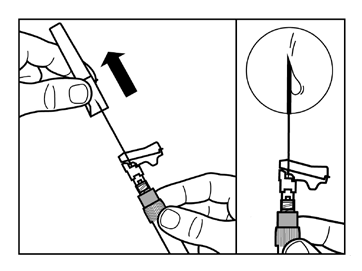
- Odtworzony produkt leczniczy Sandostatin LAR jest teraz gotowy do natychmiastowegopodania - należy przejść do punktu Krok 8. Każde opóźnienie może spowodować wytrącanie się osadu.
Krok 8
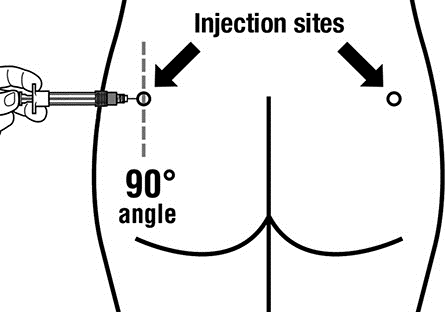
- Produkt leczniczy Sandostatin LAR musi być podawany wyłącznie w głębokim wstrzyknięciu domięśniowym, NIGDYdożylnie .
- Wprowadzić całą igłę w lewy lub prawy pośladek pod kątem 90 ° do powierzchni skóry.
- Powoli odciągnąć tłok ampułkostrzykawki, aby upewnić się, że igła nie znajduje się w naczyniu krwionośnym (zmienić położenie igły, jeśli znajduje się ona w naczyniu krwionośnym).
- Naciskać tłok ze stałą siłą aż do opróżnienia strzykawki. Wyjąć igłę z miejsca wkłucia i uruchomić nakładkę ochronną igły (zgodnie ze wskazówkami podanymi w punkcie Krok 9).
Krok 9
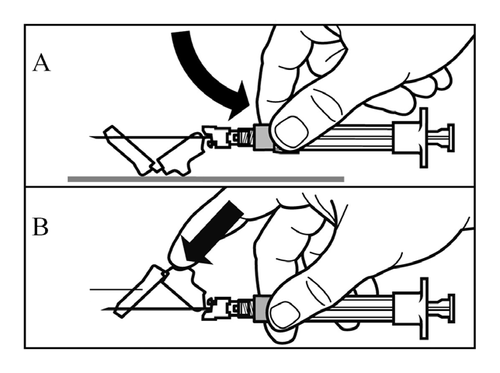
- Uruchomić nakładkę ochronną igły, stosując jedną z 2 następujących metod:
- docisnąć składaną część osłonki do twardej powierzchni (rysunek A)
- lub przycisnąć składaną część osłonki palcem (rysunek B).
- Prawidłowe uruchomienie zostanie potwierdzone głośnym kliknięciem.
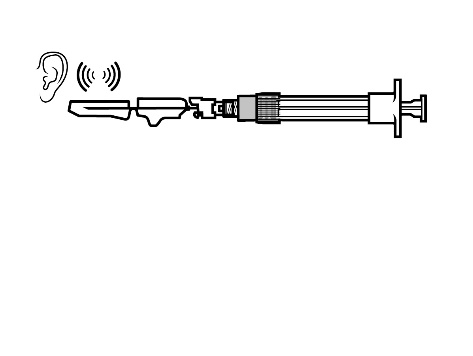
- Strzykawkę natychmiast wyrzucić (do odpowiedniego pojemnika na ostre odpady).
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- ImporterNovartis Farma - Produtos Farmacêuticos, S.A. Novartis Farma S.p.A. Novartis Farma S.p.A. Novartis Farmacéutica, S.A. Novartis Finland Oy Novartis Healthcare A/S Novartis (Hellas) SA Novartis Hungary Kft. Novartis Pharma B.V. Novartis Pharma GmbH Novartis Pharma GmbH Novartis Pharma GmbH Novartis Pharma nv/sa Novartis Pharma SAS Novartis Poland Sp. z o.o. Novartis Sverige AB
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Sandostatin LARPostać farmaceutyczna: Proszek, 10 mgSubstancja czynna: octreotidePostać farmaceutyczna: Proszek, 20 mgSubstancja czynna: octreotidePostać farmaceutyczna: Proszek, 30 mgSubstancja czynna: octreotide
Odpowiedniki Sandostatin LAR w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Sandostatin LAR – Hiszpania
Odpowiednik Sandostatin LAR – Ukraina
Lekarze online w sprawie Sandostatin LAR
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Sandostatin LAR – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.