
Fem 7
Zapytaj lekarza o receptę na Fem 7

Jak stosować Fem 7
Ulotka dołączona do opakowania: informacja dla pacjenta
Uwaga! Zachowaj ulotkę! Informacja na opakowaniu bezpośrednim w języku obcym.
Fem 7(FemSete 50)
50 μg/24 h (1,5 mg), system transdermalny, plaster
Estradiolum
Fem 7 i FemSete 50 są różnymi nazwami handlowymi tego samego leku.
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Fem 7 i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Fem 7
- 3. Jak stosować lek Fem 7
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Fem 7
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Fem 7 i w jakim celu się go stosuje
Lek Fem 7 ma postać systemu transdermalnego, plastra zawierającego estradiol jako substancję
czynną. Estradiol wchodzący w skład leku Fem 7 to 17β (beta) estradiol, hormon identyczny z
estradiolem naturalnym. Estradiol należy do grupy hormonów płciowych, estrogenów, i jest
wytwarzany głównie w komórkach ziarnistych pęcherzyka jajnikowego. W mniejszych ilościach
estrogeny powstają w ciałku żółtym, łożysku i nadnerczach. Po menopauzie (kiedy całkowicie ustaną
miesiączki) zanika czynność jajników, a organizm wytwarza jedynie niewielką ilość estradiolu.
Niedobór estrogenów jest u wielu kobiet przyczyną wystąpienia różnych zaburzeń: uderzeń gorąca,
zaburzeń snu, zaniku błony śluzowej macicy i innych tkanek układu moczowo-płciowego oraz
osteoporozy.
Lek Fem 7 jest dostępny w postaci systemu transdermalnego, plastra. Oznacza to, że estrogen, którego
braki organizm potrzebuje uzupełnić jest powoli dostarczany do organizmu przez skórę za pomocą
samoprzylepnego plastra. Estradiol wchodzący w skład tego plastra łagodzi nieprzyjemne objawy
menopauzy. Może być także stosowany w profilaktyce osteoporozy (zmniejszonej wytrzymałości
kości), jeśli pacjentka nie może przyjmować w tym celu innych leków.
Doświadczenie ze stosowaniem leku u kobiet w wieku ponad 65. lat jest ograniczone.
Lek Fem 7 nie jest środkiem antykoncepcyjnym.
2. Informacje ważne przed zastosowaniem leku Fem 7
Kiedy nie stosować leku Fem 7
- jeśli pacjentka ma uczulenie na estradiol lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6);
- jeśli u pacjentki występuje, podejrzewa się lub występował w przeszłości rak piersi (patrz podpunkt poniżej dot. raka piersi);
- jeśli u pacjentki występuje lub podejrzewa się występowanie raka endometrium (endometrium - błona śluzowa macicy) lub jakikolwiek inny estrogenozależny nowotwór złośliwy (patrz podpunkty poniżej dot. raka endometrium i raka jajnika);
- jeśli u pacjentki występuje nieleczona hiperplazja endometrium (zwiększenie ilości komórek błony śluzowej macicy wyściełającej jej jamę);
- jeśli u pacjentki występuje krwawienie z dróg rodnych o nieustalonej przyczynie;
- jeśli u pacjentki występuje lub występowała w przeszłości zakrzepica żylna (zakrzepica żył głębokich) lub zatory przemieszczające się do płuc lub innych części ciała (patrz podpunkt poniżej dot. zakrzepów);
- jeżeli pacjentka ma zaburzenia krzepnięcia krwi(takie jak niedobór białka C, białka S lub antytrombiny);
- jeśli u pacjentki występuje lub wystąpił niedawno atak serca, udar lub dusznica bolesna (patrz poniżej podpunkt dot. choroby serca i udaru);
- jeśli u pacjentki występuje ostra choroba wątroby lub choroba wątroby wystąpiła w przeszłości, do czasu normalizacji wyników badań czynności wątroby;
- jeśli u pacjentki występuje porfiria.
Dzieci i młodzież
Stosowanie leku Fem 7 u dzieci jest przeciwwskazane.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Fem 7 należy omówić to z lekarzem, farmaceutą lub
pielęgniarką.
Badanie lekarskie / badania kontrolne
Przed rozpoczęciem lub ponownym wprowadzeniem hormonalnej terapii zastępczej lekarz
przeprowadzi szczegółowy wywiad lekarski, w tym rodzinny. Badanie przedmiotowe (łącznie z
badaniem narządów miednicy oraz piersi) powinno uwzględniać dane z wywiadu oraz
przeciwwskazania i ostrzeżenia dotyczące stosowania HTZ. W czasie leczenia lekarz przeprowadzi
okresowe badania kontrolne, których częstotliwość i rodzaj powinny być dostosowane do potrzeb
danej pacjentki. HTZ powinna być stosowana tak długo, jak długo korzyść z jej stosowania przeważa
nad ryzykiem.
Jeśli pacjentka zauważy u siebie zmiany w piersiach odpowiadające guzkom piersi (patrz punkt „Rak
piersi” poniżej), powinna zgłosić to lekarzowi, który może ją skierować na mammografię.
Stany wymagające szczególnej kontroli
Jeżeli którekolwiek z poniższych sytuacji lub stanów występują, występowały wcześniej i(lub) uległy
znacznemu nasileniu w czasie ciąży lub poprzedniej hormonalnej terapii zastępczej, stan zdrowia
pacjentki powinien być pod ścisłą obserwacją lekarza. Należy wziąć pod uwagę, że wymienione
zaburzenia mogą wystąpić ponownie lub nasilić się w czasie stosowania leku Fem 7. Dotyczy to
zwłaszcza takich chorób, jak:
- łagodne nowotwory macicy (mięśniaki gładkie/włókniakomięśniaki macicy) lub endometrioza (występowanie fragmentów błony śluzowej trzonu macicy w różnych miejscach w obrębie miednicy);
- przebyte zaburzenia zakrzepowo-zatorowe lub czynniki ich ryzyka (patrz niżej);
- czynniki ryzyka nowotworu estrogenozależnego, np. rak piersi u bliskich krewnych;
- nadciśnienie tętnicze;
- choroby wątroby (np. gruczolak wątroby);
- cukrzyca ze zmianami naczyniowymi lub bez zmian naczyniowych;
- kamica żółciowa;
- migrena lub (silne) bóle głowy;
- toczeń rumieniowaty układowy (choroba autoimmunologiczna);
- hiperplazja endometrium w przeszłości (patrz niżej);
- padaczka;
- astma;
- otoskleroza (choroba dotycząca błędnika kostnego prowadząca do pogorszenia słuchu);
- dziedziczny i nabyty obrzęk naczynioruchowy.
Wskazania do natychmiastowego przerwania leczenia
Leczenie należy natychmiast przerwać w przypadku wystąpienia któregokolwiek ze stanów
wymienionych w punkcie „Kiedy nie stosować leku Fem 7” lub w przypadku wystąpienia:
- żółtaczki lub pogorszenia czynności wątroby;
- znacznego wzrostu ciśnienia tętniczego krwi;
- pojawienia się migrenowych bólów głowy;
- ciąży;
- opuchnięcia twarzy, języka i (lub) gardła i (lub) trudności w przełykaniu czy pokrzywki, w połączeniu z trudnościami w oddychaniu, które sugerują obrzęk naczynioruchowy.
Bezpieczeństwo stosowania HTZ
Oprócz korzyści, HTZ jest związana z pewnym ryzykiem, które pacjentka powinna rozważyć
decydując się na ten rodzaj leczenia lub jego kontynuację.
Rak endometrium (rak błony śluzowej trzonu macicy)
Podawanie samych estrogenów przez dłuższy czas zwiększa ryzyko raka błony śluzowej trzonu
macicy (raka endometrium). Dodatkowe podawanie progestagenu znacznie zmniejsza to ryzyko.
- Pacjentkom z zachowaną macicą lekarz zazwyczaj przepisuje terapię progestagenem i estrogenem. Substancje te mogą być przepisane oddzielnie lub w postaci leku złożonego w ramach HTZ.
- W przypadku pacjentek z usuniętą macicą (po histerektomii) lekarz omówi z pacjentką bezpieczeństwo stosowania samego estrogenu bez progestagenu.
- W przypadku pacjentek z usuniętą macicą z powodu endometriozy, u których istnieją resztkowe ogniska endometriozy, ryzyko może dotyczyć wszelkich fragmentów błony śluzowej macicy pozostających w organizmie. Dlatego lekarz może przepisać HTZ składającą się z progestagenu i estrogenu. Porównanie:
Porównując kobiety z zachowaną macicą, które nie stosują HTZ– u średnio 5 na 1 000z nich
lekarz rozpozna raka endometrium w wieku 50 – 65 lat.
W przypadku kobiet stosujących HTZ samymi estrogenami,liczba ta będzie dodatkowo od 2 do
12 razy większa, w zależności od dawki i czasu trwania HTZ.
Dodanie progestagenu do HTZ samymi estrogenami znacznie zmniejsza ryzyko raka endometrium.
Jeśli u pacjentki wystąpikrwawienie międzymiesiączkowe lub plamienie, zazwyczaj nie powinno
ono być powodem do niepokoju, zwłaszcza podczas pierwszych kilku miesięcy stosowania HTZ.
Jeśli jednak krwawienie lub plamienie:
- utrzymuje się dłużej niż przez kilka pierwszych miesięcy
- występuje po raz pierwszy jakiś czas po rozpoczęciu HTZ
- utrzymuje się nawet po przerwaniu HTZ należy poinformować lekarza. Może to oznaczać, że błona śluzowa trzonu macicy pogrubiała.
Rak piersi
Kobiety z rakiem piersi występującym obecnie lub w przeszłości nie powinny stosować HTZ.
Dane potwierdzają, że przyjmowanie hormonalnej terapii zastępczej (HTZ) w postaci skojarzenia
estrogenu i progestagenu lub samego estrogenu zwiększa ryzyko wystąpienia raka piersi. Dodatkowe
ryzyko zależy od tego, jak długo pacjentka stosuje HTZ. To dodatkowe ryzyko ujawnia się po 3 latach
stosowania HTZ.
Po zakończeniu HTZ dodatkowe ryzyko będzie się z czasem zmniejszać, ale ryzyko może się
utrzymywać przez 10 lat lub dłużej, jeśli HTZ trwała ponad 5 lat.
Ryzyko wystąpienia raka piersi jest również większe:
- u pacjentek, których bliska krewna (matka, siostra lub babcia) miała raka piersi
- u pacjentek ze znaczną nadwagą.
Jeśli pacjentka zauważywszelkie zmiany w piersiach, takie jak:
- dołeczki w skórze piersi
- zmiany brodawek
- wszelkie widoczne lub wyczuwalne guzki powinna jak najszybciej zgłosić się do lekarza.
Zakrzepy
HTZ jest związana z większym ryzykiem wystąpienia zakrzepów żylnych (zakrzepicy żył głębokich),
szczególnie w pierwszym roku stosowania HTZ.
Te zakrzepy nie zawsze są groźne dla zdrowia i życia, jeśli jednak jeden z nich przemieści się do płuc,
może spowodować ból w klatce piersiowej, duszność, zapaść, a nawet śmierć. Stan ten nazywa się
zatorowością płucną.
Zakrzepica żył głębokich i zatorowość płucna są przykładami żylnej choroby zakrzepowo-zatorowej
(ŻChZZ).
Występowanie zakrzepów jest bardziej prawdopodobne:
- u pacjentek ze znaczną nadwagą
- u pacjentek z zakrzepami w przeszłości
- jeśli w bliskiej rodzinie pacjentki występowały zakrzepy
- jeśli u pacjentki wystąpiło co najmniej jedno poronienie
- jeśli u pacjentki występują zaburzenia zakrzepowe wymagające leczenia lekami Porównanie:
W przypadku kobiet w wieku od 50 do 54 lat, które nie stosują HTZ, rak piersi zostanie
rozpoznany u średnio 13 do 17 na 1000 kobiet w okresie 5 lat.
W przypadku kobiet w wieku 50 lat, które rozpoczną pięcioletnią estrogenową HTZ,
liczba zachorowań wyniesie 16–17 na 1000 pacjentek (tj. dodatkowe 0 do 3 przypadków).
W przypadku kobiet w wieku od 50 lat, które rozpoczną pięcioletnią estrogenowo-
progestagenową HTZ, liczba zachorowań wyniesie 21 na 1000 pacjentek (tj. dodatkowe 4
do 8 przypadków).
W przypadku kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, rak piersi zostanie
rozpoznany u średnio 27 na 1000 kobiet w okresie 10 lat.
W przypadku kobiet w wieku 50 lat, które rozpoczną 10-letnią estrogenową HTZ, liczba
zachorowań wyniesie 34 na 1000 pacjentek (tj. dodatkowe 7 przypadków).
W przypadku kobiet w wieku 50 lat, które rozpoczną 10-letnią estrogenowo-
progestagenową HTZ, liczba zachorowań wyniesie 48 na 1000 pacjentek (tj. dodatkowe
21 przypadków).
przeciwzakrzepowymi
- u pacjentek unieruchomionych przez dłuższy czas z powodu dużej operacji, urazu lub choroby
- u pacjentek z rzadko występującą chorobą zwaną toczniem rumieniowatym układowym.
Jeśli którykolwiek z tych stanów występuje u danej pacjentki, należy skonsultować się z lekarzem, czy
możliwe jest rozpoczęcie HTZ.
Porównanie:
U kobiet w wieku od 50 do 59 lat niestosujących HTZ, liczbę przypadków zakrzepów krwi w
żyłach w ciągu 5 lat szacuje się na 4 do 7 na 1000 kobiet. U kobiet w wieku od 50 do 59 lat
stosujących estrogenowo-progestagenową HTZ liczba przypadków zakrzepów krwi w żyłach w
ciągu 5 lat wyniesie 9 do 12 na 1000 kobiet (tj. 5 dodatkowych przypadków). Natomiast u kobiet
w wieku od 50 do 59 lat z usuniętą macicą stosujących wyłącznie estrogenową HTZ w ciągu 5 lat
liczba przypadków zakrzepów krwi w żyłach wyniesie 5 do 8 na 1000 kobiet (tj. 1 dodatkowy
przypadek).
Jeśli u pacjentki wystąpi:
- bolesny obrzęk nogi
- nagły ból w klatce piersiowej
- trudności w oddychaniu powinna jak najszybciej zgłosić się do lekarza i nie stosować HTZ, aż do chwili, gdy zgodę wyrazi lekarz. Mogą to być objawy zakrzepicy.
Jeśli u pacjentki planuje się operację, powinna ona poinformować o tym lekarza. Może zajść
konieczność przerwania HTZ na 4 do 6 tygodni przed operacją, aby zmniejszyć ryzyko powstania
zakrzepu. Lekarz poinformuje pacjentkę, kiedy może wznowić HTZ.
Choroba niedokrwienna serca
HTZ nie jest zalecana u kobiet z chorobą serca występującą obecnie lub w niedalekiej przeszłości.
Jeśli u pacjentki kiedykolwiek występowała choroba serca, należy skonsultować się z lekarzem, czy
możliwe jest stosowanie HTZ.
HTZ nie wspomaga profilaktyki chorób serca.
Badania z jednym rodzajem HTZ (skoniugowanymi estrogenami i medroksyprogestogenem)
wykazały, że ryzyko wystąpienia choroby serca może być nieznacznie wyższe podczas pierwszego
roku stosowania leku. W przypadku innych HTZ, istnieje prawdopodobieństwo, że ryzyko będzie
podobne, jednak co do tego nie ma pewności.
Jeśli u pacjentki wystąpi:
- ból w klatce piersiowej, promieniujący do ramienia i szyi powinna jak najszybciej zgłosić się do lekarza i nie stosować HTZ, aż do chwili, gdy zgodę wyrazi lekarz. Mogą to być objawy choroby serca.
Udar
Ostatnie badania sugerują, że HTZ nieznacznie zwiększa ryzyko wystąpienia udaru. Inne czynniki,
które mogą zwiększać ryzyko udaru to:
- starzenie się
- wysokie ciśnienie krwi
- palenie tytoniu
- nadużywanie alkoholu
- nieregularne bicie serca.
Jeśli u pacjentki występują wyżej wymienione czynniki zwiększające ryzyko udaru, lub jeśli u
pacjentki w przeszłości wystąpił udar, powinna skonsultować się z lekarzem, czy może stosować
HTZ.
Porównanie:
U kobiet w wieku od 50 do 59 lat niestosujących HTZ, średnio u 8 na 1000 kobiet w ciągu 5 lat
wystąpi udar. U kobiet w wieku od 50 do 59 lat stosujących HTZ liczba przypadków udaru w
ciągu 5 lat wyniesie 11 przypadków na 1000 kobiet (tj. 3 dodatkowe przypadki).
Nowotwór jajnika
Nowotwór jajnika występuje rzadko – znacznie rzadziej niż nowotwór piersi. Stosowanie HTZ
obejmującej tylko estrogeny lub skojarzenie estrogenów i progestagenów wiąże się z nieznacznie
zwiększonym ryzykiem nowotworu jajnika.
Ryzyko nowotworu jajnika zależy od wieku. Na przykład u kobiet w wieku od 50 do 54 lat, które nie
stosują HTZ, nowotwór jajnika zostanie rozpoznany w okresie 5 lat u około 2 na 2000 kobiet. U
kobiet, które przyjmowały HTZ przez 5 lat, wystąpi u około 3 kobiet na 2000 stosujących (tj. około 1
dodatkowy przypadek).
Inne zaburzenia
Estrogeny mogą powodować zatrzymanie płynów, dlatego też należy uważnie obserwować pacjentki z
zaburzeniami czynności serca lub nerek. Pacjentki z krańcową niewydolnością nerek powinny być
uważnie monitorowane, gdyż można spodziewać zwiększenia stężenia substancji czynnych leku
Fem 7 w krwiobiegu.
Pacjentki z występującą wcześniej hipertrójglicerydemią powinny być uważnie obserwowane w
trakcie terapii estrogenami lub innej hormonalnej terapii zastępczej, ponieważ zgłaszano rzadkie
przypadki, w których zwiększenie stężenia trójglicerydów w osoczu prowadziło do zapalenia trzustki
przy stosowaniu terapii estrogenami.
Estrogeny wpływają na stężenia innych hormonów i białek.
HTZ nie poprawia funkcji poznawczych (utrata pamięci, zaburzenia percepcji, uwagi). Istnieją
dowody na zwiększone ryzyko otępienia u kobiet, które rozpoczęły HTZ w wieku powyżej 65 lat.
Lek Fem 7 a inne leki
Metabolizm estrogenów i progestagenów może ulec nasileniu w czasie jednoczesnego stosowania
substancji indukujących aktywność enzymów metabolizujących leki (głównie enzymów cytochromu
P-450), takich jak leki przeciwdrgawkowe (np. fenobarbital, fenytoina, karbamazepina) oraz leki
przeciwzakaźne (ryfampicyna, ryfabutyna, newirapina, efawirenz).
Rytonawir i nelfinawir, choć znane jako silne inhibitory enzymów, wykazują właściwości
pobudzające enzymy, gdy stosuje się je jednocześnie z hormonami steroidowymi.
Produkty ziołowe zawierające ziele dziurawca zwyczajnego (Hypericum perforatum)mogą pobudzać
metabolizm estrogenów.
Przy zastosowaniu przezskórnym nie występuje tzw. „efekt pierwszego przejścia” w wątrobie, dlatego
też substancje pobudzające enzymy mają mniejszy wpływ na stosowane w ten sposób estrogeny i
progestageny niż hormony przyjmowane doustnie.
Pod względem klinicznym, przyspieszony metabolizm estrogenów i progestagenów może
doprowadzić do osłabienia działania tych hormonów i zaburzeń w profilu krwawienia z dróg rodnych.
Uwaga!Dotyczy to także leków przyjmowanych w ostatnim czasie.
Hormonalna terapia zastępcza może wpływać na działanie innych leków:
- leku na padaczkę (lamotrygina), ponieważ może wpłynąć na zwiększenie częstości napadów drgawkowych;
- leków stosowanych w leczeniu wirusowego zapalenie wątroby typu C (HCV) (takie jak schemat leczenia za pomocą ombitaswiru/parytaprewiru/rytonawiru z dazabuwirem lub bez dazabuwiru oraz schemat leczenia za pomocą glekaprewiru/pibrentaswiru) ponieważ może powodować zwiększenie parametrów czynności wątroby w badaniach laboratoryjnych krwi (zwiększona aktywność enzymu wątrobowego AlAT) u kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające etynyloestradiol. Lek Fem 7 zawiera estradiol zamiast etynyloestradiolu. Nie wiadomo, czy zwiększona aktywność enzymu wątrobowego AlAT może wystąpić podczas stosowania leku Fem 7 jednocześnie z tego rodzaju schematem leczenia skojarzonego przeciwko wirusowi HCV.
Należy powiedzieć lekarzowi o wszystkich lekach przyjmowanych przez pacjenta obecnie lub
ostatnio, a także o lekach, które pacjent planuje stosować. Lekarz udzieli pacjentce stosownych
wskazówek.
Testy laboratoryjne
Jeśli konieczne jest wykonanie badania krwi, należy poinformować lekarza lub personel laboratorium
o przyjmowaniu leku Fem 7, ponieważ lek ten może wpływać na wyniki niektórych badań.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Lek Fem 7 nie jest wskazany do stosowania podczas ciąży. Jeśli pacjentka zajdzie w ciążę w trakcie
leczenia lekiem Fem 7, lek należy natychmiast odstawić.
Wyniki większości dotychczasowych badań epidemiologicznych dotyczących przypadkowej
ekspozycji płodu na działanie estrogenów nie wykazały efektów szkodliwych dla zarodka i płodu.
Karmienie piersią
Lek Fem 7 nie jest wskazany do stosowania w czasie karmienia piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie zgłaszano wpływu leku Fem 7 na zdolność prowadzenia pojazdów mechanicznych i obsługi
urządzeń mechanicznych w ruchu.
3. Jak stosować lek Fem 7
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić
się do lekarza lub farmaceuty.
Dawkowanie u dorosłych
- Lek Fem 7 stosuje się raz na tydzień, tzn. zużyty plaster należy natychmiast zastępować nowym co 7 dni (zawsze tego samego dnia tygodnia).
- Leczenie należy rozpoczynać od przyklejenia jednego plastra.
- Jeśli nie nastąpi złagodzenie objawów menopauzy, dawkę można zwiększyć do dwóch plastrów na tydzień.
- Nie należy stosować więcej niż dwóch plastrów tygodniowo.
- Jeśli wystąpią objawy przedawkowania, np. tkliwość piersi, dawkę należy odpowiednio zmniejszyć.
- Lek Fem 7 należy stosować cyklicznie (3 tygodnie leczenia, 1 tydzień bez przyklejania plastra) lub metodą ciągłą.
- W przypadku stosowania plastra leku Fem 7 u kobiet z zachowaną macicą musi być podawany dodatkowo hormon ciałka żółtego (progestagen) przez co najmniej 12 dni cyklu. Po zakończeniu przyjmowania progestagenu może wystąpić regularne krwawienie z odstawienia.
U kobiet, którym usunięto macicę nie stosujących hormonalnej terapii zastępczej lub przechodzących
z innego produktu do HTZ, stosowanie leku Fem 7 można rozpocząć w dowolnym czasie.
U kobiet z zachowaną macicą nie stosujących hormonalnej terapii zastępczej, stosowanie leku Fem 7
można rozpocząć w dowolnym czasie.
U kobiet z zachowaną macicą stosujących sekwencyjną HTZ stosowanie leku Fem 7 można rozpocząć
po zakończeniu poprzedniego cyklu leczenia.
Stosowanie leku Fem 7 u dzieci jest przeciwwskazane.
Sposób stosowania
Instrukcję postępowania zilustrowano poniższymi rysunkami.
Plaster składa się z cienkiej, przejrzystej folii, o kształcie ośmiokąta połączonej z dwuczęściową,
mocniejszą folią ochronną.
Ośmiokątna część plastra jest właściwym, aktywnym plastrem. Wewnętrzna strona przylepna zawiera
hormon estradiol, który jest w sposób ciągły uwalniany do skóry.
Każdy plaster leku Fem 7 jest zapakowany w oddzielną szczelnie zamkniętą saszetkę.
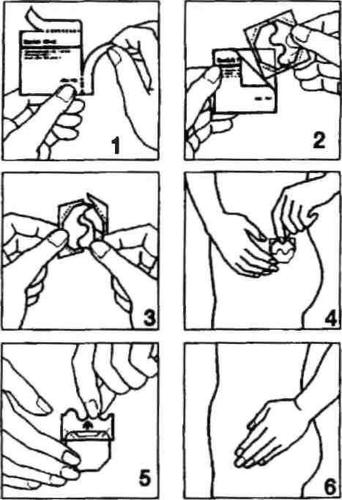
- Rozerwać jedną z saszetek wzdłuż bocznych nacięć (nie używać nożyczek), a następnie wyjąć plaster. (Rys. 1 i 2).
- Plaster należy naklejać na skórę bezpośrednio po wyjęciu z opakowania.
- Oderwać połowę dwuczęściowej warstwy ochronnej. Nie dotykać palcami części przylepnej plastra. Część przylepną plastra przyłożyć do skóry. (Rys. 3 i 4).
- Usunąć drugą połowę warstwy ochronnej. Docisnąć plaster dłonią i przytrzymać przez 30 sekund. Plaster zostanie ogrzany do temperatury ciała, co zapewni jego optymalne przyleganie do skóry. (Rys. 5 i 6). Należy upewnić się, że cały plaster przylega do skóry, zwłaszcza przy brzegach.
- Miejsce przyklejenia plastra, powinno być za każdym razem zmieniane, to znaczy, że nowy plaster można przykleić na to samo miejsce po dwóch tygodniach.
- Skóra w wybranym miejscu powinna być zdrowa, odtłuszczona, sucha i nie uszkodzona.
- Najlepszymi miejscami do przyklejenia plastra są biodra, górne części pośladków i dolne partie brzucha, ponieważ w tych miejscach skóra jest względnie gładka. Plastra leku Fem 7 nie wolnoprzyklejać na piersiach i ich najbliższej okolicy! Nie należy przyklejać plastra w talii!
- Plaster mocno trzyma się skóry. Kąpiel w wannie, pod prysznicem i wykonywanie ćwiczeń fizycznych nie powinno mieć wpływu na działanie plastra.
- Należy unikać pocierania plastra gąbką lub ręcznikiem, ponieważ może dojść do odklejenia się plastra.
- Nie należy nosić obcisłej odzieży, która może spowodować odklejenie się plastra.
- Jeśli plaster odklei się całkowicie przed upływem 7 dni, należy po prostu nakleić nowy plaster.
- Każdy plaster należy stosować przez siedem dni. Zaleca się zmienianie plastra zawsze tego samego dnia tygodnia.
- Następny plaster należy nalepić zgodnie z pierwotnym planem terapii. Należy unikać wystawiania plastra na bezpośrednie działanie promieni słonecznych.
Jeśli po nałożeniu plastra na skórze pozostanie trochę kleju, należy go delikatnie zetrzeć przy pomocy
kremu lub mleczka kosmetycznego.
Jak długo można stosować lek Fem 7
Każdy plaster należy stosować przez siedem dni.
HTZ należy kontynuować tak długo, jak długo korzyści związane z łagodzeniem objawów menopauzy
przewyższają ryzyko związane ze stosowaniem HTZ.
Zastosowanie większej niż zalecana dawki leku Fem 7
Ze względu na drogę podania duże przedawkowanie estradiolu w przypadku stosowania leku Fem 7
jest mało prawdopodobne, a skutki przedawkowania można natychmiast usunąć przez odklejenie
plastra.
Objawami przedawkowania są przede wszystkim: tkliwość piersi, obrzęki, nudności i krwawienie z
dróg rodnych.
W przypadku przedawkowania dawkę leku należy odpowiednio zmniejszyć.
Pominięcie przyjęcia leku Fem 7
Również w przypadku pominięcia zmiany plastra po siedmiu dniach należy go niezwłocznie
wymienić, a następnej zmiany plastra dokonać wyznaczonego dnia, w zwykłym terminie.
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętego plastra.
Przerwanie stosowania leku Fem 7
Czas trwania całego leczenia określa lekarz. Należy regularnie (np. co 6 miesięcy) ustalać, czy dalsze
prowadzenie leczenia jest konieczne. W razie wcześniejszego przerwania leczenia lub w przypadku
wystąpienia działań niepożądanych, należy skonsultować się z lekarzem.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Poniżej wymieniono możliwe działania niepożądane, podczas stosowania terapii hormonalnej w
okresie menopauzy.
Bardzo częste działania niepożądane (które mogą wystąpić u ponad 1 na 10 pacjentek):
- Działanie niepożądane na skórę w miejscu naklejenia plastra w tym świąd, zaczerwienienie skóry (rumień), wyprysk, pokrzywka, opuchnięcie skóry i zmiany pigmentacji skóry. Działania te zazwyczaj ustępują po 2-3 dniach od odklejenia plastra.
Częste działania niepożądane (które mogą wystąpić u mniej niż 1 na 10 pacjentek):
- zwiększenie lub zmniejszenie masy ciała
- bóle głowy,
- ból brzucha, nudności,
- wysypka, świąd,
- krwawienia lub plamienia z macicy lub pochwy.
Niezbyt częste działania niepożądane (które mogą wystąpić u mniej niż 1 na 100 pacjentek):
- reakcja nadwrażliwości,
- depresyjny nastrój,
- zaburzenia widzenia,
- palpitacje,
- rumień guzowaty, pokrzywka,
- ból piersi, tkliwość piersi,
- zawroty głowy,
- niestrawność,
- obrzęki.
Rzadkie działania niepożądane (które mogą wystąpić u mniej niż 1 na 1 000 pacjentek):
- nerwowość,
- zmniejszenie lub zwiększenie libido,
- migrena,
- nietolerancja soczewek kontaktowych,
- wzdęcia i wymioty,
- hirsutyzm, trądzik,
- kurcze mięśni,
- bolesne miesiączkowanie, upławy, zespół napięcia przedmiesiączkowego, powiększenie piersi,
- zmęczenie,
- mięśniaki gładkie macicy.
W razie wystąpienia któregokolwiek z tych objawów należy powiadomić lekarza, który dostosuje
dawkowanie leku.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309,
strona internetowa: https://smz.ezdrowie.gov.pl.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Fem 7
- Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci
- Przechowywać w temperaturze poniżej 30°C.
- Nie stosować tego leku po upływie terminu ważności zamieszczonego opakowaniu. Termin ważności oznacza ostatni dzień podanego miesiąca.
- Zużyte plastry należy skleić składając na pół powierzchnią przylepną do wewnątrz, a następnie wyrzucić.
- Leków nie należy wrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Fem 7
Substancją czynną leku jest estradiol (w postaci estradiolu półwodnego).
1 system transdermalny, plaster zawiera:
substancję czynną
estradiol (w postaci estradiolu półwodnego 1,5 mg).
Czynna powierzchnia systemu wynosi 15 cm .
Szybkość uwalniania estradiolu wynosi 50 μg/24 h przez 7 dni.
pozostałe składniki to:Warstwa przylepna: kopolimer styrenu i izoprenu, estry gliceryny z
uwodornionymi kwasami żywicznymi.
Warstwa ochronna zewnętrzna: poli(tereftalan etylenu) (PET).
Warstwa ochronna (do usunięcia): poli(tereftalan etylenu) (PET) pokryty silikonem.
Jak wygląda lek Fem 7 i co zawiera opakowanie
Lek Fem 7 jest ośmiokątnym, w pełni przezroczystym systemem transdermalnym, plastrem. Jego
wewnętrzna (przylepna) warstwa jest pokryta dwuczęściową, przezroczystą folią ochronną.
4 systemy transdermalne, plastry lub 12 systemów transdermalnych, plastrów.
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do podmiotu
odpowiedzialnego lub importera równoległego.
Podmiot odpowiedzialny w Portugalii, kraju eksportu:
Theramex Ireland Limited
3 Floor, Kilmore House
Park Lane, Spencer Dock
D01 YE64 - Dublin 1, Irlandia
Wytwórca:
LTS Lohmann Therapie-Systeme AG
Lohmannstr. 2
56626 Andernach
Niemcy
Importer równoległy:
InPharm Sp. z o.o.
ul. Strumykowa 28/11
03-138 Warszawa
Przepakowano w:
InPharm Sp. z o.o. Services sp. k.
ul. Chełmżyńska 249
04-458 Warszawa
Numer pozwolenia w Portugalii, kraju eksportu:2638682
2638781
Numer pozwolenia na import równoległy: 174/24
Data zatwierdzenia ulotki: 25.04.2024
[Informacja o zastrzeżonym znaku towarowym]
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Podmiot odpowiedzialny (MAH)Theramex Ireland Limited
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Fem 7Postać farmaceutyczna: Żel, 0,5 mgSubstancja czynna: estradiolProducent: Orion CorporationWymaga receptyPostać farmaceutyczna: Żel, 1 mgSubstancja czynna: estradiolProducent: Orion CorporationWymaga receptyPostać farmaceutyczna: Żel, 1 mg/gSubstancja czynna: estradiolWymaga recepty
Odpowiedniki Fem 7 w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Fem 7 – Hiszpania
Odpowiednik Fem 7 – Ukraina
Lekarze online w sprawie Fem 7
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Fem 7 – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.










