

Diphereline SR 11,25 mg

Zapytaj lekarza o receptę na Diphereline SR 11,25 mg

Jak stosować Diphereline SR 11,25 mg
Ulotka dołączona do opakowania: informacja dla użytkownika
Diphereline SR 11,25 mg
11,25 mg
proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań
Triptorelinum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Diphereline SR 11,25 mg i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Diphereline SR 11,25 mg
- 3. Jak stosować lek Diphereline SR 11,25 mg
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Diphereline SR 11,25 mg
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Diphereline SR 11,25 mg i w jakim celu się go stosuje
Ten lek zawiera triptorelinę. Triptorelinę zalicza się do grupy leków znanych jako analogi hormonu
uwalniającego gonadotropinę (GnRH). Jednym z jej działań jest zmniejszenie wytwarzania hormonów
płciowych w organizmie.
Długotrwałe podawanie tryptoreliny, po początkowej stymulacji, powoduje zahamowanie wydzielania
hormonów gonadotropowych, co w konsekwencji prowadzi do zahamowania czynności gonad (jąder
i jajników).
Lek stosuje się:
- W leczeniu raka gruczołu krokowego. Leczenie raka gruczołu krokowego kiedy wymagane jest obniżenie stężenia testosteronu do stężenia charakterystycznego dla braku czynności gruczołów płciowych (stężenia kastracyjnego). Pacjenci, którzy nie byli poddawani terapii hormonalnej, lepiej reagują na leczenie tryptoreliną.
- U dzieci w leczeniu dojrzewania płciowego, które pojawia się w bardzo wczesnym wieku, czyli przed 8. rokiem życia u dziewcząt i przed 10. rokiem życia u chłopców (przedwczesne dojrzewanie płciowe pochodzenia ośrodkowego).
2. Informacje ważne przed zastosowaniem leku Diphereline SR 11,25 mg
Kiedy nie stosować leku Diphereline SR 11,25 mg
- jeśli pacjent ma uczulenie na tryptorelinę, gonadoliberynę (GnRH), inne analogi GnRH lub którykolwiek z pozostałych składników leku Diphereline SR 11,25 mg,
- w okresie ciąży i karmienia piersią.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem przyjmowania leku Diphereline SR 11,25 mg należy omówić to z lekarzem lub
farmaceutą.
Pacjenci otrzymujący ten lek powinni pozostawać pod ścisłą kontrolą lekarską z regularną kontrolą
parametrów biochemicznych, kontrolą kliniczną i radiologiczną jeśli to konieczne.
Istnieją doniesienia o występowaniu depresji, w tym przypadków ciężkiej depresji u pacjentów
przyjmujących lek Diphereline SR 11,25 mg. Jeśli w trakcie przyjmowania leku Diphereline SR
11,25 mg wystąpią nastroje depresyjne, należy poinformować o tym lekarza.
W przypadku stosowania leków zapobiegających krzepnięciu krwi, w miejscu iniekcji może wystąpić
zasinienie. Jedynie u mężczyzn lek może być podawany domięśniowo lub podskórnie.
U dorosłych, długotrwałe leczenie tryptoreliną może powodować osłabienie kości (osteoporozę)
związane ze zwiększonym ryzykiem złamań kości. Należy poinformować lekarza, jeśli u pacjenta
występuje którykolwiek z poniższych czynników ryzyka, ponieważ lekarz może zalecić przyjmowanie
bisfosfonianów (leków stosowanych w leczeniu osteoporozy) w celu leczenia utraty masy kostnej.
Czynniki ryzyka mogą obejmować:
- wystąpienie osteoporozy u pacjenta lub w najbliższej rodzinie pacjenta;
- nadużywanie alkoholu, palenie papierosów, niedożywienie;
- przyjmowanie przez długi czas leków, które mogą powodować utratę masy kostnej, na przykład leków stosowanych w leczeniu padaczki lub kortykosteroidów (takich jak hydrokortyzon, prednizolon).
Podczas leczenia lekiem Diphereline SR 11,25 mg może ujawnić się powiększenie (łagodny guz)
przysadki mózgowej, którego pacjent nie był świadomy. Objawy obejmują nagły ból głowy, wymioty,
zaburzenia widzenia oraz porażenie mięśni oczu.
Jeśli wystąpią drgawki, należy natychmiast poinformować lekarza. Zgłaszano drgawki u pacjentów
przyjmujących triptorelinę lub podobne leki. Występowały one u pacjentów z wcześniej stwierdzoną
padaczką lub bez niej.
Mężczyźni
Na początku leczenia obserwowano zwiększone stężenie testosteronu w organizmie. Może to
spowodować nasilenie objawów, związanych z nowotworem. W takim przypadku należy
skontaktować się z lekarzem. Lekarz może zalecić dodatkowy lek (antyandrogen), aby zapobiec
nasileniu tych objawów.
Jeżeli u pacjenta wystąpi niedrożność dróg moczowych lub ucisk na rdzeń kręgowy z powodu
rozprzestrzeniania się nowotworu, lekarz będzie ściśle nadzorował pacjenta przez pierwsze kilka
tygodni leczenia. W przypadku trudności z oddawaniem moczu, bólu kości, osłabienia kończyn
dolnych lub uczucia mrowienia, należy natychmiast skontaktować się z lekarzem, który oceni stan
pacjenta i wdroży odpowiednie leczenie.
Tryptorelina nie indukuje dalszego zmniejszenia stężenia testosteronu u pacjentów po orchidektomii
(usunięcie jądra).
Wyniki badań diagnostycznych gonadalnej czynności przysadki i narządów rozrodczych,
wykonywane w czasie leczenia lub po zaprzestaniu terapii lekiem Diphereline SR 11,25 mg mogą być
mylące.
Należy poinformować lekarza, jeśli u pacjenta występują choroby serca lub naczyń krwionośnych,
w tym zaburzenia rytmu serca (arytmia) lub jeśli pacjent przyjmuje leki stosowane w leczeniu
zaburzeń rytmu serca. Ryzyko zaburzeń rytmu serca może być zwiększone podczas stosowania leku
Diphereline SR 11,25 mg.
Należy poinformować lekarza, jeśli pacjent ma cukrzycę i (lub) choroby serca.
Leki obniżające poziom testosteronu mogą powodować zmiany w EKG związane z zaburzeniami
rytmu serca (wydłużenie odstępu QT).
Dzieci
U dziewcząt z przedwczesnym dojrzewaniem płciowym w pierwszym miesiącu leczenia może
wystąpić krwawienie z pochwy.
Należy poinformować lekarza jeśli pacjent choruje na postępującego guza mózgu. Może mieć to
wpływ na decyzję lekarza o sposobie leczenia.
Po zaprzestaniu leczenia lekiem Diphereline SR 11,25 mg u pacjenta pojawią się objawy dojrzewania.
U dziewcząt wystąpienie miesiączki następowało zwykle po roku od zaprzestania leczenia.
Lekarz powinien wykluczyć możliwość, że przedwczesne dojrzewanie płciowe spowodowane jest
przez inne choroby.
Ilość składników mineralnych w kościach zmniejsza się w czasie leczenia, ale powraca do wartości
prawidłowych po jego przerwaniu.
Po przerwaniu leczenia może wystąpić schorzenie stawu biodrowego (młodzieńcze złuszczenie głowy
kości udowej), powodujące sztywność biodra, wiotkość i (lub) silny ból w pachwinie promieniujący
do uda. W takim przypadku należy skonsultować się z lekarzem.
Jeśli u dziecka występują silne lub nawracające bóle głowy, problemy ze wzrokiem oraz dzwonienie
lub brzęczenie w uszach, należy natychmiast skontaktować się z lekarzem (patrz punkt 4).
W przypadku obaw, związanych z sytuacjami opisanymi powyżej, należy porozmawiać z lekarzem.
Lek Diphereline SR 11,25 mg a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych obecnie lub
ostatnio a także o lekach, które pacjent planuje przyjmować.
Mężczyźni:
Lek Diphreline SR 11,25 mg może wpływać na działanie innych leków stosowanych w leczeniu
zaburzeń rytmu serca (np. chinidyna, prokainamid, amiodaron, sotalol) lub może zwiększać ryzyko
zaburzeń rytmu serca w przypadku jednoczesnego przyjmowania innych leków (np. metadon
stosowany w leczeniu bólu oraz jako element detoksykacji w przypadku uzależnienia lekowego),
moksyfloksacyna (antybiotyk), leki przeciwpsychotyczne (stosowane w leczeniu ciężkich chorób
psychicznych).
Ciąża i karmienie piersią
Tego leku nie wolno stosować w okresie ciąży i karmienia piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Podczas przyjmowania leku mogą wystąpić zawroty głowy, zmęczenie lub problemy ze wzrokiem,
np. zamazane widzenie. Objawy te mogą być działaniami niepożądanymi leczenia lub wynikać
z choroby podstawowej. W przypadku wystąpienia któregokolwiek z wymienionych działań
niepożądanych, nie należy prowadzić pojazdów ani obsługiwać żadnych maszyn.
Lek Diphereline SR 11,25 mg zawiera sód
Lek zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy lek uznaje się za „wolny od sodu”.
3. Jak stosować lek Diphereline SR 11,25 mg
Jedno wstrzyknięcie leku o przedłużonym uwalnianiu co 3 miesiące.
Sposób podawania
- U MĘŻCZYZN: podanie domięśniowe lub podskórne.
- U DZIECI: jedynie podanie domięśniowe.
Lek zostanie podany przez lekarza lub pielęgniarkę.
Nie należy przerywać leczenia bez konsultacji z lekarzem.
Zastosowanie większej niż zalecana dawki leku Diphereline SR 11,25 mg
W przypadku przedawkowania wskazane jest leczenie objawowe.
4. Możliwe działania niepożądane
Jak każdy lek, Diphereline SR 11,25 mg może powodować działania niepożądane, chociaż
nie u każdego one wystąpią.
W rzadkich przypadkach może pojawić się ciężka reakcja alergiczna. Jeśli rozwiną się takie objawy,
jak trudności w połykaniu lub oddychaniu, obrzęk warg, twarzy, gardła lub języka, wysypka lub
zawroty głowy należy niezwłocznie powiadomić lekarza.
Mężczyźni
Można spodziewać się, że wiele z działań niepożądanych spowodowanych będzie zmianą stężenia
testosteronu w organizmie. Działania te obejmują: uderzenia gorąca, impotencję i zmniejszenie libido.
Bardzo często- działania niepożądane występujące u więcej niż 1 na 10 pacjentów:
- Uderzenia gorąca
- Osłabienie
- Intensywne pocenie się
- Ból pleców
- Uczucie kłucia w kończynach dolnych
- Zmniejszenie popędu płciowego
- Impotencja
Często–działania niepożądane występujące u nie więcej niż 1 na 10 pacjentów:
- Nudności, suchość w jamie ustnej
- Ból, zasinienie, zaczerwienienie i obrzęk w miejscu wstrzyknięcia
- Ból mięśni i kości, ból ramion i nóg, obrzęk (gromadzenie płynu w tkankach)
- Ból w podbrzuszu
- Wysokie ciśnienie krwi
- Reakcja alergiczna
- Zwiększenie masy ciała
- Zawroty głowy, ból głowy
- Utrata popędu płciowego, depresja, zmiany nastroju
Niezbyt często–działania niepożądane występujące u nie więcej niż 1 na 100 pacjentów:
- Zwiększenie liczby płytek krwi
- Uczucie bicia serca
- Szum w uszach, zawroty głowy, niewyraźne widzenie
- Ból brzucha, zaparcie, biegunka, wymioty
- Ospałość, dreszcze, senność, ból
- Zmiany wyników niektórych badań (w tym zwiększenie wartości parametrów określających czynność wątroby), podwyższone ciśnienie krwi
- Zmniejszenie masy ciała
- Utrata apetytu, zwiększenie apetytu, dna moczanowa (silny ból i obrzęk stawów, najczęściej dotyczący palucha), cukrzyca, duże stężenie tłuszczów we krwi
- Ból stawów, skurcz mięśni, osłabienie mięśni, ból mięśni oraz tkliwość i sztywność, ból kości, obrzęk kostek, stóp i palców
- Mrowienie i drętwienie
- Problemy ze snem, drażliwość
- Powiększenie gruczołów sutkowych u mężczyzn, ból sutków (piersi), zmniejszenie wielkości jąder, ból jąder
- Duszność
- Trądzik, wypadanie włosów, świąd, wysypka, zaczerwienienie skóry, pokrzywka
- Częste oddawanie moczu w nocy, zaburzenia w oddawaniu moczu
- Krwawienie z nosa
Rzadko– działania niepożądane występujące u nie więcej niż 1 na 1000 pacjentów
- Czerwone lub purpurowe przebarwienia skóry
- Nietypowe odczucia w oku, zamazane lub zaburzone widzenie
- Uczucie pełności w jamie brzusznej, wzdęcie, zaburzenia smaku
- Ból w klatce piersiowej
- Trudność w utrzymaniu pozycji stojącej
- Objawy grypopodobne, gorączka
- Ciężka reakcja alergiczna (reakcja anafilaktyczna), która może powodować zawroty głowy lub trudności w oddychaniu, obrzęk twarzy lub gardła
- Zapalenie błony śluzowej nosa, zapalenie gardła
- Sztywność stawów, obrzęk stawów, sztywność szkieletowo-mięśniowa, zapalenie kości i stawów
- Utrata pamięci
- Uczucie splątania, zmniejszenie aktywności, podniecenie
- Duszność w pozycji leżącej
- Pęcherze na skórze
- Niskie ciśnienie krwi
Działania niepożądane zgłaszane po wprowadzeniu leku do obrotu (częstość nieznana):
- Ciężka reakcja alergiczna powodująca obrzęk twarzy, języka i szyi, zawroty głowy lub trudności w oddychaniu (obrzęk Quinckego, wstrząs anafilaktyczny)
- Ogólne złe samopoczucie, niepokój
- Nietrzymanie moczu
- Zmiany w EKG (wydłużenie odstępu QT)
- W przypadku istniejącego guza przysadki, zwiększone ryzyko krwawienia do przysadki
Podobnie jak w przypadku innych analogów GnRH, u pacjentów leczonych lekiem Diphereline SR
11,25 mg można stwierdzić wzrost liczby białych krwinek.
U pacjentów otrzymujących długotrwałe leczenie analogiem GnRH w połączeniu z radioterapią może
wystąpić więcej działań niepożądanych, głównie żołądkowo-jelitowych i związanych z radioterapią.
Dzieci
Bardzo często–działania niepożądane występujące u więcej niż 1 na 10 pacjentów
- U dziewcząt w pierwszym miesiącu leczenia może wystąpić krwawienie z pochwy
Często–działania niepożądane występujące u nie więcej niż 1 na 10 pacjentów
- Ból brzucha
- Bolesność, zasinienie
- Zaczerwienienie i obrzęk w miejscu wstrzyknięcia
- Ból głowy
- Uderzenia gorąca
- Zwiększenie masy ciała
- Trądzik
- Reakcje nadwrażliwości
Niezbyt często–działania niepożądane występujące u nie więcej niż 1 na 100 pacjentów
- Niewyraźne widzenie
- Wymioty, zaparcia, nudności
- Ogólne uczucie dyskomfortu
- Otyłość
- Ból szyi, bóle piersi
- Zmiany nastroju
- Krwawienie z nosa
- Świąd, wysypka lub pokrzywka na skórze
Długoterminowe badanie (trwające do 4 lat) nie przyniosło żadnych nowych i znaczących danych
dotyczących bezpieczeństwa.
Działania niepożądane zgłaszane po wprowadzeniu leku do obrotu (częstość nieznana):
- Wysokie ciśnienie krwi
- Drgawki
- Nieprawidłowe widzenie
- Ciężka reakcja alergiczna powodująca obrzęk twarzy, języka i szyi, zawroty głowy lub trudności w oddychaniu (obrzęk Quinckego, wstrząs anafilaktyczny)
- Zmiany niektórych wyników badań krwi, w tym stężenie hormonów
- Bóle mięśni
- Zaburzenia nastroju, depresja, nerwowość
- Idiopatyczne nadciśnienie śródczaszkowe (zwiększone ciśnienie wewnątrz czaszki wokół mózgu, charakteryzujące się bólem głowy, podwójnym widzeniem i innymi zaburzeniami widzenia oraz dzwonieniem lub brzęczeniem w uszach)
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie, lub pielęgniarce. Działania
niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań
Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Diphereline SR 11,25 mg
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na opakowaniu. Termin
ważności oznacza ostatni dzień podanego miesiąca.
Termin ważności (EXP)
Numer serii (Lot)
Przechowywać w temperaturze poniżej 25°C.
Zawiesinę wstrzykiwać bezpośrednio po sporządzeniu.
6. Zawartość opakowania i inne informacje
Co zawiera lek Diphereline SR 11,25 mg
Substancją czynną leku jest tryptorelina w postaci tryptoreliny pamoinianu. Jedna fiolka zawiera
11,25 mg tryptoreliny.
Pozostałe składniki to:
- fiolka z proszkiem zawiera polimer laktydowo-koglikolidowy, mannitol, karmelozę sodową, polisorbat 80
- ampułka z rozpuszczalnikiem zawiera mannitol, wodę do wstrzykiwań.
Jak wygląda lek Diphereline SR 11,25 mg i co zawiera opakowanie
Proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań
Fiolka z proszkiem i ampułka z rozpuszczalnikiem.
Pudełko zawiera 1 fiolkę z proszkiem, 1 ampułkę z rozpuszczalnikiem, 1 strzykawkę
(z polipropylenu) i 3 igły.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
Ipsen Pharma
65 Quai Georges Gorse
92100 Boulogne Billancourt
Francja
Wytwórca
Ipsen Pharma Biotech
Parc d’Activités du Plateau de Signes
Chemin départemental nr 402
83870 Signes
Francja
W celu uzyskania bardziej szczegółowych informacji dotyczących tego leku należy zwrócić się do
miejscowego przedstawiciela podmiotu odpowiedzialnego:
Ipsen Poland Sp. z o.o.
ul. Chmielna 73
00-801 Warszawa
tel.:22 653 68 00
fax: 22 653 68 22
Data ostatniej aktualizacji ulotki:październik 2024 r.
<-------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Dawkowanie i sposób podawania
Rak gruczołu krokowego
Jedno wstrzyknięcie domięśniowe lub podskórne preparatu o przedłużonym uwalnianiu co 3 miesiące.
U pacjentów z rakiem gruczołu krokowego z przerzutami opornym na kastrację, niepoddającym się
leczeniu operacyjnemu, otrzymujących tryptorelinę oraz kwalifikujących się do leczenia inhibitorami
biosyntezy androgenów, leczenie tryptoreliną powinno być kontynuowane.
Przedwczesne dojrzewanie płciowe pochodzenia ośrodkowego
Leczenie dzieci za pomocą tryptoreliny powinno odbywać się pod wszechstronnym nadzorem
endokrynologa dziecięcego albo pediatry lub endokrynologa z doświadczeniem w leczeniu
przedwczesnego dojrzewania płciowego pochodzenia ośrodkowego.
Dzieci o masie ciała powyżej 20 kg: jedno wstrzyknięcie domięśniowe produktu Diphereline SR
11,25 mg podawane co 3 miesiące.
Leczenie należy przerwać w okolicy fizjologicznego wieku dojrzewania płciowego u chłopców
i dziewcząt. Nie należy kontynuować leczenia u dziewcząt, u których wiek kostny przekracza 12 lat.
Istnieją ograniczone dane dotyczące optymalnego czasu odstawienia leczenia w oparciu o wiek kostny
u chłopców, jednakże zaleca się przerwanie leczenia u chłopców, u których wiek kostny wynosi
13-14 lat.
INSTRUKCJA REKONSTYTUCJI LEKU
1 – PRZYGOTOWANIE PACJENTA PRZED REKONSTYTUCJĄ LEKU
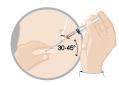
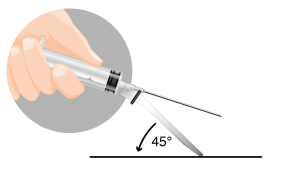
Przygotowanie pacjenta polega na zdezynfekowaniu miejsca planowanej iniekcji na pośladku. Pacjent
powinien być przygotowany do iniekcji przed rekonstytucją leku, ponieważ lek należy podać natychmiast po
jego rekonstytucji. Miejsce iniekcji:
- U MĘŻCZYZN: pośladek (podanie domięśniowe) lub brzuch lub udo (podanie podskórne)
- U DZIECI: jedynie pośladek (podanie domięśniowe)
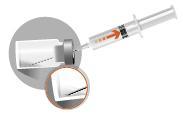
2 – PRZYGOTOWANIE LEKU DO WSTRZYKNIĘCIA
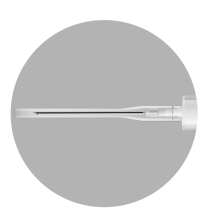
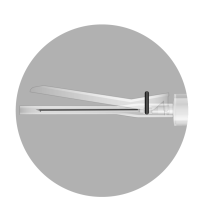
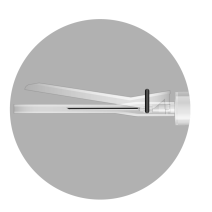
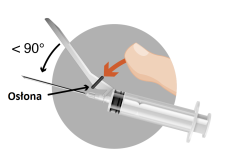
- W opakowaniu znajdują się 3 igły. W zależności od zalecanej drogi podania TYLKO DWIE z nich powinny być użyte:
- Igła 1 długaigła 20 G (o długości 38 mm) bez urządzenia zabezpieczającego do rekonstytucji leku we wszystkich przypadkach
- Igła 2 długaigła 20 G (o długości 38 mm) wyposażona w urządzenie zabezpieczające do wstrzyknięcia domięśniowego mężczyźni, dzieci)
- Igła 3: krótkaigła 20 G (o długości 25 mm) wyposażona w urządzenie zabezpieczające do wstrzyknięcia podskórnego (jedynie mężczyźni)
Igła 1: 38 mm
Igła 2: 38 mm
Igła 3: 25 mm
Obecność pęcherzyków na powierzchni liofilizatu jest normalnym wyglądem produktu.
2a
|  |
2b
|  |
2c
|  |
2d
|  |
|  |
| Mężczyźni, dzieci: domięśniowo lub jedynie u mężczyzn: podskórnie |
 | |
|  |
| Sposób A Sposób B |
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterIpsen Pharma Biotech SAS
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Diphereline SR 11,25 mgPostać farmaceutyczna: Roztwór, 0,1 mg/mlSubstancja czynna: triptorelinProducent: Ferring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 3,75 mgSubstancja czynna: triptorelinProducent: Ferring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 0,1 mgSubstancja czynna: triptorelinProducent: Ipsen Pharma Biotech SASWymaga recepty
Odpowiedniki Diphereline SR 11,25 mg w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Diphereline SR 11,25 mg – Ukraine
Odpowiednik Diphereline SR 11,25 mg – Spain
Lekarze online w sprawie Diphereline SR 11,25 mg
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Diphereline SR 11,25 mg – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.











