Jak stosować Cervidil
Ulotka dołączona do opakowania: informacja dla pacjenta
Cervidil, 10 mg, system terapeutyczny dopochwowy
Dinoprostonum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub pielęgniarki.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub pielęgniarce. Patrz punkt 4.
- Cervidil powinien być stosowany wyłącznie pod nadzorem odpowiedniego specjalisty.
Spis treści ulotki:
- 1. Co to jest Cervidil i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Cervidil
- 3. Jak stosować Cervidil
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać Cervidil
- 6. Zawartość opakowania i inne informacje
1. Co to jest Cervidil i w jakim celu się go stosuje
Cervidil zawiera substancję czynną dinoproston 10 mg i jest stosowany, aby ułatwić rozpoczęcie procesu
porodu, pod warunkiem że ukończono 37 tygodni ciąży. Dinoproston rozwiera część kanału rodnego zwaną
szyjką macicy, aby umożliwić dziecku przejście. Może być kilka powodów, dla których pacjentka może
potrzebować pomocy w rozpoczynaniu tego procesu. Należy zapytać lekarza, jeśli pacjentka chciałaby
uzyskać więcej informacji.
2. Informacje ważne przed zastosowaniem leku Cervidil
Kiedy nie stosować leku Cervidil
Lek Cervidil nie będzie podany:
- jeśli rozmiar głowy dziecka może powodować jakiekolwiek problemy podczas porodu
- jeśli dziecko nie jest ułożone w macicy w prawidłowej pozycji umożliwiającej urodzenie drogami natury
- jeśli stan zdrowia dziecka jest niezadowalający i (lub) jeśli dziecko jest zagrożone
- jeśli pacjentka przebyła wcześniej poważną operację lub pęknięcie szyjki macicy
- jeśli u pacjentki występuje nieleczona choroba zapalna w miednicy mniejszej (zakażenie macicy, jajników, jajowodów i (lub) szyjki macicy)
- jeśli łożysko przykrywa kanał rodny
- jeśli pacjentka ma lub miała niewyjaśnione krwawienie z pochwy podczas obecnej ciąży
- jeśli u pacjentki przeprowadzano uprzednio operacje macicy, w tym porody przez cesarskie cięcie
- jeśli pacjentka ma uczulenie na dinoproston lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Lekarz lub pielęgniarka nie zastosuje leku Cervidil lub usunie lek, o ile został już zastosowany:
- po rozpoczęciu porodu
- jeśli pacjentka wymaga podania leku, np. leku zawierającego oksytocynę, aby wspomóc postęp porodu
- jeśli skurcze są zbyt silne lub długotrwałe
- jeśli dziecko jest zagrożone
- jeśli u pacjentki wystąpią działania niepożądane (patrz punkt 4. Możliwe działania niepożądane).
Doświadczenie dotyczące stosowania leku Cervidil u pacjentek z pękniętymi błonami płodowymi jest
ograniczone. Jeśli lek Cervidil został już podany, to lekarz lub pielęgniarka usunie lek, gdy błony płodowe
pękną lub planowane jest ich przebicie przez lekarza lub pielęgniarkę.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Cervidil należy poinformować lekarza lub pielęgniarkę, jeśli
którakolwiek z następujących sytuacji odnosi się do pacjentki:
- jeśli u pacjentki występuje lub kiedykolwiek występowała astma (trudności z oddychaniem) lub jaskra (choroba oczu)
- jeśli u pacjentki występowały zbyt silne lub długotrwałe skurcze w poprzedniej ciąży
- jeśli u pacjentki występuje choroba płuc, wątroby lub nerek
- jeśli pacjentka ma więcej niż jedno dziecko
- jeśli pacjentka miała więcej niż trzy porody o terminie
- jeśli pacjentka przyjmuje lek przeciwbólowy i (lub) przeciwzapalny, zawierający niesteroidowe leki przeciwzapalne (znane również jako NLPZ), np. aspiryna
- jeśli pacjentka ma 35 lub więcej lat, jeśli podczas ciąży wystąpiły powikłania, takie jak cukrzyca, wysokie ciśnienie krwi i niski poziom hormonów tarczycy (niedoczynność tarczycy) lub jeśli ciąża trwa dłużej niż 40 tygodni ze względu na zwiększone ryzyko rozwinięcia się rozsianego wykrzepiania wewnątrznaczyniowego - rzadkiego schorzenia, które wpływa na krzepnięcie krwi.
Dzieci i młodzież
Nie badano stosowania leku Cervidil u dzieci i młodzieży w wieku poniżej 18 lat.
Cervidil a inne leki
Należy powiedzieć lekarzowi lub pielęgniarce o wszystkich lekach przyjmowanych przez pacjentkę obecnie
lub ostatnio, a także o lekach, które pacjentka planuje przyjmować.
Cervidil może sprawić, że pacjentka będzie bardziej wrażliwa na leki należące do klasy leków
stymulujących skurcze macicy, które są stosowane w celu wzmocnienia skurczów. Nie zaleca się podawania
tych leków razem z lekiem Cervidil.
Ciąża i karmienie piersią
Cervidil jest stosowany, aby ułatwić rozpoczęcie porodu w terminie. Leku Cervidil nie należy stosować
w innych okresach ciąży. Nie badano stosowania leku Cervidil w okresie karmienia piersią.
Cervidil może przenikać do mleka matki, ale przypuszcza się, że ilości oraz czas przenikania są ograniczone
i nie powinny stanowić przeszkody dla karmienia piersią. Nie obserwowano wpływu na noworodki
karmione piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie dotyczy, ponieważ Cervidil ma być stosowany wyłącznie w związku z porodem.
3. Jak stosować lek Cervidil
Cervidil zostanie podany pacjentce przez przeszkolony personel medyczny w szpitalu lub klinice, które
wyposażone są w urządzenia do monitorowania stanu pacjentki oraz jej dziecka.
Lekarz lub pielęgniarka umieści jeden system terapeutyczny dopochwowy (wkładkę dopochwową)
w pochwie pacjentki w pobliżu szyjki macicy. Pacjentka nie będzie tego robiła samodzielnie. Przed
umieszczeniem w pochwie lekarz lub pielęgniarka mogą powlec wkładkę dopochwową niewielką ilością
żelu nawilżającego. Tasiemka o odpowiedniej długości pozostanie poza pochwą, aby ułatwić usunięcie
wkładki dopochwowej, gdy zajdzie taka potrzeba.
Pacjentka będzie leżała w trakcie tej procedury i będzie musiała pozostać w pozycji leżącej przez około
20-30 minut po umieszczeniu wkładki dopochwowej Cervidil.
Po umieszczeniu w pochwie wkładka dopochwowa pochłania wilgoć, co umożliwia powolne uwalnianie
dinoprostonu.
W czasie, gdy wkładka dopochwowa pozostaje w pochwie pomagając w rozpoczęciu porodu, pacjentka
będzie regularnie badana, między innymi pod kątem:
- rozwarcia szyjki macicy,
- skurczów macicy,
- bólów porodowych i stanu zdrowia dziecka.
W zależności od postępu porodu lekarz lub pielęgniarka zdecyduje, jak długo Cervidil powinien pozostawać
w pochwie. Cervidil może pozostawać w pochwie przez maksymalnie 24 godziny.
Przy usuwaniu z pochwy wkładka dopochwowa będzie powiększona 2-3 krotnie w stosunku do jej
początkowych wymiarów i będzie elastyczna.
Zastosowanie leku Cervidil przez czas dłuższy niż zalecany
Jeśli Cervidil jest stosowany przez czas dłuższy niż zalecany, to może prowadzić do nasilenia skurczów
macicy lub zagrożenia dziecka. Wkładka dopochwowa Cervidil zostanie wówczas natychmiast usunięta.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Często:mogą wystąpić nie częściej niż u 1 na 10 pacjentek:
- Nasilone skurcze macicy z wpływem lub bez wpływu na stan dziecka
- Zdrowie dziecka może być zagrożone i (lub) tętno dziecka może być szybsze albo wolniejsze od normalnego
- Zmiana zabarwienia wód płodowych
Niezbyt często:mogą wystąpić nie częściej niż u 1 na 100 pacjentek:
- Ból głowy
- Zmniejszone ciśnienie krwi
- Noworodek ma trudności z oddychaniem bezpośrednio po urodzeniu
- Noworodek ma duże stężenie bilirubiny, produktu rozpadu krwinek czerwonych, co może powodować zażółcenie skóry i oczu
- Świąd
- Nadmierne krwawienie z pochwy po porodzie
- Łożysko oddziela się od ściany macicy przed urodzeniem dziecka
- Obniżony stan ogólny noworodka natychmiast po urodzeniu
- Powolny postęp porodu
- Zapalenie błon wyściełających wnętrze macicy
- Macica matki nie kurczy się po porodzie z powodu braku normalnych skurczów macicy
- Uczucie pieczenia w okolicy narządów płciowych
- Gorączka
Częstość nieznana: częstość nie może być określona na podstawie dostępnych danych
- Śmierć płodu, poród martwego płodu i śmierć noworodka; zwłaszcza po wystąpieniu ciężkich zdarzeń, takich jak pęknięcie macicy.
- Rozsiane wykrzepianie wewnątrznaczyniowe - rzadka choroba, która wpływa na krzepnięcie krwi. Może to powodować tworzenie się skrzepów krwi i może zwiększać ryzyko krwawienia.
- Płyn owodniowy, który otacza dziecko w czasie ciąży, może przedostać się do krwioobiegu matki w czasie porodu i zatkać naczynia krwionośne, prowadząc do stanu zwanego anafilaktoidalnym zespołem ciążowym, który może obejmować objawy takie jak: spłycenie oddechu, małe ciśnienie krwi, niepokój i dreszcze; zagrażające życiu zaburzenia krzepnięcia krwi, drgawki, śpiączkę, krwawienie i płyn w płucach, zagrożenie życia płodu, takie jak wolna czynność serca.
- Reakcje nadwrażliwości i ciężkie reakcje alergiczne (reakcja anafilaktyczna), które mogą obejmować: trudności w oddychaniu, spłycenie oddechu, słabe i szybkie tętno, zawroty głowy, świąd, zaczerwienienie skóry i wysypkę.
- Ból brzucha
- Nudności
- Wymioty
- Biegunka
- Swędzenie w okolicy narządów płciowych
- Rozdarcie mięśnia macicy
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub pielęgniarce. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu
Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Aleje Jerozolimskie 181C, 02-222 Warszawa
Tel: +48 22 49 21 301
Fax: +48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Cervidil
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na foliowej saszetce i tekturowym
pudełku po napisie EXP. Termin ważności oznacza ostatni dzień podanego miesiąca. Numer serii podany
jest po napisie (Lot).
Przechowywać w zamrażarce (od -10°C do -25°C). Przechowywać w oryginalnym opakowaniu w celu
ochrony przez wilgocią.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Po użyciu lekarz lub
pielęgniarka wyrzuci cały produkt jako odpad kliniczny. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera Cervidil
- Substancją czynną leku jest dinoproston, bardziej znany jako Prostaglandyna E . Każdy system terapeutyczny dopochwowy zawiera 10 mg dinoprostonu, który jest uwalniany z szybkością około 0,3 mg na godzinę przez 24 godziny. Pozostałe składniki to:
- Polimer hydrożelowy zawierający: makrogol 8000, 1,2,6-heksanotriol, 4,4’-diizocyjanian cykloheksylometanu, żelaza chlorek
- Nić poliestrowa
Jak wygląda Cervidil i co zawiera opakowanie
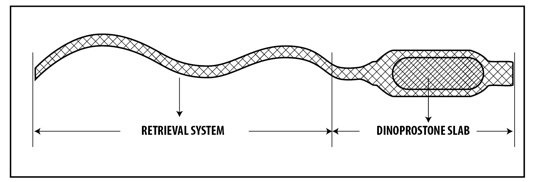
System terapeutyczny dopochwowy jest małą, prostokątną plastikową wkładką, umieszczoną w aplikatorze
z dzianiny służącym do usuwania wkładki z pochwy. Plastikowa wkładka jest hydrożelowym polimerem,
który pęcznieje w obecności wilgoci i uwalnia dinoproston. Aplikator ma długą tasiemkę, która pozwala
lekarzowi lub pielęgniarce na usunięcie wkładki z pochwy gdy zachodzi taka potrzeba.
Każdy system terapeutyczny dopochwowy jest umieszczony osobno w szczelnie zamkniętej foliowej
saszetce produkowanej z taśmy laminowanej folii aluminiowo/polietylenowej i jest zapakowany
w tekturowe pudełko.
Opakowanie zawiera 5 systemów terapeutycznych dopochwowych.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
Ferring GmbH
Wittland 11
D-24109 Kiel
Niemcy
Wytwórcy
Ferring GmbH
Wittland 11
D-24109 Kiel
Niemcy
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego i w Zjednoczonym Królestwie (Irlandii Północnej) pod następującymi nazwami:
Austria
PROPESS 10 mg vaginales Freisetzungssystem
Belgia
PROPESS 10 mg hulpmiddel voor vaginaal gebruik, PROPESS 10 mg système
de diffusion, PROPESS 10 mg vaginales Wirkstofffreisetzungssystem
Bułgaria
ПРОПЕС 10 mg вагинална лекарстводоставяща система / PROPESS 10 mg
vaginal delivery system
Chorwacja
Propess 10 mg sustav za isporuku u rodnicu
Cypr
Propess
Dania
Propess, vaginalindlæg
Estonia
Finlandia
Propess
Propess 10 mg depotlääkevalmiste, emättimeen
Francja
PROPESS 10 mg, système de diffusion vaginal
Grecja
PROPESS 10 mg σύστημα ενδοκολπικής χορήγησης
Hiszpania
PROPESS 10 mg sistema de liberación vaginal
Holandia
Propess, vaginaal toedieningssysteem 10 mg
Irlandia
Propess 10 mg vaginal delivery system
Litwa
Propess
Luksemburg
PROPESS 10 mg système de diffusion vaginal
Łotwa
Propess
Niemcy
PROPESS 10 mg vaginales Freisetzungssystem
Norwegia
Propess
Polska
Cervidil
Portugalia
PROPESS 10 mg, Sistema de libertação vaginal
Republika Czeska
CERVIDIL
Rumunia
PROPESS 10 mg/24 ore sistem cu cedare vaginală
Słowacja
Cervidil 10 mg vaginálny inzert
Słowenia
Propess 10 mg vaginalni dostavni sistem
Szwecja
Propess 10 mg vaginalinlägg
Węgry
Propess 10mg hüvelyben alkalmazott gyógyszerleadó rendszer
Wielka Brytania
(Irlandia Północna)
PROPESS 10 mg vaginal delivery system
Włochy
PROPESS 10 mg – Dispositivo vaginale
Data ostatniej aktualizacji ulotki:09/2021
--------------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
INSTRUKCJA UŻYCIA
Wprowadzanie
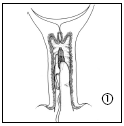
- 1. Aby wyjąć Cervidil z opakowania, najpierw należy przerwać folię wzdłuż górnej części saszetki. Nie należy używać nożyczek ani ostrych narzędzi do przecinania folii, ponieważ może to spowodować uszkodzenie produktu. Należy chwycić za aplikator, aby delikatnie wysunąć produkt z saszetki. Trzymając system terapeutyczny dopochwowy między palcem wskazującym i środkowym, wprowadzić go do pochwy. W razie potrzeby można użyć niewielkiej ilości rozpuszczalnego w wodzie środka poślizgowego.
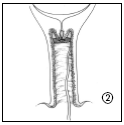
- 2. Cervidil umieszcza się poprzecznie, wysoko w tylnym sklepieniu pochwy.
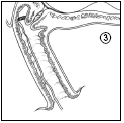
- 3. Należy pozostawić część tasiemki (około 2 cm) wystającą z pochwy, aby zapewnić łatwe usunięcie systemu terapeutycznego dopochwowego. W razie potrzeby tasiemkę można bardziej skrócić.
- 4. Należy upewnić się, że pacjentka leży lub siedzi przez 20-30 minut po wprowadzeniu wkładki, aby umożliwić jej napęcznienie.
Usuwanie
Cervidil może być szybko i z łatwością usunięty przez delikatne pociągniecie tasiemki aplikatora.
Po usunięciu należy upewnić się, że cały produkt (system terapeutyczny i aplikator) został usunięty
z pochwy.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyNie
- Producent
- ImporterFerring GmbH
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki CervidilPostać farmaceutyczna: Żel, 0,5 mg/3 gSubstancja czynna: dinoprostoneBez receptyPostać farmaceutyczna: Żel, 500 mcg/3 gSubstancja czynna: dinoprostoneBez receptyPostać farmaceutyczna: Tabletki, 25 mcgSubstancja czynna: misoprostolWymaga recepty
Odpowiedniki Cervidil w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Cervidil – Ukraina
Odpowiednik Cervidil – Hiszpania
Lekarze online w sprawie Cervidil
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Cervidil – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.