BERINERT 3000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE SUBCUTANEA

Cómo usar BERINERT 3000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE SUBCUTANEA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Berinert 3000 UI
Polvo y disolvente para solución inyectable subcutánea
Inhibidor de la C1 esterasa humano
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es Berinert y para qué se utiliza
- Qué necesita saber antes de empezar a usar Berinert
- Cómo usar Berinert
- Posibles efectos adversos
- Conservación de Berinert
- Contenido del envase e información adicional
1. Qué es Berinert y para qué se utiliza
¿Qué es Berinert?
Berinert se presenta como polvo y disolvente. La solución preparada se debe administrar mediante inyección bajo la piel.
Berinert se prepara a partir de plasma humano (la parte líquida de la sangre). El principio activo es la proteína inhibidora de la C1 esterasa humana, obtenida a partir del plasma.
¿Para qué se utiliza Berinert?
Berinert se utiliza para la prevención de los ataques recurrentes de angioedema hereditario (AEH) en pacientes adolescentes y adultos. El angioedema hereditario es una enfermedad congénita del sistema vascular. No es una enfermedad alérgica. El AEH está causado por una síntesis insuficiente, ausente o defectuosa del inhibidor de la C1 esterasa, que es una proteína importante. La enfermedad se caracteriza por los síntomas siguientes:
- hinchazón repentina de manos y pies,
- hinchazón repentina de la cara con sensación de tirantez,
- hinchazón de los párpados, labios, posible hinchazón de la laringe (órgano de la voz) con dificultades respiratorias,
- hinchazón de la lengua,
- dolor de tipo cólico en la región abdominal.
Generalmente, todas las partes del cuerpo pueden verse afectadas.
2. Qué necesita saber antes de empezar a usar Berinert
Las secciones siguientes contienen información que su médico debería tener en consideración antes de administrarle Berinert.
No use Berinert:
- Si ha experimentado reacciones de hipersensibilidad inmediata de riesgo vital, incluida anafilaxia, a la proteína inhibidor de la C1 esterasa o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Informe a su médico o farmacéutico si usted es alérgico a algún medicamento o a algún alimento.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Berinert,
- si ocurren reacciones alérgicas o anafilácticas graves (reacción alérgica grave que produce graves dificultades respiratorias o mareos). La administración de Berinert debe interrumpirse inmediatamente (por ejemplo, interrumpiendo la inyección).
- Si presenta un historial de problemas de coagulación de la sangre. Han aparecido coágulos sanguíneos en pacientes tratados con Berinert por vía intravenosa. El uso de Berinert a dosis muy alta en enfermedades distintas al AEH podrían aumentar el riesgo de coágulos de sangre. Sin embargo, en el caso de Berinert por vía subcutánea no existe una relación establecida con coágulos de sangre a la dosis que se recomienda que prescriba su médico. Consulte con su médico si presenta un historial de enfermedad cardíaca o de los vasos sanguíneos, infarto, coágulos sanguíneos o sangre espesa, un catéter permanente/dispositivo de acceso en una de sus venas o ha estado inmovilizado durante algún tiempo. Estas situaciones pueden aumentar el riesgo de presentar un coágulo tras el uso de Berinert. Informe también a su médico sobre los medicamentos que está utilizando ya que algunos medicamentos, como los anticonceptivos o ciertos andrógenos, pueden aumentar el riesgo de desarrollar un coágulo sanguíneo.
Su médico sopesará minuciosamente el beneficio del tratamiento con Berinert comparando con el riesgo de padecer estas complicaciones.
Seguridad vírica
Cuando se administran medicamentos derivados de la sangre o plasma humanos, hay que llevar a cabo ciertas medidas para evitar que las infecciones pasen a los pacientes. Tales medidas incluyen:
- cuidadosa selección de los donantes de sangre y plasma para excluir a aquellos que están en riesgo de ser portadores de enfermedades infecciosas, y
- análisis de marcadores específicos de virus e infecciones en las donaciones individuales y en las mezclas de plasma.
Los fabricantes de estos productos también incluyen etapas en el procesado de la sangre o plasma para eliminar/inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus emergentes o de naturaleza desconocida u otro tipo de infecciones.
Las medidas aplicadas se consideran eficaces para los virus envueltos tales como el virus de inmunodeficiencia humano (VIH, el virus del SIDA), el virus de la hepatitis B, el virus de la hepatitis C (inflamación del hígado) y para virus no envueltos como el virus de la hepatitis A (inflamación del hígado) y el parvovirus B19.
Es posible que su médico le recomiende la vacunación contra la hepatitis A y B si usted se trata periódicamente/repetidamente con medicamentos derivados del plasma humano.
Se recomienda encarecidamente que cada vez que se administre Berinert, se registre la fecha de administración, el número de lote y el volumen inyectado.
Uso de Berinert con otros medicamentos
- Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento, incluso los medicamentos sin receta.
- Berinert no se debe mezclar con otros medicamentos y diluyentes en la misma jeringa.
Embarazo y lactancia
- Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Berinert no afecta a su capacidad de conducir y de usar máquinas.
Berinert contiene sodio
Este medicamento contiene 29 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada vial. Esto equivale al 1,5% de la ingesta diaria máxima de sodio recomendada para un adulto.
3. Cómo usar Berinert
Berinert está indicado para la auto-administración mediante inyección subcutánea. Usted o su cuidador/a debe formarse, tanto como sea necesario, sobre el modo de administrar Berinert.
Posología
La dosis recomendada de Berinert es de 60 UI/kg de peso.
Población pediátrica
La dosis recomendada es la misma que en adultos.
Si usa más Berinert del que debe
No se han descrito casos de sobredosis.
Reconstitución y forma de administración
Si su médico decide que usted puede tratarse en casa, éste le dará instrucciones detalladas. Se le entregará un diario donde anotará cada inyección administrada en casa, que lo llevará consigo cada vez que visite al médico. Se revisará regularmente a usted o a su cuidador cómo administran las inyecciones para asegurar que lo hacen correctamente a lo largo del tiempo.
Instrucciones generales
- El polvo debe disolverse y extraerse del vial bajo condiciones asépticas. Utilice la jeringa proporcionada con el producto.
- La solución preparada debe ser transparente y clara a ligeramente opalescente. Después de filtrar o trasvasar la solución (consulte más adelante), se debe comprobar visualmente que la solución no contenga partículas ni presente decoloración antes de administrarla.
- No use la solución si está visiblemente turbia o si contiene partículas o residuos.
- Cualquier cantidad del medicamento que no se haya usado o cualquier material residual debe eliminarse de acuerdo con la normativa local y siguiendo las instrucciones de su médico.
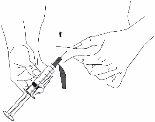
Reconstitución
Antes de abrir cualquier vial, atempere el polvo Berinert y el disolvente hasta que estén a temperatura ambiente. Para conseguirlo, puede dejar los viales a temperatura ambiente durante aproximadamente una hora o bien puede tenerlos en las manos cerradas durante unos minutos. NO exponga los viales al calor directo. Los viales no se deben calentar a una temperatura superior a la del cuerpo (37 °C).
Retire con cuidado las cápsulas protectoras del vial del disolvente y del vial con el polvo. Limpie los tapones de goma expuestos de ambos viales con una toallita impregnada en alcohol y déjelos secar. Ahora puede transferir el disolvente al vial del polvo con el sistema de administración incluido (Mix2Vial). Por favor, siga las instrucciones siguientes:
|
|
|
|
|
|
|
|
|
Deseche el vial del disolvente con el adaptador azul del Mix2Vial acoplado. |
|
|
|
|
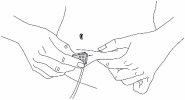
Trasvase y administración
8 |
|
9 |
|
Administración
Auto-administración (administración subcutánea)
Su médico le enseñará como administrar Berinert de forma segura. Una vez ya sepa como auto-administrarse el medicamento, siga las instrucciones que se proporcionan a continuación.
Tabla 2. Instrucciones para la auto-administración de Berinert
Paso 1: Acople los accesorios Tome la jeringa Berinert, los siguientes accesorios desechables, y otros artículos (agujas u otros envases, diario de tratamiento o libro de registro):
| |
Paso 2: Limpie la superficie
| |
Paso 3: Lávese las manos
| |
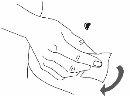
Paso 4: Prepare el punto de inyección
|
Figura 1
Figura 2 |
Paso 5: Inyección en la zona abdominal Conforme le indique su profesional sanitario:
Inyección con aguja hipodérmica:
Inyección con equipo de perfusión subcutánea:
|
Figura 3 |
Figura 4 | |
Paso 6: Limpiar
| |
Paso 7: Registre el tratamiento
|
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Póngase inmediatamente en contacto con su médico
- si se produce cualquier efecto adverso o
- si advierte cualquier efecto adverso no mencionado en este prospecto.
Los efectos adversos con Berinert son raros.
Los siguientes efectos adversos se han observado muy frecuentemente (pueden afectar a más de 1 de cada 10 personas):
- Reacciones en el lugar donde se administró la inyección (cardenales, sensación de frío, supuración, eritema, hematoma, hemorragia, endurecimiento, edema, dolor, prurito, sarpullido, cicatriz, hinchazón, urticaria, calor).
- Nasofaringitis (nariz congestionada, estornudos, ojos llorosos).
Los efectos adversos siguientes se han observado frecuentemente (pueden afectar hasta 1 de cada 10 personas):
- Reacciones de hipersensibilidad o alérgicas (como por ejemplo hipersensibilidad, prurito, sarpullido y urticaria)
- Mareos
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Berinert
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en el envase de cartón después de EXP.
- No conservar a temperatura superior a 30 °C.
- No congelar.
- Conservar el vial en el embalaje exterior para protegerlo de la luz.
- Berinert no contiene conservantes, de modo que es preferible que la solución preparada se utilice inmediatamente.
- Si la solución preparada no se administra inmediatamente, se deberá utilizar en el plazo de 8 horas y sólo se debe conservar en el vial.
6. Contenido del envase e información adicional
Composición de Berinert
El principio activo es:
Inhibidor de la C1 esterasa humano (3.000 UI/vial; después de la reconstitución con 5,6 ml de agua para preparaciones inyectables 500 UI/ml).
Para más información ver la sección “Estainformación está destinada únicamente a profesionales del sector sanitario”.
Los demás componentes son:
Glicina, cloruro sódico, citrato sódico.
Disolvente:agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Berinert se presenta como un polvo blanco y se suministra con agua para preparaciones inyectables como disolvente.
La solución preparada debe ser transparente y clara a ligeramente opalescente.
Presentación
Un envase contiene:
1 vial con polvo
1 vial con 5,6 ml de agua para preparaciones inyectables
1 trasvasador con filtro 20/20
Equipo de administración (caja interior):
1 jeringa de 10 ml desechable
1 aguja hipodérmica
1 equipo para inyección subcutánea (mariposa)
2 toallitas con alcohol
1 apósito
Envase múltiple de 5 x 3.000 UI, incluyendo una caja con 5 equipos de administración.
Envase múltiple de 20 x 3.000 UI, incluyendo 4 cajas con 5 equipos de administración.
Puede que solamente estén comercializados algunos tamaños de envase.
Titular de la autorización de comercialización y responsable de la fabricación
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg
Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
CSL Behring S.A.
c/ Tarragona 157, planta 18
08014 Barcelona
España
Este medicamento está autorizado en los estados miembros del Espacio EconómicoEuropeoy en el Reino Unido (Irlanda del Norte)con los siguientes nombres:
Berinert 3000 I.E. Pulver und
Lösungsmittel zur Herstellung einer
Injektionslösung Austria
Berinert 3000 IE, poeder en oplosmiddel
voor oplossing voor injectie Bélgica, Países Bajos
Berinert 3000 Chipre, Alemania, Grecia, Polonia, Portugal
???????? 3000, ???? ? ???????????
?? ??????????? ???????
C1- ????????? ?????????, ??????? Bulgaria
Berinert 3000 IU República Checa, Eslovaquia
Berinert 3000 IU prašak i otapalo za otopinu
za injekciju _______________________________ Croacia
Berinert Dinamarca, Italia
Berinert SC Estonia
Berinert 3000 IU, injektiokuiva-aine
ja liuotin, liuosta varten Finlandia
Berinert 3000 UI, poudre et solvant pour
solution injectable Francia, Luxemburgo
Berinert 3000 NE por és oldószer
oldatos injekcióhoz Hungría
Berinert 3000 a.e. stungulyfsstofn
og leysir, lausn Islandia
Human C1-esterase inhibitor CSL Behring
3000 TV milteliai ir tirpiklis injekciniam
tirpalui Lituania
Berinert 3000 IU pulver og væske til
injeksjonsvæske, oppløsning Noruega
Berinert 3000 3000 UI, pulbere si
solvent pentru solutie injectabila Rumanía
Berinert 3000 i.e. prašek in vehikel za
raztopino za injiciranje Eslovenia
Berinert 3000 UI polvo y disolvente
para solución inyectable subcutánea España
Berinert 3000 IE, pulver och vätska till
injektionsvätska, lösning Suecia
Berinert 3000 IU Powder and solvent
for solution for injection _____________________ Reino Unido, Malta, Irlanda
Fecha de la última revisión de este prospecto:Octubre 2021
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
Estainformación está destinada únicamente a profesionales del sector sanitario
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
La potencia del inhibidor de la C1 esterasa humano se expresa en Unidades Internacionales (UI), que está relacionado con el actual estándar de la OMS para los productos inhibidores de la C1 esterasa.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a BERINERT 3000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE SUBCUTANEAForma farmacéutica: INYECTABLE, 1500 UIPrincipio activo: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequiere recetaForma farmacéutica: INYECTABLE, 2000 IUPrincipio activo: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequiere recetaForma farmacéutica: INYECTABLE, 500 UPrincipio activo: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequiere receta
Médicos online para BERINERT 3000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE SUBCUTANEA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de BERINERT 3000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE SUBCUTANEA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes




 1
1 2
2 3
3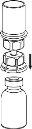 4
4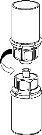 5
5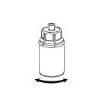 6
6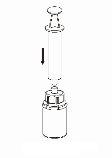 7
7