
Тіцагрелор Голстен

Запитайте лікаря про рецепт на Тіцагрелор Голстен

Інструкція із застосування Тіцагрелор Голстен
ХАРАКТЕРИСТИКА ЛІКАРСЬКОГО ЗАСОБУ
1. НАЗВА ЛІКАРСЬКОГО ЗАСОБУ
Тикагрелор Голстен, 60 мг, покриті таблетки
2. ЯКІСНА І КІЛЬКІСНА СКЛАД
Кожна покрита таблетка містить 60 мг тикагрелору.
Повний перелік допоміжних речовин див. пункт 6.1.
3. ФАРМАЦЕВТИЧНА ФОРМА
Покрита таблетка.
Кругла (8,1 x 8,1 мм), двосторонньо опукла, рожеві таблетки з позначенням номером «60» з одного боку та гладенькі з іншого боку.
4. ПОДРОБНІ КЛІНІЧНІ ДАНІ
4.1 Показання до застосування
Лікарський засіб Тикагрелор Голстен у комбінації з ацетилсаліциловою кислотою (ASA) показаний для профілактики серцево-судинних подій у дорослих пацієнтів:
- із гострим коронарним синдромом (ГКС) або
- із інфарктом міокарда в анамнезі та високим ризиком серцево-судинних подій (див. пункти 4.2 та 5.1).
4.2 Дозування і спосіб застосування
Дозування
Пацієнти, які приймають лікарський засіб Тикагрелор Голстен, повинні щоденно приймати також низьку підтримуючу дозу ацетилсаліцилової кислоти (ASA) 75-150 мг, якщо це не є індивідуально протипоказано.
Гострі коронарні синдроми
Застосування лікарського засобу Тикагрелор Голстен повинно розпочинатися з одноразової навантажувальної дози 180 мг (2 таблетки по 90 мг) та продовжуватися лікуванням дозою 90 мг двічі на добу.
У пацієнтів з ГКС тривалість лікування лікарським засобом Тикагрелор Голстен 90 мг двічі на добу повинна становити 12 місяців, якщо немає клінічних показань для припинення лікування (див. пункт 5.1).
Відміна ASA можна розглядати після 3 місяців у пацієнтів з ГКС, які пройшли процедуру перкутанної коронарної інтервенції (PCI), та у яких є підвищений ризик кровотечі. У такому випадку введення тикагрелору як єдиного антиплательного засобу повинно продовжуватися протягом 9 місяців (див. пункт 4.4).
Інфаркт міокарда в анамнезі
Рекомендованою дозою лікарського засобу Тикагрелор Голстен є 60 мг двічі на добу, якщо необхідне тривале лікування пацієнтів з інфарктом міокарда в анамнезі та високим ризиком серцево-судинних подій (див. пункт 5.1). Лікування можна розпочинати без перерви як продовження початкового річного лікування лікарським засобом Тикагрелор Голстен 90 мг або іншим інгібітором рецепторів дифосфату аденозину (ADP) у пацієнтів з ГКС та високим ризиком серцево-судинних подій. Лікування можна також розпочинати до 2 років після інфаркту міокарда або протягом року після припинення лікування попереднім інгібітором рецептора ADP. Дані щодо ефективності та безпеки застосування тикагрелору понад 3 роки тривалого лікування обмежені.
Якщо необхідна зміна лікарського засобу, першу дозу лікарського засобу Тикагрелор Голстен слід призначити через 24 години після останньої дози іншого антиплательного засобу.
Пропуск дози
Також слід уникати помилок у дозуванні. У разі пропуску дози лікарського засобу Тикагрелор Голстен пацієнт повинен прийняти тільки одну таблетку (наступну дозу) згідно з прийнятим схемою дозування.
Особливі групи пацієнтів
Пацієнти похилого віку
У пацієнтів похилого віку не потрібно коригування дози (див. пункт 5.2).
Забурення функції нирок
Коригування дози не потрібно у пацієнтів із забуреннями функції нирок (див. пункт 5.2).
Забурення функції печінки
Не проводилися дослідження щодо застосування тикагрелору у пацієнтів із важкими забуреннями функції печінки, і тому його застосування у цих пацієнтів є протипоказаним (див. пункти 4.2, 4.4 та 5.2). Доступні лише обмежені дані щодо застосування лікарського засобу у пацієнтів із помірними забуреннями функції печінки. Коригування дози не потрібно, однак тикагрелор слід застосовувати з обережністю (див. пункти 4.4 та 5.2). У пацієнтів із легкими забуреннями функції печінки коригування дози не потрібно (див. пункт 5.2).
Діти та підлітки
Не встановлено безпеки та ефективності застосування тикагрелору у дітей віком до 18 років.
Застосування тикагрелору у дітей не є доречним у показанні серпоподібноклітинна анемія (див. пункти 5.1 та 5.2).
Способу застосування
Перорально.
Тикагрелор Голстен можна застосовувати під час прийому їжі або незалежно від прийому їжі.
У разі якщо пацієнти мають труднощі з ковтанням таблетки/таблеток ціліми, таблетки можна подрібнити на дрібний порошок, змішати з півсклянкою води та негайно випити. Склянку слід потім промити водою (наступна півсклянка води) та знову випити вміст.
Змішану з водою подрібнену таблетку (або таблетки) також можна вводити через назогастральний зонд (CH8 або більший). Важливо, щоб після введення суміші промити назогастральний зонд водою (півсклянка: мінімум 50 мл до максимально 125 мл).
4.3 Протипоказання
- Гіперчутливість до активної речовини або до якоїсь допоміжної речовини, переліченої в пункті 6.1 (див. пункт 4.8).
- 6.1 (див. пункт 4.8).
- Активне патологічне кровотеча.
- Кровотеча в анамнезі (див. пункт 4.8).
- Важке порушення функції печінки (див. пункти 4.2, 4.4 та 5.2).
- Одночасне застосування тикагрелору та сильних інгібіторів ферменту CYP3A4 (наприклад, кетоконазол, кларитроміцин, нефазодон, ритонавір та атаzanавір), оскільки це може привести до суттєвого збільшення експозиції до тикагрелору (див. пункт 4.5).
4.4 Спеціальні попередження та обережність при застосуванні
Ризик кровотечі
У пацієнтів, у яких встановлено підвищений ризик кровотечі, слід розглянути співвідношення ризиків та вигод від профілактики серцево-судинних подій (див. пункти 4.8 та 5.1). У разі наявності клінічних показань для застосування тикагрелору слід застосовувати його з обережністю у наступних груп пацієнтів:
- Пацієнти зі схильністю до кровотечі (наприклад, через недавні травми, хірургічні операції, порушення згортання крові, активні або недавні кровотечі з травної системи) або у яких є підвищений ризик травми. Застосування тикагрелору є протипоказаним у пацієнтів з активним патологічним кровотечею, у пацієнтів з кровотечею в анамнезі та у пацієнтів з важким порушенням функції печінки (див. пункт 4.3).
- Пацієнти, які одночасно приймають лікарські засоби, які можуть збільшити ризик кровотечі (наприклад, нестероїдні протизапальні засоби (НПЗ), пероральні антикоагулянти та (або) фібринолітичні засоби), які застосовуються протягом 24 годин до прийому дози тикагрелору.
У двох рандомізованих дослідженнях з контрольною групою (TICO та TWILIGHT) з участю пацієнтів з ГКС, яким проводили процедуру PCI з використанням стента, який виділяє лікарський засіб, було показано, що відміна ASA після 3 місяців дволікової антиплательної терапії тикагрелором та ASA, а потім продовження лікування тикагрелором як єдиним антиплательним засобом протягом 9 та 12 місяців зменшувало ризик кровотечі та не призводило до збільшення спостережуваного ризику важких непожаданих серцево-судинних подій (MACE) порівняно з продовженням дволікової антиплательної терапії. Рішення про відміну ASA після 3 місяців та продовження введення тикагрелору як єдиного антиплательного засобу протягом 9 місяців у пацієнтів із підвищеним ризиком кровотечі повинно прийматися на основі клінічної оцінки, враховуючи ризик кровотечі щодо ризику тромботичних подій (див. пункт 4.2).
Переливання тромбоцитів не призводило до зворотного дії антиплательного ефекту тикагрелору у здорових добровольців і малоймовірно, щоб було клінічно корисним у пацієнтів з кровотечами.
Оскільки застосування десмопресину разом з тикагрелором не скорочує стандартний час кровотечі, сумнівно, щоб десмопресин був ефективним у лікуванні клінічних випадків кровотечі (див. пункт 4.5).
Антифібринолітична терапія (амінокапронова кислота або транексамова кислота) та (або) лікування рекомбінантним фактором VIIа можуть збільшувати гемостаз. Тикагрелор можна знову застосувати, якщо причину кровотечі було визначено та усунуто.
Хірургічні операції
Пацієнтів слід інструктувати, щоб вони повідомляли лікарів та стоматологів про застосування тикагрелору перед планованими хірургічними операціями та застосуванням будь-яких нових лікарських засобів.
У пацієнтів, які брали участь у дослідженні PLATO та яким проводили коронарне шунтування, у групі, яка приймала тикагрелор, спостерігалося більше кровотеч than у групі, яка приймала клопідогрел, якщо застосування лікарського засобу було припинено за один день до операції, але якщо застосування лікарського засобу було припинено за два або більше днів до операції, кількість важких кровотеч була подібною в обидвох групах (див. пункт 4.8). Якщо пацієнту необхідно проводити плановану хірургічну операцію та антиплательна дія не є бажаною, тикагрелор слід припинити за 5 днів до операції (див. пункт 5.1).
Пацієнти після інфаркту міокарда
Пацієнти з ГКС після інфаркту міокарда можуть бути ліковані тикагрелором протягом максимум 12 місяців (дослідження PLATO).
До дослідження PEGASUS не включалися пацієнти з інфарктом міокарда в анамнезі та з інсультом в анамнезі. Тому, через відсутність даних, не рекомендується лікування цих пацієнтів триваліше ніж рік.
Порушення функції печінки
Застосування тикагрелору у пацієнтів з важкими порушеннями функції печінки є протипоказаним (див. пункти 4.2 та 4.3). Існують лише обмежені дані щодо застосування тикагрелору у пацієнтів з помірною недостатністю печінки, тому рекомендується застосування з обережністю у цих пацієнтів (див. пункти 4.2 та 5.2).
Пацієнти з ризиком розвитку подій брадикардії
Моніторинг параметрів ЕКГ у дослідженні Holter показав збільшення частоти безсимптомних коморних пауз під час лікування тикагрелором порівняно з клопідогрелом. Пацієнти з підвищеним ризиком подій брадикардії (наприклад, пацієнти без кардіостимулятора з синдромом хворого синусного вузла, з блоком AV II або III ступеня, або у яких спостерігаються синкопи, пов'язані з брадикардією) були виключені з основних досліджень, які оцінювали безпеку та ефективність застосування тикагрелору. Тому, через обмежений клінічний досвід, тикагрелор повинен бути застосований у цій групі пацієнтів з обережністю (див. пункт 5.1).
Крім того, слід бути обережним при одночасному застосуванні тикагрелору з лікарськими засобами, які викликають брадикардію. Однак не було виявлено доказів клінічно значимих непожаданих дій, спостережуваних у дослідженні PLATO після одночасного застосування з одним або більше лікарськими засобами, які викликають брадикардію (тобто 96% бета-адреноблокаторів, 33% антагоністів кальцію дилтіазем та верапаміл, а також 4% дигоксину) (див. пункт 4.5).
У дослідженні PLATO у підгрупі, яка пройшла дослідження Holter, у пацієнтів, які приймали тикагрелор, частіше, ніж у пацієнтів, які приймали клопідогрел, спостерігалися коморні паузи >3 секунди під час гострого періоду ГКС. Збільшення кількості виявлених за допомогою дослідження Holter коморних пауз під час лікування тикагрелором було більш вираженим у пацієнтів з хронічною серцевою недостатністю, ніж у загальній популяції під час гострого періоду ГКС, але не під час одного місяця лікування тикагрелором, а також не порівняно з клопідогрелом.
Не було виявлено жодних непожаданих клінічних наслідків, пов'язаних з цією диспропорцією (у тому числі синкопи або імплантація кардіостимулятора) у цій групі пацієнтів (див. пункт 5.1).
Після введення лікарського засобу на ринок у пацієнтів, які приймали тикагрелор, повідомлялося про випадки брадикардії та блоків AV (див. пункт 4.8), в основному у пацієнтів з ГКС, де ішемія міокарда та одночасне застосування лікарських засобів, які знижують частоту серцевих скорочень або впливають на проведення в серці, є потенційними факторами, які порушують.
Перед коригуванням лікування слід оцінити клінічний стан пацієнта та одночасне застосування лікарських засобів як потенційні причини.
Дихальна недостатність
Пацієнти, які лікувалися тикагрелором, повідомляли про розвиток дихальної недостатності. Дихальна недостатність зазвичай є легкою до помірної та часто проходить без необхідності припинення лікарського засобу. У пацієнтів з бронхіальною астмою/хронічною обструктивною хворобою легень (ХОЗЛ) може спостерігатися збільшення абсолютного ризику дихальної недостатності під час застосування тикагрелору. Тикагрелор слід застосовувати з обережністю у пацієнтів з бронхіальною астмою та (або) ХОЗЛ в анамнезі. Механізм розвитку дихальної недостатності не встановлено. Якщо пацієнт повідомляє про нові випадки дихальної недостатності, тривалість їх збільшення або погіршення симптомів дихальної недостатності під час лікування тикагрелором, слід провести повне діагностичне обстеження, а якщо пацієнт погано переносить цей стан, слід припинити лікування тикагрелором. Більш детальну інформацію див. у пункті 4.8.
Центральна апное під час сну
Після введення лікарського засобу на ринок у пацієнтів, які приймали тикагрелор, повідомлялося про випадки центральної апное під час сну, включаючи дихання Чейна-Стокса. Якщо підозрюється розвиток центральної апное під час сну, слід розглянути питання про подальше клінічне обстеження.
Збільшення рівня креатиніну
Під час лікування тикагрелором може спостерігатися збільшення рівня креатиніну. Механізм цього явища не встановлено.
Слід проводити контрольні дослідження функції нирок згідно з прийнятою клінічною практикою. У пацієнтів з ГКС рекомендується контролювати функцію нирок також через місяць після початку лікування тикагрелором, з особливою увагою до пацієнтів віком ≥75 років, пацієнтів з помірними до важких порушеннями функції нирок та тих, хто одночасно приймає лікарські засоби групи антагоністів рецептора ангіотензину (анг. angiotensin receptor blocker, ARB).
Збільшення рівня сечовини
Під час лікування тикагрелором може розвинутися гіперурікемія (див. пункт 4.8). Слід бути обережним у разі пацієнтів з гіперурікемією або подагрою в анамнезі.
Як заходи обережності, не рекомендується застосування тикагрелору у пацієнтів з нефропатією сечовини.
Тромботична тромбоцитопенічна пурпура (анг. thrombotic thrombocytopenic purpura,TTP)
Під час лікування тикагрелором дуже рідко повідомлялося про випадки тромботичної тромбоцитопенічної пурпури (TTP).
Характеризується вона тромбоцитопенією та мікроангіопатичною гемолітичною анемією, пов'язаною з неврологічними симптомами, порушеннями функції нирок або гарячкою. TTP є потенційно смертельним захворюванням, яке вимагає швидкого лікування, включаючи плазмаферез.
Порушення тестів функції тромбоцитів, які проводяться для діагностики тромбоцитопенії, індукованої гепарином (анг. heparin induced thrombocytopenia, HIT)
У функціональному тесті активації тромбоцитів, індукованої гепарином (анг. heparin induced platelet activation,
HIPA), який застосовується для діагностики HIT, антитіла до комплексу фактору тромбоцитів 4/гепарин у сироватці пацієнта активують тромбоцити здорових донорів у присутності гепарину.
У пацієнтів, які приймають тикагрелор, повідомлялося про хибно негативні результати функціональних тестів тромбоцитів (у тому числі тесту HIPA), які проводяться для діагностики HIT. Це пов'язано з інгібуванням рецептора P2Y12 на здорових тромбоцитах донора тикагрелором, який присутній у сироватці/плазмі пацієнта. Інформація про одночасне лікування тикагрелором необхідна для інтерпретації результатів функціональних тестів тромбоцитів, які проводяться для діагностики HIT.
У пацієнтів, у яких розвинулася тромбоцитопенія, індукована гепарином, слід оцінити співвідношення вигод та ризиків подальшого лікування тикагрелором, враховуючи як про-закризовий стан HIT, так і підвищений ризик кровотечі під час одночасного лікування антикоагулянтом та тикагрелором.
Інше
На підставі спостережуваної у дослідженні PLATO залежності між підтримуючою дозою ацетилсаліцилової кислоти та відносною ефективністю тикагрелору порівняно з клопідогрелом, не рекомендується одночасне застосування тикагрелору та ацетилсаліцилової кислоти у високих підтримуючих дозах (>300 мг) (див. пункт 5.1).
Передчасне припинення лікування
Передчасне припинення будь-якого антиплательного лікування, включаючи лікарський засіб Тикагрелор Голстен, може привести до підвищеного ризику смерті з серцево-судинних причин, інфаркту міокарда або інсульту, викликаного основним захворюванням. Тому слід уникати передчасного припинення лікування.
Натрій
Тикагрелор Голстен містить менше 1 ммоль натрію (23 мг) на одну дозу, тобто є суттєво «вільним від натрію».
4.5 Взаємодія з іншими лікарськими засобами та інші види взаємодій
Тикагрелор є в основному субстратом ізоензиму CYP3A4, а також його легким інгібітором.
Тикагрелор також є субстратом глікопротеїну P (P-gp) і слабким інгібітором P-gp і може збільшувати експозицію до субстратів P-gp.
Вплив лікарських засобів та інших речовин на дію тикагрелору
Інгібітори CYP3A4
- Сильні інгібітори CYP3A4 - одночасне застосування кетоконазолу з тикагрелором призвело до 2,4-кратного збільшення C та 7,3-кратного збільшення AUC тикагрелору. C та AUC активного метаболіту було зменшено відповідно на 89% та 56%. Передбачається, що інші сильні інгібітори CYP3A4 (кларитроміцин, нефазодон, ритонавір, атаzanавір) викликають подібну дію та тому одночасне застосування сильних інгібіторів CYP3A4 з тикагрелором є протипоказаним (див. пункт 4.3).
- Помірні інгібітори CYP3A4 - одночасне застосування дилтіазему та тикагрелору призвело до збільшення C тикагрелору на 69%, а AUC - у 2,7 раза, а також зменшення C активного метаболіту на 38%, без впливу на його AUC. Тикагрелор не вплинув на концентрацію дилтіазему в плазмі. Інші помірні інгібітори CYP3A4 (наприклад, ампернавір, апрепітант, еритроміцин та флуконазол) можуть мати подібну дію та також можуть бути застосовані одночасно з тикагрелором.
- Спостерігалося 2-кратне збільшення експозиції до тикагрелору після щоденного вживання великих кількостей соку грейпфруту (3 x 200 мл). Не слід очікувати, щоб ця величина збільшення експозиції до тикагрелору була клінічно значимою у більшості пацієнтів.
Індуцтори CYP3A
Одночасне застосування рифампіцину та тикагрелору знизило C та AUC тикагрелору відповідно на 73% та 86%. C активного метаболіту не змінилося, а його AUC знизилося на 46%. Передбачається, що інші індуцтори CYP3A (наприклад, фенітоїн, карбамазепін та фенобарбітал) також знижують експозицію до тикагрелору.
Одночасне застосування тикагрелору та сильних індуktorів CYP3A може знижувати концентрацію та ефективність тикагрелору, тому одночасне застосування їх з тикагрелором не рекомендується.
Циклоспорин (інгібітор P-gp та CYP3A)
Одночасне застосування циклоспорину (600 мг) та тикагрелору підвищило у 2,3 раза C тикагрелору, а AUC - у 2,8 раза. У присутності циклоспорину AUC активного метаболіту тикагрелору збільшився на 32%, а C зменшився на 15%.
Відсутні дані щодо одночасного застосування тикагрелору та інших активних речовин, які є сильними інгібіторами глікопротеїну P (P-gp) та помірними інгібіторами CYP3A4 (наприклад, верапаміл, хінідин), які можуть збільшувати експозицію до тикагрелору. Якщо не можна уникнути комбінованої терапії, їх одночасне застосування вимагає обережності.
Інше
Клінічні дослідження взаємодій показали, що одночасне застосування тикагрелору з гепарином, еноксапарином та ацетилсаліциловою кислотою або десмопресином не впливало на фармакокінетику тикагрелору або його активного метаболіту або індуковану ADP агрегацію тромбоцитів порівняно з застосуванням самого тикагрелору. Якщо це клінічно показано, лікарські засоби, які змінюють гемостаз, повинні бути застосовані з обережністю в комбінації з тикагрелором.
У пацієнтів з ACS, які лікувалися морфіном, спостерігалося запізнення та зниження експозиції до пероральних інгібіторів P2Y , включаючи тикагрелор та його активний метаболіт (зниження експозиції до тикагрелору на 35%). Ця взаємодія може бути пов'язана зі зниженням моторики шлунково-кишкового тракту та стосується також інших опіоїдів. Клінічне значення цього невідоме, але дані свідчать про можливе зниження ефективності тикагрелору у пацієнтів, які одночасно приймають тикагрелор та морфін.
У пацієнтів з ACS, у яких не можна припинити застосування морфіну, а швидке інгібування P2Y вважається критично важливим, можна розглянути застосування позащелепного інгібітора P2Y .
Вплив тикагрелору на дію інших лікарських засобів
Лікарські засоби, метаболізовані ферментом CYP3A4
- Сімвастатин - одночасне застосування тикагрелору з сімвастатином призвело до збільшення C сімвастатину на 81% та AUC на 56%, а також збільшення C кислоти сімвастатину на 64% та його AUC на 52% з окремими випадками збільшення у 2-3 раза. Одночасне застосування тикагрелору та сімвастатину у дозі більше 40 мг на добу могло привести до розвитку побічних дій сімвастатину, тому це слід враховувати при оцінці потенційних вигод цієї комбінації. Не спостерігалося впливу сімвастатину на концентрацію тикагрелору в плазмі. Тикагрелор може мати подібний вплив на застосування ловастатину. Не рекомендується одночасне застосування тикагрелору з сімвастатином або ловастатином у дозах більше 40 мг.
- Аторвастатин - одночасне застосування аторвастатину та тикагрелору призвело до збільшення C та AUC кислоти аторвастатину відповідно на 23% та 36%. Подібне збільшення AUC та C спостерігалося для всіх метаболітів кислоти аторвастатину. Передбачається, що це не є клінічно значимим.
- Не можна виключити подібний вплив на інші статини, метаболізовані ферментом CYP3A4. У дослідженні PLATO пацієнти приймали різні статини, та у 93% пацієнтів, які брали участь у цьому дослідженні, не було зауважено жодних проблем з безпекою, пов'язаних з застосуванням статинів.
Тикагрелор є помірним інгібітором CYP3A4. Не рекомендується одночасне застосування тикагрелору та субстратів CYP3A4 з вузьким терапевтичним індексом (тобто цизаприд та алкалоїди жаб'ячої шкіри), оскільки тикагрелор може збільшувати експозицію до цих лікарських засобів.
Субстрати P-gp (у тому числі дигоксин, циклоспорин)
Одночасне застосування тикагрелору збільшувало C та AUC дигоксину відповідно на 75% та 28%. Середні мінімальні концентрації дигоксину збільшувалися приблизно на 30% після одночасного застосування з тикагрелором, при цьому окремі максимальні концентрації збільшувалися до 2-кратного. Присутність дигоксину не впливала на C та AUC тикагрелору та його активного метаболіту. Тому рекомендується відповідний клінічний контроль та (або) моніторинг лабораторних параметрів під час одночасного застосування лікарських засобів з вузьким терапевтичним індексом, залежних від P-gp, таких як дигоксин та тикагрелор.
Тикагрелор не впливав на концентрацію циклоспорину в крові. Не вивчалося вплив тикагрелору на інші субстрати P-gp.
Лікарські засоби, метаболізовані ферментом CYP2C9
Одночасне застосування тикагрелору та толбутаміду не призвело до зміни концентрації жодного з цих лікарських засобів в плазмі, що свідчить про те, що тикагрелор не є інгібітором CYP2C9, та малоймовірно, щоб він змінював метаболізм лікарських засобів, таких як варфарин або толбутамід, за допомогою CYP2C9.
Росувастатин
Тикагрелор може впливати на виділення росувастатину через нирки, збільшуючи ризик його накопичення. Хоча правильний механізм невідомий, у деяких випадках одночасне застосування тикагрелору та росувастатину призводило до погіршення функції нирок, збільшення активності CPK (фосфокреатинкіназа) та рабдоміолізу.
Пероральні контрацептиви
Одночасне застосування тикагрелору та левоноргестрелу та етинилоестрадилу призвело до приблизно 20% збільшення експозиції до етинилоестрадилу, але не впливало на фармакокінетику левоноргестрелу. Не передбачається клінічно значимого впливу на ефективність пероральних контрацептивів у разі одночасного застосування левоноргестрелу та етинилоестрадилу з тикагрелором.
Лікарські засоби, які викликають брадикардію
У зв'язку зі спостережуваними під час застосування селективних інгібіторів зворотного захоплення серотоніну (анг. selective serotonin reuptake inhibitors, SSRIs) (тобто пароксетину, сертраліну та циталопраму) неправидłових кровотеч з шкіри слід бути обережним у разі застосування SSRIs разом з тикагрелором, оскільки це може збільшити ризик кровотечі.
4.6 Вплив на фертильність, вагітність та лактацію
Жінки репродуктивного віку
Жінки репродуктивного віку повинні застосовувати відповідні контрацептивні засоби, щоб запобігти вагітності під час лікування тикагрелором.
Вагітність
Немає або обмежена кількість даних щодо застосування тикагрелору під час вагітності. Дослідження на тваринах показали шкідливий вплив на репродукцію (див. пункт 5.3). Не рекомендується застосування тикагрелору під час вагітності.
Грудне вигодовування
Доступні дані фармакодинамічних та токсикологічних досліджень на тваринах показали, що тикагрелор та його активні метаболіти проникають до молока (див. пункт 5.3). Не можна виключити ризик для новонароджених/немовлят. Слід прийняти рішення про припинення грудного вигодовування, чи закінчення/припинення терапії тикагрелором, враховуючи вигоди грудного вигодовування для дитини та вигоди терапії для жінки.
Фертильність
У тварин тикагрелор не впливає на фертильність самців чи самиць (див. пункт 5.3).
4.7 Вплив на здатність керувати транспортними засобами та обслуговувати машини
Тикагрелор не має або має незначний вплив на здатність керувати транспортними засобами та обслуговувати машини. Повідомлялося про випадки головокружіння та дезорієнтації у пацієнтів, які лікувалися тикагрелором. У зв'язку з цим пацієнти, у яких спостерігаються ці симптоми, повинні бути обережними під час керування транспортними засобами або обслуговування машин.
4.8 Побічні дії
Підсумок профілю безпеки
Профіль безпеки тикагрелору був оцінений на підставі результатів двох великих досліджень фази 3 (PLATO та PEGASUS), які включали понад 39 000 пацієнтів (див. пункт 5.1).
У дослідженні PLATO у пацієнтів, які приймали тикагрелор, спостерігалося більше випадків припинення лікування через побічні дії, ніж у групі, яка приймала клопідогрел (7,4% проти 5,4%).
У дослідженні PEGASUS у пацієнтів, які приймали тикагрелор, спостерігалося більше випадків припинення лікування через побічні дії порівняно з пацієнтами, які лікувалися ацетилсаліциловою кислотою в монотерапії (16,1% у групі, яка лікувалася тикагрелором у дозі 60 мг у комбінації з ацетилсаліциловою кислотою, проти 8,5% у групі, яка лікувалася ацетилсаліциловою кислотою в монотерапії). Найчастішими зареєстрованими побічними діями у пацієнтів, які лікувалися тикагрелором, були кровотеча та дихальна недостатність (див. пункт 4.4).
Табличне перелік побічних дій
Нижче перелічені побічні дії були визначені під час досліджень або зареєстровані після введення тикагрелору на ринок (таблиця 1).
Побічні дії перелічені згідно з класифікацією систем та органів (анг. System Organ Class, SOC) MedDRA. У межах кожної групи SOC побічні дії впорядковані за частотою їхнього виникнення.
Частота визначається наступним чином: дуже часто (≥1/10), часто (≥1/100 до <1>Таблиця 1 – Побічні дії, перелічені за частотою виникнення та класифікацією систем та органів (SOC)
| Класифікація систем та органів | Дуже часто | Часто | Не дуже часто | Частота невідома |
| Легкі, злоякісні та невизначені пухлини (у тому числі кісти та поліпи) | Кровотечі з пухлин | |||
| Забурення крові та імунної системи | Забурення крові, кровотечі | Тромботична тромбоцитопенічна пурпура | ||
| Забурення імунної системи | Надчутливість, у тому числі набряк Квінке | |||
| Забурення метаболізму та харчування | Гіперурікемія | Подагра/подагроподібний артрит | ||
| Забурення психіки | Дезорієнтація | |||
| Забурення нервової системи | Головокружіння, синкопи, головний біль | Кровотеча в мозок | ||
| Забурення ока | Кровотеча в око | |||
| Забурення вуха та лабіринту | Головокружіння лабіринтного походження | Кровотеча в вухо | ||
| Забурення серця | Брадикардія, блок AV |
| Класифікація систем та органів | Дуже часто | Часто | Не дуже часто | Частота невідома |
| Забурення судин | Гіпотонія | |||
| Забурення дихальної системи, грудної клітки та середостіння | Дихальна недостатність | Кровотечі з дихальної системи | ||
| Забурення шлунково-кишкового тракту | Кровотеча з шлунково-кишкового тракту, діарея, нудота, блювота, запор | Кровотеча в черевну порожнину | ||
| Забурення шкіри та підшкірної клітковини | Кровотечі підшкірної клітковини або в шкіру | |||
| Забурення м'язів та кісткової системи | Кровотечі в м'язи | |||
| Забурення нирок та сечовидільної системи | Кровотеча з сечовидільної системи | |||
| Забурення репродуктивної системи та грудей | Кровотечі з репродуктивної системи | |||
| Діагностичні дослідження | Збільшення рівня креатиніну в крові | |||
| Травми, отруєння та ускладнення після процедур | Кровотеча після процедури, кровотечі після травми |
Опис окремих побічних дій
Кровотечі
Результати дослідження PLATO щодо кровотеч
Загальний результат щодо частоти кровотеч у дослідженні PLATO наведено в таблиці 2.
Таблиця 2 – Аналіз усіх подій кровотечі, оцінені за допомогою методу
Каплана-Меєра через 12 місяців (PLATO)
| Тикагрелор 90 мг двічі на добу, N=9235 | Клопідогрел, N=9186 | П-значення* | |
| Поважні кровотечі загалом, PLATO | 11,6 | 11,2 | 0,4336 |
| Поважні, що призводять до смерті/загрожують життю, PLATO | 5,8 | 5,8 | 0,6988 |
| Поважні, не пов'язані з CABG, PLATO | 4,5 | 3,8 | 0,0264 |
| Поважні, не пов'язані з процедурами, PLATO | 3,1 | 2,3 | 0,0058 |
| Поважні + незначні кровотечі загалом, PLATO | 16,1 | 14,6 | 0,0084 |
| Поважні + незначні, не пов'язані з процедурами, PLATO | 5,9 | 4,3 | <0,0001 |
| Поважні, визначені за TIMI | 7,9 | 7,7 | 0,5669 |
| Поважні + незначні, визначені за TIMI | 11,4 | 10,9 | 0,3272 |
Тикагрелор та клопідогрел не відрізнялися за частотою виникнення важних, що призводять до смерті/загрожують життю, кровотеч, за PLATO, важних кровотеч загалом за PLATO, важних кровотеч за TIMI чи незначних кровотеч за TIMI (таблиця 2). Однак більше важних та незначних кровотеч загалом за критеріями дослідження PLATO спостерігалося у групі тикагрелору порівняно з клопідогрелом. У лише невеликій кількості пацієнтів, які брали участь у дослідженні PLATO, спостерігалися кровотечі, що призводили до смерті: 20 (0,2%) у групі, яка приймала тикагрелор, та 23 (0,3%) у групі, яка приймала клопідогрел (див. пункт 4.4).
Вік, стать, маса тіла, раса, географічний регіон, супутні захворювання, одночасне лікування та історія захворювання, включаючи інсульт чи транзиторну ішемічну атаку, не були передбачувальними факторами важних кровотеч загалом або важних кровотеч, не пов'язаних з процедурами, за критеріями дослідження PLATO. У зв'язку з цим не було визначено жодної групи, у якій існував би підвищений ризик якоїсь підгрупи кровотеч.
Кровотеча, пов'язана з CABG:
У дослідженні PLATO у 42% з 1584 пацієнтів (12% когорти), яким проводили процедуру CABG, спостерігалося важне, що призводить до смерті/загрожує життю, кровотеча за критеріями дослідження PLATO, при цьому не було виявлено різниці між групами лікування. Кровотеча після CABG, що призвела до смерті, спостерігалася у 6 пацієнтів у кожній групі дослідження (див. пункт 4.4).
Кровотечі, не пов'язані з CABG та не пов'язані з процедурами:
Тикагрелор та клопідогрел не відрізнялися за частотою виникнення важних, не пов'язаних з CABG, що призводять до смерті/загрожують життю, кровотеч за критеріями кровотеч PLATO, однак важні кровотечі загалом за PLATO, важні кровотечі за TIMI та важні + незначні кровотечі за TIMI спостерігалися частіше у групі, яка приймала тикагрелор. Аналогічно, коли були виключені всі кровотечі, пов'язані з процедурами, виявилося, що більше кровотеч спостерігалося у групі, яка приймала тикагрелор, ніж клопідогрел (таблиця 2). До припинення лікування через кровотечі, не пов'язані з процедурами, доходило частіше у групі тикагрелору (2,9%) ніж у групі клопідогрелу (1,2%; p<0,001).
Кровотечі в мозок:
У дослідженні PLATO спостерігалося більше випадків кровотеч у мозок, не пов'язаних з процедурами, у разі тикагрелору (n=27 кровотеч у 26 пацієнтів, 0,3%), ніж у разі клопідогрелу (n=14 кровотеч, 0,2%), у тому числі 11 кровотеч у разі тикагрелору та 1 у разі клопідогрелу, які призводили до смерті. Не було виявлено різниці за загальною кількістю кровотеч, що призводять до смерті.
Результати дослідження PEGASUS щодо кровотеч
Загальний результат щодо подій кровотечі у дослідженні PEGASUS наведено в таблиці 3.
4.9 Передозування
Тікагрелор добре переноситься після прийому одної дози до 900 мг. У дослідженні з однією зростаючою дозою, токсичне дія на травну систему залежала від дози. До інших клінічно значимих небажаних реакцій, які можуть виникнути після передозування, належать дихальна недостатність і коморні паузи (див. пункт 4.8).
У випадку передозування можуть виникнути вище згадані потенційні небажані реакції, і необхідно розглянути можливість моніторингу електрокардіограми (ЕКГ).
На даний час не відомо антидот, який усуває дію тікагрелору, і тікагрелор не видаляється під час діалізу (див. пункт 5.2). Лікування передозування повинно проводитися згідно з місцевою стандартною медичною практикою. Очікуваним ефектом передозування тікагрелору є ризик тривалого кровотечі, пов'язаного з інгібіцією тромбоцитів. Малоймовірно, щоб переливання тромбоцитів було клінічно корисним у пацієнтів з кровотечами (див. пункт 4.4). Якщо виникне кровотеча, необхідно провести інші відповідні заходи медичної допомоги.
5. ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ
5.1 Фармакодинамічні властивості
Група фармакотерапевтичних засобів: лікарські засоби, що інгібують агрегацію тромбоцитів, крім гепарину, код АТХ:
B01AC24
Механізм дії
Тікагрелор Холстен містить тікагрелор, який належить до хімічної групи циклопентилотріазолопірідин (CPTP).
Тікагрелор є пероральним, безпосередньо діючим, селективним і оборотним антагоністом рецептора P2Y12, який запобігає АДФ-залежній активації та агрегації тромбоцитів, пов'язаної з рецептором P2Y12.
Тікагрелор не запобігає зв'язуванню АДФ, але після приєднання до рецептора P2Y12 запобігає стимульованому АДФ передаванню сигналу. Оскільки тромбоцити беруть участь у ініціації та (або) прогресії тромботичних ускладнень атеросклерозу, було доведено, що інгібування функції тромбоцитів знижує ризик серцево-судинних подій, таких як смерть, інфаркт міокарда чи інсульт.
Тікагрелор також збільшує місцеві концентрації ендогенної аденозини внаслідок інгібування рівновагового транспорту нуклеозидів-1 (ENT-1, англ. equilibrative nucleoside transporter 1).
Було доведено, що тікагрелор посилює наступні, залежні від аденозини, дії у здорових добровольців та пацієнтів з СХС: розширення судин (вимірюється як збільшення коронарного потоку у здорових добровольців та у пацієнтів з СХС; головний біль), інгібування функції тромбоцитів (у повній крові людини в умовах in vitro) та дихальна недостатність. Однак зв'язок між спостережуваним збільшенням кількості аденозини та клінічними наслідками (наприклад, захворюваність-летальність) не був чітко визначений.
Фармакодинамічна дія
Початок дії
У пацієнтів зі стабільною ішемічною хворобою серця, які приймали ацетилсаліцилову кислоту, тікагрелор проявляє швидкий початок фармакологічної дії, про що свідчить середнє інгібування агрегації тромбоцитів (IPA) рівне близько 41% через 30 хвилин після прийому тікагрелору в дозі 180 мг з максимальним впливом IPA рівним 89% через 2-4 години після прийому лікарського засобу, який зберігався від 2 до 8 годин. У 90% пацієнтів найбільший ступінь інгібування тромбоцитів, що перевищує 70%, спостерігався через 2 години після прийому лікарського засобу.
Kінець дії
Якщо планується виконання операції КАБГ, ризик кровотечі, пов'язаний з прийомом тікагрелору, є більшим порівняно з клопідогрелом після припинення прийому на менший термін, ніж 96 годин до операції.
Дані про зміну терапії
Зміна лікування з клопідогрелу в дозі 75 мг на тікагрелор в дозі 90 мг двічі на добу призводить до збільшення IPA на 26,4% в абсолютних числах, а зміна з тікагрелору на клопідогрел призводить до зниження IPA на 24,5% в абсолютних числах. Пацієнти можуть перейти з клопідогрелу на тікагрелор без порушення дії на тромбоцити (див. пункт 4.2).
Ефективність і безпека застосування в клінічних дослідженнях
Клінічні дані, що підтверджують ефективність і безпека застосування тікагрелору, походять з двох досліджень фази 3:
- із дослідження PLATO [ PLATelet Inhibition and Patient Outcomes], у якому тікагрелор порівнювався з клопідогрелом, при цьому обидва ці лікарські засоби приймалися в поєднанні з АСА (ацетилсаліцилова кислота) та іншими стандартними методами лікування;
- із дослідження PEGASUS TIMI-54 [ PrEvention with TicaGrelor of SecondAry Thrombotic Events inHigh-RiSk AcUte Coronary Syndrome Patients], у якому тікагрелор у поєднанні з АСА порівнювався з АСА в монотерапії.
Дослідження PLATO (гострі коронарні синдроми)
Дослідження PLATO охоплювало 18 624 пацієнтів з гострим коронарним синдромом, які звернулися протягом 24 годин після появи симптомів нестабільної ангіни (UA), інфаркту міокарда без підйому сегмента ST (NSTEMI) або інфаркту міокарда з підйому сегмента ST (STEMI) і які були попередньо лікувані фармакологічно, або мали виконану перкутанну коронарну інтервенцію (PCI), або мали виконану операцію КАБГ.
Клінічна ефективність
У поєднанні з добовою дозою АСА тікагрелор у дозі 90 мг двічі на добу проявляв перевагу над клопідогрелом у дозі 75 мг на добу у запобіганні виникненню складного кінцевого пункту (смерть з серцево-судинних причин, інфаркт міокарда або інсульт), при цьому різниця була в основному пов'язана з кількістю смертей з серцево-судинних причин і інфарктів міокарда. Пацієнти приймали клопідогрел у дозі 300 мг (у пацієнтів, які піддавалися перкутанній коронарній інтервенції, можлива була доза 600 мг) або тікагрелор у дозі 180 мг.
Такий результат був отриманий рано (абсолютне зниження ризику [ARR] 0,6% і відносне зниження ризику [RRR] 12% через 30 днів), а ефективність лікування зберігалася протягом всього періоду 12 місяців, досягнувши ARR 1,9% за рік і RRR 16%. Ці результати свідчать про те, що відповідний час лікування пацієнтів тікагрелором 90 мг двічі на добу становить 12 місяців (див. пункт 4.2).
Лікування 54 пацієнтів з СХС тікагрелором замість клопідогрелу запобігло 1 серцево-судинному подію; лікування 91 пацієнта запобігло 1 смерті з серцево-судинних причин (див. графік 1 і таблицю 4).
Кращі результати лікування тікагрелором порівняно з клопідогрелом є послідовно видимими у багатьох підгрупах пацієнтів, включаючи масу тіла, стать, цукровий діабет в анамнезі, транзиторні ішемічні атаки або інсульт, не пов'язаний з кровотечею або реваскуляризацією; одночасне лікування з застосуванням гепарину, інгібіторів GpIIb/IIIa і інгібіторів протонної помпи (див. пункт 4.5); остаточне клінічне діагноз (STEMI, NSTEMI чи UA) і запланований під час рандомізації метод лікування (інвазивне лікування або консервативне лікування).
З незначною значимістю ефект лікування відрізнявся залежно від регіону, через що коефіцієнт ризику (HR) для першочергового кінцевого пункту вказує на користь тікагрелору у всьому світі, крім Північної Америки, яка представляє близько 10% загальної досліджуваної популяції, де результат HR є більш вигідним для клопідогрелу (наявність взаємодії p=0,045).
Аналізи факторів свідчать про можливість існування зв'язку з дозою АСА, що означає, що було спостережено зниження ефективності тікагрелору при збільшенні доз АСА. Дози АСА для тривалого застосування з тікагрелором повинні становити 75-150 мг (див. пункти 4.2 і 4.4).
Графік 1 показує оцінені ризики першої появи будь-якого з подій складного кінцевого пункту для оцінки ефективності.
Графік 1 – Аналіз першочергового клінічного складного кінцевого пункту смерті з серцево-судинних причин, інфаркту міокарда і інсульту (PLATO)
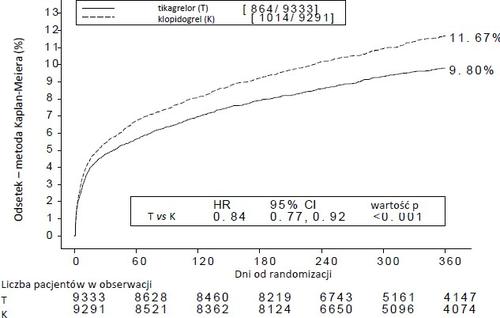
Тікагрелор знижував частоту появи першочергового складного кінцевого пункту порівняно з клопідогрелом, у обидвох групах пацієнтів UA/NSTEMI і STEMI (таблиця 4). З цього погляду лікарський засіб Тікагрелор Холстен у дозі 90 мг двічі на добу разом з АСА в малій дозі можна застосовувати у пацієнтів з СХС (нестабільна ангіна, інфаркт міокарда без підйому сегмента ST [NSTEMI] або інфаркт міокарда з підйому сегмента ST [STEMI]), включаючи пацієнтів, які лікувалися фармакологічно, а також пацієнтів, які піддавалися перкутанній коронарній інтервенції (PCI) або операції КАБГ.
Таблиця 4 - Аналіз першочергових і другочергових кінцевих пунктів оцінки ефективності (PLATO)
| Тікагрелор 90 мг двічі на добу (% пацієнтів, у яких виступило подія) N=9333 | Клопідогрел 75 мг раз на добу (% пацієнтів, у яких виступила подія) N=9291 | ARRa (%/рік) | RRRa (%) (95% CI) | Значення p |
| виступила подія) N=9333 | подія) N=9291 | ||||
| Смерть з серцево-судинних причин, інфаркт міокарда (крім безсимптомного інфаркту міокарда) або інсульт | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| План інвазивного лікування | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| План консервативного лікування | 11,3 | 13,2 | 2,3 | 15 (0,3, 27) | 0,0444 |
| Смерть з серцево-судинних причин | 3,8 | 4,8 | 1,1 | 21 (9, 31) | 0,0013 |
| Інфаркт міокарда (крім безсимптомного інфаркту міокарда) | 5,4 | 6,4 | 1,1 | 16 (5, 25) | 0,0045 |
| Інсульт | 1,3 | 1,1 | -0,2 | 17 (-52, 9) | 0,2249 |
| Смерть з будь-якої причини, інфаркт міокарда (крім безсимптомного інфаркту міокарда) або інсульт | 9,7 | 11,5 | 2,1 | 16 (8, 23) | 0,0001 |
| Смерть з серцево-судинних причин, загальний інфаркт міокарда, інсульт, СРІ, РІ, ТІА або інші АТЕ | 13,8 | 15,7 | 2,1 | 12 (5, 19) | 0,0006 |
| Смерть з будь-якої причини | 4,3 | 5,4 | 1,4 | 22 (11, 31) | 0,0003 |
| Тромбоз, що закриває стент | 1,2 | 1,7 | 0,6 | 32 (8, 49) | 0,0123 |
Субаналіз генетичних даних у дослідженні PLATO
Генотипування за CYP2C19 і ABCB1, виконане у дослідженні PLATO у 10 285 пацієнтів, дозволило визначити зв'язок між генотипними групами та результатами дослідження PLATO.
Перевага тікагрелору над клопідогрелом у зниженні кількості серцево-судинних подій не була значимо залежна від генотипу CYP2C19 або ABCB1. Подібно до всього дослідження PLATO, загальна кількість серйозних кровотеч за визначенням PLATO не відрізнялася у групі тікагрелору та клопідогрелу, незалежно від генотипу CYP2C19 або ABCB1. Кровотечі, серйозні за визначенням PLATO, не пов'язані з КАБГ, траплялися частіше у групі тікагрелору порівняно з клопідогрелом у пацієнтів з втратою одного або більше функціональних алелів CYP2C19, але подібно до групи клопідогрелу у пацієнтів без втрати функціональних алелів.
Комбінована оцінка ефективності та безпеки застосування
Комбінована оцінка ефективності та безпеки застосування (смерть з серцево-судинних причин, інфаркт міокарда, інсульт або серйозне кровотеч за визначенням PLATO) свідчить про те, що користь від ефективності тікагрелору порівняно з клопідогрелом не втрачається через кількість серйозних кровотеч (ARR 1,4%, RRR 8%, HR 0,92; p=0,0257) протягом 12 місяців після виникнення СХС.
Клінічна безпека
Підгрупа з дослідженням Голтера
Для вивчення виникнення коморних пауз і інших аритмій під час дослідження PLATO дослідники проводили моніторинг методом Голтера підгрупи близько 3000 пацієнтів, з яких у близько 2000 виконувалися записи в гострій фазі СХС і після місяця. Основною спостережуваною змінною було виникнення коморних пауз ≥3 секунд. Більшу кількість коморних пауз спостерігалося у групі тікагрелору (6,0%) ніж у групі клопідогрелу (3,5%) в гострій фазі СХС; і після місяця - відповідно 2,2% і 1,6% (див. пункт 4.4). Збільшена частота коморних пауз у гострій фазі СХС спостерігалася виразніше у пацієнтів, які лікувалися тікагрелором із застійною серцевою недостатністю в анамнезі (9,2% проти 5,4% пацієнтів без застійної серцевої недостатності в анамнезі; у випадку клопідогрелу - 4,0% пацієнтів із застійною серцевою недостатністю в анамнезі і 3,6% пацієнтів без застійної серцевої недостатності). Ця диспропорція не спостерігалася після 1 місяця: 2% проти 2,1% у випадку пацієнтів, які приймали тікагрелор, відповідно з або без застійної серцевої недостатності; і 3,8% проти 1,4% у випадку прийому клопідогрелу. Не було виявлено несприятливих клінічних наслідків, пов'язаних з цими порушеннями (включаючи застосування кардіостимулятора) у цій групі пацієнтів.
Дослідження PEGASUS (інфаркт міокарда в анамнезі)
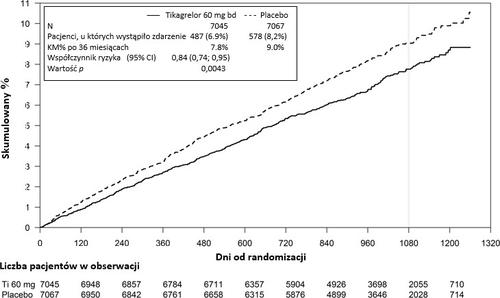
Дослідження PEGASUS TIMI-54 було дослідженням, яке включало 21 162 пацієнтів, рандомізованим, проведеним методом подвійної сліпої проби в паралельних групах, контрольованим за допомогою плацебо, міжнародним мультицентровим дослідженням, яке оцінювало запобігання серцево-судинним подіям за допомогою тікагрелору в 2 дозах (або 90 мг двічі на добу, або 60 мг двічі на добу) у поєднанні з АСА в малій дозі (75-150 мг) порівняно з АСА в монотерапії у пацієнтів з інфарктом міокарда в анамнезі та з додатковими факторами ризику виникнення таких подій.
Пацієнтів включали до дослідження, якщо вони були у віці не менше 50 років, перенесли інфаркт міокарда в минулому (в період від 1 до 3 років до рандомізації) і мали не менше одного з наступних факторів ризику виникнення атеротромботичних подій: вік ≥65 років, цукровий діабет, який вимагає фармакологічного лікування, другий інфаркт міокарда, ознаки багатовудової хвороби коронарних артерій або хронічна не кінцевої стадії ниркова недостатність.
Пацієнти не включалися до дослідження, якщо планувалося застосування антагоніста рецептора P2Y12, дипіридамолу, цилостазолу або антикоагулянтної терапії під час дослідження; якщо у них спостерігалося кровотечне порушення або інсульт, або вони мали пухлину центральної нервової системи або аномальну будову церебральних судин в анамнезі; якщо у них виникло кровотеч у травній системі за останні 6 місяців або вони перенесли важкий хірургічний втручання за останні 30 днів.
Клінічна ефективність
Графік 2 – Аналіз першочергового клінічного складного кінцевого пункту смерті з серцево-судинних причин, інфаркту міокарда і інсульту (PEGASUS)
5.2 Фармакокінетичні властивості
Тикагрелор проявляє лінійну фармакокінетику, а експозиція на тикагрелор і його активний метаболіт
(AR-C124910XX) є приблизно залежною від дози, у діапазоні до 1260 мг.
Всмоктування
Всмоктування тикагрелору є швидким, медіана часу tmax становить близько 1,5 години. Формування головного циркулюючого метаболіту AR-C124910XX (також активного) з тикагрелору є швидким,
медіана tmax становить близько 2,5 годин. Після введення одної дози перорально 90 мг тикагрелору
на голодний шлунок здоровим добровольцям C становить 529 нг/мл, а AUC 3451 нг*год/мл. Для метаболіту
пов'язаного з речовinou співвідношення становлять 0,28 для C і 0,42 для AUC.
Фармакокінетика тикагрелору і AR-C124910XX у пацієнтів з інфарктом серця в анамнезі була
засадnicно подібна до спостережуваної в популяції пацієнтів з ГКН. За аналізом
фармакокінетики популяції в дослідженні PEGASUS медіана тикагрелору C становила 391 нг/мл і
AUC становила 3801 нг*год/мл у стані стазису після введення тикагрелору в дозі 60 мг. У
разі тикагрелору в дозі 90 мг C становила 627 нг/мл і AUC становила 6255 нг*год/мл у стані стазису.
Середню абсолютну біодоступність тикагрелору оцінено на 36%. Вживання висококалорійної
їжі призводить до збільшення AUC тикагрелору на 21% і зменшення C активного метаболіту на
22%, але не спричиняє змін C тикагрелору і AUC активного метаболіту. Вважається, що ці
незначні зміни мають мінімальне клінічне значення, тому тикагрелор може бути прийнятий під час
їжі або незалежно від неї. І тикагрелор, і активний метаболіт є субстратами
глікопротеїну P (P-gp).
Тикагрелор у вигляді розчавлених таблеток, змішаних з водою, введених перорально або через
зонд носово-шлунковий, має біодоступність, порівнянну з таблеткою, введеною цілком у
діапазоні AUC і C для тикагрелору і активного метаболіту. Експозиція на початковому етапі (0,5 і 1 година
після введення) тикагрелору, застосованого у вигляді розчавленої таблетки, змішаної з водою, була
більшою, ніж у випадку застосування цілої (не розчавленої) таблетки, з суттєво ідентичним
профілем концентрацій у пізнішому часі (від 2 до 48 годин).
Дистрибуція
Об'єм дистрибуції у стані стазису становить 87,5 л. Тикагрелор і активний метаболіт у значній
мірі зв'язуються з білками плазми людини (>99,0%).
Біотрансформація
CYP3A4 є основним ферментом, відповідальним за метаболізм тикагрелору і формування
активного метаболіту, а їх взаємодії з іншими субстратами ізоензиму CYP3A включають
як активацію, так і гальмування.
Головний метаболіт тикагрелору, AR-C124910XX, є також активним, що було встановлено в
дослідженнях in vitro, в яких він зв'язується з тромбоцитарним рецептором ADP P2Y .
Огólnосистемна експозиція на активний метаболіт становить близько 30 ‒ 40% експозиції на тикагрелор.
Елімінація
Основним шляхом елімінації тикагрелору є метаболізм у печінці. Після введення
радіоактивно позначеного тикагрелору, середній відсоток радіоактивності становив
близько 84% (57,8% у калі і 26,5% у сечі). Відновлений тикагрелор і активний метаболіт у
сечі в обидвох випадках становили менше 1% від введеної дози. Головним шляхом елімінації активного метаболіту, ймовірно, є виділення з жовчю. Середній
період напіврозпаду становив близько 7 годин для тикагрелору і 8,5 годин для активного метаболіту.
Особливі групи пацієнтів
Особи похилого віку
У ході аналізу фармакокінетики в популяціях, у осіб похилого віку (≥75
років) з ГКН спостерігалося більше експозиції на тикагрелор (близько 25% для C і AUC) і
на активний метаболіт у порівнянні з молодшими пацієнтами. Вважається, що ці різниці не
є клінічно значимими (див. пункт 4.2).
Діти і підлітки
Доступні обмежені дані щодо дітей і підлітків з серповидно-клітинною анемією (див. пункт 4.2 і 5.1).
У дослідженні HESTIA 3 пацієнтам у віці від 2 до менше 18 років, вагою від ≥ 12 до ≤
24 кг, від >24 до ≤ 48 кг і > 48 кг призначався тикагрелор у вигляді 15 мг таблеток
розпаду в роті для дітей, у дозах, що становили відповідно 15, 30 і 45 мг двічі на добу. Аналіз фармакокінетики
популяції показав, що середнє AUC коливалося від 1095 нг*год/мл до 1458 нг*год/мл, а
середнє C становило від 143 нг/мл до 206 нг/мл у стані стазису.
Стать
У жінок спостерігалося більше експозиції на тикагрелор і на активний метаболіт, ніж у
чоловіків. Вважається, що ці різниці не є клінічно значимими.
Забурення функції нирок
У пацієнтів з важкими порушеннями функції нирок (кліренс креатиніну <30 мл хв)
експозиція на тикагрелор була на близько 20% меншою, а експозиція на активний метаболіт була
близько 17% більшою, ніж у пацієнтів з нормальною функцією нирок.
У пацієнтів з термінальною хворобою нирок, які проходили гемодіаліз, значення AUC і C
тикагрелору в дозі 90 мг, введеного в день без діалізу, були на 38% і 51% більшими, ніж у
пацієнтів з нормальною функцією нирок. Подібне збільшення експозиції
спостерігалося, коли тикагрелор вводився безпосередньо перед діалізом (відповідно на
49% і 61%), що свідчить про те, що тикагрелор не піддається діалізу. Експозиція на активний метаболіт
зросла в меншому ступені (AUC на 13-14%, а C на 17-36%). Дія тикагрелору щодо гальмування агрегації тромбоцитів була незалежною від діалізу у пацієнтів з
термінальною хворобою нирок і була подібною до дії у пацієнтів з нормальною функцією нирок
(див. пункт 4.2).
Забурення функції печінки
C і AUC тикагрелору були відповідно на 12% і 23% більшими у пацієнтів з легкими
забуреннями функції печінки у порівнянні з відповідними здоровими особами, однак дія тикагрелору щодо гальмування агрегації тромбоцитів була подібною в обидвох
групах. Не є необхідним коригування дози у пацієнтів з помірними
забуреннями функції печінки. Не проводилися дослідження щодо застосування тикагрелору у пацієнтів з важкою нирковою недостатністю, і немає інформації щодо його фармакокінетики у пацієнтів з помірними забуреннями функції печінки. У пацієнтів з первинним помірним або важким збільшенням показників печінки стężення тикагрелору в плазмі було в середньому подібним
або трохи більшим, ніж у пацієнтів без первинного збільшення цих параметрів. Не є необхідним коригування дозування у пацієнтів з помірними
забуреннями функції печінки (див. пункти 4.2 і 4.4).
Расові відмінності
У пацієнтів азійського походження спостерігається на 39% більша середня
біодоступність у порівнянні з пацієнтами кавказької раси. У пацієнтів, які ідентифікують свою расу як чорну, біодоступність тикагрелору є на 18% меншою, ніж у пацієнтів кавказької раси. У дослідженнях клінічної фармакології серед японців спостерігалося більше на близько 40% (а на 20% після коригування на масу тіла) експозиції на тикагрелор (C і AUC), у порівнянні з особами кавказької раси. Експозиція у пацієнтів, які ідентифікують свою расу як латиноамериканську, була подібною до пацієнтів кавказької раси.
5.3 Дані про безпеку до клінічних досліджень
Дані до клінічних досліджень походять з конвенційних фармакологічних досліджень тикагрелору і його головного метаболіту, які стосувалися безпеки фармакотерапії, досліджень токсичності після одноразового і багаторазового застосування, а також потенційної генотоксичності, і не виявили неприйнятного ризику виникнення побічних ефектів у людей.
Після відповідного клінічному стану експозиції у кількох видів тварин спостерігалося підrážнення травного тракту (див. пункт 4.8).
У самиць щурів, яким вводили тикагрелор у великих дозах, спостерігалося збільшення кількості випадків пухлин матки (гржолакорак) і збільшення кількості
гржолаків печінки. Механізм виникнення пухлин матки у щурів, ймовірно, полягає у порушення рівноваги гормональної, яка може привести до виникнення пухлин у щурів. Механізм виникнення гржолаків печінки, ймовірно, є специфічним для гризунів збільшенням активності ферментів у печінці. Тому вважається малоймовірним, щоб ці випадки мали значення для людей.
У щурів спостерігалися незначні порушення розвитку після введення вагітним самицям токсичних доз (маржа безпеки 5,1). У плодів кроликів спостерігалося незначне запізнення у дозріванні печінки і розвитку скелетної системи, коли вагітним самицям вводили великі дози без ознак токсичності у вагітних самиць (маржа безпеки 4,5).
Дослідження на щурах і кроликах показали токсичну дію на репродукцію, з незначним зменшенням приросту маси тіла вагітних самиць, а також зменшенням виживаності новонароджених і меншою вагою при народженні, а також запізненням у зростанні.
Тикагрелор спричиняв у самиць щурів нерегулярні цикли (у більшості випадків тривалі),
але не впливав на загальну плодючість у самців і самиць щурів. Дослідження
фармакокінетики, проведені зі знакованим радіоактивно тикагрелором, показали, що як сама речовина, так і її метаболіти проникають до молока щурів (див. пункт 4.6).
6. ФАРМАЦЕВТИЧНІ ДАНІ
6.1 Перелік допоміжних речовин
Ядро таблетки
Гіпромелоза (E464)
Манітол (E421)
Мікрокристалічна целюлоза (E460)
Карбоксиметилскробова сіль натрію
Стеарин магнію (E470b)
Покриття таблетки
Гіпромелоза (E464)
Двутленок титану (E171)
Макрогол 400 (E1521)
Тальк (E553b)
Оксид заліза червоний (E172)
6.2 Фармацевтична несовместимость
Не застосовується.
6.3 Термін придатності
3 роки
6.4 Спеціальні заходи осторожності під час зберігання
Цей лікарський засіб не вимагає спеціальних умов зберігання при певній температурі; зберігати в оригінальній упаковці для захисту від світла.
6.5 Тип і вміст упаковки
Прозорі блистерні упаковки з плівки PVC/PVDC/Алюмінію і/або прозорі блистерні упаковки з плівки PVC/PE/PVDC/Алюмінію в паперовій коробці.
Блистерні упаковки з плівки (з символами сонця/місяця або без) в паперових коробках по 14, 15, 20, 28, 30,
56, 60, 90, 98, 100, 168, 195, 196 і 200 покритих таблеток.
Не всі розміри упаковок повинні бути в обігу.
6.6 Спеціальні заходи осторожності при видаленні
Всі невикористані залишки лікарського засобу або його відходи повинні бути видалені згідно з місцевими правилами.
7. ПОДМІТОТ, ВІДПОВІДАЛЬНИЙ ЗА ВИДАННЯМ ДОЗВОЛУ НА
ДОПУСК ДО ОБІГУ
Holsten Pharma GmbH
Ганнштрассе 31-35
60528 Франкфурт-на-Майні
Німеччина
8. НОМЕРИ ДОЗВОЛІВ НА ДОПУСК ДО ОБІГУ
Дозвіл №:
9. ДАТА ВИДАННЯ ПЕРШОГО ДОЗВОЛУ НА ДОПУСК ДО ОБІГУ
І ДАТА ПРОТРОВЖЕННЯ ДОЗВОЛУ
Дата видання першого дозволу на допуск до обігу:
10. ДАТА ЗАТВЕРДЖЕННЯ АБО ЧАСТКОВОЇ ЗМІНИ ТЕКСТУ
ХАРАКТЕРИСТИКИ ЛІКАРСЬКОГО ЗАСОБУ
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- ІмпортерGenepharm S.A.
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Тіцагрелор ГолстенФорма випуску: Таблетки, 60 мгДіючі речовини: ticagrelorПотрібен рецептФорма випуску: Таблетки, 90 мгДіючі речовини: ticagrelorПотрібен рецептФорма випуску: Таблетки, 60 мгДіючі речовини: ticagrelorВиробник: Krka, d.d., Novo mestoПотрібен рецепт
Аналоги Тіцагрелор Голстен в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Тіцагрелор Голстен у Hiszpania
Аналог Тіцагрелор Голстен у Ukraina
Лікарі онлайн щодо Тіцагрелор Голстен
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Тіцагрелор Голстен – за рішенням лікаря та згідно з місцевими правилами.














