
Іг Вена

Запитайте лікаря про рецепт на Іг Вена

Інструкція із застосування Іг Вена
Укладена інформація для користувача
Ig VENA, 50 г/л, розчин для інфузії
Людська нормальна імуноглобулін для внутрішньовенної інфузії (IVIg)
Перед застосуванням препарату необхідно ретельно ознайомитися з вмістом цієї брошури, оскільки вона містить важливу інформацію для пацієнта.
- Зберігайте цю брошуру, щоб у разі потреби ви могли знову її прочитати.
- У разі виникнення будь-яких сумнівів зверніться до лікаря або медсестри.
- Якщо у пацієнта виникнуть будь-які непередбачені симптоми, включаючи всі непередбачені симптоми, не перераховані в цій брошурі, повідомте про це лікаря або медсестру. Див. пункт 4.
Зміст брошури:
- 1. Що таке лікарський препарат Ig VENA і для чого він призначений
- 2. Інформація, яка повинна бути відомою перед застосуванням лікарського препарату Ig VENA
- 3. Як застосовувати Ig VENA
- 4. Можливі непередбачені реакції
- 5. Як зберігати Ig VENA
- 6. Зміст упаковки і інші відомості
1. Що таке лікарський препарат Ig VENA і для чого він призначений
Ig VENA - розчин людської нормальної імуноглобулін для внутрішньовенної інфузії.
Імуноглобуліни - це людські антитіла, які також присутні в крові.
Ig VENA застосовується для наступних терапій:
Лікування дорослих, а також дітей та підлітків (0-18 років), коли у пацієнта недостатня кількість
антитіл (замісна терапія) у наступних випадках:
- 1. У пацієнтів з вродженим дефіцитом виробництва антитіл (у складі первинних імунодефіцитів).
- 2. У пацієнтів з набутим дефіцитом виробництва антитіл (вторинний імунодефіцит), у яких виникли важкі або повторювані інфекції, викликані різними клінічними станами (наприклад, онкологічними або аутоімунними захворюваннями чи внаслідок лікування цих захворювань). Лікування антибіотиками у цих пацієнтів було неефективним, і вони не мали достатнього збільшення рівня антитіл IgG після вакцинації (пневмококова полімерна вакцина та вакцина, що містить поліпептидний антиген), або рівень IgG в сироватці крові становив менше 4 г/л.
Лікування дорослих та дітей (0-18 років) з певними запальними захворюваннями (імуномодуляція) у наступних випадках:
- 1. У пацієнтів з недостатньою кількістю тромбоцитів (первинна імунна тромбоцитопенія) та у пацієнтів з високим ризиком кровотечі або перед операцією для досягнення достатньої кількості тромбоцитів.
- 2. У пацієнтів із синдромом Гієна-Барре. Це гостре захворювання, яке проявляється запаленням периферійних нервів, що викликає важке слабіння м'язів, переважно в ногах і верхніх кінцівках.
- 3. У пацієнтів із хворобою Кавасакі (у поєднанні з ацетилсаліциловою кислотою). Хвороба Кавасакі - це гостре захворювання маленьких дітей, яке проявляється запаленням кровеносних судин всього тіла.
- 4. У пацієнтів із хронічним запальним демієлінізуючим полірадикулонеуритом (анг. CIDP - Chronic Inflammatory Demyelinating Polyradiculoneuropathy). Це хронічне захворювання є рідкісним порушенням периферійних нервів, яке характеризується поступовим прогресуючим слабінням нижніх кінцівок і, у меншій мірі, верхніх кінцівок.
- 5. У багатократній моторній нейропатії (анг. MMN - Multifocal Motor Neuropathy). Це рідке захворювання, яке атакує рухові нерви і проявляється повільним, прогресуючим асиметричним слабінням кінцівок без втрати чутливості.
2. Інформація, яка повинна бути відомою перед застосуванням лікарського препарату Ig VENA
Коли не застосовувати лікарський препарат Ig VENA
Якщо пацієнт має алергію (гіперчутливість) на людську нормальну імуноглобулін або
будь-який з інших компонентів цього препарату (перелічених у пункті 6).
Коли у пацієнта наявні антитіла проти імуноглобуліну А (IgA) у крові,
оскільки введення препарату, який містить IgA, може призвести до важкої алергічної реакції.
Обережність та попередження
Перед початком застосування лікарського препарату Ig VENA необхідно обговорити це з лікарем або медсестрою.
Пацієнти повинні бути ретельно відстежені та обережно спостерігатися під час інфузії через ризик
викликання непередбачених реакцій.
Деякі непередбачені реакції можуть виникнути частіше:
- у разі надто швидкої інфузії;
- у пацієнтів з симптомами невилікованої інфекції (наприклад, гарячка) або хронічного запального стану;
- у пацієнтів, які отримують людську нормальну імуноглобулін вперше;
- у рідких випадках, коли змінюється раніше застосований препарат людської нормальної імуноглобулін на інший або коли з моменту останньої інфузії минуло багато часу.
У деяких випадках імуноглобуліни можуть збільшувати ризик інфаркту міокарда, інсульту, тромбозу легеневої артерії або погіршувати тромбоз глибоких вен
З цієї причини лікар повинен проявляти особливу обережність у наступних випадках:
- у пацієнтів з ожирінням,
- у осіб похилого віку,
- у пацієнтів з цукровим діабетом,
- у пацієнтів з гіпертонією,
- у пацієнтів із зниженою об'ємом крові (гіповолемія),
- у пацієнтів з захворюваннями судин,
- у пацієнтів з ризиком виникнення станів тромбозу крові (набуті або вроджені порушення згортання),
- у пацієнтів з тромботичними станами в анамнезі
- у пацієнтів із захворюваннями, які проявляються збільшенням в'язкості крові,
- у пацієнтів, які тривало імобілізовані,
- у пацієнтів з нирковими захворюваннями, які зараз або раніше мали ниркові захворювання, або які приймають препарати, які можуть пошкоджувати нирки (нефротоксичні препарати), оскільки були зафіксовані випадки гострої ниркової недостатності. У разі пошкодження ниркової функції необхідно розглянути можливість припинення введення імуноглобулінів.
Пацієнт може мати алергію (гіперчутливість) на імуноглобулін (антитіла) без знання про це.
Гіперчутливість може виникнути навіть у пацієнта, який раніше вже приймав людську нормальну імуноглобулін і добре її переносив. Це може виникнути особливо у випадках дефіциту імуноглобулінів типу IgA (у пацієнтів з антитілами проти IgA). У цих рідких випадках можуть виникнути алергічні реакції (гіперчутливість) такі як раптовий спад артеріального тиску або анафілактична реакція.
У разі виникнення непередбаченої реакції необхідно або зменшити швидкість введення, або припинити введення імуноглобулінів. Лікування залежить від типу і тяжкості непередбаченої реакції.
У разі виникнення анафілактичної реакції необхідно діяти згідно з чинними медичними стандартами лікування анафілаксії. Необхідно повідомити лікаря, якщо хоча б один з вищезазначених випадків стосується пацієнта. Лікар прийме відповідні заходи обережності при застосуванні препарату Ig VENA.
Профілактика вірусних інфекцій
Препарати, виготовлені з людської крові або плазми, піддаються певним процедурам, які повинні запобігти передачі інфекції пацієнтам. До цих процедур належить відбір донорів крові та плазми, метою якого є виключення донорів, які можуть бути джерелом інфекції; дослідження плазми на наявність інфекційних чинників/вірусів. Виробники препаратів з людської крові або плазми також застосовують процеси, які інактивують або видаляють віруси. Незважаючи на ці заходи профілактики, не можна повністю виключити можливість передачі інфекційних чинників через препарат, виготовлений з людської крові або плазми. Це стосується також невідомих або недавно відкритих вірусів та інших патогенів.
Вважається, що прийняті заходи профілактики є ефективними щодо вірусів з оболонкою, таких як вірус людського імунодефіциту (ВІЛ), вірус гепатиту Б (HBV) і типу С (HCV), а також щодо вірусів без оболонки, таких як вірус гепатиту А (HAV).
Ці заходи можуть мати обмежену ефективність проти вірусів без оболонки, таких як парвовірус В19.
Не встановлено, що імуноглобуліни можуть бути причиною гепатиту А або інфекції парвовірусом В19, оскільки наявність антитіл може відігравати важливу роль у захисті від вірусних інфекцій.
Рекомендується записувати назву та серійний номер кожного введення Ig VENA для можливості ідентифікації препарату.
Діти та підлітки
Після застосування препарату Ig VENA у дітей та підлітків спостерігалося тимчасове та легке підвищення рівня глюкози в сечі (глюкозурія), без клінічних симптомів. Це може бути пов'язано з вмістом мальтози в препараті Ig VENA, яка в ниркових канальцях піддається гідролізу до глюкози. Глюкоза реабсорбується та видаляється з сечею в дуже малій кількості. Реабсорбція глюкози залежить від віку пацієнта. Тимчасове підвищення рівня мальтози в сироватці крові може перевищувати ниркову здатність реабсорбції цукру та впливати на позитивний результат дослідження глюкози в сечі.
Препарат Ig VENA та інші препарати
Необхідно повідомити лікаря про всі препарати, які пацієнт зараз приймає або приймав недавно, а також про препарати, які пацієнт планує приймати.
Не можна змішувати людську нормальну імуноглобулін для внутрішньовенної інфузії з іншими препаратами
або іншими препаратами, які містять імуноглобулін для внутрішньовенної інфузії (IVIg).
Вплив на живі атENUовані вірусні вакцини
Введення імуноглобулінів може послабити протягом至少 6 тижнів до 3 місяців ефективність вакцин, які містять живі атENUовані віруси, такі як вірус кору, кір, скарлатини або вітряної віспи. Після застосування цього препарату необхідно дотримуватися 3-місячної перерви перед вакцинацією вакциною, яка містить живі атENUовані віруси. У разі кору це послаблення може тривати до року. З цієї причини пацієнти, які отримують вакцину проти кору, повинні мати визначений рівень антитіл.
Діуретики петлі (група препаратів, які збільшують виділення сечі)
Необхідно уникати одночасного застосування з діуретиками петлі.
Вплив на результати аналізів крові
Після введення імуноглобулінів тимчасове підвищення рівня пасивно перенесених різних антитіл у крові пацієнта може призвести до хибно позитивних результатів серологічних тестів.
Пасивна передача антитіл проти антигенів еритроцитів, наприклад А, В, D (відповідальних за групу крові), може впливати на результати деяких серологічних тестів на антитіла до червоних кров'яних тілець, наприклад непрямого антиглобулінового тесту (DAT, тест Кумбса).
Дослідження рівня глюкози в крові
Деякі типи досліджень рівня глюкози в крові (наприклад, які використовують методи, засновані на дегідрогеназі глюкози - піролохінолінохіноні (GDH-PQQ) або оксидоредуктазі глюкози-барвнику) хибно інтерпретують мальтозу (100 мг/мл) у препараті Ig VENA як глюкозу. Це може призвести до хибно підвищеного показника рівня глюкози в крові під час інфузії та протягом приблизно 15 годин після закінчення інфузії, що внаслідок може привести до неправильного застосування інсуліну, що призводить до загрозливої для життя гіпоглікемії. Крім того, випадки справжньої гіпоглікемії можуть залишитися без лікування, якщо стан гіпоглікемії був замаскований хибно підвищеними показниками рівня глюкози. У зв'язку з цим при застосуванні Ig VENA або інших препаратів для парентерального застосування, які містять мальтозу, вимірювання рівня глюкози в крові повинно проводитися методом, специфічним для глюкози. Необхідно ретельно ознайомитися з інформацією щодо тестів для визначення рівня глюкози в крові, включаючи інформацію про тест-стріпси, щоб визначити, чи можна їх застосовувати з препаратами для парентерального застосування, які містять мальтозу. У разі сумнівів необхідно звернутися до виробника пристрою для визначення можливості його застосування з препаратами для парентерального застосування, які містять мальтозу.
Діти та підлітки
Хоча не проводилися дослідження взаємодії у дітей та підлітків, однак не очікується різниці між дорослими та дітьми та підлітками.
Вагітність, годування грудьми та вплив на фертильність
- Якщо пацієнтка вагітна або годує грудьми, підозрює вагітність або планує мати дитину, вона повинна проконсультуватися з лікарем перед застосуванням цього препарату. Лікар вирішить, чи може бути застосований препарат Ig VENA у вагітної пацієнтки.
- Не проводилися клінічні дослідження з Ig VENA у вагітних жінок. Встановлено, що продукти імуноглобулінів для внутрішньовенної інфузії проникають через плаценту, з посиленням у третьому триместрі. Однак тривале клінічне спостереження щодо застосування імуноглобулінів свідчить про те, що не варто очікувати жодного шкідливого впливу на перебіг вагітності, на плід чи на новонародженого.
- Якщо пацієнтка годує грудьми та приймає препарат Ig VENA, антитіла з цього препарату можуть проникати до грудного молока. Це може сприяти захисту новонародженого від певних інфекцій.
- Клінічні дані щодо застосування імуноглобулінів свідчать про те, що не варто очікувати жодного шкідливого впливу на фертильність.
Проведення транспортних засобів та обслуговування машин
Деякі непередбачені реакції, пов'язані з продуктом Ig VENA, можуть погіршувати здатність керувати транспортними засобами та обслуговувати машини. Пацієнти, у яких виникли непередбачені реакції під час лікування, повинні чекати їхнього проходження перед керуванням транспортними засобами або обслуговуванням машин.
Ig VENA містить мальтозу та натрій
Препарат містить 100 мг мальтози на 1 мл.
Цей препарат містить близько 69 мг натрію на 1 літр. Це потрібно враховувати у пацієнтів, які дотримуються дієти з низьким вмістом натрію.
3. Як застосовувати Ig VENA
Ig VENA може бути застосований лікарем або кваліфікованим медичним персоналом лише в умовах лікарні або амбулаторії.
Доза та схема дозування залежать від показань; лікар визначить відповідне дозування для конкретного пацієнта.
Ig VENA повинен бути введений спочатку повільно. Якщо препарат добре переноситься, швидкість інфузії можна поступово збільшувати.
Застосування у дітей та підлітків
Дозування у дітей та підлітків (0-18 років) не відрізняється від того, яке застосовується у дорослих, оскільки дозування в окремих показаннях визначається на основі маси тіла та клінічного стану пацієнта.
Прийом підвищеної дози Ig VENA
Передозування може призвести до перевантаження кровообігу та надмірної в'язкості крові, особливо у пацієнтів групи ризику, у пацієнтів похилого віку або з нирковою недостатністю чи серцевою недостатністю.
У разі виникнення будь-яких подальших питань щодо застосування цього препарату необхідно звернутися до лікаря або медсестри.
4. Можливі непередбачені реакції
Як і будь-який препарат, цей препарат може викликати непередбачені реакції, хоча не у всіх вони виникають.
Наступні непередбачені реакції можуть виникнути після застосування препарату, який містить імуноглобулін:
- дрожи, головний біль, запаморочення, гарячка, нудота, реакції алергічного типу, біль у суглобах, зниження артеріального тиску та помірний біль у нижній частині спини можуть виникнути рідко;
- поодинокі випадки тимчасового зниження кількості червоних кров'яних тілець (зворотна гемолітична анемія/гемоліз);
- раптовий спад артеріального тиску може виникнути рідко, а в окремих випадках може виникнути анафілактичний шок, навіть у пацієнта, у якого раніше не виникала гіперчутливість після попередніх застосувань;
- спостерігалися рідкі випадки тимчасових шкірних реакцій;
- дуже рідко виникали ускладнення, пов'язані з тромбозом (утворення тромбів), які можуть призвести до інфаркту міокарда, інсульту, тромбозу легеневої артерії (пульмонемболія), тромбозу глибоких вен;
- виникали випадки тимчасового, не пов'язаного з інфекцією, асеептичного менінгіту (зворотне асеептичне менінгіт);
- спостерігалося підвищення рівня креатиніну в сироватці крові та/або раптова ниркова недостатність;
- виникали випадки гострої поперечної легеневої інфекції (анг. TRALI - Transfusion related acute lung injury).
У клінічних дослідженнях та після введення препарату Ig VENA до обігу спостерігалися наступні непередбачені реакції, перелічені за зменшенням частоти виникнення.
Часто (може стосуватися менше 1 особи з 10)
- Біль у спині
- Нудота
- Чувство слабкості, втома, гарячка
- Біль у м'язах
- Головний біль, сонливість.
Частота невідома (не може бути визначена на основі доступних даних)
- Асеептичний менінгіт
- Розпад червоних кров'яних тілець, який викликає анемію
- Алергічні реакції та загрозливі для життя анафілактичні шоки
- Стан сплутаності
- Інсульт, запаморочення, неконтрольоване дрижання, дрижання або оніміння шкіри чи кінцівок
- Інфаркт міокарда, блідість шкіри, швидке серцебиття, повільне серцебиття, нерегулярне серцебиття
- Тромбоз крові в глибоких венах та кровоносних судинах, низький артеріальний тиск, високий артеріальний тиск, блідість шкіри
- Тромбоз головної легеневої артерії, неправильна кількість рідини в легенях, труднощі з диханням із свистячим диханням або кашлем
- Вомітування, діарея, біль у животі
- Швидко прогресуючий набряк шкіри, кропив'янка, червоність та запалення шкіри, висипка на шкірі, свербіж, екзема, надмірне потіння
- Біль у суглобах та м'язах, біль у спині, біль у шиї, тугорукість м'язів скелета
- Раптова ниркова недостатність
- Запалення вени в місці введення препарату, гарячка, біль чи відчуття дискомфорту в грудній клітці, набряк обличчя, загальне погане самопочуття
- Збільшення рівня креатиніну в крові
Додаткові непередбачені реакції у дітей та підлітків
Необхідно очікувати, що частота, тип та тяжкість непередбачених реакцій у дітей та підлітків будуть такими ж, як і у дорослих.
Після застосування препарату Ig VENA у дітей та підлітків спостерігалося тимчасове та легке підвищення рівня глюкози в сечі (глюкозурія), без клінічних симптомів.
Інформація щодо безпеки щодо вірусів див. пункт 2. «Інформація, яка повинна бути відомою перед застосуванням лікарського препарату Ig VENA».
Звіт про непередбачені реакції
Якщо виникнуть будь-які непередбачені реакції, включаючи всі непередбачені реакції, не перераховані в цій брошурі, необхідно повідомити про це лікаря або медсестру. Непередбачені реакції можна повідомляти до Департаменту моніторингу непередбачених реакцій лікарських засобів Міністерства охорони здоров'я України (вул. Миколи Амосова, 7, м. Київ, 03022),
телефон:
044 279-65-44,
факс:
044 279-65-44,
адреса електронної пошти:
[email protected],
веб-сайт:
http://www.pharmvig.org.ua
Непередбачені реакції також можна повідомляти відповідальному суб'єкту.
5. Як зберігати Ig VENA
Препарат повинен зберігатися в місці, недоступному для дітей.
Не застосовуйте цей препарат після закінчення терміну придатності, зазначеного на етикетці флакона та пачки після «EXP». Термін придатності означає останній день вказаного місяця.
Зберігайте в холодильнику (2°C - 8°C).
До застосування та протягом терміну придатності препарат можна зберігати при кімнатній температурі, не вищій за 25°C, протягом максимум 6 послідовних місяців. Після цього терміну препарат необхідно видалити.
У жодному разі не можна знову помістити препарат до холодильника, якщо він зберігався при кімнатній температурі. На пачці необхідно записати початкову дату зберігання при кімнатній температурі.
Після відкриття флакона вміст необхідно застосувати негайно.
Флакони зберігати в зовнішній упаковці. Не заморожуйте.
Не застосовуйте цей препарат, якщо ви помітили, що розчин став мутним, змінив колір або має видимий осад.
Препарати не слід викидати до каналізації чи домашніх контейнерів для відходів. Необхідно запитати у фармацевта, як видалити препарати, які вже не використовуються. Такий підхід допоможе захистити навколишнє середовище.
6. Зміст упаковки та інші відомості
Що містить препарат Ig VENA
Активною речовиною препарату є людська нормальна імуноглобулін.
1 мл розчину містить 50 мг людської нормальної імуноглобулін.
Розчин містить людський білок 50 г/л, у тому числі не менше 95% IgG (імуноглобулін G).
Розподіл підкласів IgG наступний:
IgG1
62,1%
IgG2
34,8%
IgG3
2,5%
IgG4
0,6%
Максимальний вміст IgA становить 50 мкг/мл.
Препарат виготовлено з плазми донорів крові.
Інші компоненти препарату: мальтоза, вода для ін'єкцій.
Як виглядає препарат Ig VENA та що містить упаковка
Розчин для інфузії Ig VENA доступний у окремих флаконах по 50 мл, 100 мл або 200 мл з встановленим руків'ям (флакон + руків'я). Розчин прозорий або легкий опалесцентний, безбарвний або світло-жовтий.
Величини упаковок:
Одинарні упаковки:
1 флакон містить 2,5 г/50 мл
1 флакон містить 5 г/100 мл
1 флакон містить 10 г/200 мл
Збірні упаковки:
Збірна упаковка, яка містить 2 окремі упаковки по 1 флакону 10 г/200 мл
Збірна упаковка, яка містить 3 окремі упаковки по 1 флакону 10 г/200 мл.
Не всі величини упаковок повинні бути в обігу.
Відповідальний суб'єкт:
Kedrion S.p.A.
Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), Італія
Виробник:
Kedrion S.p.A.
55027 Bolognana, Gallicano (Lucca), Італія
Цей лікарський препарат дозволений до обігу в країнах-членах Європейського економічного простору під наступними назвами:
Таблиця назв препарату в різних країнах
| Австрія | Ig Vena 50г/л розчин для інфузії |
| Німеччина | Ig Vena 50 г/л розчин для інфузії |
| Греція | Ig VENA |
| Італія | IG VENA |
| Польща | Ig VENA |
| Португалія | Ig Vena |
Для отримання більш детальної інформації необхідно звернутися до місцевого представника відповідального суб'єкта:
MB&S Medical Business and Science, вул. Челмська, 30/34, 00-725 Варшава
Телефон/факс: 22 851 52 08
Дата останньої актуалізації брошури: 11/2020
Інформація, призначена виключно для фахового медичного персоналу:
Інструкція правильного застосування
- Перед застосуванням продукту Ig VENA необхідно привести до кімнатної температури або температури тіла.
- Перед застосуванням розчин повинен бути візуально оцінений щодо наявності твердих частинок та забарвлення. Не слід застосовувати розчини, які є мутними або мають осад.
- Людську нормальну імуноглобулін необхідно вводити внутрішньовенно з початковою швидкістю інфузії 0,46 - 0,92 мл/кг/год (10 - 20 крапель на хвилину) протягом 20 - 30 хвилин. У разі виникнення непередбаченої реакції необхідно зменшити швидкість інфузії або припинити введення імуноглобулінів. Якщо препарат добре переноситься, швидкість інфузії можна поступово збільшувати максимум до 1,85 мл/кг/год (40 крапель на хвилину).
- У пацієнтів з первинним імунодефіцитом, які переносили швидкість інфузії 0,92 мл/кг/год, можна поступово збільшувати швидкість введення кожні 20-30 хвилин до 2 мл/кг/год, 4 мл/кг/год та максимум до 6 мл/кг/год, але лише якщо пацієнт добре переносить інфузію. Зазвичай дозування та швидкість інфузії повинні бути індивідуально підібрані для конкретного пацієнта. У залежності від маси тіла пацієнта, дозування та виникнення непередбачених реакцій максимальна швидкість інфузії може не бути досягнута. У разі виникнення непередбачених реакцій необхідно негайно припинити влив та згодом відновити з відповідною для пацієнта швидкістю.
Особливі популяції
У дітей та підлітків (0-18 років) та у осіб похилого віку (>64 роки) початкова швидкість введення повинна становити 0,46 – 0,92 мл/кг/год (10 – 20 крапель на хвилину) протягом 20 - 30 хвилин. Якщо препарат добре переноситься, після урахування клінічного стану пацієнта, швидкість можна поступово збільшувати максимум до 1,85 мл/кг/год (40 крапель на хвилину).
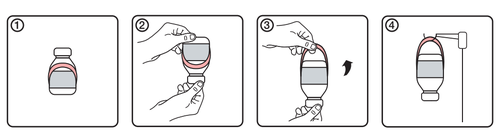
Інструкція використання руків'я
- 1.Початковий вигляд флакона з етикеткою руків'я
- 2.Обернути флакон догори дном
- 3.Створити руків'я шляхом розгортання його з етикетки
- 4. Повісити флакон на стійку для інфузії
Заходи обережності
Деякі важкі непередбачені реакції можуть бути пов'язані зі швидкістю інфузії.
Потенційних ускладнень можна часто уникнути, забезпечивши:
- що пацієнти не мають алергії на людську нормальну імуноглобулін, шляхом початкового повільного введення препарату (швидкість введення 0,46 - 0,92 мл/кг/год);
- що пацієнти ретельно відстежуються та обережно спостерігаються під час інфузії через ризик виникнення непередбачених реакцій. Особливо пацієнти, які отримують людську нормальну імуноглобулін вперше, пацієнти, які раніше приймали інший препарат IVIg, або у разі тривалої перерви після попередньої інфузії, повинні бути відстежені під час інфузії щодо непередбачених реакцій. Інші пацієнти повинні бути спостережені протягом至少 20 хвилин після інфузії.
Діти та підлітки
Відсутні спеціальні рекомендації щодо профілактичних заходів або спостереження у дітей та підлітків. Не варто очікувати різниці у дітей та підлітках (від 0 до 18 років).
Закрепово-заторове захворювання
Існують клінічні дані про зв'язок між внутрішньовенним введенням імуноглобулінів та випадками закрепово-заторового захворювання, такими як інфаркт міокарда, епізод судинного захворювання мозку (в тому числі інсульт), тромбоз легеневої артерії (пульмонемболія) та тромбоз глибоких вен, які вважаються пов'язаними зі відносним збільшенням в'язкості крові після інтенсивного введення імуноглобулінів у пацієнтів групи ризику.
Необхідно проявляти обережність при призначенні та введенні препарату пацієнтам з ожирінням та пацієнтам, у яких існує ризик виникнення станів тромбозу (наприклад, похилий вік, гіпертонія, цукровий діабет та захворювання судин чи стани тромбозу в анамнезі, набуті або вроджені порушення згортання, тривало імобілізовані пацієнти, пацієнти з важкою гіповолемією, пацієнти з захворюваннями, які проявляються збільшенням в'язкості крові).
У пацієнтів з ризиком непередбачених реакцій, пов'язаних з тромбозом, імуноглобуліни для внутрішньовенної інфузії повинні бути введені з мінімальною швидкістю інфузії та у можливо найменшій застосованій дозі.
Гостра ниркова недостатність
Відзначені випадки гострої ниркової недостатності у пацієнтів, які лікувалися імуноглобулінами для внутрішньовенної інфузії. У більшості з них були визначені чинники ризику, такі як існуюча раніше ниркова недостатність, цукровий діабет, важке зниження об'єму крові, надмірна маса тіла, одночасне застосування препаратів з нефротоксичними властивостями або вік понад 65 років.
Необхідно оцінити ниркові параметри перед введенням інфузії IVIg та повторно у відповідних інтервалах часу, особливо у пацієнтів, у яких існує потенційно підвищений ризик виникнення гострої ниркової недостатності. У пацієнтів з ризиком гострої ниркової недостатності імуноглобуліни для внутрішньовенної інфузії повинні бути введені з мінімальною швидкістю інфузії та у можливо найменшій застосованій дозі.
У разі пошкодження ниркової функції необхідно розглянути можливість припинення внутрішньовенної інфузії імуноглобулінів.
Асеептичний менінгіт
Під час лікування імуноглобулінами для внутрішньовенної інфузії відзначені випадки асеептичного менінгіту (анг. AMS - aseptic meningitis syndrome). Синдром зазвичай починається протягом кількох годин до 2 днів після застосування IVIg.
У дослідженнях спинномозкової рідини часто визначається плейцитоз до кількох тисяч клітин на мм, переважно гранулоцитів, та підвищення рівня білка до кількох сотень мг/дл.
AMS може виникнути частіше у зв'язку з лікуванням великими дозами IVIg (2 г/кг).
Пацієнти з об'єктивними та суб'єктивними симптомами повинні бути піддані ретельному неврологічному обстеженню, включаючи дослідження спинномозкової рідини, для виключення інших причин менінгіту.
Припинення лікування IVIg призводило до remisії AMS протягом кількох днів без виникнення ускладнень.
Гемолітична анемія
Продукти імуноглобулінів для внутрішньовенної інфузії можуть містити антитіла проти груп крові, які можуть діяти як гемолізини та індукувати в умовах in vivo оплешування червоних кров'яних тілець імуноглобуліном, що призводить до позитивної безпосередньої реакції антиглобулінової (тест Кумбса) та, рідко, гемолізу.
Гемолітична анемія може розвинутися під час лікування IVIg внаслідок підвищення секвестрації червоних кров'яних тілець. Пацієнти, які отримують внутрішньовенно імуноглобулін, повинні бути відстежені щодо можливості виникнення клінічних симптомів гемолізу.
Нейтропенія/лейкопенія
Після лікування IVIg повідомлялося про тимчасове зниження кількості нейтрофілів та/або епізоди нейтропенії, іноді важких. Зазвичай це відбувається протягом кількох годин або днів після введення IVIg та проходить самостійно протягом 7-14 днів.
Гостра поперечна легенева інфекція (анг. TRALI - Transfusion related acute lung injury)
У пацієнтів, які отримують продукти лікарських засобів IVIg, повідомлялося про окремі випадки гострого некардіогенного набряку легенів (гостра поперечна легенева інфекція - TRALI). TRALI характеризується важким гіпоксією (недостатньою оксигенацією), нирковою недостатністю, порушеннями дихання, ціанозом, гарячкою та недоїданням. Симптоми TRALI зазвичай виникають під час інфузії IVIg, часто протягом 1-2 годин. Тому необхідно відстежувати пацієнтів; у разі виникнення непередбачених реакцій зі сторони дихальної системи необхідно негайно припинити інфузію IVIg. Виникнення TRALI може бути загрозливим для життя, потребує негайного лікування в інтенсивній терапії.
Цей лікарський препарат у 1 мл містить 100 мг мальтози як допоміжну речовину. Наявність мальтози у крові може впливати на результат дослідження глюкози, даючи хибно підвищений показник рівня глюкози у крові, що внаслідок може привести до неправильного застосування інсуліну, яке викликає загрозливу для життя гіпоглікемію та смерть. Крім того, випадки справжньої гіпоглікемії можуть залишитися без лікування, якщо стан гіпоглікемії був замаскований хибно підвищеним показником рівня глюкози. Для отримання додаткової інформації див. пункт «Дослідження рівня глюкози у крові».
Дозування
Замісна терапія повинна бути розпочата і контролюватися лікарем-спеціалістом, який має досвід у лікуванні імунодефіцитних станів.
Дозування
Доза і схема дозування залежать від показань. Дозу необхідно встановити індивідуально для кожного пацієнта залежно від клінічної реакції. Доза, залежна від маси тіла, може потребувати корекції у пацієнтів з недовагою або надвагою.
Нижче наведені способи дозування подані як орієнтовні.
Замісна терапія при первинних імунодефіцитних станах
Дозу необхідно встановити так, щоб досягти рівня IgG (вимірюється перед наступною інфузією) не менше 6 г/л або в межах норми для вікової групи населення. Від початку лікування до досягнення стабільного рівня потрібно три-шість місяців (стабільний рівень IgG). Рекомендується початкова доза 0,4-0,8 г/кг, введена однократно, а потім не менше 0,2 г/кг, вводиться кожні три-чотири тижні. Доза, необхідна для досягнення мінімального рівня IgG 6 г/л, становить 0,2-0,8 г/кг/місяць. Після досягнення стабільного стану інтервали між інфузіями становлять 3-4 тижні. Необхідно визначати і оцінювати рівень імуноглобулінів у відношенні до частоти виникнення інфекцій. Для зменшення частоти виникнення бактеріальних інфекцій може бути необхідне збільшення дози для досягнення вищого рівня.
Вторинні імунодефіцитні стани
Рекомендована доза становить 0,2-0,4 г/кг кожні три-чотири тижні.
Необхідно визначати і оцінювати мінімальний рівень IgG у відношенні до частоти виникнення інфекцій. Дозу необхідно коригувати за необхідності для досягнення належного захисту від інфекцій; може бути необхідне збільшення дози у пацієнтів з тривалими інфекціями; зменшення дози можна розглянути, якщо у пацієнта немає інфекції.
Первинна імунна тромбоцитопенія
Два альтернативних схеми лікування:
- доза 0,8-1,0 г/кг у перший день; доза може бути повторена один раз протягом 3 днів
- 0,4 г/кг на добу протягом двох-п'яти днів. Лікування можна повторити, якщо відбувається рецидив захворювання.
Синдром Гієна-Барре
0,4 г/кг/добу протягом понад 5 днів (можливе повторення дозування у разі рецидиву).
Хвороба Кавасакі
Необхідно вводити 2,0 г/кг однократно. Пацієнти повинні отримувати одночасно ацетилсаліцилову кислоту.
Хронічна запальна демієлінізуюча полінейропатія (CIDP)
Початкова доза: 2 г/кг протягом 2-5 послідовних днів.
Утримувальна доза: 1 г/кг протягом 1-2 послідовних днів кожні 3 тижні.
Ефективність лікування необхідно оцінювати після кожного циклу; якщо спостерігається відсутність ефективності після 6 місяців, лікування необхідно припинити.
Якщо терапія є ефективною, лікар повинен прийняти рішення про довгострокове лікування, враховуючи реакції пацієнта і відповідь на утримувальне лікування. Дозування і інтервали між інфузіями можуть потребувати корекції залежно від індивідуального перебігу захворювання.
Багатофокусна рухова нейропатія (MMN)
Початкова доза: 2 г/кг, вводиться протягом 2-5 послідовних днів.
Утримувальна доза: 1 г/кг кожні 2-4 тижні або 2 г/кг кожні 4-8 тижнів.
Ефективність лікування необхідно оцінювати після кожного циклу; якщо спостерігається відсутність ефективності після 6 місяців, лікування необхідно припинити.
Якщо терапія є ефективною, лікар повинен прийняти рішення про довгострокове лікування, враховуючи реакції пацієнта і відповідь на утримувальне лікування. Дозування і інтервали між інфузіями можуть потребувати корекції залежно від індивідуального перебігу захворювання.
Рекомендоване дозування представлено в нижченаведеній таблиці:
| Показання | Доза | Частота інфузій |
| Замісна терапія | ||
| Первинні імунодефіцитні стани | початкова доза: 0,4-0,8 г/кг, утримувальна доза: 0,2-0,8 г/кг | кожні 3-4 тижні |
| Вторинні імунодефіцитні стани | 0,2-0,4 г/кг | кожні 3-4 тижні |
| Іммуномодулююче лікування | ||
| Первинна імунна тромбоцитопенія | 0,8-1 г/кг або 0,4 г/кг/добу | у перший день, можлива повторна інфузія один раз протягом 3 днів, протягом 2-5 днів |
| Синдром Гієна-Барре | 0,4 г/кг/добу | протягом 5 днів |
| Хвороба Кавасакі | 2 г/кг | однократно в поєднанні з ацетилсаліциловою кислотою |
| Хронічна запальна демієлінізуюча полінейропатія (CIDP) | початкова доза: 2 г/кг, утримувальна доза: 1 г/кг | у роздільних дозах протягом 2-5 днів, кожні 3 тижні протягом 1-2 днів |
| Багатофокусна рухова нейропатія (MMN) | утримувальна доза: 1 г/кг або 2 г/кг | кожні 2-4 тижні або кожні 4-8 тижнів протягом 2-5 днів |
Застосування у дітей і підлітків
Дозування у дітей і підлітків (0-18 років) не відрізняється від того, що застосовується у дорослих, оскільки дозування у окремих показаннях визначається на підставі маси тіла і клінічного стану пацієнта відповідно до вищезазначеного.
Пацієнти з нирковою недостатністю
Відсутні дані про необхідність корекції дозування.
Пацієнти з нирковою недостатністю
Необхідна корекція дози, якщо це клінічно обґрунтовано.
Особи похилого віку
Необхідна корекція дози, якщо це клінічно обґрунтовано.
CIDP
Через рідкість хронічної запальної демієлінізуючої полінейропатії та, як наслідок, малу кількість пацієнтів, дані про застосування імуноглобулінів для внутрішньовенної інфузії у дітей з CIDP обмежені; тому доступні лише дані з літератури.
Однак опубліковані дані узгоджені і всі свідчать про те, що лікування IVIg у дорослих і дітей є однаково ефективним, як і у випадку затверджених раніше показань.
- Країна реєстрації
- Діючі речовини
- Потрібен рецептНі
- Виробник
- ІмпортерKedrion S.p.A.
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Іг ВенаДіючі речовини: immunoglobulins, normal human, for intravascular adm.Виробник: Baxalta Belgium Manufacturing S.A.Потрібен рецептФорма випуску: Розчин, 100 мг/млДіючі речовини: immunoglobulins, normal human, for intravascular adm.Виробник: Instituto Grifols S.A.Потрібен рецептФорма випуску: Розчин, 50 г/л (50 мг/мл)Діючі речовини: immunoglobulins, normal human, for intravascular adm.Виробник: Biotest Pharma GmbHПотрібен рецепт
Аналоги Іг Вена в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Іг Вена у Іспанія
Аналог Іг Вена у Україна
Лікарі онлайн щодо Іг Вена
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Іг Вена – за рішенням лікаря та згідно з місцевими правилами.














