

Феиба Нф

Спросите врача о рецепте на Феиба Нф

Инструкция по применению Феиба Нф
Инструкция, прилагаемая к упаковке: информация для пользователя
FEIBA NF, 500 ЕД, порошок и растворитель для приготовления раствора для инъекций
Комплекс факторов свертывания крови, противодействующий ингибитору фактора VIII
Прежде чем использовать лекарство, необходимо внимательно ознакомиться с содержанием инструкции, поскольку она содержит важную информацию для пациента.
- Необходимо сохранить инструкцию, чтобы в случае необходимости можно было ее повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу, фармацевту или медсестре.
- Это лекарство назначено конкретному человеку. Не следует передавать его другим. Лекарство может нанести вред другому человеку, даже если симптомы его заболевания такие же.
- Если у пациента出现 любые нежелательные реакции, включая любые нежелательные реакции, не указанные в этой инструкции, необходимо сообщить об этом врачу, фармацевту или медсестре. См. пункт 4.
Содержание инструкции
- 1. Что такое лекарство FEIBA NF и для чего оно используется
- 2. Важные сведения перед использованием лекарства FEIBA NF
- 3. Как использовать лекарство FEIBA NF
- 4. Возможные нежелательные реакции
- 5. Как хранить лекарство FEIBA NF
- 6. Содержание упаковки и другие сведения
1. Что такое лекарство FEIBA NF и для чего оно используется
FEIBA NF - это лекарство, полученное из человеческой плазмы крови, которое позволяет крови свертываться в случае дефицита или отсутствия некоторых факторов свертывания. Лекарство FEIBA NF используется для лечения кровотечений и предотвращения кровотечений у пациентов с гемофилией А и гемофилией Б, осложненных наличием ингибиторов факторов свертывания. Кроме того, лекарство FEIBA NF может использоваться для лечения и предотвращения кровотечений у людей, не страдающих гемофилией, но имеющих приобретенные ингибиторы факторов VIII, IX и XI. Существуют единичные сообщения об использовании FEIBA NF в лечении пациентов с приобретенными ингибиторами факторов X и XIII. Лекарство FEIBA NF также используется в сочетании с концентратом фактора VIII во время длительного лечения, направленного на полное и постоянное устранение ингибиторов фактора VIII, чтобы ermögнить регулярное лечение концентратом фактора VIII, как у пациентов без ингибиторов.
2. Важные сведения перед использованием лекарства FEIBA NF
Необходимо проинформировать врача, если у пациента есть аллергия. Необходимо проинформировать врача, если пациент придерживается диеты с низким содержанием натрия.
Когда не использовать лекарство FEIBA NF
В ситуациях, перечисленных ниже, лекарство FEIBA NF должно использоваться только тогда, когда не можно ожидать результатов лечения с помощью других подходящих концентратов факторов свертывания, например, из-за очень высокого титра ингибитора и угрожающего жизни кровотечения или риска кровотечения (травматического, послеоперационного).
- Если у пациента выявлена аллергия (чувствительность) к комплексу факторов свертывания, противодействующему ингибитору фактора VIII, или к любому другому компоненту лекарства FEIBA NF.
- Если существует распространенное внутрисосудистое свертывание (DIC, коагулопатия с потреблением, угрожающее жизни состояние, связанное с массированным свертыванием крови с образованием тромбов в сосудах. Это приводит к общему истощению факторов свертывания.): когда результаты лабораторных исследований и (или) клинические симптомы указывают на повреждение печени, существует повышенный риск DIC из-за задержки деградации активных факторов свертывания;
- В случае коронарной болезни сердца, острой тромбозы и (или) эмболий: лекарство FEIBA NF должно использоваться только в случаях угрожающих жизни кровотечений.
Предостережения и меры предосторожности
Прежде чем использовать FEIBA NF, необходимо связаться с врачом, поскольку, как и в случае с другими плазменными продуктами, вводимыми внутривенно, возможно возникновение аллергических реакций. Пациент должен уметь распознавать ранние симптомы аллергической реакции, такие как:
- краснота
- высыпание на коже
- зудящее высыпание (крапивница)
- зуд
- отек губ и языка
- свистящее дыхание
- чувство сдавления в груди
- недомогание
- головокружение
- внезапное падение артериального давления, чтобы как можно раньше распознать аллергическую реакцию.
Другими симптомами аллергической реакции на плазменные продукты являются кома и беспокойство. В случае возникновения одного или нескольких из этих симптомов необходимо немедленно прекратить использование лекарства и связаться с врачом. Указанные симптомы могут быть ранними признаками анафилактического шока. Тяжелые симптомы аллергической реакции требуют немедленного оказания экстренной помощи. В случае пациентов с подозрением на аллергическую реакцию на лекарство или любой из его компонентов, врач решает о повторном введении лекарства FEIBA NF только после тщательного рассмотрения риска и ожидаемой пользы и (или) когда не можно ожидать результатов лечения с помощью другой профилактической или альтернативной терапии.
- Если у пациента возникают значительные изменения артериального давления или частоты сердечных сокращений, трудности с дыханием, кашель или боль в груди. Необходимо немедленно прекратить введение лекарства и связаться с врачом. Врач примет необходимые диагностические и терапевтические меры.
- У пациентов с гемофилией и наличием ингибитора или приобретенных ингибиторов к факторам свертывания. Во время лечения лекарством FEIBA NF у этих пациентов может возникать повышенная тенденция к кровотечениям и одновременно повышенный риск тромбозов.
Во время лечения лекарством FEIBA NF возникали тромбозные осложнения, включая распространенное внутрисосудистое свертывание (DIC), венозный тромбоз, легочную эмболию, инфаркт миокарда и инсульт. Некоторые тромбозные осложнения возникали при использовании высоких доз лекарства FEIBA NF. Одновременное использование рекомбинантного фактора VIIа может повышать риск возникновения тромбозных осложнений. Случаи микроангиопатической тромботической анемии сообщались в клиническом исследовании эмицизумаба, в котором пациенты получали лекарство FEIBA NF в качестве части схемы лечения кровотечения. В случае лекарств, изготовленных из человеческой крови или плазмы, принимаются определенные меры предосторожности, чтобы предотвратить инфекции, передающиеся пациентам. К этим мерам относятся тщательный отбор доноров крови и плазмы, чтобы убедиться, что те, кто находится в группе риска передачи инфекций, исключены, а также проверка отдельных проб донованной крови и пула собранной плазмы на вирусы/инфекции. Производители этих продуктов включают в процесс обработки крови и плазмы этапы, направленные на инактивацию или удаление вирусов. Несмотря на такие меры, при введении лекарств, изготовленных из человеческой крови или плазмы, нельзя полностью исключить возможность передачи инфекции. Это относится также к неизвестным или недавно обнаруженным вирусам или другим типам инфекций. Принимаемые меры считаются эффективными против вирусов с оболочкой, таких как вирус иммунодефицита человека (ВИЧ, вызывающий СПИД), вирус гепатита Б и вирус гепатита С, а также против безоболочечного вируса гепатита А. Принимаемые меры могут иметь ограниченную ценность против безоболочечных вирусов, таких как парвовирус В19. Инфекция парвовирусом В19 может быть серьезной у беременных женщин (инфекция плода) и для людей с иммунодефицитом или повышенной эритропоэзой (например, гемолитическая анемия). У пациентов, регулярно или многократно получающих фактор VIII, полученный из человеческой плазмы, следует рассмотреть возможность проведения соответствующих вакцинаций (против вирусного гепатита А и Б). После введения высоких доз лекарства FEIBA NF может возникнуть временный рост пассивно переданных антител к поверхностному антигену вируса гепатита Б, что может привести к ложноположительным результатам серологических тестов. Лекарство содержит изогемагглютинины, антитела к красным кровяным клеткам, которые могут пассивно передаваться и вызывать путаницу в результатах серологических тестов. Следует обязательно записывать название и номер серии лекарства при каждом введении пациенту, чтобы сохранить информацию о использованных сериях.
FEIBA NF и другие лекарства
Необходимо проинформировать врача о всех лекарствах, которые пациент принимает в настоящее время или принимал recently, включая те, которые доступны без рецепта. Не проводились соответствующие и хорошо контролируемые исследования по лечению в комбинации или последовательно с использованием FEIBA NF и рекомбинантного фактора VIIа, лекарств, ингибирующих фибринолиз, или эмицизумаба. Необходимо рассмотреть возможность возникновения тромбозных осложнений при одновременном использовании системных лекарств, ингибирующих фибринолиз, таких как, например, транексамовая кислота и аминокапроновая кислота, в сочетании с FEIBA NF. Поэтому лекарства, ингибирующие фибринолиз, не должны использоваться в течение примерно 6-12 часов после введения FEIBA NF. В отношении доступных данных исследований in vitro и клинических наблюдений, при одновременном использовании рекомбинантного фактора VIIа, нельзя исключить возможность потенциального взаимодействия лекарств, которое может привести к тромбозному осложнению. Если лечение лекарством FEIBA NF рассматривается после того, как пациент получал эмицизумаб, пациент должен быть внимательно отслежен врачом. Как и в случае со всеми лекарственными продуктами факторов свертывания, не следует смешивать лекарство FEIBA NF с другими лекарствами перед введением; это может негативно повлиять на эффективность и безопасность лекарства. Рекомендуется, чтобы перед и после введения лекарства FEIBA NF вход в вену промывался изотоническим раствором хлорида натрия.
Беременность, грудное вскармливание и влияние на фертильность
Врач решает, можно ли использовать FEIBA NF во время беременности или грудного вскармливания. Учитывая повышенный риск тромбозов во время беременности, лекарство FEIBA NF должно использоваться только под строгим медицинским контролем и когда это явно показано.
Вождение транспортных средств и эксплуатация механизмов
Не наблюдалось никакого влияния на способность вождения транспортных средств и эксплуатации механизмов.
FEIBA NF содержит натрий
Лекарство содержит 80 мг натрия (основного компонента поваренной соли) в каждой флаконе. Это соответствует 4% максимальной рекомендуемой суточной дозы натрия в диете для взрослых.
3. Как использовать лекарство FEIBA NF
Лиофилизированный порошок FEIBA NF растворяется в прилагаемом растворителе и вводится внутривенно. Лекарство FEIBA NF должно использоваться строго по рекомендации врача. В случае сомнений необходимо обратиться к врачу или фармацевту. Врач устанавливает подходящую дозу и частоту введения индивидуально для каждого пациента, учитывая тяжесть нарушения свертывания крови, местоположение и объем кровотечения, а также общее состояние пациента и его реакцию на лекарство. Не следует самостоятельно изменять дозировку лекарства, установленную врачом, или прекращать его введение. Если пациент чувствует, что лекарство действует слишком сильно или слишком слабо, необходимо связаться с врачом или фармацевтом. Перед введением необходимо нагреть лекарство до комнатной температуры или температуры тела, если это необходимо. Лекарство FEIBA NF должно готовиться непосредственно перед введением. Приготовленный раствор должен использоваться немедленно (лекарство не содержит консервантов). Аккуратно перемешать вращательным движением до полного растворения порошка. Необходимо убедиться, что лекарство FEIBA NF полностью растворилось, в противном случае через фильтр прибора пройдет меньше единиц FEIBA. Не следует использовать раствор, который является мутным или содержит осад. Не использовать раствор из ранее открытых флаконов. Использовать только прилагаемый растворитель (стерильную воду для инъекций) и набор для приготовления раствора. Если используется другой набор для приготовления и введения, чем прилагаемый в упаковке FEIBA NF, необходимо убедиться, что используется подходящий фильтр с размером пор не менее 149 мкм. Не использовать, если система поддержания стерильности или упаковка лекарства повреждены или испорчены. Записать введение лекарства на прилагаемой самоклеящейся этикетке. Все неиспользованные остатки лекарства или его отходы должны утилизироваться в соответствии с местными правилами. Введение с использованием игл:
Приготовление раствора для инъекций
Необходимо соблюдать правила асептики во время всей процедуры.
- 1. Нагреть закрытую флакону с растворителем (стерильной водой для инъекций) до комнатной температуры, если это необходимо, например, используя для нагрева водяную баню в течение нескольких минут (макс. 37°C).
- 2. Удалить защитные колпачки с флаконов с порошком и растворителем и продезинфицировать резиновые пробки обеих флаконов.
- 3. Повернув и потянув, удалить защитный колпачок с одного конца прилагаемой двусторонней иглы (рис. А) и вставить открытый конец иглы в пробку флакона с растворителем (рис. Б).
- 4. Удалить защитный колпачок с другого конца двусторонней иглы, обращая внимание, чтобы не коснуться открытой части.
- 5. Перевернуть флакон с растворителем вверх дном над флаконом с порошком и вставить свободный конец двусторонней иглы в резиновую пробку флакона с порошком (рис. Д). Растворитель будет всосан в флакон с порошком на основе вакуума.
- 6. Отсоединить обе флаконы, вытащив иглу из флакона с порошком (рис. Е). Аккуратно встряхнуть или повернуть флакон с порошком, чтобы ускорить процесс растворения.
- 7. После завершения процесса растворения порошка вставить иглу с воздушным клапаном (рис. Ф), и образовавшаяся пена исчезнет. Удалить иглу с воздушным клапаном.
Введение/инфузия:
Необходимо соблюдать правила асептики во время всей процедуры.
- 1. Удалить защитный колпачок с прилагаемой иглы с фильтром, повернув и потянув, и надеть иглу на стерильный шприц для одноразового использования. Взять раствор в шприц (рис. Г).
- 2. Отсоединить иглу с фильтром от шприца и, после надеть прилагаемый инфузионный набор с иглой-бабочкой (или одноразовой иглой для инъекций), ввести раствор медленно внутривенно. Для контроля скорости введения может использоваться шприцевый насос.
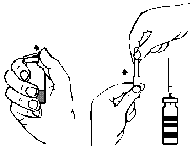
рис. А рис. Б рис. В рис. Г рис. Д рис. Е рис. Ж
Введение с использованием BAXJECT II Hi-Flow
Приготовление раствора для инъекций
Необходимо соблюдать правила асептики во время всей процедуры.
- 1. Довести флакон с растворителем (стерильной водой для инъекций) до комнатной температуры, если это необходимо, например, используя для нагрева водяную баню в течение нескольких минут (макс. 37°C).
- 2. Удалить защитные колпачки с флаконов с порошком и растворителем и продезинфицировать резиновые пробки обеих флаконов. Поместить флаконы на плоскую поверхность.
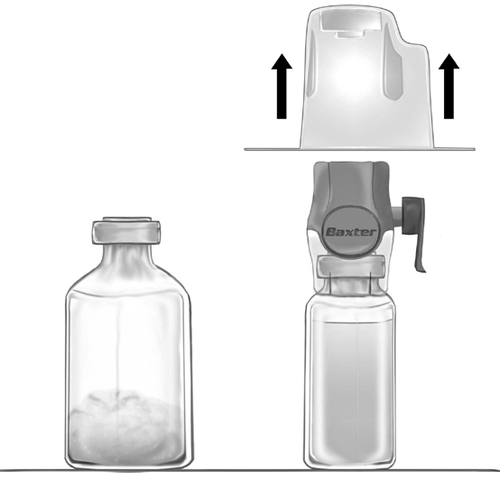
- 3. Открыть упаковку устройства BAXJECT II Hi-Flow, оторвав бумажную крышку, не касаясь внутренней части (рис. а). Не вынимать устройство из упаковки.
- 4. Перевернуть упаковку вверх дном и проколоть прозрачную пластиковую иглу через пробку флакона с растворителем (рис. б). Держа упаковку за края, снять ее с устройства BAXJECT II Hi-Flow (рис. в). Не удалять синюю пробку с устройства BAXJECT II Hi-Flow.
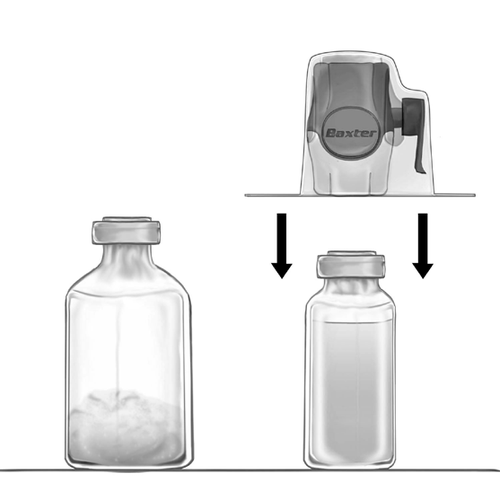
- 5. Устройство BAXJECT II Hi-Flow, соединенное с флаконом с растворителем, перевернуть так, чтобы флакон с растворителем был над устройством. Проколоть белую пластиковую иглу через пробку флакона с порошком FEIBA NF. Под действием вакуума растворитель будет всосан в флакон с порошком FEIBA NF (рис. д).
- 6. Аккуратно перемешать, вращательным движением, но без встряхивания, до полного растворения продукта. Необходимо убедиться, что FEIBA NF полностью растворился – в противном случае активное вещество не пройдет через фильтр устройства.
рис. а
рис. б
рис. в

Введение/инфузия
Необходимо соблюдать правила асептики во время всей процедуры
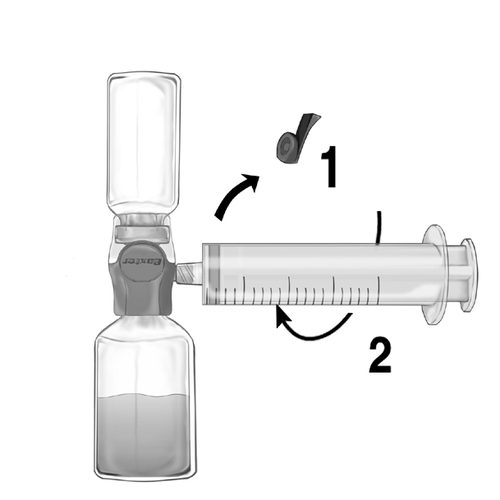
- 1. Удалить синюю пробку с устройства BAXJECT II Hi-Flow. Тщательно соединить шприц с устройством BAXJECT II Hi-Flow (НЕ ВЗЯТЬ ВОЗДУХ В ШПРИЦ) Для обеспечения герметичного соединения между шприцем и устройством BAXJECT II Hi-Flow особенно рекомендуется использовать шприц с концом типа луэр (закрепляя шприц, необходимо повернуть его по часовой стрелке до момента остановки) (рис. е).
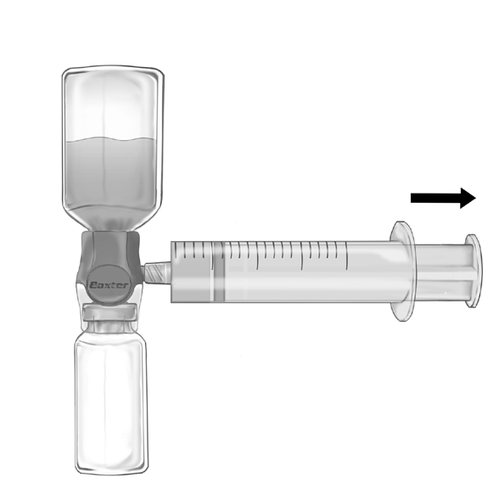
- 2. Перевернуть набор так, чтобы раствор был сверху. Взять раствор в шприц, МЕДЛЕННО потянув за поршень назад и убедившись, что соединение между шприцем и устройством BAXJECT II Hi-Flow герметично и шприц закреплен во время всего процесса взятия раствора (рис. ф).
- 3. Отсоединить шприц.
- 4. Если в шприце появился пенящийся раствор, необходимо подождать до исчезновения пены. Раствор медленно вводить внутривенно, используя инфузионный набор (или одноразовую иглу для инъекций). Для контроля скорости введения может использоваться шприцевой насос.
рис. д
рис. е
рис. ж

Не следует превышать скорость 2 единицы FEIBA на кг веса тела в минуту.
В случае приема большей дозы, чем рекомендована:
Необходимо немедленно проинформировать врача. Передозировка FEIBA NF может увеличить риск нежелательных реакций, таких как тромбозные осложнения (образование тромбов, которые перемещаются в кровеносных сосудах), коагулопатия с потреблением (нарушение свертывания крови DIC) или инфаркт миокарда.
4. Возможные нежелательные реакции
Как и любой лекарственный препарат, это лекарство может вызывать нежелательные реакции, хотя они не возникают у каждого.
Если ухудшится любой из симптомов нежелательных реакций или возникнут какие-либо симптомы нежелательных реакций, не указанные в инструкции, необходимо сообщить об этом врачу или фармацевту.
Следующие частоты были использованы для оценки нежелательных реакций:
Очень часто: может возникать более чем у 1 из 10 человек
Часто: может возникать до 1 из 10 человек
Не очень часто: может возникать до 1 из 100 человек
Редко: может возникать у 1 из 1000 человек
Очень редко: может возникать до 1 человека из 10 000 человек
Неизвестно: частота не может быть определена на основе доступных данных
В клинических исследованиях следующие нежелательные реакции были зарегистрированы как частые:
Аллергические реакции,
Головная боль,
Головокружение,
Низкое артериальное давление,
Высыпание
Положительный результат антител к поверхностному антигену вируса гепатита Б.
В исследованиях, проведенных после введения лекарства в обращение, следующие нежелательные реакции были зарегистрированы с частотой, не известной:
Нарушения крови и лимфатической системы: распространенное внутрисосудистое свертывание (DIC); повышение титра ингибитора
Нарушения иммунной системы: аллергические реакции, зудящее высыпание на коже (крапивница)
Нарушения нервной системы: онемение конечностей (парестезия), неправильное или ослабленное чувство (дисестезия), инсульт (ишемический, эмболический), сонливость, нарушения вкуса
Нарушения сердца: инфаркт миокарда (инфаркт), частое сердцебиение (тахикардия)
Нарушения сосудов: образование тромбов, которые перемещаются в кровеносных сосудах (тромбозные осложнения), повышение артериального давления (гипертония), внезапное покраснение
Нарушения дыхательной системы, груди и средостения: эмболия легочной артерии (легочная эмболия), сужение дыхательных путей (бронхоспазм), свистящее дыхание, кашель, одышка (диспноэ)
Нарушения желудка и кишечника: рвота, диарея, дискомфорт в животе, тошнота
Нарушения кожи и подкожной клетчатки: онемение лица, отек лица, языка и губ (ангиоэдем), зудящее высыпание на коже (крапивница), зуд (прурит)
Нарушения общего состояния и местные реакции: боль в месте введения, общее плохое самочувствие, чувство жара, озноб, лихорадка, боль в груди, дискомфорт в груди
Исследования: падение артериального давления
Быстрое внутривенное введение может вызвать колющий боль и онемение лица и конечностей, а также падение артериального давления.
Инфаркты миокарда возникали после введения доз, превышающих максимальную суточную дозу, и (или) после длительного использования и (или) при наличии факторов риска, предрасполагающих к тромбозным осложнениям.
Сообщение о нежелательных реакциях
Если возникают какие-либо нежелательные реакции, включая любые нежелательные реакции, не указанные в инструкции, необходимо сообщить об этом врачу или фармацевту. Нежелательные реакции можно сообщать trực tiếp в Департамент мониторинга нежелательных реакций лекарственных средств Управления по регистрации лекарственных средств, медицинских изделий и биоцидных продуктов Ал. Ерозолимских 181С 02-222 Варшава Тел.: + 48 22 49 21 301 Факс: + 48 22 49 21 309 Сайт: https://smz.ezdrowie.gov.pl Нежелательные реакции можно также сообщать в организацию, ответственное за лекарственный препарат. Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности использования лекарства.
5. Как хранить лекарство FEIBA NF
Хранить в месте, недоступном для детей.
Не хранить при температуре выше 25°C. Не замораживать.
Хранить лекарство в оригинальной упаковке, чтобы защитить от света.
Не следует использовать лекарство FEIBA NF после истечения срока годности, указанного на упаковке.
Срок годности указывает последний день месяца.
Лекарства не следует выбрасывать в канализацию или в домашние мусорные контейнеры. Необходимо спросить у фармацевта, что делать с лекарствами, которые больше не нужны. Такое поведение поможет защитить окружающую среду.
6. Содержание упаковки и другие сведения
Что содержит FEIBA NF
Порошок
- Активным веществом является фактор VIII с обходным действием на ингибитор. 1 флакон содержит 500 ЕД фактора VIII с обходным действием на ингибитор в 200-600 мг белка человеческой плазмы.
- FEIBA NF также содержит факторы II, IX и X, в основном в неактивной форме, а также активированный фактор VII. Антиген коагуляционного фактора VIII (F VIII C:Ag) и факторы калликреин-кининовой системы присутствуют только в следовых количествах или вообще не присутствуют.
- Другими компонентами лекарства являются хлорид натрия и цитрат натрия
Растворитель
- Вода для инъекций
Как выглядит FEIBA NF и что содержит упаковка
Лекарство выпускается в виде лиофилизированного порошка или мелкой твердой субстанции белого или бледно-зеленого цвета.
Порошок и растворитель поставляются в стеклянных флаконах, закрытых резиновыми пробками.
Значение pH раствора после реconstitution составляет между 6,8 и 7,6.
Размер упаковки: 1 набор
Содержание упаковки (с иглами):
1 флакон с 500 ЕД FEIBA NF, закрытый резиновой пробкой
1 флакон с 20 мл воды для инъекций, закрытый резиновой пробкой
1 двусторонняя игла
1 игла с воздушным клапаном
1 шприц для одноразового использования
1 игла для инъекций
1 игла с фильтром
1 игла-бабочка (инфузионный набор с иглой-бабочкой)
Содержание упаковки (с BAXJECT II Hi-Flow):
1 флакон с 500 ЕД FEIBA NF, закрытый резиновой пробкой
1 флакон с 20 мл воды для инъекций, закрытый резиновой пробкой
1 BAXJECT II Hi-Flow - бесигловое устройство для переноса, используемое для переноса в шприц и смешивания лекарств, содержащихся в двух флаконах
1 шприц для одноразового использования
1 игла для инъекций
1 игла-бабочка (инфузионный набор с иглой-бабочкой)
Ответственное лицо и производитель:
Ответственное лицо:
Takeda Pharma Sp. z o.o.
ул. Проста 68
00-838 Варшава
Производитель:
Baxter AG, Industriestrasse 67, A-1220 Вена, Австрия
Takeda Manufacturing Austria AG, Industriestrasse 67, 1221 Вена, Австрия
Дата последней актуализации инструкции:
-----------------------------------------------------------------------------------------------------------------
Информация, предназначенная только для медицинского персонала:
Лечение должно быть начато и контролироваться врачом, имеющим опыт в лечении гемофилии.
Дозирование
Дозирование и продолжительность лечения зависят от тяжести нарушения свертывания крови, местоположения и объема кровотечения, а также от клинического состояния пациента.
Доза, а также частота введения должны быть всегда направлены на клиническую эффективность в данном случае.
Обычно рекомендуется доза 50-100 ЕД FEIBA на кг веса тела, однако не следует превышать однократную дозу 100 ЕД/кг и максимальную суточную дозу 200 ЕД/кг, если только тяжесть кровотечения не требует и не оправдывает использование более высоких доз.
Учитывая специфические факторы, связанные с данным пациентом, ответ на комплекс факторов с обходным действием на ингибитор фактора VIII может быть разной, и в определенных случаях кровотечения у пациента, у которого ответ на один из факторов является недостаточным, следует рассмотреть использование другого фактора.
Дети и подростки
Опыт использования у детей в возрасте до 6 лет ограничен; схема дозирования такая же, как для взрослых, необходимо скорректировать в зависимости от клинического состояния ребенка.
- 1)
Самостоятельные кровотечения
Кровотечения в суставах, мышцах и мягких тканях
В случаях легких или умеренных кровотечений рекомендуется доза 50-75 ЕД/кг в 12-часовых интервалах. Лечение должно продолжаться до тех пор, пока не будет достигнута явная клиническая улучшение, такая как исчезновение боли, уменьшение отека или восстановление подвижности сустава.
В случаях тяжелых кровотечений в мышцах и мягких тканях, таких как кровотечения в забрюшинное пространство, рекомендуется доза 100 ЕД/кг в 12-часовых интервалах.
Кровотечения из слизистых оболочек
Рекомендуется доза 50 ЕД/кг каждые 6 часов с тщательным наблюдением за пациентом (наблюдение за поверхностью кровотечения, повторные определения гематокрита у пациента). Если кровотечение не останавливается, дозу можно увеличить до 100 ЕД/кг. Не следует превышать максимальную суточную дозу 200 ЕД/кг.
Другие тяжелые кровотечения
В тяжелых кровотечениях, таких как кровотечение в центральную нервную систему, рекомендуется доза 100 ЕД/кг в 12-часовых интервалах. В отдельных случаях можно вводить FEIBA NF в 6-часовых интервалах до тех пор, пока не будет достигнута явная клиническая улучшение. Не следует превышать максимальную суточную дозу 200 ЕД/кг!
- 2)
Хирургические операции
Вводить 50-100 ЕД/кг в 6-часовых интервалах, обращая внимание, чтобы не превышать максимальную суточную дозу.
- 3)
Профилактика
- Профилактическое лечение кровотечений у пациентов с высоким титром ингибитора и частыми кровотечениями, у которых индукция толерантности к иммунному ответу (ITI) не удалась или не рассматривается: Рекомендуется доза 70-100 ЕД/кг каждые 2 дня. Если кровотечение у пациента не останавливается, дозу можно увеличить до 100 ЕД/кг, вводимых ежедневно, или постепенно уменьшать.
- Профилактическое лечение кровотечений у пациентов с высоким титром ингибиторов во время индукции толерантности к иммунному ответу (ITI): Лекарство FEIBA NF можно вводить одновременно с концентратами фактора VIII в дозах 50-100 ЕД/кг дважды в день, пока титр ингибитора фактора VIII не снизится до <2 БЮ*.< li>
Мониторинг
Учитывая сложный механизм действия, нет прямого способа мониторинга активных веществ. Исследования системы свертывания крови, такие как время свертывания крови (WBCT), тромбоэластограмма (TEG, r-коэффициент) и аПТТ, обычно показывают незначительные изменения и могут не отражать клиническую улучшение. Поэтому эти исследования имеют ограниченную ценность в мониторинге лечения лекарством FEIBA NF.
Способ введения
Лекарство FEIBA NF должно вводиться медленно внутривенно (не быстрее 2 ЕД/кг/мин). FEIBA NF должно готовиться непосредственно перед введением. Раствор должен использоваться немедленно (не содержит консервантов). Не следует использовать раствор, который является мутным или содержит осад. Неиспользованные остатки раствора должны утилизироваться в соответствии с действующей процедурой.
Мониторинг лечения
Не следует превышать однократные дозы, составляющие 100 ЕД/кг, и максимальную суточную дозу 200 ЕД/кг. Пациенты, получающие более 100 ЕД/кг, должны быть под наблюдением на предмет возникновения DIC и (или) острой коронарной болезни. Большие дозы FEIBA NF должны вводиться только в течение периода, необходимого для остановки кровотечения. В случаях возникновения значительных изменений артериального давления, частоты сердечных сокращений, нарушений дыхания, боли в груди и кашля необходимо немедленно прекратить введение лекарства и провести соответствующие диагностические и терапевтические меры. Результатами лабораторных исследований, указывающими на DIC, являются: снижение содержания фибриногена, снижение количества тромбоцитов и наличие продуктов деградации фибрина/фибриногена (FDP). Дальнейшими симптомами возникновения DIC являются значительное удлинение времени тромбина, протромбина или аПТТ. У пациентов, страдающих гемофилией, осложненной наличием ингибитора, или у пациентов с приобретенными ингибиторами факторов VIII, IX, X и XI, аПТТ может быть удлинено в связи с самим нарушением свертывания. Введение лекарства FEIBA NF пациентам с ингибиторами может привести к первоначальному анамнестическому повышению уровня ингибитора. Под действием дальнейшего введения FEIBA NF уровень ингибитора может снижаться с течением времени. Клинические и литературные данные указывают, что эффективность FEIBA NF не снижается. Во время введения FEIBA NF у пациентов, страдающих гемофилией, осложненной наличием ингибитора, или у пациентов с приобретенными ингибиторами факторов свертывания, может возникать одновременно склонность к кровотечениям и повышенный риск тромбозов.
Исследования и клиническая эффективность
Результаты исследований in vitro для оценки эффективности лечения, такие как аПТТ, время свертывания крови и тромбоэластограмма (TEG), могут не отражать клиническую улучшение. Поэтому попытки восстановить нормальные значения этих параметров путем увеличения доз FEIBA NF могут быть ненадежными и следует их избегать из-за возможности возникновения DIC, вызванного передозировкой.
Значение количества тромбоцитов
В случае недостаточной реакции на лечение лекарством FEIBA NF рекомендуется определить количество тромбоцитов, поскольку достаточное количество функционально активных тромбоцитов необходимо для эффективности FEIBA NF.
Дополнительные сведения о устройстве Baxject II Hi-Flow:
- Устройство стерилизуется гамма-излучением.
- Предназначено только для одноразового использования.
- Не содержит латекс.

Не использовать в случае повреждения упаковки. BAXJECT и FEIBA являются зарегистрированными товарными знаками Baxalta Incorporated.
- Страна регистрации
- Активное вещество
- Требуется рецептДа
- Производитель
- ИмпортерTakeda Manufacturing Austria AG
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Феиба НфФорма выпуска: Порошок, 1000 МЕ (1000 МЕ FEIBA), 50 МЕ/млАктивное вещество: factor VIII inhibitor bypassing activityПроизводитель: Takeda Manufacturing Austria AGТребуется рецептФорма выпуска: Порошок, 500 МЕ (500 МЕ FEIBA), 50 МЕ/млАктивное вещество: factor VIII inhibitor bypassing activityПроизводитель: Takeda Manufacturing Austria AGТребуется рецептФорма выпуска: Порошок, 2500 МЕ (2500 МЕ FEIBA), 50 МЕ/млАктивное вещество: factor VIII inhibitor bypassing activityПроизводитель: Takeda Manufacturing Austria AGТребуется рецепт
Аналоги Феиба Нф в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Феиба Нф в España
Врачи онлайн по Феиба Нф
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Феиба Нф – по решению врача и с учетом местных правил.














