
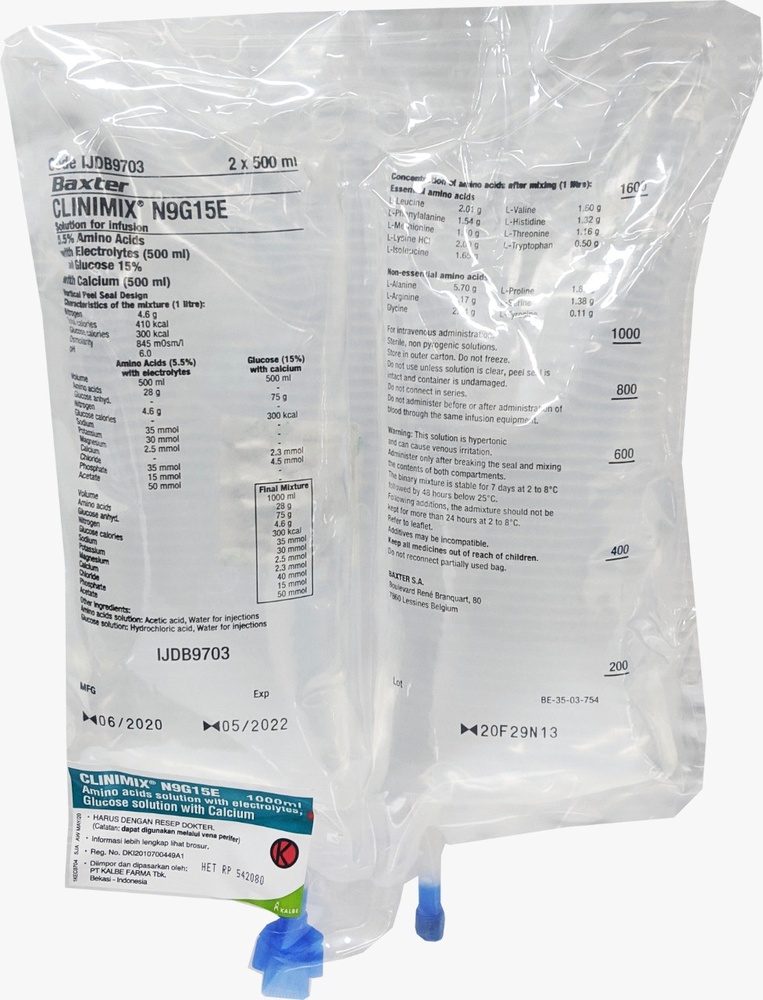
Цлинимикс Н9г15е

Спросите врача о рецепте на Цлинимикс Н9г15е

Инструкция по применению Цлинимикс Н9г15е
Инструкция, прилагаемая к упаковке: информация для пользователя
CLINIMIX N9G15E
раствор для инфузии
Прежде чем использовать лекарство, необходимо внимательно ознакомиться с содержанием инструкции, поскольку она содержит важную информацию для пациента.
- Необходимо сохранить эту инструкцию, чтобы в случае необходимости можно было ее повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу или медсестре.
- Если у пациента出现ы какие-либо нежелательные реакции, включая любые нежелательные реакции, не указанные в этой инструкции, необходимо сообщить об этом врачу или медсестре. См. пункт 4.
Содержание инструкции
- 1. Что такое лекарство CLINIMIX и для чего оно используется
- 2. Важные сведения перед использованием лекарства CLINIMIX
- 3. Как принимать лекарство CLINIMIX
- 4. Возможные нежелательные реакции
- 5. Как хранить лекарство CLINIMIX
- 6. Состав упаковки и другие сведения
1. Что такое лекарство CLINIMIX и для чего оно используется
Лекарство CLINIMIX представляет собой раствор для инфузии. Оно поставляется в двухкамерных мешках. Одна камера содержит раствор аминокислот с электролитами, другая - раствор глюкозы с кальцием. Камеры разделены разрывным швом. Содержимое обеих камер необходимо смешать непосредственно перед введением пациенту путем сжатия или скручивания мешка сверху для разрыва шва. Лекарство CLINIMIX вводится через внутривенное вливание для обеспечения питательных веществ взрослым и детям, когда пероральное питание нецелесообразно. CLINIMIX может быть введен только под контролем врача.
2. Важные сведения перед использованием лекарства CLINIMIX
Когда не использовать лекарство CLINIMIX
- если у пациента выявлена аллергия на любой из компонентов лекарства (перечисленных в пункте 6)
- если использование некоторых аминокислот вызывает проблемы для организма пациента
- если у пациента слишком высокая концентрация сахара в крови (тяжелая гипергликемия)
- если кровь пациента имеет слишком кислую реакцию (метаболический ацидоз, вызванный повышенной концентрацией лактата)
- если в крови пациента слишком высокие концентрации натрия, калия, магния, кальция и (или) фосфора (гипернатриемия, гиперкалиемия, гипермагниемия, гиперкальциемия и (или) гиперфосфатемия).
- у детей до 28 дня жизни не следует вводить цефтриаксон одновременно с внутривенными жидкостями, поскольку могут образовываться нерастворимые частицы.
В каждом случае решение врача о возможности введения этого лекарства пациенту будет зависеть от таких факторов, как возраст, вес пациента, его клиническое состояние, включая результаты всех проведенных исследований.
Предостережения и меры предосторожности
Прежде чем начать принимать лекарство CLINIMIX, необходимо обсудить это с врачом или медсестрой. В случае появления необычных симптомов или признаков аллергической реакции, таких как лихорадка, озноб, кожная сыпь или затруднение дыхания, чрезмерное потоотделение, тошнота или головная боль, необходимо сообщить об этом врачу или медсестре: вливание будет немедленно прекращено. Врач будет контролировать состояние пациента во время введения лекарства и может рекомендовать изменение дозы или добавление дополнительных питательных компонентов, таких как жиры, витамины, электролиты и микроэлементы, если он считает это необходимым. Некоторые лекарства и заболевания могут увеличивать риск развития инфекций или сепсиса (наличие бактерий в крови). Особый риск инфекций или сепсиса связан с введением в вену пациента катетера (центрального венозного катетера). Врач будет внимательно наблюдать за пациентом, чтобы обнаружить любые признаки инфекции. Соблюдение правил асептики при введении и поддержании катетера, а также во время подготовки смеси для питания может уменьшить этот риск инфекции. Лекарство CLINIMIX с электролитами содержит кальций. Не следует вводить его одновременно с антибиотиком цефтриаксоном, поскольку это может привести к образованию частиц. В случае тяжелого недоедания, требующего внутривенного питания, рекомендуется начинать питание медленно и с осторожностью. С самого начала вливания врач будет контролировать состояние пациента, особенно если у него есть проблемы с печенью, почками, надпочечниками или кровообращением. Врач также должен быть проинформирован о тяжелых заболеваниях, влияющих на обмен углеводов, жиров, белков и солей в организме (метаболические расстройства). Если появляются какие-либо необычные симптомы, включая раздражение вены, то вливание должно быть немедленно прекращено. Во время введения лекарства врач будет проводить клинические испытания и лабораторные исследования, чтобы проверить эффективность и постоянно контролировать безопасность введения лекарства. Если пациент получает лекарство в течение нескольких недель, анализы крови будут проводиться регулярно. В частности, в случае непереносимости глюкозы, концентрация глюкозы в крови и моче требует регулярного контроля, и если пациент страдает диабетом, дозировка инсулина может потребовать коррекции.
Дети и подростки
При использовании у младенцев и детей до 2 лет раствор (в мешке и наборе для введения) должен быть защищен от света до окончания введения. Воздействие света на раствор CLINIMIX, особенно после добавления микроэлементов и (или) витаминов, приводит к образованию перекисей и других продуктов разложения, что можно ограничить, обеспечив защиту от света.
Лекарство CLINIMIX и другие лекарства
Необходимо сообщить врачу о всех лекарствах, которые пациент принимает в настоящее время или принимал recently, а также о лекарствах, которые пациент планирует принимать. CLINIMIX с электролитами содержит кальций. Не следует вводить его одновременно с антибиотиком цефтриаксоном, поскольку это может привести к образованию частиц. Учитывая содержание калия в лекарстве CLINIMIX, необходимо проявлять особую осторожность у пациентов, принимающих мочегонные препараты, сохраняющие калий (например, амилорид, спиронолактон, триамтерен), ингибиторы конвертинга ангиотензина ACE, антагонисты рецептора ангиотензина II или иммунодепрессивные препараты такролимус или циклоспорин в связи с риском развития гиперкалиемии.
Беременность, грудное вскармливание и влияние на фертильность
Если пациентка беременна или кормит грудью, предполагает, что может быть беременной, или планирует иметь ребенка, она должна проконсультироваться с врачом перед использованием этого лекарства.
3. Как принимать лекарство CLINIMIX
Прежде чем ввести лекарство, шов между двумя камерами должен быть разорван, и содержимое обеих камер должно быть смешано. Лекарство CLINIMIX можно вводить взрослым и детям. При использовании у младенцев и детей до 2 лет раствор (в мешке и наборе для введения) должен быть защищен от света до окончания введения (см. пункт 2). CLINIMIX представляет собой раствор для инфузии, вводимый через периферический или центральный внутривенный катетер.
Дозировка - Взрослые и дети
Врач решает, какая доза необходима пациенту и как долго она будет вводиться. Это будет зависеть от возраста, веса и роста, клинического состояния, суточного баланса жидкости, энергетических потребностей и потребности в азоте. Всегда необходимо принимать лекарство CLINIMIX точно согласно рекомендациям врача. В случае сомнений необходимо обратиться к врачу. Лечение можно продолжать столько, сколько это необходимо, в зависимости от клинического состояния пациента. Вливание одного мешка обычно длится от 8 до 24 часов.
Использование большей, чем рекомендуемая, дозы лекарства CLINIMIX
В случае введения пациенту слишком большой дозы лекарства или слишком быстрого вливания может произойти увеличение объема жидкости в кровеносной системе или слишком кислая реакция крови. Глюкоза, содержащаяся в продукте, может увеличить концентрацию глюкозы в крови и моче. Введение слишком большого объема раствора может вызвать тошноту, рвоту, озноб, а также нарушения электролитного баланса. В этом случае вливание должно быть немедленно прекращено. В некоторых тяжелых случаях, чтобы помочь почкам пациента удалить излишки лекарства CLINIMIX, врач может использовать временную диализ почек. Чтобы предотвратить такие ситуации, врач регулярно контролирует состояние пациента и проверяет параметры крови. В случае любых дальнейших сомнений, связанных с использованием этого лекарства, необходимо обратиться к врачу.
4. Возможные нежелательные реакции
Как и любой лекарственный препарат, это лекарство может вызывать нежелательные реакции, хотя они не появляются у каждого пациента. В случае наблюдения любых изменений самочувствия во время лечения или после его окончания необходимо немедленно сообщить об этом врачу или медсестре. Исследования, проводимые врачом во время использования лекарства, должны минимизировать риск нежелательных реакций. Если появляются какие-либо необычные признаки или симптомы аллергической реакции, такие как аномально низкое или высокое кровяное давление, появление синего или фиолетового оттенка кожи, аномально быстрый сердечный ритм, проблемы с дыханием, рвота, тошнота, кожная сыпь, повышенная температура тела, чрезмерное потоотделение, озноб, вливание должно быть немедленно прекращено. Также были наблюдены другие нежелательные реакции, которые出现али с большей или меньшей частотой:
- Анафилаксия (тяжелая аллергическая реакция, появляющаяся внезапно и способная привести к смерти)
- Повышенная концентрация глюкозы, аммиака и азотсодержащих соединений в крови
- Нарушения функции печени, аномальные результаты анализа крови, оценивающие функцию печени
- Воспаление желчного пузыря, наличие камней в желчном пузыре
- Воспаление вены в месте введения, раздражение вены, боль, раздражение, тепло, отек
- Наличие глюкозы в моче
- Сахарный диабетический кома
- Образование мелких частиц (осадка), блокирующих кровеносные сосуды в легких
Сообщение о нежелательных реакциях
Если появляются какие-либо нежелательные реакции, включая любые нежелательные реакции, не указанные в этой инструкции, необходимо сообщить об этом врачу или фармацевту. Нежелательные реакции можно сообщать напрямую в Департамент мониторинга нежелательных реакций лекарственных средств Управления регистрации лекарственных средств, медицинских изделий и биоцидных продуктов Аль. Ерозолимских 181 С 02-222 Варшава Тел.: + 48 22 49 21 301 Факс: + 48 22 49 21 309 Веб-сайт: https://smz.ezdrowie.gov.pl Нежелательные реакции также можно сообщать ответственному лицу. Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности использования лекарства.
5. Как хранить лекарство CLINIMIX
Хранить в месте, недоступном для детей. При использовании у младенцев и детей до 2 лет раствор (в мешке и наборе для введения) должен быть защищен от света до окончания введения (см. пункт 2). Не использовать это лекарство после истечения срока годности, указанного на этикетке мешка и внешней упаковке (ММ/РРРР). Срок годности указывает последний день указанного месяца. Хранить при комнатной температуре. Не замораживать. Хранить в внешней картонной упаковке. Лекарства не следует выбрасывать в канализацию или домашние мусорные контейнеры. Необходимо спросить у фармацевта, что делать с лекарствами, которые больше не нужны. Такое поведение поможет защитить окружающую среду.
6. Состав упаковки и другие сведения
Что содержит лекарство CLINIMIX N9G15E
Содержание активных веществ в каждом мешке после смешения содержимого обеих камер:
| Активные вещества | 1 л | 1,5 л | 2 л |
| 5,70 г 3,17 г 2,84 г 1,32 г 1,65 г 2,01 г 1,60 г (2,00 г) 1,10 г 1,54 г 1,87 г 1,38 г 1,16 г 0,50 г 0,11 г 1,60 г 2,16 г 2,61 г 1,12 г 0,51 г 75 г (83 г) 0,33 г | 8,54 г 4,75 г 4,25 г 1,98 г 2,48 г 3,02 г 2,39 г (2,99 г) 1,65 г 2,31 г 2,81 г 2,06 г 1,73 г 0,74 г 0,17 г 2,39 г 3,23 г 3,92 г 1,68 г 0,77 г 113 г (124 г) 0,50 г | 11,39 г 6,33 г 5,67 г 2,64 г 3,30 г 4,02 г 3,19 г (3,99 г) 2,20 г 3,08 г 3,74 г 2,75 г 2,31 г 0,99 г 0,22 г 3,19 г 4,31 г 5,22 г 2,24 г 1,02 г 150 г (165 г) 0,66 г |
Другие компоненты - это:
- уксусная кислота, соляная кислота (для установления pH раствора),
- вода для инъекций.
Как выглядит лекарство CLINIMIX и что содержит упаковка
CLINIMIX представляет собой раствор для инфузии, поставляемый в двухкамерном мешке, который является многослойным пластиковым мешком. Внутренняя (контактная) поверхность мешка изготовлена из полимеров (смесь полиолефиновых сополимеров), которые совместимы со составом раствора и допустимыми добавками. Остальные слои изготовлены из ЭВА (поли(этилен-октановинил)) и кополиэстера. До смешения содержимого камер мешка раствор аминокислот и раствор глюкозы прозрачны, бесцветны или слегка желтые. После смешения раствор также прозрачный, бесцветный или слегка желтый. Чтобы защитить от кислорода, мешок помещен в защитную упаковку, содержащую пакет, поглощающий кислород. Размеры упаковок: Мешки 1000 мл - упаковываются по 8 штук Мешки 1500 мл - упаковываются по 6 штук Мешки 2000 мл - упаковываются по 4 штуки Не все типы упаковок могут находиться в обращении.
Ответственное лицо
Baxter Polska Sp. z o.o. ул. Кручковского, 8 00-380 Варшава
Производитель
Baxter S.A. Бульвар Рене Бранкварт, 80 7860 Лессин Бельгия
Дата последнего обновления инструкции:
--------------------------------------------------------------------------------------------------------------
Информация, предназначенная только для медицинского персонала:
1. КОЛИЧЕСТВЕННЫЙ СОСТАВ
После смешения содержимого обеих камер состав смеси для доступных размеров мешков следующий:
2. ДОЗИРОВКА И СПОСОБ ВВЕДЕНИЯ
Ввести только после разрыва шва, разделяющего две камеры, и смешения содержимого обеих камер.
Дозировка и скорость вливания
Дозировка должна быть адаптирована к индивидуальным потребностям пациента в питании и жидкости, энергетическим расходам, клиническому состоянию, весу и способности к метаболизму компонентов лекарственного препарата CLINIMIX, а также дополнительной энергии или белка, вводимого перорально или энтерально. Кроме того, с возрастом постоянно уменьшается суточная потребность в жидкости, азоте и энергии. У взрослых потребность составляет от 0,16 г азота/кг/день (около 1 г аминокислот/кг/день) до 0,32 г азота/кг/день (около 2 г аминокислот/кг/день).
| 1 л | 1,5 л | 2 л | |
| азот (г) аминокислоты (г) глюкоза (г) | 4,6 28 75 | 6,8 41 113 | 9,1 55 150 |
| Общая энергетическая ценность (ккал) Энергетическая ценность глюкозы (ккал) | 410 300 | 615 450 | 820 600 |
| натрий (ммоль) калий (ммоль) магний (ммоль) кальций (ммоль) октаны (ммоль) хлориды (ммоль) фосфаты как НРО4 (ммоль) | 35 30 2,5 2,3 50 40 15 | 53 45 3,8 3,4 75 60 23 | 70 60 5 4,5 100 80 30 |
| pH осмолярность (мОсм/л) | 6 845 | ||
У детей до 2 лет потребность составляет от 0,16 г азота/кг/день (около 1,0 г аминокислот/кг/день) до 0,40 г азота/кг/день (около 2,5 г аминокислот/кг/день). У взрослых и пациентов в возрасте от 12 до 18 лет потребность в энергии варьируется от 25 до 40 ккал/кг/день, в зависимости от состояния питания пациента и степени катаболизма. Пациенты моложе 12 лет могут иметь более высокие потребности. Могут возникать клинические ситуации, когда пациенты требуют введения других количеств питательных веществ, чем в составе лекарственного препарата CLINIMIX. В таких случаях любые корректировки объема (дозы) должны учитывать влияние на дозировку всех других питательных веществ лекарственного препарата CLINIMIX. Скорость и объем инфузии должны быть определены врачом, имеющим опыт в парентеральном питании детей и терапии внутривенными жидкостями. Этот продукт не содержит аминокислот цистеин и таурин, считающихся условно необходимыми для младенцев и детей до 2 лет. Этот лекарственный препарат не рекомендуется для недоношенных новорожденных, родившихся в срок, и для детей до 2 лет. Скорость введения должна быть выбрана в зависимости от дозы, характеристик вводимого раствора, общего объема жидкости, вводимой в течение 24 часов, и продолжительности вливания. Вливание должно длиться более 8 часов. Обычно скорость вливания увеличивается постепенно в течение первой часа до максимальной величины 3 мл/кг/час, а максимальная суточная доза составляет 40 мл/кг/день.
Способы введения
При использовании у младенцев и детей до 2 лет раствор (в мешке и наборе для введения) должен быть защищен от света до окончания введения.
Путь введения
Выбор периферической или центральной вены зависит от конечной осмолярности смеси. Обычно считается, что смеси с осмолярностью до примерно 800 мОсм/л можно вводить в периферические вены, однако это может сильно варьироваться в зависимости от возраста, общего состояния пациента, состояния периферических вен, продолжительности инфузии и состава вводимого питательного мешка.
3. СПЕЦИАЛЬНЫЕ ПРЕДОСТОРОЖНОСТИ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ПРИМЕНЕНИИ
ПРЕПАРАТА
ПРЕДОСТОРОЖНОСТИ При применении препаратов CLINIMIX сообщалось о возникновении реакций повышенной чувствительности/реакций на вливание, включая артериальную гипотензию, артериальную гипертензию, периферическую цианоз, тахикардию, одышку, рвоту, тошноту, крапивницу, кожную сыпь, зуд, покраснение, чрезмерное потоотделение, лихорадку и озноб. При применении других препаратов для парентерального питания сообщалось о реакциях анафилаксии. В начале каждого внутривенного вливания необходим специальный клинический надзор. Если出现 какие-либо необычные симптомы, например реакция повышенной чувствительности/реакция на вливание, то вливание должно быть немедленно прекращено. У пациентов, чувствительных к кукурузе или кукурузным продуктам, необходимо проявлять осторожность при введении растворов, содержащих глюкозу, если их вообще вводят. У пациентов, получающих парентеральное питание, отмечалось образование осадка в легочных сосудах. Некоторые случаи закончились летальным исходом. Чрезмерное введение кальция и фосфата увеличивает риск образования осадка фосфата кальция. Случаи образования осадка сообщались даже при отсутствии фосфатных солей в растворе. Также сообщалось о случаях образования осадка, удаленного от фильтра, установленного на линии вливания, и случаев подозрения на образование осадка in vivo. Могут возникать клинические осложнения, связанные с осадком в легочных сосудах, например острая респираторная недостаточность, пульмональная эмболия, интерстициальное воспаление легких. В случае возникновения симптомов острой респираторной недостаточности вливание должно быть прекращено, и необходимо провести медицинское обследование. Помимо контроля раствора, также необходимо периодически проверять систему для инфузии и катетер на наличие осадка. У пациентов старше 28 дня жизни (в том числе взрослых) не следует вводить цефтриаксон одновременно с внутривенными растворами, содержащими кальций, включая препарат CLINIMIX N9G15E, через один и тот же набор для вливания (например, через соединитель типа Y). Если того же набора для вливания используется для следующего введения, между вливаниями необходимо тщательно промыть его совместимой жидкостью. Инфекция и сепсис могут возникать у пациентов, получающих парентеральное питание, в результате использования внутривенных катетеров, недостаточного ухода за катетерами или загрязненных растворов. Иммунодепрессия и другие факторы, такие как гипергликемия, недоедание и (или) состояние, связанное с основным заболеванием, могут предрасполагать пациентов к осложнениям в виде инфекций. Тщательный контроль симптомов и результатов лабораторных исследований для обнаружения лихорадки/озноба, лейкоцитоза, технических осложнений, связанных с оборудованием для доступа к вене, и гипергликемии может помочь в ранней диагностике инфекции. Частота возникновения осложнений, связанных с инфекциями, можно уменьшить, увеличивая внимание к соблюдению асептических техник при введении и поддержании катетера, а также во время подготовки продукта для питания. У пациентов, получающих внутривенные жидкости для питания, необходимо точно определить и контролировать потребность в электролитах, особенно при введении растворов, не содержащих электролитов. Непереносимость глюкозы является частым метаболическим осложнением у тяжелобольных пациентов. В результате вливания может возникнуть гипергликемия, глюкозурия и гиперосмолярный синдром. Концентрация глюкозы в крови и моче должна быть проверена регулярно, и дозировка инсулина у пациентов с диабетом должна быть правильно скорректирована. Необходимо проявлять осторожность при использовании препарата у пациентов с почечной недостаточностью, особенно при наличии гиперкалиемии, поскольку существует риск развития или усиления метаболического ацидоза и гиперазотемии, если не проводится дополнительное позанальное удаление продуктов метаболизма. У этих пациентов необходимо внимательно контролировать состояние жидкости и электролитов. В случае тяжелой почечной недостаточности следует предпочтительно использовать растворы аминокислот со специальным составом. Необходимо проявлять осторожность при введении раствора CLINIMIX пациентам с надпочечной недостаточностью. Необходимо проявлять осторожность, чтобы избежать перегрузки кровеносной системы, особенно у пациентов с отеком легких, компенсированной и некомпенсированной сердечной недостаточностью. Во время лечения необходимо контролировать баланс жидкости в организме. У пациентов с заболеваниями печени в анамнезе или с печеночной недостаточностью, помимо регулярных проб печени, следует обращать внимание на возможность возникновения симптомов гипераммонемии. У некоторых пациентов, получающих парентеральное питание, возникают нарушения печени и желчных путей, включая холестаз, стеатоз, фиброз и цирроз печени, которые могут привести к печеночной недостаточности, а также воспаление желчного пузыря и желчнокаменная болезнь. Считается, что этиология этих заболеваний является многофакторной и может быть различной у разных пациентов. Пациенты, у которых возникают аномалии в результатах лабораторных исследований или другие признаки нарушений печени и желчных путей, должны быть как можно скорее обследованы врачом, имеющим знания в области гепатологии. У пациентов, получающих растворы аминокислот, может возникать повышение концентрации аммиака и гипераммонемия. У некоторых пациентов это может указывать на врожденные нарушения метаболизма аминокислот (см. пункт 4.3 в Характеристике продукта) или печеночную недостаточность. Концентрация аммиака в крови должна быть измерена с большой частотой у детей до 2 лет для обнаружения гипераммонемии, которая может указывать на наличие врожденных нарушений метаболизма аминокислот. В зависимости от концентрации и этиологии гипераммонемия может потребовать немедленного вмешательства. Слишком быстрое вливание аминокислот может вызвать тошноту, рвоту и озноб. В таких случаях вливание должно быть немедленно прекращено. В принципе, необходимо проявлять осторожность при выборе дозы у пожилых людей, учитывая более высокую частоту нарушений функции печени, почек или сердца, а также наличие сопутствующих заболеваний и прием других лекарств. Дети и подростки
- Не проводились исследования у детей и подростков.
- Относительно мониторинга гипераммонемии у детей до 2 лет - см. выше.
Воздействие света на растворы для парентерального питания, особенно после добавления микроэлементов и (или) витаминов, может иметь неблагоприятное влияние на клинические результаты у младенцев, в результате образования перекисей и других продуктов разложения. При использовании у младенцев и детей до 2 лет препарат CLINIMIX должен быть защищен от света до окончания введения.
4. ПРАКТИЧЕСКИЕ СВЕДЕНИЯ О ПОДГОТОВКЕ ПРОДУКТА ЛЕЧЕБНОГО ПРИМЕНЕНИЯ И УТИЛИЗАЦИИ ЕГО ОСТАТКОВ
ОСТАТКОВ
Внимание: Ввести только после разрыва шва и смешения содержимого обеих камер.

Разорвать защитную упаковку
сверху.
Удалить переднюю часть
защитной упаковки, чтобы
обнажить мешок CLINIMIX.
Выбросить защитную упаковку
и пакет, поглощающий кислород.
Поместить мешок на плоскую,
горизонтальную и чистую поверхность,
удерживая за ручку.

Поднять мешок, удерживая за
ручку, чтобы удалить жидкость из
верхней части мешка. Скрутить
мешок обеими руками, начиная
сверху мешка, пока швы не
разорвутся (примерно до половины
их длины). Смешать содержимое
мешка, поворачивая его не менее
3 раз.
Подвесить мешок. Удалить
пластиковую крышку с места
введения иглы набора для
приточения.
Вставить иглу набора для
приточения в него плотно.
Не использовать, если раствор не
прозрачный, бесцветный или
слегка желтый, и если контейнер
поврежден.
Перед введением необходимо
допроводить CLINIMIX до комнатной
температуры.
Содержимое обеих камер мешка
CLINIMIX можно смешать до или
после удаления защитной упаковки.
Только для одноразового использования.
Не хранить частично использованные
упаковки и выбросить все
оборудование после использования.
Не подключать повторно частично
использованные мешки.
Не следует соединять мешки
последовательно.
При использовании у младенцев и
детей до 2 лет необходимо
защитить от света до окончания
введения. Воздействие света на
препарат CLINIMIX, особенно после
добавления микроэлементов и (или)
витаминов, приводит к образованию
перекисей и других продуктов
разложения, что можно ограничить,
обеспечив защиту от света.
Дополнительные компоненты
Пациентам, получающим парентеральное питание в течение длительного времени, необходимо обеспечить дополнительное введение жиров, витаминов и микроэлементов. Если добавление других компонентов необходимо, необходимо проверить их совместимость с раствором и контролировать стабильность смеси. Все дополнительные компоненты можно вводить только после разрыва шва (после смешения содержимого обеих камер). CLINIMIX можно дополнить следующими компонентами:
- жировые эмульсии (например, CLINOLEIC 20%) в количестве 50 до 250 мл на 1 литр CLINIMIX.
| CLINIMIX N9G15E – 1 л + 100 мл жиров 20% | CLINIMIX N9G15E – 1,5 л + 100 мл жиров 20% | CLINIMIX N9G15E – 2 л + 250 мл жиров 20% | |
| азот (г) аминокислоты (г) глюкоза (г) жиры (г) | 4,6 28 75 20 | 6,8 41 113 20 | 9,1 55 150 50 |
| Общая энергетическая ценность (ккал) Энергетическая ценность глюкозы (ккал) Энергетическая ценность жиров (ккал) Соотношение: глюкоза/жиры | 610 300 200 60/40 | 815 450 200 69/31 | 1320 600 500 55/45 |
| натрий (ммоль) калий (ммоль) магний (ммоль) кальций (ммоль) октаны (ммоль) хлориды (ммоль) фосфаты как НРО4 (ммоль) | 35 30 2,5 2,3 50 40 15 | 53 45 3,8 3,4 75 60 23 | 70 60 5,0 4,5 100 80 30 |
| pH осмолярность (мОсм/л) | 6 795 | 6 810 | 6 785 |
- электролиты: на 1 литр CLINIMIX
| Натрий | Калий | Магний | Кальций | |
| До конечной концентрации | 80 ммоль | 60 ммоль | 5,6 ммоль | 3,0 ммоль |
- микроэлементы: на 1 литр CLINIMIX
- витамины: на 1 литр CLINIMIX
Данные о стабильности смеси CLINIMIX с другими доступными жировыми эмульсиями, а также другими добавками и питательными компонентами доступны по запросу. Если наблюдается легкое разделение смеси, необходимо тщательно смешать раствор с добавленным компонентом путем осторожного встряхивания, пока не будет получена однородная эмульсия перед введением. Дополнительные компоненты должны быть добавлены в асептических условиях. Дополнительные компоненты можно вводить с помощью иглы для инъекций или набора для приточения.
- Добавление компонента с помощью шприца или набора для приточения с иглой для инъекций: о Подготовить порт для инъекций (одиночный порт, см. Рис. 1 в Характеристике продукта). о Проколить порт и ввести. о Смешать раствор с добавленными компонентами.
Несовместимости
Дополнительные компоненты могут вызывать фармацевтические несовместимости. Необходимо обратиться к ответственному лицу за подробную информацию. Если добавление других компонентов необходимо, необходимо проверить их совместимость с раствором и контролировать стабильность смеси. CLINIMIX N9G15E содержит ионы кальция, которые вызывают дополнительный риск свертывания в препаратах крови или компонентов крови, сохраненных цитратом. Так же, как и в случае других растворов для вливания, содержащих кальций, одновременное введение цефтриаксона и CLINIMIX N9G15E противопоказано у новорожденных (≤ 28 дня жизни), даже если используется отдельный набор для вливания (из-за риска смерти в результате образования солей кальция цефтриаксона в кровообращении ребенка). У пациентов старше 28 дня жизни (в том числе взрослых) не следует вводить цефтриаксон одновременно с внутривенными растворами, содержащими кальций, включая препарат CLINIMIX N9G15E, через один и тот же набор для вливания (см. пункт Предостережения). Если того же набора для вливания используется для следующего введения, между вливаниями необходимо тщательно промыть его совместимой жидкостью.
| До конечной концентрации | Медь | 10 мкмоль | Цинк | 77 мкмоль |
| Хром | 0,14 мкмоль | Марганец | 2,5 мкмоль | |
| Фториды | 38 мкмоль | Кобальт | 0,0125 мкмоль | |
| Селен | 0,44 мкмоль | Молибден | 0,13 мкмоль | |
| Йод | 0,5 мкмоль | Железо | 10 мкмоль |
| До конечной концентрации | Витамин А | 1750 МЕ | Биотин | 35 мкг |
| Витамин В6 | 2,27 мг | Витамин В1 | 1,76 мг | |
| Витамин Д | 110 МЕ | Фолиевая кислота | 207 мкг | |
| Витамин В12 | 3,0 мкг | Витамин В2 | 2,07 мг | |
| Витамин Е | 5,1 мг | Витамин С | 63 мг | |
| Витамин РР | 23 мг | Витамин В5 | 8,63 мг | |
| Витамин К | 75 мкг |
Так же, как и в случае других растворов для вливания, содержащих кальций, одновременное введение цефтриаксона и CLINIMIX N9G15E противопоказано у новорожденных (≤ 28 дня жизни), даже если используется отдельный набор для вливания (из-за риска смерти в результате образования солей кальция цефтриаксона в кровообращении ребенка). У пациентов старше 28 дня жизни (в том числе взрослых) не следует вводить цефтриаксон одновременно с внутривенными растворами, содержащими кальций, включая препарат CLINIMIX N9G15E, через один и тот же набор для вливания (см. пункт Предостережения). Если того же набора для вливания используется для следующего введения, между вливаниями необходимо тщательно промыть его совместимой жидкостью.
5. СРОК ГОДНОСТИ
2 года, если хранить в защитной упаковке. Рекомендуется использовать препарат немедленно после открытия швов, разделяющих содержимое 2 камер. Однако было показано, что после смешения содержимого обеих камер (т.е. после разрыва внутреннего шва, разделяющего камеры) полученная смесь сохраняет химическую и физическую стабильность в течение 7 дней при температуре от 2 °C до 8 °C и затем в течение 48 часов при температуре ниже 25 °C. В случае введения в смесь дополнительных компонентов с микробиологической точки зрения такая смесь должна быть использована немедленно. Если смесь не используется сразу после приготовления, и добавление не производилось в контролируемых, проверенных и асептических условиях, то время и условия ее хранения до использования являются ответственностью пользователя. Это время обычно не должно превышать 24 часа при температуре от 2 °C до 8 °C. Если в исключительных случаях необходимо более длительное хранение готовой смеси, можно обратиться к производителю, поскольку для этих продуктов доступны данные о химической и физической стабильности в течение 7 дней при температуре от 2 °C до 8 °C и затем 48 часов при температуре ниже 25 °C. Baxter, Clinimix, ClinOleic являются зарегистрированными товарными знаками компании Baxter International Inc.
- Страна регистрации
- Требуется рецептНет
- Производитель
- ИмпортерBaxter S.A.
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Цлинимикс Н9г15еФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецептФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецептФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецепт
Аналоги Цлинимикс Н9г15е в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Цлинимикс Н9г15е в Іспанія
Врачи онлайн по Цлинимикс Н9г15е
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Цлинимикс Н9г15е – по решению врача и с учетом местных правил.














