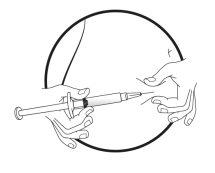
TIVACOMA 30 mg Solução injetável em seringa pré-carregada
Pergunte a um médico sobre a prescrição de TIVACOMA 30 mg Solução injetável em seringa pré-carregada

Como usar TIVACOMA 30 mg Solução injetável em seringa pré-carregada
Introdução
Prospecto: informação para o paciente
Tivacoma 30 mg solução injetável em seringa precarregada EFG
icatibanto
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Tivacoma e para que é utilizado
- O que precisa saber antes de começar a usar Tivacoma
- Como usar Tivacoma
- Posíveis efeitos adversos
- Conservação de Tivacoma
- Conteúdo do envase e informação adicional
1. O que é Tivacoma e para que é utilizado
Tivacoma contém o princípio ativo icatibanto.
Este medicamento é utilizado para o tratamento dos sintomas do angioedema hereditário (AEH) em adultos, adolescentes e crianças maiores de 2 anos.
No AEH, aumentam as concentrações de uma substância presente no sangue chamada bradicinina, o que produz sintomas como inchação, dor, náuseas e diarreia.
Este medicamento bloqueia a atividade da bradicinina e, portanto, freia a progressão dos sintomas de uma crise de AEH.
2. O que precisa saber antes de começar a usar Tivacoma
Não use Tivacoma
- se é alérgico a icatibanto ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
Advertências e precauções
Consulte o seu médico antes de começar a usar este medicamento:
- Se sofre de angina de peito (diminuição do fluxo de sangue que chega ao coração).
- Se sofreu recentemente um acidente vascular cerebral.
Os efeitos adversos relacionados com este medicamento são semelhantes aos sintomas da sua própria doença. Consulte imediatamente com o seu médico se nota que os sintomas da crise se agravam após a administração deste medicamento.
Além disso:
- Si ou o seu cuidador devem aprender a técnica de administração de injeções subcutâneas (sob a pele) antes de autoadministrar ou de que o seu cuidador lhe administre este medicamento.
- Imediatamente após se autoadministrar este medicamento ou de que o seu cuidador lhe administre enquanto experimenta uma crise laríngea (obstrução da via aérea superior), deve procurar atendimento médico em um centro médico.
- Se os seus sintomas não se resolvem após uma injeção deste medicamento autoadministrada ou administrada pelo seu cuidador, deve consultar o médico sobre a administração de injeções adicionais deste medicamento. Em pacientes adultos, podem ser administradas até 2 injeções adicionais no prazo de 24 horas.
Crianças e adolescentes
Não se recomenda o uso deste medicamento em crianças menores de 2 anos ou que pesem menos de 12 kg porque não foi estudado nestes pacientes.
Outros medicamentos e Tivacoma
Informa ao seu médico se está tomando, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Não se conhecem interações deste medicamento com outros medicamentos. Se está tomando algum medicamento que seja um inibidor da enzima de conversão da angiotensina (IECA) (por exemplo: captopril, enalapril, ramipril, quinapril, lisinopril) para reduzir a pressão arterial ou por qualquer outro motivo, informe ao seu médico antes de utilizar este medicamento.
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de começar a usar este medicamento.
Se se encontra em período de lactação, não deve amamentar o seu filho durante as 12 horas seguintes à última administração deste medicamento.
Condução e uso de máquinas
Não conduza nem maneje máquinas se se sentir cansado ou mareado como consequência da crise de AEH ou após usar este medicamento.
Tivacoma contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) de sódio por seringa; isto é, é essencialmente “isento de sódio”.
3. Como usar Tivacoma
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
Se nunca se lhe administrou este medicamento previamente, a primeira dose sempre deve ser injetada por pessoal médico ou de enfermagem. O médico dar-lhe-á alta quando considerar seguro que se vá para casa. Após analisar com o seu médico ou enfermeiro, e após aprender a técnica para injeções subcutâneas (sob a pele), si mesmo ou a pessoa que o cuida pode administrar-lhe este medicamento se tiver uma crise de AEH. É importante injetar este medicamento por via subcutânea (sob a pele) assim que notar uma crise de angioedema. O pessoal sanitário ensinar-lhe-á a si e ao seu cuidador o modo de injetar este medicamento de forma segura, seguindo as instruções do prospecto.
Quando e com que frequência deve usar Tivacoma?
O seu médico determinou a dose exata deste medicamento e dir-lhe-á com que frequência deve usá-lo.
Adultos
- A dose recomendada deste medicamento é de uma injeção (3 ml, 30 mg) administrada por via subcutânea (debaixo da pele) assim que notar a crise de angioedema (por exemplo, com aumento da inchação cutânea, sobre todo na face e no pescoço, ou aumento da dor abdominal).
- Se não notar uma melhoria dos sintomas, após seis horas, deve procurar aconselhamento médico sobre a administração de injeções adicionais deste medicamento. Em adultos, podem ser administradas até 2 injeções adicionais no prazo de 24 horas.
- Não deve receber mais de 3 injeções em um período de 24 horas e se precisar de mais de 8 injeções em um mês, deve procurar aconselhamento médico.
Crianças e adolescentes de 2 a 17 anos
- A dose recomendada deste medicamento é de uma injeção de 1 ml até um máximo de 3 ml em função do peso corporal por via subcutânea (sob a pele) assim que apresente sintomas de uma crise de angioedema (por exemplo, um aumento da inchação cutânea, sobre todo na face e no pescoço, ou aumento da dor abdominal).
- Consulte a seção das instruções de uso para ver a dose que deve injetar.
- Se não tiver certeza sobre a dose que deve injetar, consulte o seu médico, farmacêutico ou enfermeiro.
- Se os seus sintomas pioram ou não melhoram, deve procurar aconselhamento médico imediatamente.
Como deve administrar Tivacoma?
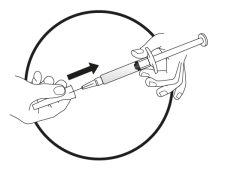
Este medicamento é administrado por injeção subcutânea (debaixo da pele). Cada seringa deve ser usada apenas uma vez.
Este medicamento é injetado com uma agulha curta no tecido gordo situado debaixo da pele do abdômen (barriga).
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
As seguintes instruções passo a passo estão previstas para:
- autoadministração (adultos)
- administração por parte de um cuidador ou um profissional de saúde para adultos, adolescentes ou crianças maiores de 2 anos (que pesem 12 kg como mínimo).
As instruções incluem os seguintes passos principais:
- Informação geral
2a) Preparação da seringa para crianças e adolescentes (2-17 anos) que pesem 65 kg ou menos
2b) Preparação da seringa e da agulha para a injeção (todos os pacientes)
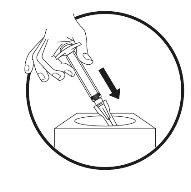
- Preparação do local da injeção
- Injeção da solução
- Eliminação dos materiais da injeção
Instruções passo a passo para a injeção
- Informação geral
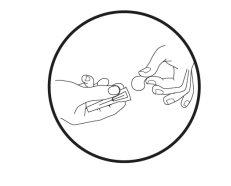
- Limpe a área (superfície) de trabalho que se vai usar antes de começar o processo.
- Lave as mãos com água e sabão.
- Retire a seringa precarregada da bandeja.
- Desrosqueie e retire a tampa do extremo da seringa precarregada.
- Deixe a seringa precarregada uma vez desrosqueada a tampa.
2a) Preparação da seringa para crianças e adolescentes (2-17 anos) que pesem 65 kg ou menos: | ||||||||||
Informação importante para profissionais de saúde e cuidadores: Quando a dose é inferior a 30 mg (3 ml), é necessário o seguinte equipamento para extrair a dose adequada (ver informação a seguir):
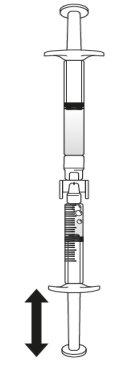
O volume de injeção necessário em ml deve ser preparado em uma seringa graduada de 3 ml vazia (ver tabela a seguir). Tabela 1: Pauta posológica para crianças e adolescentes
Os pacientes que pesem mais de 65kgusarão todo o conteúdo da seringa precarregada (3 ml).
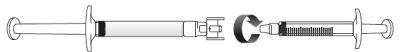
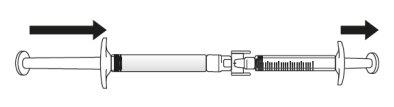
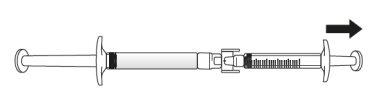
Transferir a solução de icatibanto para a seringa graduada:
Se houver arna seringa graduada:
Empurre o êmbolo da seringa graduada para que o ar seja transferido de novo para a seringa precarregada (pode ser que este passo precise ser repetido várias vezes).
| ||||||||||
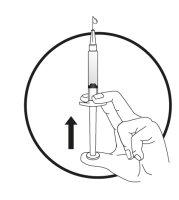
2b) Preparação da seringa e da agulha para a injeção:Todos os pacientes (adultos, adolescentes e crianças) | ||||||||||
|
|
|
|
|
|
|
|
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram. Quase todos os pacientes que recebem este medicamento experimentarão uma reação no local da injeção (como irritação da pele, inchação, dor, picazão, vermelhidão da pele e sensação de ardor). Estes efeitos geralmente são leves e desaparecem sem necessidade de qualquer tratamento adicional.
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
Reações adicionais no local da injeção (sensação de pressão, hematoma, diminuição da sensibilidade e/ou entorpecimento, aumento da erupção cutânea com picazão e calor).
Frequentes (podem afetar até 1 de cada 10 pessoas): Náuseas
Dor de cabeça
Tontura
Febre
Picazão
Erupção
Vermelhidão da pele
Testes de função hepática anormais
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis): Ronchas (urticária)
Informe ao seu médico imediatamente se observar que os sintomas da crise se agravam após ter recebido este medicamento.
Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Tivacoma
Mantenha este medicamento fora da vista e do alcance das crianças.
Não use este medicamento após a data de validade que aparece no envase após “CAD”. A data de validade é o último dia do mês que se indica.
Não conserve a uma temperatura superior a 25°C. Não congele.
Não use este medicamento se observar que o envase da seringa ou da agulha está danificado ou se observar sinais visíveis de deterioração; por exemplo, se a solução está turva, se contém partículas flutuantes ou se mudou a cor da solução.
Os medicamentos não devem ser jogados nos deságues nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Tivacoma
O princípio ativo é icatibanto. Cada seringa precarregada contém 30 miligramas de icatibanto (na forma de acetato). Os outros componentes são cloreto de sódio (para ajustar o pH), ácido acético glacial, hidróxido de sódio (para ajustar o pH) e água para preparações injetáveis.
Aspecto de Tivacoma e conteúdo do envase
Tivacoma apresenta-se como solução injetável transparente e incolora em uma seringa de vidro precarregada de 3 ml com tampão de êmbolo.
O envase contém uma agulha hipodérmica (25 G, 16 mm).
Este medicamento está disponível em envase unitário de uma seringa precarregada com uma agulha ou em envase múltiplo de três seringas precarregadas com três agulhas.
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Day Zero ehf.
Reykjavíkurvegi 62
220 Hafnarfjördur
Islândia
Responsável pela fabricação
Merckle GmbH
Ludwig-Merckle-Strasse 3
89143, Blaubeuren
Alemanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Suécia: | Tivacoma |
Espanha: | Tivacoma 30 mg solução injetável em seringa precarregada EFG |
Data da última revisão deste prospecto: Dezembro 2021
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TIVACOMA 30 mg Solução injetável em seringa pré-carregadaForma farmacêutica: INJETÁVEL, 30 mgSubstância ativa: icatibantRequer receita médicaForma farmacêutica: INJETÁVEL, 30 mgSubstância ativa: icatibantFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 30 mgSubstância ativa: icatibantFabricante: Laboratoire AguettantRequer receita médica
Alternativas a TIVACOMA 30 mg Solução injetável em seringa pré-carregada noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TIVACOMA 30 mg Solução injetável em seringa pré-carregada em Польща
Alternativa a TIVACOMA 30 mg Solução injetável em seringa pré-carregada em Україна
Médicos online para TIVACOMA 30 mg Solução injetável em seringa pré-carregada
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TIVACOMA 30 mg Solução injetável em seringa pré-carregada – sujeita a avaliação médica e regras locais.




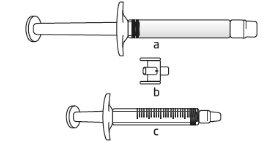
 Se não tiver certeza sobre o volume de solução que deve extrair, consulte o seu médico, farmacêutico ou enfermeiro
Se não tiver certeza sobre o volume de solução que deve extrair, consulte o seu médico, farmacêutico ou enfermeiro Evite tocar os extremos do conector e as pontas das seringas, para prevenir a contaminação
Evite tocar os extremos do conector e as pontas das seringas, para prevenir a contaminação