
REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
ReFacto AF 250 UI pó e diluente para solução injectável
ReFacto AF 500 UI pó e diluente para solução injectável
ReFacto AF 1000 UI pó e diluente para solução injectável
ReFacto AF 2000 UI pó e diluente para solução injectável
moroctocog alfa (factor de coagulação VIII humano recombinante)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si e não deve ser dado a outras pessoas, mesmo que tenham os mesmos sintomas, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é ReFacto AF e para que é utilizado
- O que precisa saber antes de começar a usar ReFacto AF
- Como usar ReFacto AF
- Posíveis efeitos adversos
- Conservação de ReFacto AF
- Conteúdo do envase e informações adicionais
1. O que é ReFacto AF e para que é utilizado
ReFacto AF contém o princípio ativo moroctocog alfa, factor de coagulação VIII humano. O factor VIII é necessário para que o sangue forme coágulos e detenha as hemorragias. Nos pacientes com hemofilia A (deficiência do factor VIII de nascimento) não está presente ou não actua adequadamente.
ReFacto AF é utilizado para o tratamento e a prevenção (profilaxia) de episódios hemorrágicos em adultos e crianças de todas as idades (incluindo recém-nascidos) com hemofilia A.
2. O que precisa saber antes de começar a usar ReFacto AF
Não use ReFacto AF
- se é alérgico a moroctocog alfa ou a algum dos outros componentes deste medicamento (incluídos na secção 6);
- se é alérgico a proteínas de hámster.
Consulte o seu médico se tiver dúvidas.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a usar ReFacto AF
- se sofre reacções alérgicas. Alguns dos sinais de reacções alérgicas são dificuldade para respirar, falta de ar, inchaço, urticária, comichão, opressão torácica, silvos ao respirar e tensão arterial baixa. A anafilaxia é uma reacção alérgica grave que produz dificuldade para engolir ou para respirar, vermelhidão ou inchaço das mãos, da face ou de ambas. Se se apresentar algum desses sintomas, interrompa a perfusão imediatamente e contacte o seu médico ou procure assistência médica de urgência imediata. Em casos de reacções alérgicas graves deve ser considerado tratamento alternativo.
- a formação de inibidores (anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos compostos por factor VIII. Estes inibidores, especialmente em níveis elevados, impedem que o tratamento funcione corretamente, por isso serão supervisionados cuidadosamente si ou o seu filho desenvolverem ditos inibidores. Se a hemorragia ou a do seu filho não se está a controlar com ReFacto AF, consulte o seu médico imediatamente.
- se a hemorragia não se detém como caberia esperar contacte o seu médico ou procure assistência médica de urgência imediata.
Outros medicamentos e ReFacto AF
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Condução e uso de máquinas
A influência de ReFacto AF sobre a capacidade para conduzir e utilizar máquinas é nula.
ReFacto AF contém sódio
Após a reconstituição, ReFacto AF contém 1,27 mmol (ou 29 mg) de sódio (componente principal do sal de mesa/cozinha) por frasco. Isto equivale a 1,5% da ingestão diária máxima de sódio recomendada para um adulto. Consoante o seu peso corporal e a sua dose de ReFacto AF, pode receber vários frascos. Isto deve ser tido em conta se si segue uma dieta baixa em sal.
3. Como usar ReFacto AF
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
O tratamento com ReFacto AF deve ser iniciado por um médico com experiência no tratamento de pacientes com hemofilia A. O seu médico decidirá a dose de ReFacto AF que deve receber. Esta dose e a sua duração dependerão das suas necessidades individuais de tratamento substitutivo com factor VIII. ReFacto AF é administrado mediante injeção numa veia e dita injeção dura vários minutos. As injeções de ReFacto AF podem ser administradas pelos pacientes ou pelos seus cuidadores, desde que tenham recebido a formação adequada.
Durante o seu tratamento o seu médico pode modificar a dose de ReFacto AF que si recebe.
Consulte com o seu médico antes de viajar. Quando viajar deve levar o seu produto de factor VIII em quantidade suficiente para o tratamento previsto.
Recomenda-se que cada vez que se administre ReFacto AF registe o nome que figura no envase e o número do lote do produto. Pode colar uma das etiquetas despegáveis que se encontram no frasco para documentar o número do lote no seu diário ou para notificar qualquer efeito secundário.
Reconstituição e administração
As instruções facilitadas a seguir são uma guia para a reconstituição e administração de ReFacto AF. Os pacientes devem seguir as instruções de reconstituição e administração específicas indicadas pelos seus médicos.
Para a reconstituição utilize apenas a seringa pré-carregada que se encontra no envase. Para a administração podem ser utilizadas outras seringas estéreis descartáveis.
ReFacto AF é administrado por perfusão intravenosa (IV) após reconstituir o pó liofilizado para injeção com a seringa de diluente fornecida, [uma solução injectável de cloreto de sódio de 9 mg/ml (0,9%)]. Não se deve misturar ReFacto AF com outras soluções para perfusão.
Lave sempre as mãos antes de realizar a reconstituição e administração. Durante o procedimento de reconstituição deve seguir-se uma técnica asséptica (ou seja, limpa e livre de germes).
Reconstituição:
- Espere até que o frasco liofilizado de ReFacto AF e a seringa pré-carregada do diluente atinjam a temperatura ambiente.
- Retire a tampa de fecho de plástico do frasco de ReFacto AF para que fique visível a parte central da tampa de borracha.
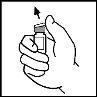
- Limpe a parte superior do frasco com a toalhita embebida em álcool que se fornece ou com outra solução antiséptica, e espere até que seque. Depois de limpar não toque a tampa de borracha com a mão nem deixe que esta toque qualquer superfície.
- Despegue a tampa do envase do adaptador do frasco de plástico transparente. Não retire o adaptador do envase.
- Coloque o frasco numa superfície plana. Enquanto segura o envase do adaptador, coloque o adaptador do frasco sobre o frasco e pressione com firmeza sobre o envase até que o adaptador encaixe na parte superior do frasco e o punção do adaptador penetre na tampa do frasco.
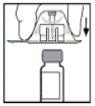
- Retire o envase do adaptador e elimine o envase.
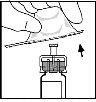
- Acople a vara do êmbolo à seringa de diluente inserindo a vara na abertura da tampa da seringa, pressionando e girando com firmeza até que esteja assentada na tampa.
- Retire a ponta da tampa de plástico da seringa de diluente rompendo a perfuração da tampa. Isto consegue-se dobrando a tampa para cima e para baixo até que se rompa a perfuração. Não toque o interior da tampa nem a ponta da seringa. Pode ser necessário voltar a colocar a tampa (se não se administra de imediato o ReFacto AF reconstituído), por isso deve colocá-la de lado sobre a sua parte superior.
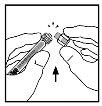
- Coloque o frasco numa superfície plana. Conecte a seringa de diluente ao adaptador do frasco inserindo a ponta da seringa na abertura do adaptador enquanto pressiona e gira com firmeza no sentido dos ponteiros do relógio até que fique fixa a conexão.
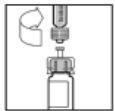
- Empurre lentamente a vara do êmbolo para injetar todo o diluente no frasco de ReFacto AF.
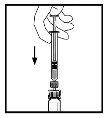
- Com a seringa ainda conectada ao adaptador, gire suavementeo frasco até dissolver o pó.

- Inspeccione visualmente a solução final em relação à presença de partículas antes da administração. A solução terá um aspecto de transparente a ligeiramente opalescente e será incolor.
Nota: Se usa mais de um frasco de ReFacto AF por perfusão, cada frasco deve ser reconstituído seguindo as instruções anteriores. A seringa de diluente deve ser retirada, deixando o adaptador do frasco colocado no seu lugar e pode ser utilizada outra seringa grande com fecho luer para extrair os conteúdos reconstituídos de cada um dos frascos individuais.
- Certifique-se de que a vara do êmbolo da seringa está ainda totalmente introduzida, dê a volta ao frasco e volte a pôr lentamente toda a solução na seringa através do adaptador do frasco.
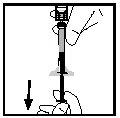
- Separe a seringa do adaptador do frasco puxando a seringa e girando no sentido contrário ao dos ponteiros do relógio. Elimine o frasco com o adaptador.
Nota: Se não se usa imediatamente a solução, deve-se colocar novamente a tampa da seringa cuidadosamente. Não toque a ponta da seringa nem o interior da tampa.
ReFacto AF deve ser utilizado imediatamente, ou nas 3 horas seguintes à sua reconstituição. Antes da administração, a solução reconstituída pode ser conservada à temperatura ambiente.
Administração (Perfusão Intravenosa):
ReFacto AF deve ser administrado utilizando o sistema de perfusão fornecido neste envase e a seringa pré-carregada de diluente que se fornece ou uma seringa de plástico estéril descartável com fecho luer.
- Acople a seringa à conexão luer do sistema de perfusão.
- Aplique um torniquete e prepare o local de injeção limpando bem a pele com uma das toalhitas com álcool que se fornecem.
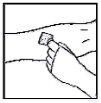
- Insira a agulha do sistema de perfusão na veia, seguindo as instruções do seu médico, e retire o torniquete. Elimine o ar que possa haver no sistema de perfusão aspirando-o para a seringa. Deve-se injetar por via intravenosa o produto reconstituído em vários minutos. O seu médico pode alterar a velocidade de perfusão recomendada para que seja mais confortável.
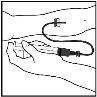
Elimine a solução não utilizada, o(s) frasco(s) vazio(s) e as agulhas e seringas utilizadas num recipiente adequado para eliminar resíduos médicos, porque estes materiais podem prejudicar outros se não forem eliminados adequadamente.
Se usa mais ReFacto AF do que deve
Consulte o seu médico ou farmacêutico.
Se interrompe o tratamento com ReFacto AF
Não deixe de utilizar ReFacto AF sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Reacções alérgicas
Se aparecem reacções alérgicas(anafilácticas) súbitas, graves, deve parar imediatamentea infusão. Deve consultar o seu médico imediatamentese si apresenta algum dos seguintes sintomas precoces de reacções alérgicas:
- erupção, habão urticarial, ronchas, comichão generalizada
- inchaço dos lábios e língua
- dificuldade para respirar, silvos ao respirar, opressão no peito
- sensação geral de mal-estar
- tontura e perda de consciência
Os sintomas graves, como a dificuldade para respirar e o desmaio (ou o quase desmaio), precisam de um tratamento de emergência rápido. As reacções alérgicas (anafilácticas) súbitas, graves são pouco frequentes (podem afectar até 1 de cada 100 pacientes)
Desenvolvimento de inibidores
Nas crianças que não receberam tratamento prévio com medicamentos compostos por factor VIII, podem ocorrer anticorpos inibidores (ver secção 2) muito frequentemente (mais de 1 de cada 10 pacientes); no entanto, nos pacientes que receberam tratamento prévio com factor VIII (mais de 150 dias de tratamento), o risco é pouco frequente (menos de 1 de cada 100 pacientes). Se isto acontecer, os medicamentos que si ou o seu filho tomam podem deixar de funcionar corretamente e si ou o seu filho podem sofrer uma hemorragia persistente. Nesse caso, contacte o seu médico imediatamente.
Efeitos adversos muito frequentes(podem afectar mais de 1 de cada 10 pacientes)
- desenvolvimento de inibidores em pacientes que nunca haviam sido tratados previamente com produtos de factor VIII
- dor de cabeça
- tosse
- dor articular
- febre
Efeitos adversos frequentes(podem afectar até 1 de cada 10 pacientes)
- hemorragia
- tontura
- perda do apetite, diarreia, vómitos, dor de estômago, náuseas
- urticária, erupção cutânea, comichão
- dor muscular
- arrepios, reacção relacionada com a localização do catéter
- algumas análises de sangue podem mostrar um aumento de anticorpos contra o factor VIII
Efeitos adversos pouco frequentes(podem afectar até 1 de cada 100 pacientes)
- desenvolvimento de inibidores em pacientes que haviam sido tratados previamente com produtos de factor VIII (menos de 1 de cada 100 pacientes)
- reacção alérgica grave
- entorpecimento, sonolência, alteração do gosto
- dor no peito, batimentos cardíacos rápidos, palpitações
- pressão arterial baixa, dor e vermelhidão das veias relacionado com a presença de coágulos de sangue, rubor
- dificuldade para respirar
- sudorese excessiva
- fraqueza, reacção no local de injeção (incluindo a dor)
- ligeiro aumento das enzimas cardíacas
- aumento das enzimas hepáticas, aumento da bilirrubina
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos si pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de ReFacto AF
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase exterior e na etiqueta do frasco após CAD. A data de validade é o último dia do mês que se indica.
Conservar e transportar refrigerado (2°C-8°C). Não congelar para evitar que se danifique a seringa pré-carregada que contém o diluente.
Para a sua comodidade, o medicamento pode ser retirado de dito armazenamento e conservado à temperatura ambiente (até 25ºC) durante um único período de 3 meses como máximo. Ao final deste período de armazenamento à temperatura ambiente o produto não deve voltar a ser refrigerado, mas deve ser utilizado ou eliminado. Anote no envase exterior a data em que se retira o ReFacto AF da geladeira e se põe à temperatura ambiente (até 25ºC). Mantenha o frasco dentro do envase exterior para protegê-lo da luz.
O produto reconstituído deve ser utilizado nas 3 horas seguintes à reconstituição.
A solução será de clara a ligeiramente opalescente e incolor. Não utilize este medicamento se apreciar que é turva ou contém partículas visíveis.
Os medicamentos não devem ser deitados fora pelos esgotos nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de ReFacto AF
- O princípio ativo é moroctocog alfa (fator VIII de coagulação recombinante). Cada frasco de ReFacto AF contém nominalmente 250, 500, 1000 ou 2000 UI de moroctocog alfa.
- Os outros componentes são sacarose, dihidrato de cloreto de cálcio, L-histidina, polissorbato 80 e cloreto de sódio (ver seção 2 “ReFacto AF contém sódio”). Também é fornecido um diluente [solução injetável de cloreto de sódio de 9 mg/ml (0,9%)] para a reconstituição.
- Após a reconstituição com o diluente [solução de cloreto de sódio de 9 mg/ml (0,9%)], cada frasco contém 62,5; 125; 250 ou 500 UI, respectivamente (conforme a potência de moroctocog alfa, ou seja, 250, 500, 1000 ou 2000 UI) de moroctocog alfa por 1 ml de solução preparada para injeção.
Aspecto do produto e conteúdo do envase
ReFacto AF é um frasco de vidro com pó para injeção e um diluente fornecido em uma seringa pré-carregada.
O conteúdo do envase é:
- um frasco de 250, 500, 1000 ou 2000 UI de pó de moroctocog alfa
- uma seringa pré-carregada de diluente, 4 ml de solução estéril injetável de cloreto de sódio de 9 mg/ml (0,9%), com uma vara de êmbolo
- um dispositivo estéril de adaptação ao frasco para reconstituição
- um sistema de perfusão estéril
- duas toalhetas com álcool
- esparadrapo
- uma gaze
Titular da autorização de comercialização
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelas
Bélgica
Responsável pela fabricação
Wyeth Farma S.A
Autovía del Norte A-1 Km 23
Desvío Algete Km 1
28700 San Sebastián de los Reyes
Madri
Espanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização.
Bélgica Luxemburgo Pfizer NV/SA Tel: +32 (0)2 554 62 11 | Lituânia Pfizer Luxembourg SARL filial em Lituânia Tel: +370 5 251 4000 |
Bulgária ??????? ?????????? ????, ???? ???????? ???.: +359 2 970 4333 | Hungria Pfizer Kft. Tel.: + 36 1 488 37 00 |
República Tcheca Pfizer, spol. s r.o. Tel: +420 283 004 111 | Malta Vivian Corporation Ltd. Tel: +356 21344610 |
Dinamarca Pfizer ApS Tlf.: +45 44 20 11 00 | Países Baixos Pfizer bv Tel: +31 (0)800 63 34 636 |
Alemanha PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Noruega Pfizer AS Tlf: +47 67 52 61 00 |
Estônia Pfizer Luxembourg SARL filial na Estônia Tel: +372 666 7500 | Áustria Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
Grécia Pfizer Ελλάς Α.Ε Τηλ: +30 210 6785800 | Polônia Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
Espanha Pfizer S.L. Tel: +34 91 490 99 00 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
França Pfizer Tél: +33 (0)1 58 07 34 40 | Romênia Pfizer Romania S.R.L. Tel: +40 (0) 21 207 28 00 |
Croácia Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 | Eslovênia Pfizer Luxembourg SARL Pfizer, filial para consultoria em atividades farmacêuticas, Liubliana Tel: + 386 (0) 1 52 11 400 |
Irlanda Pfizer Healthcare Ireland Unlimited Company Tel: 1800 633 363 (gratuito) Tel: +44 (0)1304 616161 | República Eslovaca Pfizer Luxembourg SARL, filial na República Eslovaca Tel: + 421 2 3355 5500 |
Islândia Icepharma hf. Sími: +354 540 8000 | Finlândia Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Itália Pfizer S.r.l. Tel: +39 06 33 18 21 | Suécia Pfizer AB Tel: + 46 (0)8 550 520 00 |
Chipre Pfizer Ελλάς Α.Ε. (filial no Chipre) Τηλ: +357 22817690 | |
Letônia Pfizer Luxembourg SARL filial na Letônia Tel: +371 670 35 775 |
Data da última revisão deste prospecto:
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1000 UI - após reconstituição em 2 ml de água para injetáveis, a dose é de 500 UI/mlSubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica
Alternativas a REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Alternativa a REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de REFACTO AF 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.














