

Pharmavate

Pergunte a um médico sobre a prescrição de Pharmavate

Como usar Pharmavate
Folheto informativo para o utilizador
Pharmavate, 50 UI/ml, pó e solvente para solução injectável
Fator VIII humano Pharmavate, 100 UI/ml, pó e solvente para solução injectável
Fator VIII humano
Deve ler-se atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para o poder reler se necessário.
- Deve consultar um médico, farmacêutico ou enfermeiro se tiver alguma dúvida adicional.
- O medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se algum dos efeitos secundários se agravar ou se ocorrerem efeitos secundários não listados neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro.
Índice do folheto:
- 1. O que é o medicamento Pharmavate e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Pharmavate
- 3. Como tomar o medicamento Pharmavate
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento Pharmavate
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Pharmavate e para que é utilizado
O Pharmavate pertence a um grupo de medicamentos chamados de factores de coagulação e contém fator VIII humano. É uma proteína especial que aumenta a capacidade do sangue de coagular. O Pharmavate é utilizado no tratamento e prevenção de hemorragias em doentes com hemofilia A. É uma condição em que o sangue demora mais tempo a coagular do que o esperado. Isso ocorre devido a uma deficiência congénita de fator VIII no sangue.
2. Informações importantes antes de tomar o medicamento Pharmavate
Recomenda-se fortemente que, sempre que o doente receber uma dose de Pharmavate, o nome e o número de série do produto sejam registados para manter um registo da série utilizada. O médico pode recomendar a vacinação contra a hepatite viral A e B se o doente receber regularmente ou repetidamente produtos de fator VIII de origem humana.
Quando não tomar o medicamento Pharmavate
- se o doente tiver alergia ao fator VIII humano ou a qualquer um dos outros componentes do medicamento (listados no ponto 6).
Precauções e advertências
Antes de começar a tomar o Pharmavate, deve consultar um médico, farmacêutico ou enfermeiro. O Pharmavate contém quantidades residuais de outras proteínas humanas. Qualquer medicamento que contenha proteínas e seja administrado por via intravenosa pode causar reações alérgicas (ver ponto 4. Efeitos secundários possíveis). A formação de inibidores (anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos que contenham fator VIII. Esses inibidores, especialmente em altas concentrações, podem interromper o tratamento eficaz e o doente será monitorizado de perto para a produção desses inibidores. Se a hemorragia no doente não for controlada adequadamente com o medicamento Pharmavate, deve informar imediatamente o seu médico.
Informações sobre o sangue e o plasma utilizados na produção do Pharmavate
Durante a produção de medicamentos a partir de sangue ou plasma humano, são tomadas medidas para prevenir a transmissão de infecções para os doentes. Incluem a seleção cuidadosa de doadores de sangue e plasma para garantir a exclusão de doadores que possam ser portadores de infecções, bem como testes de todas as amostras e pools de plasma para detectar a presença de vírus/infecções. Os fabricantes desses produtos implementaram etapas no processo de tratamento do sangue ou plasma para inativar ou remover vírus. No entanto, apesar dessas medidas, não é possível excluir completamente a possibilidade de transmissão de infecção quando se administram medicamentos preparados a partir de sangue ou plasma humano. Isso inclui vírus desconhecidos ou que surgiram recentemente, ou outros tipos de infecções. As medidas tomadas são consideradas eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), o vírus da hepatite B (HBV) e o vírus da hepatite C (HCV), bem como contra o vírus da hepatite A (HAV) não envelopado. Os métodos utilizados podem ter eficácia limitada contra vírus não envelopados, como o parvovirus B19. A infecção por parvovirus B19 pode ser grave para as mulheres grávidas (infecção do feto) e para indivíduos cujo sistema imunológico está suprimido ou que sofrem de certos tipos de anemia (por exemplo, anemia falciforme ou hemólise anormal de glóbulos vermelhos).
Outros medicamentos e Pharmavate
Deve informar o seu médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar, incluindo os que são vendidos sem receita médica. Não são conhecidas interações entre o fator VIII humano e outros produtos medicinais. No entanto, não se deve misturar o Pharmavate com outros medicamentos durante a infusão.
Gravidez e amamentação
Se estiver grávido, a amamentar ou se suspeitar que está grávido, ou se planeia engravidar, deve consultar um médico ou farmacêutico antes de tomar este medicamento.
Condução de veículos e utilização de máquinas
Não foi observado qualquer efeito na capacidade de conduzir veículos ou utilizar máquinas.
O medicamento Pharmavate contém:
No caso de uma ampola de 250 UI, o produto contém menos de 1 mmol de sódio (23 mg) por dose, o que significa que o medicamento é considerado "livre de sódio". No caso de uma ampola de 500 UI e 1000 UI, o produto contém no máximo 1,75 mmol de sódio (40 mg) por dose. Isso corresponde a 2% da dose diária máxima recomendada de sódio para adultos. Deve ser considerado para doentes que estão a seguir uma dieta com controle de sódio.
3. Como tomar o medicamento Pharmavate
O Pharmavate deve ser administrado por via intravenosa após reconstituição com o solvente fornecido. O tratamento deve ser iniciado sob supervisão médica.
Dosagem para prevenção de hemorragias:
Na prevenção de longo prazo de hemorragias em doentes com hemofilia A grave, deve ser administrado fator VIII em doses de 20 a 40 UI por quilograma de peso corporal a cada 2 a 3 dias. A dose deve ser ajustada de acordo com a resposta clínica. Em alguns casos, pode ser necessário administrar o medicamento em intervalos de tempo mais curtos ou em doses maiores.
Cálculo da dose:
O Pharmavate deve ser sempre administrado de acordo com as recomendações do médico. Em caso de dúvida, deve consultar novamente o médico ou farmacêutico. A atividade do fator VIII no sangue corresponde ao teor de fator VIII no sangue. É expressa em percentagem (em relação ao sangue humano normal) ou em unidades internacionais (UI). A dose de fator VIII é expressa em UI. Uma Unidade Internacional (UI) de atividade de fator VIII é equivalente à quantidade de fator VIII contida em 1 ml de sangue humano normal. 1 UI de fator VIII por quilograma de peso corporal aumenta a atividade do fator VIII no sangue em 1,5% a 2% da atividade normal. Para calcular a dose necessária, deve determinar a atividade do fator VIII no sangue do doente. Isso permitirá determinar quanto a atividade deve ser aumentada. Deve consultar o médico em caso de incerteza sobre quanto a atividade do fator VIII deve ser aumentada no sangue e como calcular a dose necessária. A dose necessária é calculada usando a seguinte fórmula: dose necessária = peso corporal (kg) x aumento necessário da atividade do fator VIII (%) (UI/ml) x 0,5. A quantidade a ser administrada e a frequência de administração do produto devem ser sempre ajustadas de acordo com a eficácia clínica no doente individual. Em casos de hemorragia, a atividade do fator VIII não deve diminuir abaixo do nível de atividade no sangue (% do valor normal) durante o período especificado. A seguinte tabela pode ser útil para determinar as doses em casos de hemorragia ou procedimentos cirúrgicos:
| Gravidade da hemorragia / Tipo de procedimento cirúrgico | Nível necessário de fator VIII (%) (UI/ml) | Frequência de administração (horas)/ Duração do tratamento (dias) |
| Hemorragia | ||
| Hemorragia inicial nos joelhos, músculos ou boca | 20-40 | Repetir a cada 12 a 24 horas. Pelo menos 1 dia até que a dor causada pela hemorragia desapareça ou a ferida seja curada. |
| Hemorragia mais grave nos joelhos, músculos ou hematomas | 30-60 | Repetir a infusão a cada 12 a 24 horas durante 3 a 4 dias ou mais até que a dor desapareça e a função seja restaurada. |
| Hemorragias que ameaçam a vida | 60-100 | Repetir a infusão a cada 8 a 24 horas até que o perigo tenha passado. |
| Operações | ||
| Menores, incluindo extração de dentes | 30-60 | A cada 24 horas, durante pelo menos 1 dia, até a cura. |
| Maior | 80-100 (pré e pós-operatório) | Repetir a infusão a cada 8 a 24 horas até a cura adequada da ferida, e então continuar o tratamento por pelo menos 7 dias adicionais para manter a atividade do fator VIII em 30% a 60%. |
A dose e a frequência de administração do Pharmavate serão determinadas pelo médico. A resposta ao fator VIII pode variar entre doentes. Portanto, durante o tratamento, é recomendado determinar os níveis de fator VIII para estabelecer a dose e a frequência de administração adequadas.
Uso em crianças
Nos estudos clínicos, não foram encontrados requisitos especiais de dosagem para crianças. A dosagem é a mesma para adultos e crianças, tanto no tratamento quanto na prevenção.
Instruções para uso em casa
- Deve ler todas as instruções e segui-las cuidadosamente!
- Não use o produto Pharmavate após a data de validade impressa na etiqueta.
- Durante o procedimento descrito abaixo, deve manter condições assépticas!
- A solução na seringa deve ser clara ou ligeiramente perlada, brilhante. Não injete soluções turvas ou que contenham partículas sólidas.
- Deve usar o conjunto fornecido para injeção. O uso de outro equipamento para injeção/infusão pode causar riscos adicionais e falha no tratamento.
Instruções para preparar a solução usando o sistema Mix2Vial:
- 1. Não use o produto imediatamente após a retirada da geladeira. Deixe o solvente e o pó em frascos fechados até atingir a temperatura ambiente.
- 2. Remova as tampas dos dois frascos e limpe as rolhas de borracha com um dos cotonetes fornecidos com álcool.
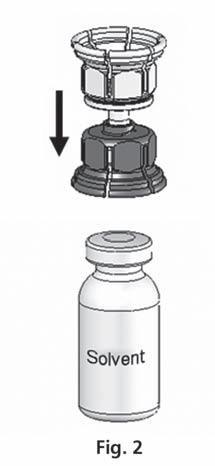
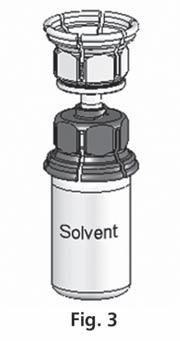
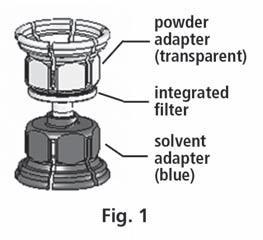
- 3. O sistema Mix2Vial é apresentado na fig. 1. Coloque o frasco com o solvente em uma superfície plana e segure firmemente. Pegue o sistema Mix2Vial e vire. Coloque a parte azul do Mix2Vial sobre o frasco com o solvente e pressione firmemente até ouvir um clique (fig. 2 + 3).
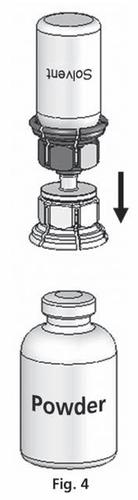
- 4. Coloque o frasco com o pó em uma superfície plana e segure firmemente. Pegue o frasco com o solvente com o sistema Mix2Vial conectado e vire-o de cabeça para baixo. Coloque a parte transparente do conjunto sobre o frasco com o pó e pressione firmemente até ouvir um clique (fig. 4). O solvente flui automaticamente para o frasco com o pó.
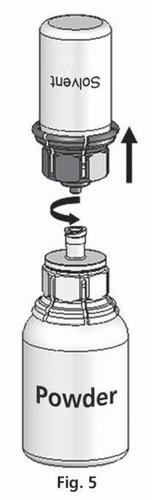
- 5. Com os dois frascos conectados, agite suavemente o frasco com o pó até que o produto seja completamente dissolvido. A dissolução é concluída em menos de 10 minutos à temperatura ambiente. Durante a preparação, pode ocorrer uma ligeira formação de espuma. Desrosqueie o Mix2Vial em duas partes (fig. 5). A espuma desaparecerá.
Descarte o frasco vazio com o solvente com a parte azul do Mix2Vial.
Instruções para administrar a injeção:
Como medida de precaução, deve verificar a frequência cardíaca antes e durante a injeção. Se ocorrer um aumento significativo da frequência cardíaca, deve reduzir a velocidade de injeção ou interromper a administração do medicamento por um curto período.
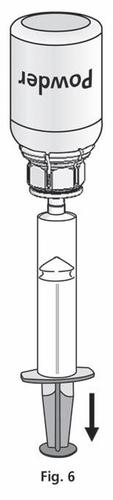
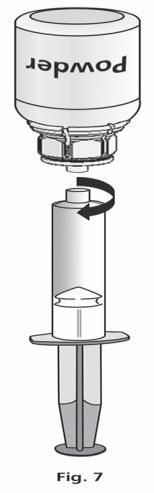
- 1. Conecte a seringa à parte transparente do Mix2Vial. Vire o frasco de cabeça para baixo e aspire a solução para a seringa (fig. 6). A solução na seringa deve ser clara ou ligeiramente perlada, brilhante. Após transferir a solução, segure firmemente o êmbolo da seringa (com o lado para baixo) e retire a seringa do Mix2Vial (fig. 7). Descarte o Mix2Vial e o frasco vazio.
- 2. Limpe o local de injeção escolhido com um dos cotonetes fornecidos com álcool.
- 3. Conecte a agulha fornecida para injeção à seringa.
- 4. Insira a agulha na veia escolhida. Se estiver usando uma braçadeira de compressão para visualizar a veia, deve soltá-la antes de iniciar a injeção do produto Pharmavate. O sangue não deve entrar na seringa devido ao risco de formação de coágulos de fibrina.
- 5. Injete a solução lentamente na veia, não mais rápido do que 2-3 ml por minuto.
Se estiver usando mais de um frasco de pó do Pharmavate durante uma única administração, pode usar a mesma agulha para injeção e seringa, mas o conjunto Mix2Vial é para uso único.
Instruções para preparar a solução usando o conjunto de transferência (1 agulha de dupla ponta e 1 agulha de filtro):
- 1. Não use o produto imediatamente após a retirada da geladeira. Deixe o pó e o solvente em frascos fechados até atingir a temperatura ambiente. Mantenha essa temperatura durante a preparação. Se estiver usando uma banheira de água para aquecer, certifique-se de que a água não entre em contato com as rolhas de borracha (sem látex) ou com as tampas dos frascos. A temperatura da banheira de água não deve exceder 37°C.
- 2. Remova as tampas dos frascos com o pó e o solvente (fig. 1) e limpe as rolhas de borracha com um dos cotonetes fornecidos com álcool (fig. 2).
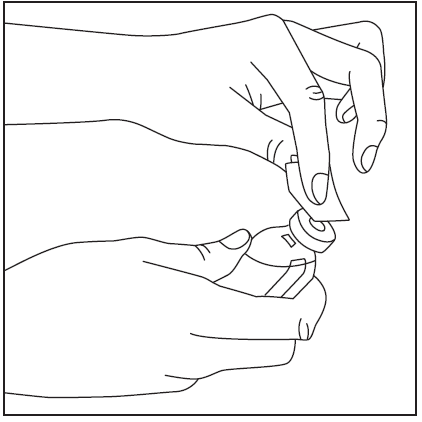
fig.1
fig.2
fig.1
fig.2
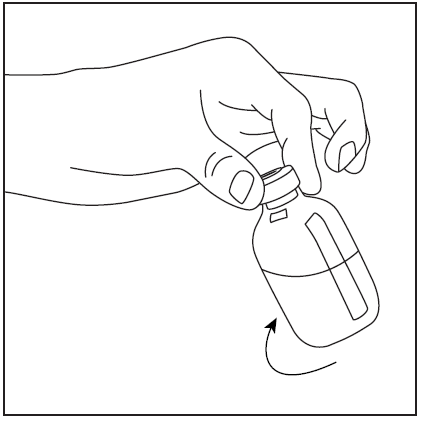
- 3. Retire a cobertura protetora da ponta curta da agulha de dupla ponta (fig. 3), certificando-se de não tocar na ponta exposta da agulha. Em seguida, perfure o centro da rolha de borracha do frasco com o solvente com a agulha na vertical (fig. 4). Para retirar completamente o líquido do frasco com o solvente, a agulha deve ser inserida na rolha de borracha de modo que penetre na rolha e seja visível no frasco.
fig. 4
fig.3
fig.4
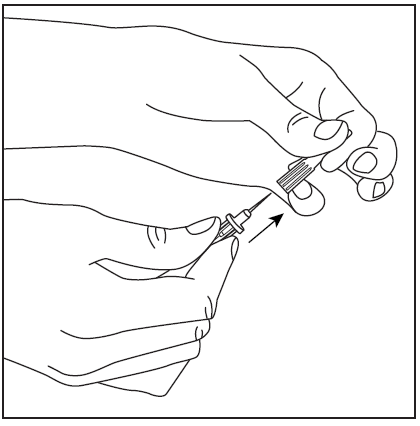
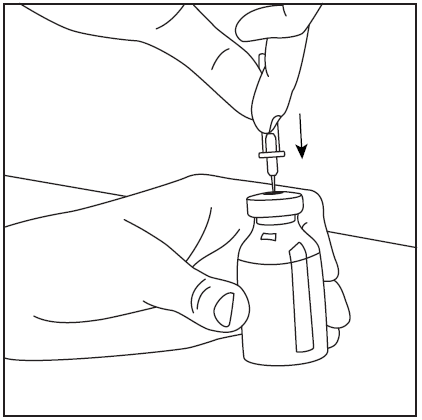
- 4. Retire a cobertura protetora da ponta mais longa da agulha de dupla ponta, certificando-se de não tocar na ponta exposta da agulha (fig. 5). Pegue o frasco com o solvente e a agulha inserida e vire-o de cabeça para baixo sobre o frasco com o pó. Em seguida, insira rapidamente a agulha na rolha de borracha do frasco com o pó (fig. 6). O vácuo dentro do frasco faz com que o solvente flua para o frasco com o pó.
fig.6
fig.5
fig.6
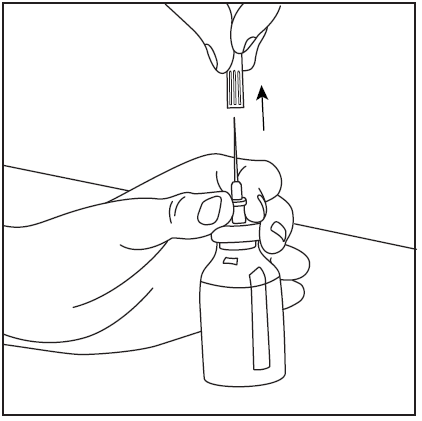
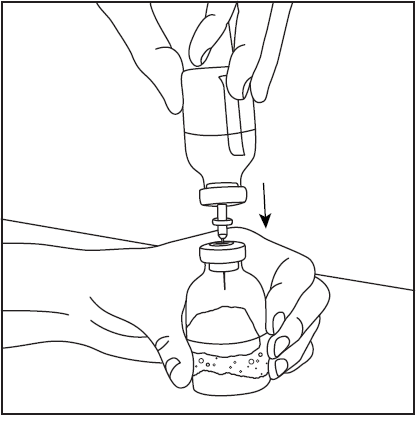
- 5. Retire a agulha de dupla ponta junto com o frasco vazio de solvente (fig. 7), em seguida, agite suavemente o frasco com o pó e o solvente até que o produto seja completamente dissolvido. O Pharmavate dissolve-se rapidamente à temperatura ambiente em uma solução clara (fig. 8).
fig.8
fig.7
fig.8
Instruções para administrar a injeção:
Como medida de precaução, deve verificar a frequência cardíaca antes e durante a injeção. Se ocorrer um aumento significativo da frequência cardíaca, deve reduzir a velocidade de injeção ou interromper a administração do medicamento.
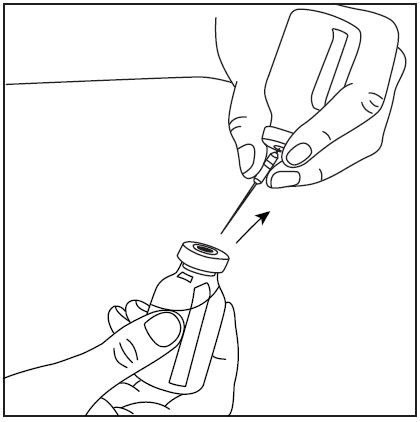
- 1. Após preparar o pó como descrito acima, retire a cobertura protetora da agulha de filtro e perfure a rolha de borracha do frasco com o concentrado preparado.
- 2. Retire a cobertura da agulha de filtro e conecte a seringa.
- 3. Vire o frasco com a seringa conectada de cabeça para baixo e aspire a solução para a seringa.
- 4. Limpe o local de injeção escolhido com um dos cotonetes fornecidos com álcool.
- 5. Retire a agulha de filtro da seringa e conecte a agulha para injeção à seringa.
- 6. Injete a solução na veia, não mais rápido do que 2-3 ml por minuto.
Qualquer resíduo não utilizado do medicamento ou seus dejetos deve ser descartado de acordo com as regulamentações locais. Doentes que usam mais de um frasco de concentrado do Pharmavate podem usar a mesma agulha para injeção e seringa, mas a agulha de filtro é para uso único. Ao aspirar a solução para a seringa, sempre use a agulha de filtro.
Uso de dose maior do que a recomendada do medicamento Pharmavate
Não foram observados sinais de superdose de fator VIII humano. No entanto, recomenda-se não exceder a dose recomendada.
Omissão de uma dose do medicamento Pharmavate
Não deve tomar uma dose dupla para compensar a dose omitida. Deve continuar com a próxima dose conforme recomendado pelo médico ou farmacêutico. Deve consultar o médico ou farmacêutico se tiver outras dúvidas sobre o uso deste medicamento.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não todos os doentes os experimentem. Embora sejam raros(podem ocorrer em 1 doente em 1000), foram observados casos de reações de hipersensibilidade ou alergias em doentes tratados com produtos que contenham fator VIII. Deve consultar o médico se ocorrerem os seguintes sintomas: vômitos, sensação de queimadura e dor ardente no local da injeção, sensação de aperto no peito, calafrios, taquicardia, náuseas, sensação de formigamento, rubor, dor de cabeça, urticária, queda da pressão arterial, erupção cutânea, ansiedade, inchaço facial, lábios, boca, língua ou garganta, que pode levar a dificuldade para engolir ou respirar (angioedema), fadiga (letargia), respiração sibilante. Muito raramente(podem ocorrer em 1 doente em 10 000) a hipersensibilidade pode levar a uma reação alérgica grave e potencialmente fatal chamada anafilaxia, que pode incluir choque, bem como uma ou todas as sintomas mencionados acima. Nesse caso, deve procurar atendimento médico imediatamente ou chamar os serviços de emergência. Outros efeitos secundários raros (podem ocorrer em 1 doente em 1000) Febre Em crianças não tratadas previamente com medicamentos que contenham fator VIII, anticorpos inibidores (ver ponto 2) podem ocorrer muito frequentemente (mais de 1 em 10 doentes). No entanto, em doentes que foram tratados previamente com fator VIII (mais de 150 dias de tratamento), o risco é incomum (menos de 1 em 100 doentes). Se isso ocorrer, os medicamentos do doente podem parar de funcionar corretamente e o doente pode experimentar hemorragia persistente. Se isso ocorrer, deve procurar atendimento médico imediatamente. Informações relacionadas à segurança viral, ver ponto 2. (Deve ter cuidado ao usar o Pharmavate).
Notificação de efeitos secundários
Se ocorrerem qualquer efeito secundário, incluindo qualquer efeito secundário não listado neste folheto, deve informar o seu médico ou farmacêutico. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos, Produtos Médicos e Produtos Biocidas Al. Jerozolimskie 181C PL - 02-222 Varsóvia Tel.: +48 22 49 21 301 Fax: +48 22 49 21 309 Site da internet: https://smz.ezdrowie.gov.pl Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização. A notificação de efeitos secundários ajudará a obter mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Pharmavate
Deve conservar o medicamento em um local seguro e fora do alcance das crianças. Não use este medicamento após a data de validade impressa na etiqueta. A data de validade se refere ao último dia do mês indicado. Conservar em temperatura abaixo de 25°C. Não congelar. Conservar na embalagem exterior para proteger da luz. A solução reconstituída deve ser usada imediatamente e apenas durante uma única administração. Não use este medicamento se notar que a solução está turva ou não está completamente dissolvida. Os medicamentos não devem ser descartados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Pharmavate
A substância ativa do medicamento é o fator VIII humano.
Volume e concentrações
| Tamanho do frasco com pó Pharmavate® (UI de fator VIII) | Tamanho do frasco com solvente (para adicionar ao frasco com pó Pharmavate®) (ml) | Concentração nominal da solução após reconstituição (UI de fator VIII/ml) |
| 250 UI | 5 | 50 |
| 500 UI | 10 | 50 |
| 1 000 UI | 10 | 100 |
Os outros componentes são: Para o pó: citrato de sódio, cloreto de sódio, cloreto de cálcio, glicina Para o solvente: água para injeção
Como é o medicamento Pharmavate e que conteúdo tem a embalagem
O Pharmavate é apresentado como pó e solvente para solução injectável. Pó branco ou amarelo claro, ou massa friável. O solvente é um líquido claro e incolor. 3 tamanhos de embalagem estão disponíveis, diferindo no conteúdo de fator VIII e solvente:
- 250 UI/frasco: após reconstituição em 5 ml, a concentração é de 50 UI/ml
- 500 UI/frasco: após reconstituição em 10 ml, a concentração é de 50 UI/ml
- 1000 UI/frasco: após reconstituição em 10 ml, a concentração é de 100 UI/ml
Todos os tamanhos de embalagem contêm: 1 sistema de transferência Mix2Vial, 1 seringa de uso único, 1 agulha para injeção e 2 cotonetes com álcool ou 1 conjunto de transferência (1 agulha de dupla ponta e 1 agulha de filtro), 1 seringa de uso único, 1 agulha para injeção e 2 cotonetes com álcool. Nem todos os tamanhos de embalagem podem estar disponíveis no mercado.
Titular da autorização de comercialização
Octapharma (IP) SPRL Route de Lennik 451 1070 Anderlecht Bélgica
Fabricante
Octapharma Pharmazeutika Produktionsges.m.b.H Oberlaaer Str. 235 1100 Viena Áustria Octapharma S.A.S 72 Rue du Maréchal Foch 67380 Lingolsheim França Octapharma AB 112 75 Estocolmo Suécia
Data da última atualização do folheto: 01.01.2025
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorOctapharma AB Octapharma Pharmazeutika Produktionsges.m.g.H. Octapharma S.A.S.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PharmavateForma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 2000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 250 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Pharmavate noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Pharmavate em España
Alternativa a Pharmavate em Ucrania
Médicos online para Pharmavate
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Pharmavate – sujeita a avaliação médica e regras locais.














