

PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO

Pergunte a um médico sobre a prescrição de PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO

Como usar PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO
Introdução
Prospecto: informação para o utilizador
Prismasol 2 mmol/lPotássio solução para hemodiálise e hemofiltrção.
Cloreto de cálcio, di-hidrato / Cloreto de magnésio hexa-hidrato / Glucose mono-hidrato / solução de ácido láctico 90%/ Cloreto de sódio/ Cloreto de potássio / Hidrogenocarbonato de sódio
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se sofrer efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Prismasol e para que é utilizado.
- O que precisa saber antes de começar a usar Prismasol.
- Como usar Prismasol
- Possíveis efeitos adversos
- Conservação de Prismasol
- Conteúdo do envase e informação adicional
1. O que é Prismasol e para que é utilizado
Prismasol contém os seguintes princípios ativos: cloreto de cálcio, di-hidrato; cloreto de magnésio, hexa-hidrato; glucose mono-hidrato, solução de ácido láctico a 90%; cloreto de sódio; cloreto de potássio e hidrogenocarbonato de sódio.
Prismasol é utilizado no tratamento da insuficiência renal como uma solução para hemofiltrção ou hemodiafiltrção contínua (como substituição da perda do líquido produzido pelo passo da sangue através do filtro) e hemodiálise contínua ou hemodiafiltrção (a sangue passa por um lado da membrana de diálise enquanto a solução de hemodiálise passa por o outro lado da mesma).
Prismasol também pode ser utilizado em caso de intoxicação com substâncias dializáveis ou filtráveis.
Prismasol 2 mmol/l potássio está especialmente indicado em pacientes com tendência à hipercaliemia (nível alto de potássio na sangue)
2. O que precisa saber antes de começar a administrar Prismasol
Não use Prismasol 2 mmol/l potássio em caso de:
- alergia a algum dos princípios ativos ou a algum dos outros componentes (incluídos na secção 6),
- baixo nível de potássio na sangue (hipocaliemia),
- alta concentração de bicarbonato na sangue (alcalose metabólica).
Não se pode excluir a presença de antígeno derivado de milho em Prismasol.
Não use hemofiltrção ou tratamento de diálise em caso de:
- Insuficiência renal com hipercatabolismo pronunciado (catabolismo anormalmente incrementado), se os sintomas urémicos (sintomas causados por uma alta concentração de ureia na sangue) não podem corrigir-se com hemofiltrção.
- Pressão arterial insuficiente no acesso vascular.
- Anticoagulação sistémica (coagulação reduzida da sua sangue) se há um alto risco de hemorragia (sangrado)
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Prismasol
A solução só pode ser utilizada por ou sob a supervisão de um médico competente em tratamentos de insuficiência renal usando técnicas de hemofiltrção, hemodiafiltrção e hemodiálise contínua.
Antes e durante o tratamento, será controlado o estado da sua sangue, por exemplo, far-se-á um seguimento do equilíbrio ácido-base e das concentrações de eletrólitos (sales na sangue), bem como de todos os líquidos que lhe sejam administrados (perfusão intravenosa) e que produza (diurese), mesmo que se trate de líquidos não directamente relacionados com o tratamento.
Deve ser controlada estreitamente a concentração de glucose na sangue, especialmente se você é diabético.
Outros medicamentos e Prismasol
Informa ao seu médico ou farmacêutico se está a tomar, tomou recentemente ou se pudesse ter tomado outros medicamentos
A concentração na sangue de alguns dos outros medicamentos pode reduzir-se durante o tratamento. O seu médico decidirá se se deve alterar a sua medicação.
Em particular, informe ao seu médico nos casos seguintes:
- Medicamentos digitálicos (para o tratamento de algumas insuficiências cardíacas) já que o risco de arritmias cardíacas (latidos do coração irregulares ou rápidos) induzidas por estes medicamentos aumenta durante a hipocaliemia (baixa concentração de potássio na sangue).
- Vitamina D e medicamentos que contenham cálcio, já que podem aumentar o risco de hipercalcemia (uma elevada concentração de cálcio na sangue).
- Qualquer suplemento de hidrogenocarbonato de sódio (ou outra fonte tamponada), já que pode aumentar o risco de alcalose metabólica (excesso de bicarbonato na sangue).
- Quando o citrato é usado como anticoagulante (como protector em equipamentos de diálise), pode reduzir os níveis de cálcio no plasma.
Gravidez e Lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Se você está grávida ou em período de lactação, o seu médico decidirá se se lhe deve administrar Prismasol.
Condução e uso de máquinas
Não se têm dados de que Prismasol afete a capacidade para conduzir ou utilizar máquinas.
3. Como usar Prismasol
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
O volume de Prismasol a administrar dependerá das suas condições clínicas e do equilíbrio de líquidos desejado. Por isso, o volume da dose dependerá do critério do seu médico.
Via de administração: via intravenosa e hemodiálise.
Se acredita que usa mais Prismasol do que devia:
O seu equilíbrio de líquidos, de ácido – base e electrolítico deve ser cuidadosamente controlado
No caso improvável de que se produza uma sobredose, o seu médico tomará as medidas correctivas necessárias para ajustar a dose.
Uma sobredose pode causar:
- sobrecarga de líquidos na sangue,
- aumento do nível de bicarbonato na sangue (alcalose metabólica),
- e/ou redução dos níveis de sales na sangue (hipofosfatemia, hipocaliemia).
A sobredose poderia conduzir a consequências graves, tais como insuficiência cardíaca congestiva, desequilíbrio electrolítico ou de ácido-base.
Para instruções de uso, consulte a secção “Esta informação está destinada únicamente a profissionais do sector sanitário”.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Foram notificados os seguintes efeitos adversos:
Não conhecida: a frequência não pode ser estimada a partir dos dados disponíveis
- Mudanças nos níveis de sales na sangue (desequilíbrios electrolíticos como hipofosfatemia ou hipocaliemia)
- Elevação da concentração de bicarbonato no plasma (alcalose metabólica) ou redução da concentração de bicarbonato no plasma (acidose metabólica)
- Volume de água no organismo anormalmente elevado ou reduzido (hiper ou hipovolemia)
- Concentração de glucose anormalmente alta na sangue (hiperglicemia)
- Náuseas
- Vómitos
- Cãibras musculares
- Hipotensão (pressão sanguínea baixa)
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto.
Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de Prismasol
Mantenha este medicamento fora da vista e do alcance das crianças.
Não conserve a temperatura inferior a + 4º C.
Não utilize este medicamento após a data de caducidade indicada na etiqueta e no embalagem após CAD. A data de caducidade é o último dia do mês que se indica.
Demonstrou-se a estabilidade química e física da solução reconstituída durante 24 horas a uma temperatura de +22 °C. De não utilizar a solução imediatamente, o tempo de conservação em uso e as condições antes do uso são responsabilidade do utilizador e não devem superar as 24 horas, incluindo a duração do tratamento.
Os medicamentos não devem ser jogados nos desagües nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
(FORMATOPVC COM VÁLVULA)
O que contém PRISMASOL
Os princípios ativos são:
Antes da reconstituição:
1000 ml de Solução de eletrólitos (Compartimento A pequeno) contém:
Cloruro de cálcio dihidrato 5,145 g
Cloruro de magnésio hexahidrato 2,033 g
Glicose 22,000 g
Ácido (S)-Láctico 5,400 g
1000 ml de solução tampão (Compartimento B grande) contém:
Cloruro de sódio 6,450 g
Hidrogenocarbonato de sódio 3,090 g
Cloruro de potássio 0,157 g
Depois da reconstituição:
A solução do compartimento A (250 ml) e do compartimento B (4750 ml) se mistura para originar uma solução reconstituída (5000 ml) cuja composição é a seguinte:
mmol/l | mEq/l | |
Cálcio Ca2+ | 1,75 | 3,50 |
Magnésio Mg2+ | 0,50 | 1,00 |
Sódio Na+ | 140,00 | 140,00 |
Cloruro Cl- | 111,50 | 111,50 |
Lactato | 3,00 | 3,00 |
Hidrogenocarbonato HCO3- | 32,00 | 32,00 |
Potássio K+ | 2,00 | 2,00 |
Glicose | 6,10 | |
Osmolaridade teórica: | 297 mOsm/l |
Os outros componentes são:dióxido de carbono (E-290), água para preparações injetáveis.
pH da solução reconstituída: 7,0 – 8,5
Aspecto do produtoe conteúdo do envase
Prismasol é apresentado em uma bolsa bicompartimental, contendo o compartimento pequeno A a solução de eletrólitos e o compartimento grande B a solução tampão. A solução final reconstituída é obtida após romper o vástago rompível e misturar ambas as soluções. A solução reconstituída é transparente e ligeiramente amarela. Cada bolsa (A+B) contém 5000 ml de solução para hemodiálise e hemofiltrção. A bolsa está recoberta por uma sobrebolsa transparente.
Cada caixa contém duas bolsas e um prospecto.
Título da autorização de comercialização:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.
Via Stelvio 94
23035 Sondalo (SO)
Itália
Ó
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Bulgária, Chipre, República Checa, Dinamarca, Eslováquia, Eslovénia, Estónia, Espanha, Finlândia, França, Grécia, Holanda, Hungria, Islândia, Irlanda, Itália, Letónia, Lituânia, Luxemburgo, Malta, Noruega, Polónia, Portugal, Roménia, Suécia, Reino Unido (Irlanda do Norte): Prismasol 2
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Vantive Health, S.L.
Polígono industrial sector 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valência
Espanha
Data da última revisão deste prospecto: 03/2018
A informação detalhada e atualizada sobre este medicamento está disponível no site da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.es
--------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário
Prismasol 2 mmol/lPotássio solução para hemodiálise e hemofiltrção
Precauções
Devem ser seguidas com exatidão as instruções de uso e manipulação de Prismasol.
As soluções dos dois compartimentos devem ser misturadas antes de usadas.
O uso de soluções de hemofiltrção e hemodiálise contaminadas pode causar sepse, choque e condições que podem causar a morte.
Prismasol pode ser aquecido a 37 ºC para melhorar o bem-estar do paciente. O aquecimento da solução antes de seu uso deve ser realizado antes de sua reconstituição apenas com calor seco. As soluções não devem ser aquecidas em água nem no micro-ondas. A solução deve ser inspecionada visualmente antes da administração para detectar a presença de partículas e um possível cambio de cor, quando a solução e o envase o permitam. Não administrar se a solução não for transparente ou se o precinto não estiver intacto.
Prismasol é uma solução que contém potássio. Antes e durante a hemofiltrção e a hemodiálise, deve ser feito um acompanhamento da concentração sanguínea de potássio. Em função da concentração de potássio no sangue antes do tratamento, pode desenvolver-se hipopotasemia ou hipopotasemia.
Se produzir hipopotasemia, pode ser necessária a adição de potássio e/ou a administração de um dializado com uma maior concentração de potássio.
Se produzir hipopotasemia uma vez iniciado o tratamento, deverá ser avaliada a adição de fontes de potássio que afetem as concentrações. Quando a solução for utilizada como solução de substituição, deve ser diminuída a velocidade de perfusão e confirmado que se alcançou a concentração de potássio desejada. Se não se resolver a hipopotasemia, deve ser interrompida a perfusão imediatamente.
Se a hipopotasemia se desenvolver quando a solução for utilizada como dializado, pode ser necessário administrar um dializado sem potássio para aumentar a eliminação do potássio.
A concentração de fosfatos inorgânicos deve ser medida regularmente. No caso de que os níveis de fosfato inorgânico no sangue sejam baixos, deve ser restabelecido. Pode ser adicionado à solução uma concentração de fosfatos de até 1,2 mmol/l. Se for adicionado fosfato potássico, a concentração total de potássio não deve superar os 4 mEq/l (4 mmol/l).
Embora não tenham sido notificados casos de reação de hipersensibilidade graves ao milho com Prismasol, as soluções que contêm glicose procedente de amido de milho hidrolisado não devem ser utilizadas em pacientes com alergia conhecida ao milho ou a produtos derivados do milho.
Se se desenvolverem sinais ou sintomas de uma suspeita de reação de hipersensibilidade, a administração deve ser interrompida imediatamente. Devem ser instituídas as medidas terapêuticas compensatórias apropriadas que estejam clinicamente indicadas.
Devido ao conteúdo de glicose e lactato da solução, pode dar origem a hiperglicemia, especialmente em pacientes diabéticos. Os níveis de glicose no sangue devem ser monitorizados regularmente. Em caso de desenvolver hiperglicemia, pode ser necessário administrar uma solução de substituição ou dializado livre de dextrosa. Para manter o controle glicêmico desejado, podem ser necessárias outras medidas corretivas.
Prismasol contém hidrogenocarbonato de sódio (bicarbonato) e lactato (precursor do bicarbonato) que pode influir no equilíbrio ácido-base. Se a alcalose metabólica se desenvolver ou piorar durante o tratamento com a solução, pode ser necessário reduzir a velocidade de administração ou interromper a administração.
Antes e durante o tratamento, deve ser feito um acompanhamento estreito do equilíbrio electrolítico e de ácido-base durante todo o procedimento.
Em caso de desequilíbrio de líquidos, a situação clínica deve ser controlada cuidadosamente e o equilíbrio de líquidos deve ser corrigido conforme necessário.
Método de administração
Via intravenosa e para hemodiálise. Prismasol, quando utilizado como solução de substituição, é administrado dentro do circuito antes do hemofiltro (pré-diluição) ou após o hemofiltro (pós-diluição)
Posologia
O volume e a velocidade de uso de Prismasol dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-base e do estado clínico geral do paciente. A pauta de administração (dose, velocidade de perfusão e volume acumulativo) de Prismasol deve ser estabelecida por um médico.
As velocidades de fluxo utilizadas para a solução de substituição em hemofiltrção e hemodiafiltrção são:
Adultos: 500 – 3000 ml/hora
As velocidades de fluxo utilizadas para a solução de diálise (dializado) em hemodiálise contínua e hemodiafiltrção contínua são:
Adultos: 500 - 2500 ml/hora
Normalmente, as velocidades de fluxo utilizadas em adultos são de aproximadamente 2000 a 2500 ml/h, o que corresponde a um volume de líquido diário de entre 48 e 60 litros, aproximadamente.
População pediátrica
Os intervalos de velocidades de fluxo da solução de substituição em hemofiltrção e hemodiafiltrção e da solução de diálise (dializado) em hemodiálise contínua são:
Crianças (de neonatos a adolescentes de até 18 anos de idade): de 1000 a 2000 ml/h/1,73 m2.
Podem ser necessárias velocidades de fluxo de até 4000 ml/h/1,73 m2, especialmente em crianças pequenas (≤10 kg). A velocidade de fluxo absoluta (em ml/h) da população pediátrica não deve superar, em geral, a velocidade de fluxo máxima dos adultos.
Instruções de manipulação
A solução de eletrólitos (compartimento pequeno A) é adicionada à solução tampão (compartimento grande B) após romper o vástago rompível justo antes de usar para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve ser seguida uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Usar apenas se a sobrebolsa estiver intacta, todos os selos estiverem intactos, o vástago rompível não estiver quebrado e a solução for transparente. Aperte a bolsa com firmeza para garantir que não haja vazamentos. Se forem observados vazamentos, descartar imediatamente a solução, pois a esterilidade não pode ser garantida.
O compartimento grande (B) está equipado com um puerto de injeção para adicionar outros fármacos que sejam necessários uma vez reconstituída a solução. É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado a Prismasol, verificando o eventual cambio de cor e/ou precipitação eventual, complexos insolúveis ou cristais. Antes de adicionar um medicamento, verificar se é solúvel e estável em água no pH de Prismasol (o pH da solução reconstituída está compreendido entre 7,0 e 8,5). Os aditivos podem não ser compatíveis. Devem ser consultadas as Instruções de uso do medicamento adicionado.
Eliminar qualquer líquido do puerto de injeção, colocar a bolsa em posição invertida, adicionar o medicamento através do puerto de injeção e misturar perfeitamente. A solução deve ser administrada imediatamente.A introdução e o mistura dos aditivos sempre devem ser realizados antes de conectar a bolsa da solução ao circuito extracorpóreo.
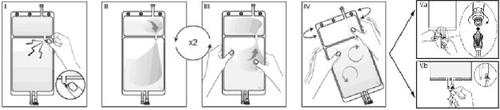
IRetirar a sobrebolsa da bolsa imediatamente antes de usar e descartar qualquer outro material de envasado. Abrir o precinto rompendo o vástago rompível situado entre os dois compartimentos da bolsa. O vástago ficará dentro da bolsa. (Ver figura I abaixo).
IIGarantir que todo o líquido do compartimento pequeno A seja transferido para o compartimento grande B. (Ver figura II abaixo).
IIIClarificar duas vezeso compartimento pequeno A forçando a solução misturada a voltar a este compartimento e, em seguida, novamente ao compartimento grande B (Ver figura III abaixo).
IVUma vez esvaziado o compartimento pequeno A, agitar o compartimento grande B para que se misture completamente o seu conteúdo. A solução já está preparada para usar e pode ser pendurada no equipamento. (Ver figura IV abaixo).
VA linha de diálise ou de substituição pode ser conectada a qualquer um dos dois puertos de acesso.
V.aSe for utilizado o conector luer, retire a tampa mediante um movimento de giro e extração e conecte o conector luer macho da linha de diálise ou substituição no receptor luer fêmea da bolsa mediante um movimento de pressão e giro. Garanta que a conexão esteja bem feita e apertada. A conexão se abrirá. Verifique que o líquido circula livremente. (Ver figura Va abaixo).
Se a linha de diálise ou substituição for desconectada do conector luer, o conector se fechará e o fluxo da solução se interromperá. O puerto luer é um puerto sem agulha que pode ser limpo.
V.bSe for utilizado o acesso de injeção, retire primeiro a cápsula. O puerto de injeção é um puerto que pode ser desinfetado com torunda. Introduza o espigão através da parede de borracha. Verifique que a solução circula livremente. (Ver figura Vb abaixo).
A solução deve ser usada imediatamente após retirar a sobrebolsa. Se não for feito assim, a solução reconstituída deve ser usada em um prazo de 24 horas, incluindo a duração do tratamento após a adição da solução de eletrólitos à solução tampão.
A solução reconstituída é para uso único. Descartar imediatamente qualquer resto de solução não utilizada.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.
(FORMATO PVC COM VÁSTAGO ROMPIVEL)
O que contém PRISMASOL
Os princípios ativos são:
Antes da reconstituição:
1000 ml de Solução de eletrólitos (Compartimento A pequeno) contém:
Cloruro de cálcio dihidrato 5,145 g
Cloruro de magnésio hexahidrato 2,033 g
Glicose 22,000 g
Ácido (S)-Láctico 5,400 g
1000 ml de solução tampão (Compartimento B grande) contém:
Cloruro de sódio 6,450 g
Hidrogenocarbonato de sódio 3,090 g
Cloruro de potássio 0,157 g
Depois da reconstituição:
A solução do compartimento A (250 ml) e do compartimento B (4750 ml) se mistura para originar uma solução reconstituída (5000 ml) cuja composição é a seguinte:
mmol/l | mEq/l | |
Cálcio Ca2+ | 1,75 | 3,50 |
Magnésio Mg2+ | 0,50 | 1,00 |
Sódio Na+ | 140,00 | 140,00 |
Cloruro Cl- | 111,50 | 111,50 |
Lactato | 3,00 | 3,00 |
Hidrogenocarbonato HCO3- | 32,00 | 32,00 |
Potássio K+ | 2,00 | 2,00 |
Glicose | 6,10 | |
Osmolaridade teórica: | 297 mOsm/l |
Os outros componentes são:dióxido de carbono (E-290), água para preparações injetáveis.
pH da solução reconstituída: 7,0 – 8,5
Aspecto do produtoe conteúdo do envase
Prismasol é apresentado em uma bolsa bicompartimental, contendo o compartimento pequeno A a solução de eletrólitos e o compartimento grande B a solução tampão. A solução final reconstituída é obtida após romper o vástago rompível e misturar ambas as soluções. A solução reconstituída é transparente e ligeiramente amarela. Cada bolsa (A+B) contém 5000 ml de solução para hemodiálise e hemofiltrção. A bolsa está recoberta por uma sobrebolsa transparente.
Cada caixa contém duas bolsas e um prospecto.
Título da autorização de comercialização:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.
Via Stelvio 94
23035 Sondalo (SO)
Itália
Ó
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Bulgária, Chipre, República Checa, Dinamarca, Eslováquia, Eslovénia, Estónia, Espanha, Finlândia, França, Grécia, Holanda, Hungria, Islândia, Irlanda, Itália, Letónia, Lituânia, Luxemburgo, Malta, Noruega, Polónia, Portugal, Roménia, Suécia, Reino Unido (Irlanda do Norte): Prismasol 2
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Vantive Health, S.L.
Polígono industrial sector 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valência
Espanha
Data da última revisão deste prospecto: 03/2018
A informação detalhada e atualizada sobre este medicamento está disponível no site da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.es
--------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário
Prismasol 2 mmol/lPotássio solução para hemodiálise e hemofiltrção
Precauções
Devem ser seguidas com exatidão as instruções de uso e manipulação de Prismasol.
As soluções dos dois compartimentos devem ser misturadas antes de usadas.
O uso de soluções de hemofiltrção e hemodiálise contaminadas pode causar sepse, choque e condições que podem causar a morte.
Prismasol pode ser aquecido a 37 ºC para melhorar o bem-estar do paciente. O aquecimento da solução antes de seu uso deve ser realizado antes de sua reconstituição apenas com calor seco. As soluções não devem ser aquecidas em água nem no micro-ondas. A solução deve ser inspecionada visualmente antes da administração para detectar a presença de partículas e um possível cambio de cor, quando a solução e o envase o permitam. Não administrar se a solução não for transparente ou se o precinto não estiver intacto.
Prismasol é uma solução que contém potássio. Antes e durante a hemofiltrção e a hemodiálise, deve ser feito um acompanhamento da concentração sanguínea de potássio. Em função da concentração de potássio no sangue antes do tratamento, pode desenvolver-se hipopotasemia ou hipopotasemia.
Se produzir hipopotasemia, pode ser necessária a adição de potássio e/ou a administração de um dializado com uma maior concentração de potássio.
Se produzir hipopotasemia uma vez iniciado o tratamento, deverá ser avaliada a adição de fontes de potássio que afetem as concentrações. Quando a solução for utilizada como solução de substituição, deve ser diminuída a velocidade de perfusão e confirmado que se alcançou a concentração de potássio desejada. Se não se resolver a hipopotasemia, deve ser interrompida a perfusão imediatamente.
Se a hipopotasemia se desenvolver quando a solução for utilizada como dializado, pode ser necessário administrar um dializado sem potássio para aumentar a eliminação do potássio.
A concentração de fosfatos inorgânicos deve ser medida regularmente. No caso de que os níveis de fosfato inorgânico no sangue sejam baixos, deve ser restabelecido. Pode ser adicionado à solução uma concentração de fosfatos de até 1,2 mmol/l. Se for adicionado fosfato potássico, a concentração total de potássio não deve superar os 4 mEq/l (4 mmol/l).
Embora não tenham sido notificados casos de reação de hipersensibilidade graves ao milho com Prismasol, as soluções que contêm glicose procedente de amido de milho hidrolisado não devem ser utilizadas em pacientes com alergia conhecida ao milho ou a produtos derivados do milho.
Se se desenvolverem sinais ou sintomas de uma suspeita de reação de hipersensibilidade, a administração deve ser interrompida imediatamente. Devem ser instituídas as medidas terapêuticas compensatórias apropriadas que estejam clinicamente indicadas.
Devido ao conteúdo de glicose e lactato da solução, pode dar origem a hiperglicemia, especialmente em pacientes diabéticos. Os níveis de glicose no sangue devem ser monitorizados regularmente. Em caso de desenvolver hiperglicemia, pode ser necessário administrar uma solução de substituição ou dializado livre de dextrosa. Para manter o controle glicêmico desejado, podem ser necessárias outras medidas corretivas.
Prismasol contém hidrogenocarbonato de sódio (bicarbonato) e lactato (precursor do bicarbonato) que pode influir no equilíbrio ácido-base. Se a alcalose metabólica se desenvolver ou piorar durante o tratamento com a solução, pode ser necessário reduzir a velocidade de administração ou interromper a administração.
Antes e durante o tratamento, deve ser feito um acompanhamento estreito do equilíbrio electrolítico e de ácido-base durante todo o procedimento.
Em caso de desequilíbrio de líquidos, a situação clínica deve ser controlada cuidadosamente e o equilíbrio de líquidos deve ser corrigido conforme necessário.
Método de administração
Via intravenosa e para hemodiálise. Prismasol, quando utilizado como solução de substituição, é administrado dentro do circuito antes do hemofiltro (pré-diluição) ou após o hemofiltro (pós-diluição)
Posologia
O volume e a velocidade de uso de Prismasol dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-base e do estado clínico geral do paciente. A pauta de administração (dose, velocidade de perfusão e volume acumulativo) de Prismasol deve ser estabelecida por um médico.
As velocidades de fluxo utilizadas para a solução de substituição em hemofiltrção e hemodiafiltrção são:
Adultos: 500 – 3000 ml/hora
As velocidades de fluxo utilizadas para a solução de diálise (dializado) em hemodiálise contínua e hemodiafiltrção contínua são:
Adultos: 500 - 2500 ml/hora
Normalmente, as velocidades de fluxo utilizadas em adultos são de aproximadamente 2000 a 2500 ml/h, o que corresponde a um volume de líquido diário de entre 48 e 60 litros, aproximadamente.
População pediátrica
Os intervalos de velocidades de fluxo da solução de substituição em hemofiltrção e hemodiafiltrção e da solução de diálise (dializado) em hemodiálise contínua são:
Crianças (de neonatos a adolescentes de até 18 anos de idade): de 1000 a 2000 ml/h/1,73 m2.
Podem ser necessárias velocidades de fluxo de até 4000 ml/h/1,73 m2, especialmente em crianças pequenas (≤10 kg). A velocidade de fluxo absoluta (em ml/h) da população pediátrica não deve superar, em geral, a velocidade de fluxo máxima dos adultos.
Instruções de manipulação
A solução de eletrólitos (compartimento pequeno A) é adicionada à solução tampão (compartimento grande B) após romper o vástago rompível justo antes de usar para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve ser seguida uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Usar apenas se a sobrebolsa estiver intacta, todos os selos estiverem intactos, o vástago rompível não estiver quebrado e a solução for transparente. Aperte a bolsa com firmeza para garantir que não haja vazamentos. Se forem observados vazamentos, descartar imediatamente a solução, pois a esterilidade não pode ser garantida.
O compartimento grande (B) está equipado com um puerto de injeção para adicionar outros fármacos que sejam necessários uma vez reconstituída a solução. É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado a Prismasol, verificando o eventual cambio de cor e/ou precipitação eventual, complexos insolúveis ou cristais. Antes de adicionar um medicamento, verificar se é solúvel e estável em água no pH de Prismasol (o pH da solução reconstituída está compreendido entre 7,0 e 8,5). Os aditivos podem não ser compatíveis. Devem ser consultadas as Instruções de uso do medicamento adicionado.
Eliminar qualquer líquido do puerto de injeção, colocar a bolsa em posição invertida, adicionar o medicamento através do puerto de injeção e misturar perfeitamente. A solução deve ser administrada imediatamente.A introdução e o mistura dos aditivos sempre devem ser realizados antes de conectar a bolsa da solução ao circuito extracorpóreo.
IRetirar a sobrebolsa da bolsa imediatamente antes de usar e descartar qualquer outro material de envasado. Abrir o precinto rompendo o vástago rompível situado entre os dois compartimentos da bolsa. O vástago ficará dentro da bolsa. (Ver figura I abaixo).
IIGarantir que todo o líquido do compartimento pequeno A seja transferido para o compartimento grande B. (Ver figura II abaixo).
IIIClarificar duas vezeso compartimento pequeno A forçando a solução misturada a voltar a este compartimento e, em seguida, novamente ao compartimento grande B (Ver figura III abaixo).
IVUma vez esvaziado o compartimento pequeno A, agitar o compartimento grande B para que se misture completamente o seu conteúdo. A solução já está preparada para usar e pode ser pendurada no equipamento. (Ver figura IV abaixo).
VA linha de diálise ou de substituição pode ser conectada a qualquer um dos dois puertos de acesso.
V.aSe for utilizado o conector luer, retire a tampa mediante um movimento de giro e extração e conecte o conector luer macho da linha de diálise ou substituição no receptor luer fêmea da bolsa mediante um movimento de pressão e giro. Garanta que a conexão esteja bem feita e apertada. A conexão se abrirá. Verifique que o líquido circula livremente. (Ver figura Va abaixo).
Se a linha de diálise ou substituição for desconectada do conector luer, o conector se fechará e o fluxo da solução se interromperá. O puerto luer é um puerto sem agulha que pode ser limpo.
V.bSe for utilizado o acesso de injeção, retire primeiro a cápsula. O puerto de injeção é um puerto que pode ser desinfetado com torunda. Introduza o espigão através da parede de borracha. Verifique que a solução circula livremente. (Ver figura Vb abaixo).
A solução deve ser usada imediatamente após retirar a sobrebolsa. Se não for feito assim, a solução reconstituída deve ser usada em um prazo de 24 horas, incluindo a duração do tratamento após a adição da solução de eletrólitos à solução tampão.
A solução reconstituída é para uso único. Descartar imediatamente qualquer resto de solução não utilizada.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.
Em caso de ocorrência de hipopotasemia ou hipercaliemia.
Se ocorrer hipopotasemia, pode ser necessária a adição de potássio e/ou a administração de um dializado com uma maior concentração de potássio.
Se ocorrer hipercaliemia uma vez iniciado o tratamento, deverá ser avaliada a adição de fontes de potássio que afetem as concentrações. Quando a solução for utilizada como solução de substituição, deve-se diminuir a velocidade de perfusão e confirmar que se alcançou a concentração de potássio desejada. Se não se resolver a hipercaliemia, interromper a perfusão imediatamente.
Se a hipercaliemia se desenvolver quando a solução for utilizada como dializado, pode ser necessário administrar um dializado sem potássio para aumentar a eliminação do potássio.
A concentração de fosfatos inorgânicos deve ser medida com regularidade. No caso de os níveis de fosfato inorgânico no sangue serem baixos, este deve ser restabelecido. Pode ser adicionada à solução uma concentração de fosfatos de até 1,2 mmol/l. Se for adicionado fosfato potássico, a concentração total de potássio não deve ultrapassar 4 mEq/l (4 mmol/l).
Embora não tenham sido notificados casos de reação de hipersensibilidade grave ao milho com Prismasol, as soluções que contêm glicose procedente de amido de milho hidrolisado não devem ser utilizadas em pacientes com alergia conhecida ao milho ou a produtos derivados do milho.
Se desenvolverem sinais ou sintomas de suspeita de reação de hipersensibilidade, a administração deve ser interrompida imediatamente. Devem ser instituídas as medidas terapêuticas compensatórias apropriadas que estejam clinicamente indicadas.
Devido ao conteúdo de glicose e lactato da solução, pode dar origem a hiperglicemia, especialmente em pacientes diabéticos. Os níveis de glicose no sangue devem ser monitorizados regularmente. Em caso de desenvolvimento de hiperglicemia, pode ser necessário administrar uma solução de substituição ou dializado livre de dextrose. Para manter o controle glicêmico desejado, podem ser necessárias outras medidas corretivas.
Prismasol contém hidrogenocarbonato de sódio (bicarbonato) e lactato (precursor do bicarbonato) que pode influir no equilíbrio ácido-básico. Se a alcalose metabólica se desenvolver ou piorar durante o tratamento com a solução, pode ser necessário reduzir a velocidade de administração ou interromper a administração.
Antes e durante o tratamento, deve ser feito um acompanhamento estreito do equilíbrio eletrolítico e ácido-básico durante todo o procedimento.
Em caso de desequilíbrio de líquidos, a situação clínica deve ser controlada cuidadosamente e o equilíbrio de líquidos deve ser corrigido conforme necessário.
Método de administração
Via intravenosa e para hemodiálise. Prismasol, quando utilizado como solução de substituição, é administrado dentro do circuito antes do hemofiltro (pré-diluição) ou após o hemofiltro (pós-diluição)
Posologia
O volume e a velocidade de uso de Prismasol dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-básico e do estado clínico geral do paciente. A posologia (dose, velocidade de perfusão e volume acumulativo) de Prismasol deve ser estabelecida por um médico.
As velocidades de fluxo utilizadas para a solução de substituição em hemofiltrção e hemodiafiltração são:
Adultos: 500 - 3000 ml/h
As velocidades de fluxo utilizadas para a solução de diálise (dializado) em hemodiálise contínua e hemodiafiltração contínua são:
Adultos: 500 - 2500 ml/h
Normalmente, as taxas de fluxo utilizadas em adultos são de aproximadamente 2000 a 2500 ml/h, o que corresponde a um volume de líquido diário de entre 48 e 60 litros, aproximadamente.
População pediátrica
Os intervalos de taxas de fluxo da solução de substituição em hemofiltrção e hemodiafiltração e da solução de diálise (dializado) em hemodiálise contínua são:
Crianças (de neonatos a adolescentes de até 18 anos de idade): de 1000 a 2000 ml/h/1,73 m².
Podem ser necessárias velocidades de fluxo de até 4000 ml/h/1,73 m², especialmente em crianças pequenas (≤10 kg). A velocidade de fluxo absoluta (em ml/h) da população pediátrica não deve ultrapassar, em geral, a velocidade de fluxo máxima dos adultos.
Instruções de manipulação
A solução de eletrólitos (compartimento pequeno A) é adicionada à solução tampão (compartimento grande B) após a quebra da parede selada, logo antes de usar, para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve ser seguida uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Usar apenas se a sobrebolsa estiver intacta, todos os selos estiverem intactos, a parede selada não estiver quebrada e a solução for transparente. Aperte a bolsa com firmeza para garantir que não haja vazamentos. Se forem observados vazamentos, descartar imediatamente a solução, pois a esterilidade não pode ser garantida.
O compartimento grande (B) está equipado com um porto de injeção para adicionar outros fármacos que sejam necessários uma vez reconstituída a solução. É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado ao Prismasol, verificando a alteração eventual de cor e/ou precipitação eventual, complexos insolúveis ou cristais. Antes de adicionar um medicamento, verificar se é solúvel e estável em água no pH do Prismasol (o pH da solução reconstituída está compreendido entre 7,0 e 8,5). Os aditivos podem não ser compatíveis. Devem ser consultadas as Instruções de uso do medicamento adicionado.
Eliminar qualquer líquido do porto de injeção, colocar a bolsa em posição invertida, adicionar o medicamento através do porto de injeção e misturar perfeitamente. A solução deve ser administrada imediatamente. A introdução e a mistura dos aditivos sempre devem ser realizadas antes de conectar a bolsa da solução ao circuito extracorpóreo.
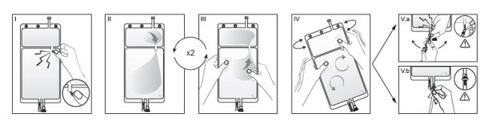
IRetirar a sobrebolsa da bolsa imediatamente antes de usar e descartar qualquer outro material de embalagem. Abrir o lacre quebrando a parede selada situada entre os dois compartimentos da bolsa. A parede selada permanecerá dentro da bolsa. (Ver figura I abaixo).
IIGarantir que todo o líquido do compartimento pequeno A seja transferido para o compartimento grande B. (Ver figura II abaixo).
IIIClarificar duas vezeso compartimento pequeno A forçando a solução misturada a voltar a este compartimento e, em seguida, novamente ao compartimento grande B (Ver figura III abaixo).
IVUma vez esvaziado o compartimento pequeno A, agitar o compartimento grande B para que se misture completamente o seu conteúdo. A solução já está pronta para uso e pode ser pendurada no equipamento. (Ver figura IV abaixo).
VA linha de diálise ou substituição pode ser conectada a qualquer um dos dois portos de acesso.
V.aSe for utilizado o acesso luer, retire o tampão e conecte o conector luer lock macho na linha de diálise ou substituição ao receptor luer fêmea da bolsa: faça-o firmemente. Usando o polegar e os outros dedos, quebre a parede azul quebrável pela base e mova-a para frente e para trás. Não use ferramentas. Verificar se a parede está completamente separada e se a solução circula livremente. A parede permanecerá no acesso luer durante o tratamento. (Ver figura Va abaixo).
V.bSe for utilizado o acesso de injeção, retire primeiro a cápsula. O porto de injeção é um porto que pode ser desinfetado com torunda. Introduza o espigão através da parede de borracha. Verificar se a solução circula livremente. (Ver figura Vb abaixo).
A solução deve ser usada imediatamente após a retirada da sobrebolsa. Se não for feito assim, a solução reconstituída deve ser usada dentro de um prazo de 24 horas, incluindo a duração do tratamento após a adição da solução de eletrólitos à solução tampão.
A solução reconstituída é para uso único. Descartar imediatamente qualquer resto de solução não utilizada.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
(FORMATO POLIOLEFINA COM VÁLVULA)
O que contém PRISMASOL
Os princípios ativos são:
Antes da reconstituição:
1000 ml de Solução de eletrólitos (Compartimento A pequeno) contém:
Cloreto de cálcio di-hidratado 5,145 g
Cloreto de magnésio hexa-hidratado 2,033 g
Glicose 22,000 g
Ácido (S)-Láctico 5,400 g
1000 ml. de solução tampão (Compartimento B grande) contém:
Cloreto de sódio 6,450 g
Hidrogenocarbonato de sódio 3,090 g
Cloreto de potássio 0,157 g
Depois da reconstituição:
A solução do compartimento A (250 ml) e do compartimento B (4750 ml) são misturadas para originar uma solução reconstituída (5000 ml) cuja composição é a seguinte:
mmol/l | mEq/l | |
Cálcio Ca2+ | 1,75 | 3,50 |
Magnésio Mg2+ | 0,50 | 1,00 |
Sódio Na+ | 140,00 | 140,00 |
Cloruro Cl- | 111,50 | 111,50 |
Lactato | 3,00 | 3,00 |
Hidrogenocarbonato HCO3- | 32,00 | 32,00 |
Potássio K+ | 2,00 | 2,00 |
Glicose | 6,10 | |
Osmolaridade teórica: | 297 mOsm/l |
Os demais componentes são:dióxido de carbono (E-290), água para preparações injetáveis.
pH da solução reconstituída: 7,0 – 8,5
Aspecto do produtoe conteúdo do envase
Prismasol é apresentado em uma bolsa bicompartimental, contendo o compartimento pequeno A a solução de eletrólitos e o compartimento grande B a solução tampão. A solução final reconstituída é obtida após a quebra da parede selada e a mistura de ambas as soluções. A solução reconstituída é transparente e ligeiramente amarela. Cada bolsa (A+B) contém 5000 ml de solução para hemodiálise e hemofiltrção. A bolsa está recoberta por uma sobrebolsa transparente.
Cada caixa contém duas bolsas e um prospecto.
Titular da autorização de comercialização:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.
Via Stelvio 94
23035 Sondalo (SO)
Itália
Ó
Vantive Manufacturing Limited Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado nos estados membros do Espaço Econômico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Bulgária, Chipre, República Checa, Dinamarca, Eslováquia, Eslovênia, Estônia, Espanha, Finlândia, França, Grécia, Holanda, Hungria, Islândia, Irlanda, Itália, Letônia, Lituânia, Luxemburgo, Malta, Noruega, Polônia, Portugal, Romênia, Suécia, Reino Unido (Irlanda do Norte): Prismasol 2
Podem ser solicitadas mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Vantive Health, S.L.
Polígono industrial setor 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valência
Espanha
Data da última revisão deste prospecto: 03/2018
A informação detalhada e atualizada deste medicamento está disponível na página web da Agência Espanhola de medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.es
-----------------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário
Prismasol 2 mmol/lPotássio solução para hemodiálise e hemofiltrção
Precauções
Devem ser seguidas com exatidão as instruções de uso e manipulação de Prismasol.
As soluções dos dois compartimentos devem ser misturadas antes de usadas.
O uso de soluções de hemofiltrção e hemodiálise contaminadas pode causar sepsis, choque e condições que podem causar a morte.
Prismasol pode ser aquecido a 37 ºC para melhorar o bem-estar do paciente. O aquecimento da solução antes de seu uso deve ser realizado antes de sua reconstituição apenas com calor seco. As soluções não devem ser aquecidas em água nem no micro-ondas. A solução deve ser inspecionada visualmente antes da administração para detectar a presença de partículas e um possível cambio de cor, quando a solução e o envase o permitam. Não administrar se a solução não for transparente ou se o lacre não estiver intacto.
Prismasol é uma solução que contém potássio. Antes e durante a hemofiltrção e/ou a hemodiálise, deve ser feito um acompanhamento da concentração sanguínea de potássio. Em função da concentração de potássio no sangue antes do tratamento, pode desenvolver-se hipopotasemia ou hipercaliemia.
Se ocorrer hipopotasemia, pode ser necessária a adição de potássio e/ou a administração de um dializado com uma maior concentração de potássio.
Se ocorrer hipercaliemia uma vez iniciado o tratamento, deverá ser avaliada a adição de fontes de potássio que afetem as concentrações de potássio. Quando a solução for utilizada como solução de substituição, deve-se diminuir a velocidade de perfusão e confirmar que se alcançou a concentração de potássio desejada. Se não se resolver a hipercaliemia, interromper a perfusão imediatamente.
Se a hipercaliemia se desenvolver quando a solução for utilizada como dializado, pode ser necessário administrar um dializado sem potássio para aumentar a eliminação do potássio.
A concentração de fosfatos inorgânicos deve ser medida com regularidade. No caso de os níveis de fosfato inorgânico no sangue serem baixos, este deve ser restabelecido. Pode ser adicionada à solução uma concentração de fosfatos de até 1,2 mmol/l. Se for adicionado fosfato potássico, a concentração total de potássio não deve ultrapassar 4 mEq/l (4 mmol/l).
Embora não tenham sido notificados casos de reação de hipersensibilidade grave ao milho com Prismasol, as soluções que contêm glicose procedente de amido de milho hidrolisado não devem ser utilizadas em pacientes com alergia conhecida ao milho ou a produtos derivados do milho.
Se desenvolverem sinais ou sintomas de suspeita de reação de hipersensibilidade, a administração deve ser interrompida imediatamente. Devem ser instituídas as medidas terapêuticas compensatórias apropriadas que estejam clinicamente indicadas.
Devido ao conteúdo de glicose e lactato da solução, pode dar origem a hiperglicemia, especialmente em pacientes diabéticos. Os níveis de glicose no sangue devem ser monitorizados regularmente. Em caso de desenvolvimento de hiperglicemia, pode ser necessário administrar uma solução de substituição ou dializado livre de dextrose. Para manter o controle glicêmico desejado, podem ser necessárias outras medidas corretivas.
Prismasol contém hidrogenocarbonato de sódio (bicarbonato) e lactato (precursor do bicarbonato) que pode influir no equilíbrio ácido-básico. Se a alcalose metabólica se desenvolver ou piorar durante o tratamento com a solução, pode ser necessário reduzir a velocidade de administração ou interromper a administração.
Antes e durante o tratamento, deve ser feito um acompanhamento estreito do equilíbrio eletrolítico e ácido-básico durante todo o procedimento.
Em caso de desequilíbrio de líquidos, a situação clínica deve ser controlada cuidadosamente e o equilíbrio de líquidos deve ser corrigido conforme necessário.
Método de administração
Via intravenosa e para hemodiálise. Prismasol, quando utilizado como solução de substituição, é administrado dentro do circuito antes do hemofiltro (pré-diluição) ou após o hemofiltro (pós-diluição)
Posologia
O volume e a velocidade de uso de Prismasol dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-básico e do estado clínico geral do paciente. A posologia (dose, velocidade de perfusão e volume acumulativo) de Prismasol deve ser estabelecida por um médico.
As velocidades de fluxo utilizadas para a solução de substituição em hemofiltrção e hemodiafiltração são:
Adultos: 500 - 3000 ml/h
As velocidades de fluxo utilizadas para a solução de diálise (dializado) em hemodiálise contínua e hemodiafiltração contínua são:
Adultos: 500 - 2500 ml/h
Normalmente, as taxas de fluxo utilizadas em adultos são de aproximadamente 2000 a 2500 ml/h, o que corresponde a um volume de líquido diário de entre 48 e 60 litros, aproximadamente.
População pediátrica
Os intervalos de taxas de fluxo da solução de substituição em hemofiltrção e hemodiafiltração e da solução de diálise (dializado) em hemodiálise contínua são:
Crianças (de neonatos a adolescentes de até 18 anos de idade): de 1000 a 2000 ml/h/1,73 m².
Podem ser necessárias velocidades de fluxo de até 4000 ml/h/1,73 m², especialmente em crianças pequenas (≤10 kg). A velocidade de fluxo absoluta (em ml/h) da população pediátrica não deve ultrapassar, em geral, a velocidade de fluxo máxima dos adultos.
Instruções de manipulação
A solução de eletrólitos (compartimento pequeno A) é adicionada à solução tampão (compartimento grande B) após a quebra da parede selada, logo antes de usar, para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve ser seguida uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Usar apenas se a sobrebolsa estiver intacta, todos os selos estiverem intactos, a parede selada não estiver quebrada e a solução for transparente. Aperte a bolsa com firmeza para garantir que não haja vazamentos. Se forem observados vazamentos, descartar imediatamente a solução, pois a esterilidade não pode ser garantida.
O compartimento grande (B) está equipado com um porto de injeção para adicionar outros fármacos que sejam necessários uma vez reconstituída a solução. É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado ao Prismasol, verificando a alteração eventual de cor e/ou precipitação eventual, complexos insolúveis ou cristais. Antes de adicionar um medicamento, verificar se é solúvel e estável em água no pH do Prismasol (o pH da solução reconstituída está compreendido entre 7,0 e 8,5). Os aditivos podem não ser compatíveis. Devem ser consultadas as Instruções de uso do medicamento adicionado.
Eliminar qualquer líquido do porto de injeção, colocar a bolsa em posição invertida, adicionar o medicamento através do porto de injeção e misturar perfeitamente. A solução deve ser administrada imediatamente. A introdução e a mistura dos aditivos sempre devem ser realizadas antes de conectar a bolsa da solução ao circuito extracorpóreo.
Portanto, verificar se é solúvel e estável em água no pH de Prismasol (o pH da solução reconstituída está compreendido entre 7,0 e 8,5). Os aditivos poderiam não ser compatíveis. Devem ser consultadas as Instruções de uso do medicamento adicionado.
Eliminar qualquer líquido do porto de injeção, colocar a bolsa em posição invertida, adicionar o medicamento através do porto de injeção e misturar perfeitamente. A solução deve ser administrada imediatamente. A introdução e a mistura dos aditivos sempre devem ser realizadas antes de conectar a bolsa da solução ao circuito extracorpóreo.
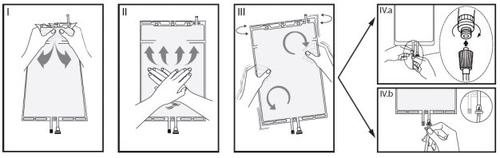
IRetirar a sobrebolsa da bolsa imediatamente antes de usar e misturar as soluções dos dois compartimentos diferentes. Segure o compartimento pequeno com ambas as mãos e aperte até que abra a parede selada desprendível entre os dois compartimentos. (Ver figura I abaixo).
IIPressione o compartimento grande com ambas as mãos até que a parede selada entre os dois compartimentos esteja completamente aberta. (Ver figura II abaixo).
IIICertifique-se de que as soluções estejam completamente misturadas, agitando a bolsa suavemente. A solução está agora pronta para uso e a bolsa pode ser pendurada no equipamento. (Ver figura III abaixo).
IVA linha de diálise ou de substituição pode ser conectada a qualquer um dos dois portos de acesso.
IV.aSe for utilizado o conector luer, retire a tampa mediante um movimento de giro e extração e conecte o conector luer macho da linha de diálise ou substituição no receptor luer fêmea da bolsa mediante um movimento de pressão e giro. Certifique-se de que a conexão está bem feita e apertada. A conexão se abrirá. Verifique que o líquido circula livremente. (Ver figura IVa abaixo).
Se a linha de diálise ou substituição for desconectada do conector luer, o conector se fechará e o fluxo da solução se deterá. O porto luer é um porto sem agulha que pode ser limpo.
IV.bSe for utilizado o acesso de injeção, retire primeiro a cápsula. O porto de injeção é um porto que pode ser desinfetado com torunda. Introduza o espigão através da parede de borracha. Verifique que a solução circula livremente. (Ver figura IVb abaixo).
A solução deveria ser usada imediatamente após retirar a sobrebolsa. Se não for feito assim, a solução reconstituída deveria ser usada em um prazo de 24 horas, incluindo a duração do tratamento após a adição da solução de eletrólitos à solução tampão.
A solução reconstituída é para uso único. Descartar imediatamente qualquer resto de solução não utilizada.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃOFabricante: Nikkiso BelgiumRequer receita médicaFabricante: Nikkiso BelgiumRequer receita médicaFabricante: Nikkiso BelgiumRequer receita médica
Alternativas a PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO em Polónia
Alternativa a PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO em Ukraine
Médicos online para PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de PRISMASOL 2 mmol/l POTÁSSIO, SOLUÇÃO PARA HEMODIÁLISE E HEMOFILTRAÇÃO – sujeita a avaliação médica e regras locais.














