
NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
- PROSPECTO
Prospecto: informação para o utilizador
Nuwiq 250 UI pó e dissolvente para solução injectável
Nuwiq 500 UI pó e dissolvente para solução injectável
Nuwiq 1000 UI pó e dissolvente para solução injectável
Nuwiq 1500UI pó e dissolvente para solução injectável
Nuwiq 2000 UI pó e dissolvente para solução injectável
Nuwiq 2500 UI pó e dissolvente para solução injectável
Nuwiq 3000 UI pó e dissolvente para solução injectável
Nuwiq 4000 UI pó e dissolvente para solução injectável
simoctocog alfa (factor VIII de coagulação humano recombinante)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Nuwiq e para que é utilizado
- O que necessita de saber antes de começar a usar Nuwiq
- Como usar Nuwiq
- Posíveis efeitos secundários
- Conservação de Nuwiq
- Conteúdo do envase e informações adicionais
1. O que é Nuwiq e para que é utilizado
Nuwiq contém o princípio ativo factor VIII de coagulação humano recombinante (simoctocog alfa). O factor VIII é necessário para que o sangue forme coágulos e detenha a hemorragia. Em doentes com hemofilia A (deficiência congénita do factor VIII), o factor VIII falta ou não actua correctamente.
Nuwiq substitui o factor VIII que falta e é utilizado para o tratamento e a prevenção de hemorragias em doentes com hemofilia A e pode ser usado em todos os grupos etários.
2. O que necessita de saber antes de começar a usar Nuwiq
Não use Nuwiq:
- se é alérgico ao princípio ativo simoctocog alfa ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Se não tiver a certeza, pergunte ao seu médico.
Advertências e precauções
Consulte o seu médico antes de começar a usar Nuwiq.
Existe uma rara possibilidade de que experimente uma reação anafiláctica (uma súbita reação alérgica grave) a Nuwiq. Deve ser capaz de reconhecer os sintomas precoces das reações alérgicas, que se incluem na secção 4 "Reações alérgicas".
Se se produzir algum destes sintomas, detenha a injeção de imediato e contacte o seu médico.
A formação de inibidores (anticorpos) é uma complicação conhecida que se pode produzir durante o tratamento com todos os medicamentos compostos por factor VIII. Estes inibidores, em especial em grandes quantidades, impedem que o tratamento funcione de forma correcta, por isso si e o seu filho serão cuidadosamente controlados para verificar se desenvolvem ditos inibidores. Se a hemorragia ou a do seu filho não for controlada com Nuwiq, consulte o seu médico de imediato.
Eventos cardiovasculares
Em doentes com presença de factores de risco cardiovascular, o tratamento restitutivo com FVIII pode aumentar o risco cardiovascular.
Complicações associadas a cateteres
Se necessitar de um dispositivo de acesso venoso central (CVAD), há que ter em conta o risco de complicações associadas ao CVAD, incluindo infecções localizadas, presença de bactérias no sangue e trombose no local de implantação do cateter.
É importante manter um registo do número do lote de Nuwiq. Por conseguinte, cada vez que receber um novo envase de Nuwiq, anote a data e o número do lote (indicado no envase após Lote) e conserve esta informação num local seguro.
Outros medicamentos e Nuwiq
Informa o seu médico se está a usar, usou recentemente ou possa ter que usar qualquer outro medicamento.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de usar este medicamento.
Condução e uso de máquinas
Nuwiq não influencia a capacidade para conduzir e utilizar máquinas.
Nuwiq contém sódio
Este medicamento contém 18,4 mg de sódio (componente principal do sal de mesa/cozinha) em cada frasco. Isto equivale a 0,92 % da ingestão diária máxima de sódio recomendada para um adulto.
3. Como usar Nuwiq
O tratamento com Nuwiq será iniciado por um médico com experiência no cuidado de doentes com hemofilia A. Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico ou enfermeiro. Em caso de dúvida, consulte novamente o seu médico ou enfermeiro.
Nuwiq é injectado normalmente numa veia (intravenosamente) pelo seu médico ou um enfermeiro com experiência no cuidado de doentes com hemofilia A. Si ou outra pessoa também podem injectar-lhe Nuwiq, mas apenas após terem recebido a formação adequada.
O seu médico calculará a sua dose de Nuwiq (em Unidades Internacionais = UI) dependendo do seu estado e peso corporal e de se está a ser utilizado como prevenção ou como tratamento das hemorragias. A frequência com que necessitará de uma injeção dependerá de como Nuwiq actua em si. Normalmente, o tratamento da hemofilia A é um tratamento de por vida.
Prevenção das hemorragias
A dose habitual de Nuwiq é de 20 a 40 UI por kg de peso corporal, administradas cada 2 a 3 dias. No entanto, em alguns casos, especialmente nos doentes mais jovens, podem ser necessárias injeções mais frequentes ou doses mais altas.
Tratamento das hemorragias
A dose de Nuwiq é calculada dependendo do seu peso corporal e dos níveis de factor VIII que se devem alcançar. Os níveis objectivos de factor VIII dependerão da gravidade e localização das hemorragias.
Se tiver a impressão de que o efeito de Nuwiq é insuficiente, consulte o seu médico. O seu médico fará os análises de laboratório pertinentes para se certificar de que tem os níveis adequados de factor VIII. Isto é de especial importância se lhe forem realizar uma cirurgia maior.
Doentes que desenvolvem inibidores do factor VIII
Se o seu factor VIII plasmático não consegue alcançar os níveis esperados com Nuwiq, ou se não se conseguem controlar as hemorragias adequadamente, pode ser devido ao desenvolvimento de inibidores do factor VIII. O seu médico o verificará. Pode ser necessário uma dose mais alta de Nuwiq ou um produto diferente para controlar as hemorragias. Não aumente a dose total de Nuwiq para controlar as suas hemorragias sem consultar o seu médico.
Uso em crianças e adolescentes
A forma como se utiliza Nuwiq em crianças e adolescentes não difere da forma como se utiliza em adultos. Uma vez que pode ser necessário administrar os medicamentos de factor VIII com mais frequência em crianças e adolescentes, pode ser necessário acoplar um dispositivo de acesso venoso central (CVAD). Um CVAD é um conector externo que permite o acesso ao fluxo sanguíneo mediante um cateter sem injeção através da pele
Se usar mais Nuwiq do que deve
Não foi notificado qualquer sintoma de sobredose. Se injectou mais Nuwiq do que devia, informe o seu médico.
Se esquecer de usar Nuwiq
Não tome uma dose dupla para compensar as doses esquecidas. Prossiga a administrar a próxima dose imediatamente e siga as recomendações do seu médico.
Se interromper o tratamento com Nuwiq
Não interrompa o tratamento com Nuwiq sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Deixe de usar este medicamento imediatamente e solicite atenção médica urgente se:
- nota sintomas de reações alérgicas
As reações alérgicas podem incluir erupção cutânea, habões, urticária (erupção pruriginosa), incluindo urticária generalizada, inchaço dos lábios e da língua, dificuldade para respirar, “pitos” ao respirar (sibilancias), opressão torácica, vómitos, inquietude, hipotensão arterial e mareio. Estes sintomas podem ser sintomas precoces de um choque anafiláctico. Se se produzirem reações alérgicas intensas súbitas (anafilácticas) (muito raras: podem afectar até 1 de cada 10.000 pessoas), deve deter imediatamente a injeção e deve contactar o seu médico de imediato. Os sintomas intensos requerem tratamento de emergência urgente.
- nota que o medicamento deixa de actuar correctamente (as hemorragias não se detêm ou se tornam frequentes)
Nas crianças e adolescentes que não receberam tratamento prévio com medicamentos compostos por factor VIII, podem produzir-se anticorpos inibidores (ver secção 2) de forma muito frequente (mais de 1 de cada 10 doentes).
No entanto, nos doentes que receberam tratamento prévio com factor VIII (mais de 150 dias de tratamento), o risco é pouco frequente (menos de 1 de cada 100 doentes). Se isto acontecer, os medicamentos que toma si ou o seu filho podem deixar de funcionar correctamente e si ou o seu filho podem sofrer uma hemorragia persistente. Nesse caso, contacte o seu médico de imediato.
Efeitos adversos frequentes que podem afectar até 1 de cada 10pessoas
Hipersensibilidade, febre.
Efeitos adversos pouco frequentes que podem afectar até 1 de cada 100 doentes
Cosquilleo ou entorpecimento (parestesia), dor de cabeça, mareio, vertigem, dispneia, secura da boca, dor de costas, inflamação e/ou dor na zona da injeção, uma vaga sensação de mal-estar corporal (mal-estar geral), anemia hemorrágica, resultados positivos para a formação de anticorpos não neutralizantes (em doentes tratados previamente).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Nuwiq
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de caducidade que aparece na caixa e na etiqueta do frasco após EXP. A data de caducidade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 °C e 8 °C). Não congelar. Conservar o frasco no embalagem original para protegê-lo da luz.
Antes de Nuwiq pó ser reconstituído, pode ser conservado a temperatura ambiente (até 25 °C) durante um período único não superior a 1 mês. Anote a data em que começar a conservar Nuwiq a temperatura ambiente na caixa do medicamento. Não conserve novamente Nuwiq no frigorífico, após ter sido conservado a temperatura ambiente.
Utilize a solução reconstituída imediatamente após a reconstituição.
Advertências com respeito a certos sinais visíveis de deterioração
Não utilize este medicamento se observar indícios visíveis de deterioração do precinto do envase, especialmente da seringa e/ou do frasco.
Os medicamentos não devem ser deitados fora por os esgotos nem para o lixo. Pergunte ao seu farmacêutico como se deve livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Nuwiq
Pó:
- O princípio ativo é Fator VIII de coagulação humano recombinante (simoctocog alfa).
Cada frasco de pó contém 250, 500, 1000, 1500, 2000, 2500, 3000 ou 4000 UI de simoctocog alfa. Cada solução reconstituída contém aproximadamente 100, 200, 400, 600, 800, 1000, 1200 ou 1600 UI/mL de simoctocog alfa.
- Os outros componentes são sacarose, cloreto de sódio, cloreto de cálcio diidratado, cloridrato de arginina, citrato de sódio diidratado e poloxamer 188. Ver seção 2, "Nuwiq contém sódio".
Dissolvente:
Água para preparações injetáveis
Aspecto do produto e conteúdo do envase
Nuwiq é fornecido como pó e dissolvente para solução injetável. O pó é de cor branca ou esbranquiçada em um frasco de vidro. O dissolvente é água para preparações injetáveis em uma seringa de vidro pré-carregada.
Uma vez reconstituído, a solução é transparente, incolor e livre de partículas estranhas.
Cada envase de Nuwiq contém:
- 1 frasco de pó com 250, 500, 1000, 1500, 2000, 2500, 3000 ou 4000 UI de simoctocog alfa
- 1 seringa pré-carregada com 2,5 mL de água para injetáveis
- 1 adaptador de frasco
- 1 agulha de borboleta
- 2 compressas com álcool
Título da autorização de comercialização e responsável pela fabricação
Octapharma AB, Lars Forssells gata 23, 112 75 Estocolmo, Suécia
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Octapharma Benelux (Bélgica) Tel: +32 2 3730890 | Lituânia Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 |
?????? Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 | Luxemburgo Octapharma Benelux (Bélgica) Tel: +32 2 3730890 |
República Tcheca Octapharma CZ s.r.o. Tel: +420 266 793 510 | Hungria Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 |
Dinamarca Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 | Malta Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 |
Alemanha Octapharma GmbH Tel: +49 2173 9170 | Países Baixos Octapharma Benelux (Bélgica) Tel: +32 2 3730890 |
Estônia Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 | Noruega Octapharma AS Tel: +47 63988860 |
Grécia Octapharma Hellas SA Tel: +30 210 8986500 | Áustria Octapharma Handelsgesellschaft m.b.H. Tel: +43 1 610321222 |
Espanha Octapharma S.A. Tel: +34 91 6487298 | Polônia Octapharma Poland Sp. z o.o. Tel: +48 22 2082734 |
França Octapharma France Tel: +33 1 41318000 | Portugal Octapharma Produtos Farmacêuticos Lda. Tel: +351 21 8160820 |
Croácia Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 | Romênia Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 |
Irlanda Octapharma AB (Suécia) Tel: +46 8 56643000 | Eslovênia Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 |
Islândia Octapharma AS (Noruega) Tel: +47 63988860 | República Eslovaca Octapharma AG, o.z.z.o. Tel: +421 2 54646701 |
Itália Kedrion S.p.A. Tel: +39 0583 767507 | Finlândia Octapharma Nordic AB Tel: +358 9 85202710 |
Chipre Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 | Suécia Octapharma Nordic AB Tel: +46 8 56643000 |
Letônia Octapharma Nordic AB (Suécia) Tel: +46 8 56643000 | Reino Unido (Irlanda do Norte) Octapharma Limited Tel: +44 161 8373770 |
Data da última revisão deste prospecto:
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
---------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais de saúde:
Tratamento a demanda
A dose a administrar e a frequência de administração devem sempre estar orientadas à eficácia clínica em cada caso individual.
No caso dos episódios hemorrágicos seguintes, a atividade do fator VIII não deve ser inferior ao nível de atividade plasmática dada (em % do normal ou UI/dL) no período correspondente. A seguinte tabela pode ser usada como guia de dosagem em cirurgia e em episódios hemorrágicos.
Grau de hemorragia /tipo de procedimento cirúrgico | Nível de Fator VIII requerido (%) (UI/dL) | Frequência das doses (horas) / duração do tratamento (dias) |
Hemorragia | ||
Hemartrose incipiente, hemorragia muscular ou oral | 20–40 | Repetir a cada 12 a 24 horas. Pelo menos 1 dia até que o episódio hemorrágico, segundo indique a dor, se resolva ou se logre a cura. |
Hemartrose mais extensa, hemorragia muscular ou hematoma | 30-60 | Repetir a perfusão a cada 12 a 24 horas, entre 3 e 4 dias ou mais, até que cesse a dor e a discapacidade aguda. |
Hemorragia potencialmente mortal | 60-100 | Repetir a perfusão a cada 8 a 24 horas até que se supere o perigo |
Cirurgia | ||
Cirurgia menorIncluindo extração dental | 30-60 | A cada 24 horas, pelo menos 1 dia, até lograr a cura. |
Cirurgia maior | 80-100 (pré e pós-operatório) | Repetir a perfusão a cada 8-24 horas até que se consiga uma cicatrização adequada da ferida, e depois pelo menos durante outros 7 dias de tratamento para manter uma atividade de fator VIII de 30% a 60% (UI/dL). |
INSTRUÇÕES PARA A PREPARAÇÃO E ADMINISTRAÇÃO
- Deixe que a seringa de dissolvente (água para preparações injetáveis) e o pó atinjam a temperatura ambiente no frasco fechado. Pode fazer isso segurando-os com as mãos até que tenham a mesma temperatura que as mãos. Não aqueça de nenhuma outra forma o frasco e a seringa pré-carregada. Esta temperatura deve ser mantida durante a reconstituição.
- Retire a cápsula de fechamento de plástico do tipo flip-off do frasco de pó para deixar expostas as partes centrais do tampão de borracha. Não retire o tampão cinza nem a argola metálica que rodeia a parte superior do frasco.
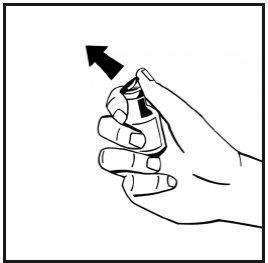
- Limpe a parte superior do frasco com uma compressa com álcool. Deixe que o álcool seque.
- Retire a cobertura de papel do envase do adaptador do frasco. Não retire o adaptador do seu envase.
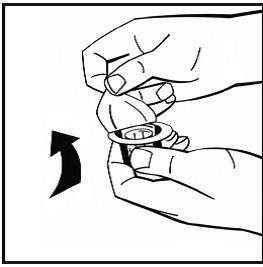
- Coloque o frasco de pó em uma superfície plana e segure-o. Pegue o envase do adaptador e coloque o adaptador do frasco sobre o centro do tampão de borracha do frasco de pó. Pressione o envase do adaptador firmemente para baixo até que a ponta do adaptador atravesse o tampão de borracha. O adaptador se acoplará ao frasco quando estiver feito.
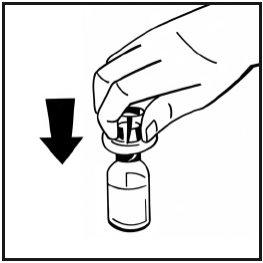
- Retire a cobertura de papel do envase da seringa pré-carregada. Segure a vara do êmbolo da seringa pelo extremo e não toque no eixo. Fixe o extremo com rosca da vara do êmbolo ao êmbolo da seringa de dissolvente. Gire a vara do êmbolo no sentido dos ponteiros do relógio até que note uma ligeira resistência.
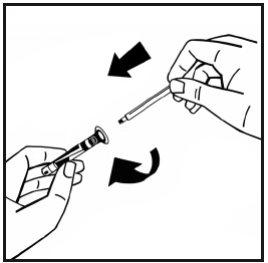
- Quebre o lacre da ponta de plástico de proteção da seringa de dissolvente partindo a perfuração da cápsula de fechamento. Não toque no interior da cápsula de fechamento nem na ponta da seringa. Em caso de não usar a solução imediatamente, feche a seringa cheia com a ponta de proteção de plástico para armazená-la.
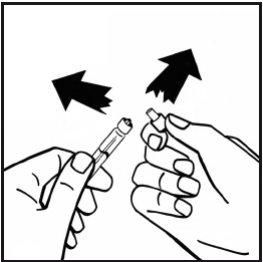
- Retire o embalagem do adaptador e descarte-o.
- Acople firmemente a seringa de dissolvente ao adaptador do frasco girando no sentido dos ponteiros do relógio até que note uma ligeira resistência.
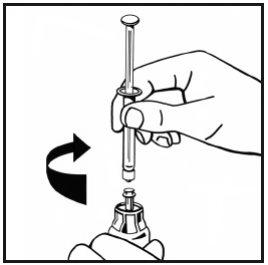
- Injete lentamente todo o dissolvente no frasco de pó pressionando a vara do êmbolo para baixo.
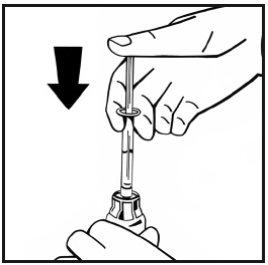
- Sem retirar a seringa, mova suavemente ou em círculos o frasco algumas vezes para dissolver o pó. Não agite. Espere até que todo o pó se dissolva completamente.
- Verifique se a solução final tem partículas antes de administrá-la. A solução deve ser transparente e incolor, praticamente livre de partículas visíveis. Não use soluções turvas ou com sedimentos.
- Dê a volta ao frasco acoplado à seringa, e lentamente extraia a solução para a seringa. Certifique-se de transferir todo o conteúdo do frasco para a seringa.
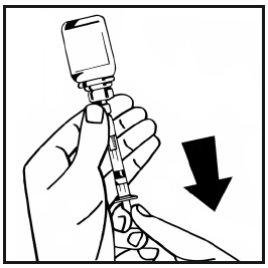
- Separe a seringa cheia do adaptador do frasco girando no sentido contrário ao dos ponteiros do relógio e descarte o frasco vazio.
- A solução estará preparada para uso imediato. Não refrigerar.
- Limpe a parte escolhida para a injeção com uma das compressas com álcool fornecidas.
- Acople o kit de injeção fornecido à seringa. Introduza a agulha do kit de injeção na veia escolhida. Se usou um torniquete para fazer a veia mais visível, deve estar afrouxado antes de começar a injetar a solução. Não deve entrar sangue na seringa devido ao risco de formação de coágulos de fibrina.
- Injete a solução na veia devagar, não mais rápido do que 4 mL por minuto.
Se usar mais de um frasco de pó para um tratamento, poderá usar a mesma agulha novamente. O adaptador do frasco e a seringa são de uso único.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1000 UI - após reconstituição em 2 ml de água para injetáveis, a dose é de 500 UI/mlSubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica
Alternativas a NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Poland
Alternativa a NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de NUWIQ 1500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.














