

MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO

Pergunte a um médico sobre a prescrição de MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO

Como usar MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO
Introdução
Prospecto: informação para o utilizador
multiBic 3 mmol/l de potássio solução para hemodiálise e hemofiltrção
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é multiBic 3 mmol/l de potássio e para que é utilizado
- O que precisa saber antes de começar a usar multiBic 3 mmol/l de potássio
- Como usar multiBic 3 mmol/l de potássio
- Possíveis efeitos adversos
- Conservação de multiBic 3 mmol/l de potássio
Conteúdo do envase e informação adicional
1. O que é multiBic 3 mmol/l de potássio e para que é utilizado
multiBic 3 mmol/l de potássio é uma solução de terapia renal substitutiva contínua para a eliminação de produtos de resíduos do organismo em pessoas com doença renal. É utilizado em pacientes com lesão renal e também para o tratamento de intoxicações. O tipo de solução que se administra depende da quantidade de potássio (um sal) no sangue. O seu médico controlará os seus níveis de potássio regularmente.
2. O que precisa saber antes de começar a usar multiBic 3 mmol/l de potássio
Não use multiBic 3 mmol/l de potássio se
- é alérgico aos princípios ativos ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
- tem hipopotassémia (os seus níveis de potássio são muito baixos)
- padece alcalose metabólica (quando tem demasiado bicarbonato no sangue)
- não pode alcançar um fluxo sanguíneo suficiente através do hemofiltro (filtro utilizado na filtragem do sangue).
- tem um alto risco de sangramento relacionado com os medicamentos necessários para prevenir a coagulação no hemofiltro.
Advertências e precauções
Consulte o seu médico antes de começar a usar multiBic 3 mmol/l de potássio
- Não use antes de misturar as duas soluções em uma bolsa de dupla câmara (dois compartimentos)
- Não deve ser utilizado se a temperatura da solução for inferior à temperatura ambiente
- Deve-se inspecionar cada 30 minutos as linhas de tubos usadas para administrar a solução pronta para uso.
Se se observar um precipitado (matéria sólida) dentro dessas linhas de tubos, as bolsas e as linhas de tubos devem ser substituídas imediatamente e o paciente deve ser monitorizado cuidadosamente.
- O seu médico controlará o seu estado de hidratação (quantidade de água no seu organismo), os níveis de potássio, sódio, outras sales, certos produtos de resíduos e os níveis de açúcar no sangue). O seu médico também pode aconselhá-lo sobre a sua dieta.
Crianças
Não foi estabelecido o uso de multiBic 3 mmol/l de potássio em crianças.
Uso de multiBic 3 mmol/l de potássio com outros medicamentos
Informa o seu médico se está utilizando, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
É possível que ocorram as seguintes interações:
- Efeitos tóxicos dos digitálicos (medicamentos para tratar doenças do coração)
- Substituições electrolíticas, nutrição parenteral (alimentação intravenosa) e outros tratamentos com perfusões. Ao usar esta terapia, deve-se ter em conta o seu efeito sobre a concentração de soro sanguíneo e o estado de líquidos.
- Esta terapia pode reduzir a concentração no sangue de medicamentos. Pode ser necessário um ajuste da dose.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento.
Não há dados ou estes são limitados relativos ao uso de multiBic 3 mmol/l de potássio em mulheres grávidas e em período de amamentação.
Este medicamento apenas deve ser usado durante a gravidez se o seu médico considerar necessário o tratamento.
Não se recomenda a amamentação durante o tratamento com multiBic 3 mmol/l de potássio.
3. Como usar multiBic 3 mmol/l de potássio
multiBic 3 mmol/l de potássio será administrado em um hospital ou em uma clínica. O seu médico sabe como usar este medicamento.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Possíveis efeitos adversos
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos de multiBic 3 mmol/l de potássio incluem:
- náuseas
- vómitos
- cãibras musculares
- mudanças na tensão sanguínea
Alguns efeitos adversos podem estar causados por ter demasiado líquido ou demasiado pouco líquido. Estes são:
- dificuldade para respirar
- inchaço dos tornozelos e pernas
- desidratação (por exemplo, tonturas, cãibras musculares, sensação de sede)
- distúrbios sanguíneos (por exemplo, concentrações anormais de sal no sangue)
Não se conhece a frequência exata desses eventos (não pode ser estimada a partir dos dados disponíveis).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de multiBic 3 mmol/l de potássio
Mantenha este medicamento fora da vista e do alcance das crianças.
Não conserve abaixo de 4 °C.
Condições de conservação após a mistura dos dois compartimentos:
A solução pronta para uso não deve ser conservada a uma temperatura superior a 30 ºC e deve ser utilizada em 48 horas.
Não utilize este medicamento após a data de validade que aparece no envase após CAD. A data de validade é o último dia do mês que se indica.
6. Conteúdo do envase e informação adicional
Composição de multiBic 3 mmol/l de potássio
- Os princípios ativos são cloreto de potássio, cloreto de sódio, bicarbonato de sódio, cloreto de cálcio, cloreto de magnésio hexahidrato e glicose monohidrato.
- Os outros componentes são água para preparações injetáveis, ácido clorídrico a 25%, dióxido de carbono e dihidrogenofosfato sódico dihidrato.
Aspecto do produto e conteúdo do envase
Está disponível em uma bolsa de dupla câmara (dois compartimentos que contêm diferentes soluções). A mistura das soluções dos dois compartimentos dá origem à solução pronta para uso.
Cada bolsa contém 5.000 ml de solução no total. A solução pronta para uso é transparente e incolor.
Cada bolsa está equipada com um conector HF, um conector Luer lock, um porto de injeção e está coberta por uma lâmina protetora.
Tamanho do envase:
2 bolsas de 5.000 ml
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização
Fresenius Medical Care Deutschland GmbH, Else-Kröner-Straße 1, 61352 Bad Homburg v.d.H., Alemanha
Responsável pela fabricação
Fresenius Medical Care Deutschland GmbH, Frankfurter Straße 6-8, 66606 St. Wendel, Alemanha
Representante local
Fresenius Medical Care España S.A.
C/ Ronda de Poniente, 8, planta baja, Parque Empresarial Euronova,
28760 Tres Cantos (Madrid)
Espanha
Data da última revisão deste prospecto: Março 2025
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
Informação destinada unicamente a profissionais do setor sanitário, ver ao final deste prospecto.
------------------------------------------------------------------------------------------------------------
A seguinte informação está destinada unicamente a profissionais do setor sanitário:
1.000 ml da solução pronta para uso contém:
Cloreto de potássio | 0,2237 g |
Cloreto de sódio | 6,136 g |
Bicarbonato sódico | 2,940 g |
Cloreto de cálcio dihidrato | 0,2205 g |
Cloreto de magnésio hexahidrato | 0,1017 g |
Glicose monohidrato | 1,100 g |
(Glicose) | (1,000 g) |
K+ | 3,0 mmol/l |
Na+ | 140 mmol/l |
Ca2+ | 1,5 mmol/l |
Mg2+ | 0,50 mmol/l |
Cl- | 112 mmol/l |
HCO3- | 35 mmol/l |
Glicose | 5,55 mmol/l |
pH ≈ 7,4
Osmolaridade teórica: 298 mOsm/l
Não use se a solução não for transparente e incolor e se a bolsa ou os conectores estiverem danificados.
Para um único uso. Qualquer resto de solução não utilizada deve ser descartado.
Utilize unicamente mediante uma bomba integrada no dispositivo de depuração extracorpórea do sangue.
Instruções de uso
A solução de hemodiálise e hemofiltrção deve ser administrada em três etapas:
- Eliminação da sobrebolsa e inspeção detalhada da bolsa
Deve-se remover a sobrebolsa apenas imediatamente antes da administração.
Os envases de plástico podem ser danificados de forma ocasional durante o transporte desde o local de fabricação até a clínica ou dentro da mesma clínica. Na solução, isso pode conduzir a uma contaminação e crescimento microbiológico ou de fungos. Por isso, é necessário realizar uma cuidadosa inspeção visual da bolsa e das soluções antes de usar. Deve-se prestar especial atenção mesmo a leves imperfeições do tapão, das soldaduras e bordos da bolsa.
- Mistura dos dois compartimentos
As duas soluções devem ser misturadas imediatamente antes do uso para obter a solução pronta para uso.
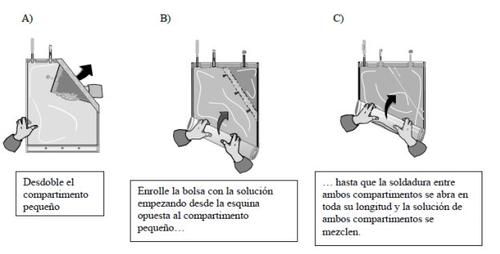
Depois de que ambos os compartimentos sejam misturados, deve-se verificar que a soldadura esteja totalmente aberta, que a solução seja transparente e incolor e que o envase não perca líquido.
- Administração da solução pronta para uso
A solução pronta para uso deve ser utilizada imediatamente, dentro das 48 horas seguintes à mistura.
Qualquer adição à solução pronta para uso apenas deve ser realizada após a solução pronta para uso ser misturada completamente. Após realizar uma adição, a solução pronta para uso deve ser misturada novamente a fundo antes do uso.
A adição de uma solução de cloreto sódico (até 30%) ou alternativamente água para preparações injetáveis são compatíveis com este medicamento e podem ser utilizadas para ajustar a concentração de sódio se necessário para limitar a velocidade dos cambios de concentração de sódio em caso de hipernatremia ou hiponatremia grave. Para mais detalhes, ver a ficha técnica.
Se não for prescrito de outra forma, a solução pronta para uso deve ser aquecida imediatamente antes da perfusão a 36,5º C – 38,0º C. A temperatura exata deve ser selecionada dependendo dos requisitos clínicos e do equipamento técnico utilizado.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃOFabricante: Nikkiso BelgiumRequer receita médicaFabricante: Nikkiso BelgiumRequer receita médicaFabricante: Nikkiso BelgiumRequer receita médica
Alternativas a MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO em Polónia
Alternativa a MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO em Ukraine
Médicos online para MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de MULTIBIC 3 mmol/L SOLUÇÃO DE POTÁSSIO PARA HEMODIÁLISE E HEMOFILTRAÇÃO – sujeita a avaliação médica e regras locais.














