LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto: informação para o paciente
Leqvio 284mg solução injetável em seringa pré-carregada
Seringa pré-carregada com protetor de agulha
inclisirán
Leia todo o prospecto detenidamente antes de que lhe administrem este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Leqvio e para que é utilizado
- O que precisa saber antes de que lhe administrem Leqvio
- Como é administrado Leqvio
- Possíveis efeitos adversos
- Conservação de Leqvio
- Conteúdo do envase e informações adicionais
1. O que é Leqvio e para que é utilizado
O que é Leqvio e como funciona
Leqvio contém o princípio ativo inclisirán. Inclisirán reduz os níveis de colesterol LDL (colesterol "mau"), que pode produzir problemas de coração e de circulação do sangue quando os níveis estão elevados.
Inclisirán actua interferindo com o ARN (encarregado de trasladar a informação genética das células do corpo) para limitar a produção de uma proteína chamada PCSK9. Esta proteína pode aumentar os níveis de colesterol LDL e impedir a sua produção ajuda a reduzir os níveis de colesterol LDL.
Para que é utilizado Leqvio
Leqvio é utilizado juntamente com a sua dieta de redução do colesterol se é um adulto com nível alto de colesterol no sangue (hipercolesterolemia primária, incluindo a heterocigótica familiar e não familiar ou dislipidemia mista).
Leqvio é dado:
- juntamente com uma estatina (um tipo de medicamento que trata o colesterol alto), algumas vezes combinado com outro tratamento que baixa o colesterol, se a dose máxima da estatina não funciona suficientemente bem, ou
- sozinho ou juntamente com outros medicamentos que baixam o colesterol quando as estatinas não funcionam bem ou não se podem usar.
2. O que precisa saber antes de que lhe administrem Leqvio
Não lhe devem administrar Leqvio
- se é alérgico a inclisirán ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de que lhe administrem Leqvio:
- se está a receber diálise
- se tem uma doença hepática grave
- se tem uma doença renal grave
Crianças e adolescentes
Não utilize este medicamento em crianças e adolescentes com menos de 18 anos de idade, porque não há experiência no uso deste medicamento neste grupo de idade.
Outros medicamentos e Leqvio
Informa o seu médico, farmacêutico ou enfermeiro se está a tomar, tomou recentemente ou pudesse ter que tomar qualquer outro medicamento.
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico, farmacêutico ou enfermeiro antes de utilizar este medicamento.
Deve evitar-se o uso de Leqvio durante a gravidez.
Ainda não se sabe se Leqvio pode passar para o leite materno. O seu médico ajudá-lo-á a decidir se continua a lactação ou se começa o tratamento com Leqvio. O seu médico considerará os potenciais benefícios do tratamento para si, comparado com os benefícios para a saúde e riscos para a lactação do seu bebé.
Condução e uso de máquinas
Não se espera que Leqvio influencie a sua capacidade para conduzir ou utilizar máquinas.
Leqvio contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, essencialmente "exento de sódio".
3. Como é administrado Leqvio
A dose recomendada de Leqvio é de 284 mg administrado mediante uma injeção sob a pele (injeção subcutânea). A seguinte dose é administrada aos 3 meses e depois as doses adicionais cada 6 meses.
Antes de começar com Leqvio, você deve estar a seguir uma dieta para baixar o seu colesterol e provavelmente esteja a tomar uma estatina. Deveria manter a dieta para baixar o colesterol e continuar a tomar a estatina durante todo o tempo que receber Leqvio.
Leqvio é administrado como uma injeção sob a pele do abdômen, lugares alternativos de administração são a parte superior do braço ou a coxa. Leqvio será administrado por um médico, farmacêutico ou enfermeiro (profissional de saúde).
Se lhe administraram mais Leqvio do que o que se deve
Este medicamento será administrado por um médico, farmacêutico ou enfermeiro (profissional de saúde). No caso improvável de que se lhe administre demasiado (uma sobredose) o médico ou outro profissional de saúde seguirá os seus efeitos adversos.
Se esqueceu que lhe administrem Leqvio
Se esqueceu de uma consulta para que lhe administrem a sua injeção de Leqvio, contacte o seu médico, farmacêutico ou enfermeiro tão pronto quanto possível para poder organizar a sua próxima injeção.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Frequentes(podem afetar até 1 de cada 10 pessoas)
- Reações no local de injeção, como dor, rubor ou erupção.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Leqvio
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de caducidade que aparece na etiqueta e na caixa após CAD/EXP. A data de caducidade é o último dia do mês que se indica.
Este medicamento não requer condições especiais de conservação. Não congelar.
O seu médico, farmacêutico ou enfermeiro verificará este medicamento e o deitará fora se contém partículas.
Os medicamentos não devem ser deitados fora pelos desgües nem para a lixeira. O seu médico, farmacêutico ou enfermeiro deitará os medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Leqvio
- O princípio ativo é o inclisirán. Cada seringa pré-carregada contém inclisirán sódio equivalente a 284 mg de inclisirán em 1,5 ml de solução. Cada ml contém inclisirán sódio equivalente a 189 mg de inclisirán.
- Os outros componentes são água para preparações injetáveis, hidróxido de sódio (E524) (ver seção 2 “Leqvio contém sódio”) e ácido fosfórico concentrado (E338).
Aspecto do produto e conteúdo do envase
Leqvio 284 mg solução injetável em seringa pré-carregada é uma solução clara, entre incolor e ligeiramente amarela, praticamente livre de partículas.
Cada envase contém uma seringa pré-carregada com protetor de agulha de um único uso.
Título da autorização de comercialização
Novartis Europharm Limited
Edifício Vista
Elm Park, Merrion Road
Dublin 4
Irlanda
Responsável pela fabricação
Sandoz GmbH
Biochemiestrasse 10
6336 Langkampfen
Áustria
Novartis Pharmaceutical Manufacturing GmbH
Biochemiestrasse 10
6336 Langkampfen
Áustria
Novartis Pharma GmbH
Roonstrasse 25
90429 Nuremberga
Alemanha
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nuremberga
Alemanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica/Bélgica/Bélgica Novartis Pharma N.V. Tel: +32 2 246 16 11 | Lituânia SIA Novartis Baltics Lietuvos filialas Tel: +370 5 269 16 50 |
Bulgária Novartis Bulgaria EOOD Tel: +359 2 489 98 28 | Luxemburgo/Luxemburgo Novartis Pharma N.V. Tel: +32 2 246 16 11 |
República Checa Novartis s.r.o. Tel: +420 225 775 111 | Hungria Novartis Hungária Kft. Tel: +36 1 457 65 00 |
Dinamarca Novartis Healthcare A/S Tel: +45 39 16 84 00 | Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
Alemanha Novartis Pharma GmbH Tel: +49 911 273 0 | Países Baixos Novartis Pharma B.V. Tel: +31 88 04 52 111 |
Estônia SIA Novartis Baltics Eesti filiaal Tel: +372 66 30 810 | Noruega Novartis Norge AS Tel: +47 23 05 20 00 |
Grécia Novartis (Hellas) A.E.B.E. Tel: +30 210 281 17 12 | Áustria Novartis Pharma GmbH Tel: +43 1 86 6570 |
Espanha Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 | Polônia Novartis Poland Sp. z o.o. Tel: +48 22 375 4888 |
França Novartis Pharma S.A.S. Tel: +33 1 55 47 66 00 | Portugal Novartis Farma – Produtos Farmacêuticos, S.A. Tel: +351 21 000 8600 |
Croácia Novartis Hrvatska d.o.o. Tel: +385 1 6274 220 | Romênia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
Irlanda Novartis Ireland Limited Tel: +353 1 260 12 55 | Eslovênia Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
Islândia Vistor ehf. Tel: +354 535 7000 | República Eslovaca Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
Itália Novartis Farma S.p.A. Tel: +39 02 96 54 1 | Finlândia Novartis Finland Oy Tel: +358 (0)10 6133 200 |
Chipre Novartis Pharma Services Inc. Tel: +357 22 690 690 | Suécia Novartis Sverige AB Tel: +46 8 732 32 00 |
Letônia SIA Novartis Baltics Tel: +371 67 887 070 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
Esta informação é destinada apenas a profissionais de saúde:
Leqvio 284 mg solução injetável em seringa pré-carregada
Seringa pré-carregada com protetor de agulha
Inclisirán
Os profissionais de saúde devem consultar a Bula para obter informações completas de prescrição.
Indicação(ver seção4.1 da Bula)
Leqvio é indicado em adultos com hipercolesterolemia primária (heterocigótica familiar e não familiar) ou dislipidemia mista, como adjuvante da dieta:
- em combinação com uma estatina ou uma estatina e outros tratamentos hipolipemiantes em pacientes que não conseguem alcançar os objetivos de C-LDL com a dose máxima de uma estatina ou,
- sozinho ou em combinação com outros tratamentos hipolipemiantes em pacientes que são intolerantes às estatinas, ou para aqueles para os quais as estatinas estão contraindicadas.
Posologia (ver seção4.2 da Bula).
A dose recomendada é de 284 mg de inclisirán em uma única injeção subcutânea administrada em uma dose inicial, outra aos 3 meses e posteriormente a cada 6 meses.
Dose esquecida
Se a administração de uma dose planejada for retardada por um período inferior a 3 meses, deve-se administrar inclisirán e manter a dosificação de acordo com o calendário inicial do paciente.
Se a administração de uma dose planejada for retardada por um período superior a 3 meses, deve-se iniciar um novo calendário de dosificação – deve-se administrar inclisirán em uma dose inicial, outra aos 3 meses e posteriormente a cada 6 meses.
Transição do tratamento de anticorpos monoclonais inibidores de proproteína convertase subtilisina/kexina tipo 9 (PCSK9)
Inclisirán pode ser administrado imediatamente após a última dose de um anticorpo monoclonal inibidor de PCSK9. Para manter a redução do colesterol de lipoproteína de baixa densidade (C-LDL), recomenda-se administrar inclisirán 2 semanas após a última dose do anticorpo monoclonal inibidor de PCSK9.
Populações especiais
Idade avançada
Não são necessários ajustes de dose em pacientes de idade avançada (ver seção 5.2 da Bula).
Insuficiência hepática
Não são necessários ajustes de dose em pacientes com insuficiência hepática leve (classe Child-Pugh A) ou moderada (classe Child-Pugh B). Não há dados disponíveis em pacientes com insuficiência hepática grave (classe Child-Pugh C) (ver seção 5.2 da Bula). Inclisirán deve ser usado com precaução em pacientes com insuficiência hepática grave.
Insuficiência renal
Não são necessários ajustes de dose em pacientes com insuficiência renal leve, moderada ou grave ou pacientes com doença renal terminal (ver seção 5.2 da Bula). A experiência com inclisirán é limitada em pacientes com insuficiência renal grave. Inclisirán deve ser usado com precaução nesses pacientes. Ver seção 4.4 da Bula para precauções em caso de hemodiálise.
População pediátrica
Não foi estabelecida ainda a segurança e eficácia de inclisirán em crianças menores de 18 anos. Não há dados disponíveis.
Forma de administração (ver seção4.2 da Bula)
Via subcutânea.
Inclisirán é de administração subcutânea no abdômen, alguns lugares alternativos de injeção são a parte superior do braço ou a coxa. As injeções não devem ser feitas em áreas com doença cutânea ativa ou com feridas, como queimaduras de sol, erupção cutânea, inflamação ou infecções cutâneas.
Cada dose de 284 mg é administrada por meio de uma seringa pré-carregada. Cada seringa pré-carregada é de um único uso.
Inclisirán está indicado para ser administrado por um profissional de saúde.
Contraindicações (ver seção4.3 da Bula)
Hipersensibilidade ao princípio ativo ou a algum dos excipientes.
Advertências e precauções especiais de uso (ver seção4.4 da Bula)
Hemodiálise
Não foi estudado o efeito da hemodiálise na farmacocinética de inclisirán. Tendo em conta que inclisirán é eliminado por via renal, não se deve realizar uma hemodiálise até pelo menos 72 horas após a administração de Leqvio.
Conservação(ver seção6.4 da Bula)
Não requer condições especiais de conservação. Não congelar.
Instruções de uso de Leqvio seringa pré-carregada com protetor de agulha
Esta seção contém informações sobre como injetar Leqvio.
Informação importante que você precisa saber antes de injetar Leqvio
- Nãouse a seringa pré-carregada se algum dos selos do envase exterior ou o selo da bandeja de plástico estiverem quebrados.
- Nãoretire o capuchão da agulha até que esteja preparado para injetar.
- Nãouse se a seringa pré-carregada tiver caído sobre uma superfície dura ou tiver sido deixada cair após retirar o capuchão da agulha.
- Nãotente reutilizar ou desmontar a seringa pré-carregada.
- A seringa pré-carregada tem um protetor de agulha que se ativará para cobrir a agulha quando a injeção tiver terminado. O protetor de agulha ajudará a evitar lesões por picada de agulha a qualquer pessoa que manipule a seringa pré-carregada após a injeção.
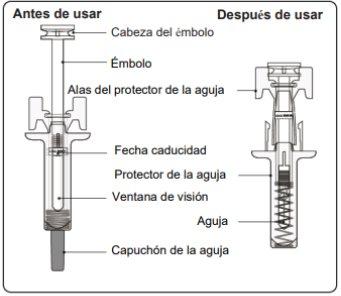
Passo 1. Inspeccionar a seringa pré-carregada
Você pode ver bolhas de ar no líquido, o que é normal. Não tenteremover o ar.
- Nãouse a seringa pré-carregada se parecer danificada ou se parte da solução injetável tiver saído fora da seringa pré-carregada.
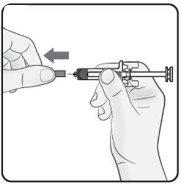
Passo 2. Retirar o capuchão da agulha Puxe com firmeza e retidão para retirar o capuchão da agulha da seringa pré-carregada. Você pode ver uma gota de líquido no final da agulha. É normal. Nãocoloque o capuchão da agulha de volta. Jogue-o fora. Nãoretire o capuchão da agulha até que esteja preparado para injetar. A retirada precoce do capuchão antes da injeção pode causar a secagem do produto terminado dentro da agulha, o que pode levar à obstrução desta. |
|
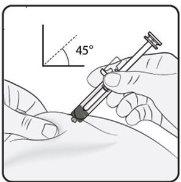
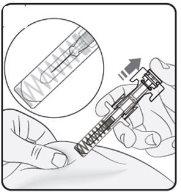
Passo 3. Inserir a agulha Puxe suavemente a pele no local de injeção e mantenha o puxão durante a injeção. Com a outra mão, insira a agulha na pele em um ângulo aproximado de 45 graus, como mostrado na imagem. |
|
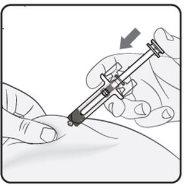
Passo 4. Iniciar a injeção Continue puxando a pele. Pressione suavemente o êmbolo tão longe quanto possível. Isso garantirá que a dose completa seja injetada. Nota: Se não puder pressionar o êmbolo após a inserção da agulha, use uma nova seringa pré-carregada. |
|
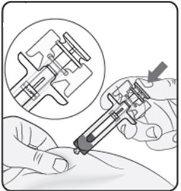
Passo 5. Concluir a injeção Certifique-se de que a cabeça do êmbolo está entre as asas do protetor de agulha, como mostrado na imagem. Isso garantirá que o protetor de agulha se ativou e cobrirá a agulha uma vez que a injeção tenha terminado. |
|
Passo 6. Liberar o êmbolo Enquanto mantém a seringa pré-carregada no local de injeção, libere devagar o êmbolo até que a seringa pré-carregada fique coberta pelo protetor de agulha. Retire a seringa pré-carregada do local de injeção. |
|
Passo 7. Descartar a seringa pré-carregada Descarte a seringa pré-carregada de acordo com as regulamentações locais. |
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: COMPRIMIDO, 10 mg de ezetimibaSubstância ativa: ezetimibeFabricante: Organon Salud S.L.Requer receita médicaForma farmacêutica: CÁPSULA, 1000 mgSubstância ativa: omega-3-triglycerides incl. other esters and acidsFabricante: Kern Pharma S.L.Requer receita médicaForma farmacêutica: CÁPSULA, 1000 mgSubstância ativa: omega-3-triglycerides incl. other esters and acidsFabricante: Strides Pharma (Cyprus) LimitedRequer receita médica
Alternativas a LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Украина
Médicos online para LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de LEQVIO 284 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.