KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Kovaltry 250 UI pó e dissolvente para solução injectável
Kovaltry 500 UI pó e dissolvente para solução injectável
Kovaltry 1000 UI pó e dissolvente para solução injectável
Kovaltry 2000 UI pó e dissolvente para solução injectável
Kovaltry 3000 UI pó e dissolvente para solução injectável
octocog alfa (factor VIII de coagulação de origem humana recombinante)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Kovaltry e para que é utilizado
- O que precisa saber antes de começar a usar Kovaltry
- Como usar Kovaltry
- Possíveis efeitos adversos
- Conservação de Kovaltry
- Conteúdo do envase e informações adicionais
1. O que é Kovaltry e para que é utilizado
Kovaltry contém o princípio ativo factor VIII de coagulação humano recombinante, também conhecido como octocog alfa. Kovaltry é preparado com tecnologia recombinante sem adição de qualquer componente de origem humana ou animal no processo de fabricação. O factor VIII é uma proteína que se encontra de forma natural no sangue e ajuda a coagular.
Kovaltry é utilizado para tratar e prevenir hemorragiaem adultos, adolescentes e crianças de qualquer idade com hemofilia A (déficit hereditário de factor VIII).
2. O que precisa saber antes de começar a usar Kovaltry
Não use Kovaltryse é
- alérgico a octocog alfa ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- alérgico a proteínas de rato ou hamster.
Advertências e precauções
Consulte o seu médico ou farmacêutico setiver:
- pressão no peito, tontura (inclusivamente quando se levanta de estar sentado ou deitado), erupção cutânea com piche, sibilância (assobio ao respirar), sensação de tontura ou desmaio. Estes podem ser sinais de uma reação alérgica repentina grave rara a Kovaltry. Interrompaimediatamente a administração do medicamentoe peça assistência médica se isso ocorrer.
- hemorragia que não se consegue controlar com a sua dose habitual de Kovaltry. A formação de inibidores (anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos compostos por factor VIII. Estes inibidores, especialmente em grandes quantidades, impedem que o tratamento funcione corretamente, por isso os pacientes em tratamento com Kovaltry serão supervisionados cuidadosamente para verificar se desenvolvem estes inibidores. Se a sua hemorragia ou a do seu filho não se está a controlar com Kovaltry, consulte o seu médico imediatamente.
- ou desenvolveu anteriormente inibidores do factor VIII a outro produto diferente. Se mudar para outro medicamento de factor VIII, pode ter risco de voltar a desenvolver inibidores.
- uma doença cardíaca confirmada ou tem risco de padecer uma doença cardíaca.
- que usar um dispositivo de acesso venoso central para a administração de Kovaltry. Pode ter risco de sofrer complicações relacionadas com o dispositivo, onde o catéter foi inserido, como por exemplo:
- infecções locais
- bactérias no sangue
- um coágulo de sangue no vaso sanguíneo
Crianças e adolescentes
As advertências e precauções enumeradas são de aplicação a pacientes de todas as idades, adultos e crianças.
Uso de Kovaltry com outros medicamentos
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento.
Não é provável que Kovaltry afete a fertilidade dos pacientes de sexo masculino ou feminino, uma vez que o princípio ativo aparece de forma natural no organismo.
Condução e uso de máquinas
Se experimenta tontura ou outros sintomas que afetem a sua capacidade para se concentrar e reagir, recomenda-se que não conduza nem utilize máquinas até que o efeito remita.
Kovaltry contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose, o que é essencialmente “isento de sódio”.
3. Como usar Kovaltry
O tratamento com Kovaltry será iniciado por um médico com experiência no cuidado de pacientes com hemofilia A. Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
O número de unidades de factor VIII é expresso em Unidades Internacionais (UI)
Tratamento da hemorragia
Para tratar a hemorragia, o seu médico calculará e ajustará a dose e a frequência de administração, dependendo de factores como:
- o seu peso
- a gravidade da sua hemofilia A
- a localização e gravidade da hemorragia
- se tem inibidores do factor VIII e o nível deles
- o nível requerido de factor VIII.
Prevenção da hemorragia
Se está a utilizar Kovaltry para prevenir a hemorragia, o seu médico calculará a dose que lhe convém. Esta dose será normalmente de 20 a 40 UI de octocog alfa por kg de peso corporal, injetada duas ou três vezes por semana. No entanto, em alguns casos, especialmente em pacientes mais jovens, podem ser necessárias doses superiores ou intervalos de tratamento mais curtos.
Testes de laboratório
Os testes de laboratório a intervalos apropriados ajudam a garantir que sempre se tenham os níveis adequados de factor VIII. No caso concreto das intervenções cirúrgicas importantes, a coagulação sanguínea deve ser estritamente monitorizada.
Uso em crianças e adolescentes
Kovaltry pode ser utilizado em crianças de todas as idades. Em crianças menores de 12 anos podem ser necessárias doses mais altas ou injeções mais frequentes do que as prescritas para adultos.
Pacientes com inibidores
Se o seu médico lhe disser que desenvolveu inibidores do factor VIII, pode precisar de uma dose superior de Kovaltry para controlar a hemorragia. Se esta dose superior não a controlar, o seu médico pode considerar a utilização de outro medicamento.
Se deseja mais informações, fale com o seu médico.
Não aumente a dose de Kovaltry que lhe foi prescrita para controlar a sua hemorragia sem consultar o seu médico.
Duração do tratamento
Geralmente, o tratamento para a hemofilia com Kovaltry será necessário por toda a vida.
Como se administra Kovaltry
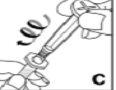
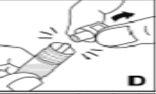
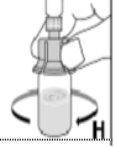
Kovaltry é injetado numa veia durante 2-5 minutos, dependendo do volume total e do seu nível de confort, e deve ser utilizado no prazo de 3 horas após a reconstituição.
Como se prepara Kovaltry para a administração
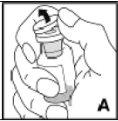
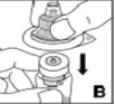
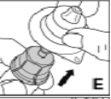
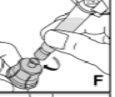
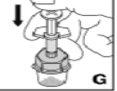
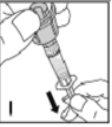
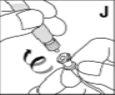
Utilize apenas os componentes (adaptador do frasco, seringa pré-carregada com o dissolvente e equipamento para punção venosa) incluídos no envase para este medicamento. Por favor, contacte o seu médico se não for possível utilizar estes componentes. Não o utilize se algum dos componentes do envase estiver aberto ou danificado.
O medicamento reconstituído deve ser filtrado usando o adaptador do frascoantes da administração para eliminar possíveis partículas presentes na solução.
Não use o equipamento de punção venosa fornecido para a extração de sangue, porque contém um filtro em linha.
Este medicamento nãodeve ser misturado com outras soluções para perfusão. Não utilize soluções se observar partículas ou se a solução estiver turva. Siga as instruções de administração que o seu médico e recolhidas no final deste prospecto.
Se usar mais Kovaltry do que deve
Informa o seu médico se isso ocorrer. Não foram comunicados casos de sobredose.
Se esquecer de usar Kovaltry
Administre imediatamente a próxima dose e continue a intervalos regulares, seguindo as instruções do seu médico.
Não use uma dose dupla para compensar as doses esquecidas.
Se interromper o tratamento com Kovaltry
Não deixe de usar este medicamento sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos mais gravessão reações alérgicasque podem incluir uma reação alérgica grave. Interrompaimediatamente a injeção de Kovaltry e fale em seguida com o seu médico se esta reação ocorrer.Os seguintes sintomas podemser um sinal precoce destas reações:
- pressão no peito ou sensação geral de mal-estar
- tontura
- sensação de tontura ao levantar-se, indicando uma diminuição da pressão arterial
- sensação de mal-estar (náuseas)
Em crianças não tratadas previamente com medicamentos de factor VIII, podem formar-se de forma muito frequente (mais de 1 de cada 10 pacientes) inibidores(ver secção 2). Nos pacientes que receberam tratamento previo com factor VIII (mais de 150 dias de tratamento), podem formar-se anticorpos inibidores (ver secção 2) com pouca frequência (menos de 1 de cada 100 pacientes). Se isso ocorrer, o medicamento que toma pode deixar de funcionar corretamente e pode sofrer uma hemorragia persistente. Nesse caso, por favor, contacte o seu médico imediatamente.
Outros possíveis efeitos adversos:
Frequentes(podem afetar até 1 de cada 10 pessoas):
- dor ou mal-estar estomacal
- dispepsia
- febre
- reações locais no local onde se injetou o medicamento (p. ex., sangramento debaixo da pele, piche forte, inchaço, sensação de queimadura, eritema passageiro)
- dor de cabeça
- dificuldade para dormir
- urticária
- erupção cutânea com ou sem piche
Pouco frequentes(podem afetar até 1 de cada 100 pessoas):
- aumento do tamanho dos nódulos linfáticos (inchaço debaixo da pele do pescoço, axila ou virilha)
- palpitações (sensação de que o coração bate forte, rápido ou irregularmente)
- batimento cardíaco acelerado
- disgeusia (alteração do gosto)
- sofoco (eritema da face)
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano www.notificaRAM.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Kovaltry
Mantenha este medicamento fora da vista e do alcance das crianças.
Nãoutilize este medicamento após a data de validade que aparece nas etiquetas e caixas.
A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (2 °C – 8 °C). Não congelar.
Conservar este medicamento no envase original para protegê-lo da luz.
Este medicamento pode ser conservado a temperatura ambiente (até 25 °C) durante um máximo de 12 meses, se o mantiver no envase original. Se conservar o medicamento a temperatura ambiente, caduca após 12 meses ou na data de validade indicada, consoante o que for anterior.
Deve anotar a nova data de validade no embalagem exterior quando o medicamento for retirado do frigorífico.
Nãorefrigerar a solução após a reconstituição. A solução reconstituída deve ser utilizada num prazo máximo de 3 horas. Utilizar o conteúdo uma única vez. Desechar a solução não utilizada.
Nãoutilize este medicamento se observar partículas na solução ou se a solução estiver turva.
Os medicamentos nãodevem ser jogados fora pela água nem pelo lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Kovaltry
O princípio ativoé octocog alfa (fator VIII de coagulação humano). Cada frasco de Kovaltry contém 250, 500, 1000, 2000 ou 3000 UI de octocog alfa.
Os demaiscomponentes são sacarose, histidina, glicina (E 640), cloreto de sódio, cloreto de cálcio diidratado (E 509), polissorbato 80 (E 433), ácido acético glacial (E 260) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Kovaltry é apresentado sob a forma de pó e diluente para solução injetável. O pó é seco e de cor branca a ligeiramente amarela. O diluente é um líquido claro.
Cada envase individual de Kovaltry contém
- um frasco de vidro com pó
- uma seringa pré-carregada com diluente
- êmbolo independente
- um adaptador de frasco
- um equipamento para punção venosa (para injeção em uma veia).
Kovaltry está disponível em tamanhos de:
- 1 envase individual
- 1 envase múltiplo com 30 envases individuais
Pode ser que nem todos os tamanhos estejam comercializados.
Título da autorização de comercialização
Bayer AG
51368 Leverkusen
Alemanha
Responsável pela fabricação
Bayer AG
Kaiser-Wilhelm-Allee
51368 Leverkusen
Alemanha
Podemsolicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Bayer SA-NV Tel: +32-(0)2-535 63 11 | Lituânia UAB Bayer Tel: +37 05 23 36 868 |
Bulgária Bayer EAD Tel: +359-(0)2-424 72 80 | Luxemburgo Bayer SA-NV Tel: +32-(0)2-535 63 11 |
República Tcheca Bayer s.r.o. Tel: +420 266 101 111 | Hungria Bayer Hungária KFT Tel: +36 14 87-41 00 |
Dinamarca Bayer A/S Tel: +45 45 23 50 00 | Malta Alfred Gera and Sons Ltd. Tel: +35 621 44 62 05 |
Alemanha Bayer Vital GmbH Tel: +49 (0)214-30 513 48 | Países Baixos Bayer B.V. Tel: +31-(0)297-28 06 66 |
Estônia Bayer OÜ Tel: +372 655 8565 | Noruega Bayer AS Tel: +47 23 13 05 00 |
Grécia Bayer Hellas AE Tel: +30-210-61 87 500 | Áustria Bayer Austria Ges.m.b.H. Tel: +43-(0)1-711 46-0 |
Espanha Bayer Hispania S.L. Tel: +34-93-495 65 00 | Polônia Bayer Sp. z o.o. Tel: +48 22 572 35 00 |
França Bayer HealthCare Tel (N° verde): +33-(0)800 87 54 54 | Portugal Bayer Portugal, Lda. Tel: +351 21 416 42 00 |
Croácia Bayer d.o.o. Tel: +385-(0)1-6599 900 | Romênia SC Bayer SRL Tel: +40 21 529 59 00 |
Irlanda Bayer Limited Tel: +353 1 216 3300 | Eslovênia Bayer d. o. o. Tel: +386 (0)1 58 14 400 |
Islândia Icepharma hf. Tel: +354 540 8000 | República Eslovaca Bayer spol. s r.o. Tel: +421 2 59 21 31 11 |
Itália Bayer S.p.A. Tel: +39 02 397 81 | Finlândia Bayer Oy Tel: +358- 20 785 21 |
Chipre NOVAGEM Limited Tel: +357 22 48 38 58 | Suécia Bayer AB Tel: +46 (0) 8 580 223 00 |
Letônia SIA Bayer Tel: +371 67 84 55 63 | Reino Unido (Irlanda do Norte) Bayer AG Tel: +44-(0)118 206 3000 |
Data da última revisão deste prospecto:
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos http://www.ema.europa.eu
--------------------------------------------------------------------------------------------------------------------Instruções detalhadas de reconstituição e administração de Kovaltry
Necessitará de gazes estéreis impregnadas em álcool, gazes estéreis, tiras adesivas e torniquete. Estes artigos não estão incluídos no envase de Kovaltry.
| |
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
| |
| |
|
|
| |
| |
| |
| |
| |
|
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1000 UI - após reconstituição em 2 ml de água para injetáveis, a dose é de 500 UI/mlSubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica
Alternativas a KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polska
Alternativa a KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraina
Médicos online para KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de KOVALTRY 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.