JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão


Como usar JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão
Introdução
Prospecto: informação para o utilizador
JEVTANA 60 mg concentrado e diluente para solução para perfusão
cabazitaxel
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeira.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeira, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é JEVTANA e para que é utilizado
- O que precisa saber antes de que lhe administrem JEVTANA
- Como usar JEVTANA
- Efeitos adversos possíveis
- Conservação de JEVTANA
- Conteúdo do envase e informações adicionais
1. O que é JEVTANA e para que é utilizado
O nome do seu medicamento é JEVTANA. A sua designação comum é cabazitaxel. Pertence a um grupo de medicamentos designado “taxanos”, utilizados para tratar cancros.
JEVTANA é utilizado para o tratamento do cancro da próstata que progrediu após ter recebido outra quimioterapia. Actua detendo o crescimento das células e a sua multiplicação.
Como parte do seu tratamento, tomará também todos os dias um corticosteroide (prednisona ou prednisolona), por via oral. Peça informações ao seu médico sobre este outro medicamento.
2. O que precisa saber antes de que lhe administrem JEVTANA
Não use JEVTANA
- se é alérgico (hipersensível) a cabazitaxel, a outros taxanos, ao polissorbato 80 ou a algum dos outros componentes deste medicamento (incluídos na secção 6),
- se o número dos seus glóbulos brancos for muito baixo (número de neutrófilos menor ou igual a 1.500/mm3),
- se tiver problemas graves de fígado,
- se recentemente foi ou vai ser vacinado contra a febre amarela.
Não deve receber JEVTANA se lhe suceder alguma das circunstâncias acima. Se não tiver certeza, consulte o seu médico antes de receber JEVTANA.
Advertências e precauções
Antes de iniciar o tratamento com JEVTANA, far-lhe-ão análises de sangue para comprovar que tem células sanguíneas suficientes e que os seus rins e fígado funcionam adequadamente para receber JEVTANA.
Informa ao seu médico imediatamente se:
- tiver febre. Durante o tratamento com JEVTANA é mais provável que se reduza o número dos seus glóbulos brancos. O médico controlará o seu sangue e o seu estado geral para detectar sinais de infecções. Podia administrar-lhe outros medicamentos para manter o número das suas células sanguíneas. As pessoas com recuentos celulares baixos podem desenvolver infecções que podem pôr em perigo a vida. O primeiro sinal de infecção podia ser febre, por isso se tiver febre, informa ao seu médico imediatamente.
- alguma vez teve alguma alergia. Durante o tratamento com JEVTANA podem produzir-se reacções alérgicas graves.
- tiver diarreia grave ou duradoura, se sentir mal (náuseas) ou está mal (vómitos). Qualquer destas situações pode produzir desidratação grave. O seu médico teria que lhe dar um tratamento.
- tiver sensação de insensibilidade, formigueiro, ardor ou diminuição das sensações em mãos e pés.
- tiver algum problema de sangramento no intestino ou tiver alterações na cor das suas fezes ou dor de estômago. Se o sangramento ou a dor for grave, o seu médico interromperá o seu tratamento com JEVTANA. Isto é porque JEVTANA podia aumentar o risco de sangramento ou desenvolvimento de perfurações na parede intestinal.
- tiver problemas de rins.
- tiver pele e olhos amarelentos, urina escura, náuseas intensas (sensação de malestar) ou vómitos, pois podem ser sinais ou sintomas de problemas hepáticos.
- nota que o volume da sua urina aumenta ou diminui significativamente.
- tiver sangue na urina.
Se lhe suceder alguma das circunstâncias acima, informa ao seu médico imediatamente. O seu médico podia reduzir a dose de JEVTANA ou interromper o tratamento.
Uso de JEVTANA com outros medicamentos
Informa ao seu médico, farmacêutico ou enfermeira se está a utilizar ou utilizou recentemente outros medicamentos, mesmo os adquiridos sem receita. Isto é devido a que alguns medicamentos podem afectar a eficácia de JEVTANA ou JEVTANA pode afectar a eficácia de outros medicamentos. Estes medicamentos incluem os seguintes:
- cetoconazol, rifampicina (para infecções);
- carbamazepina, fenobarbital ou fenitoína (para convulsões);
- erva-de-São-João ou hipérico (Hypericum perforatum) (planta medicinal utilizada para tratar a depressão e outros problemas);
- estatinas (tais como simvastatina, lovastatina, atorvastatina, rosuvastatina, ou pravastatina) (para reduzir o colesterol no seu sangue);
- valsartano (para a hipertensão);
- repaglinida (para a diabetes).
Enquanto estiver em tratamento com JEVTANA, consulte com o seu médico antes de se vacinar.
Gravidez, lactação e fertilidade
JEVTANA não é indicado para o uso em mulheres.
Use preservativos nas suas relações sexuais se a sua parceira está ou podia estar grávida. JEVTANA podia estar presente no seu sémen e pode afectar o feto. Recomenda-se não gerar um filho durante e até 4 meses após o tratamento e solicitar informações sobre a conservação do esperma antes do tratamento, pois JEVTANA podia alterar a fertilidade masculina.
Condução e uso de máquinas
Durante o tratamento com este medicamento podia sentir-se cansado ou mareado. Se isto suceder, não conduza nem use ferramentas ou máquinas até que se sinta melhor.
JEVTANA contém etanol (álcool)
Este medicamento contém 573 mg de álcool (etanol) em cada frasco de diluente. A quantidade na dose deste medicamento é equivalente a menos de 11 ml de cerveja ou 5 ml de vinho. A pequena quantidade de álcool que contém este medicamento não produz qualquer efeito perceptível. Se tiver adicção ao álcool, tiver uma doença hepática ou epilepsia, consulte com o seu médico ou farmacêutico antes de tomar este medicamento.
3. Como usar JEVTANA
Instruções de uso
Antes de receber JEVTANA, serão administrados medicamentos antialérgicos para reduzir o risco de reacções alérgicas.
- JEVTANA será administrado por um médico ou uma enfermeira.
- JEVTANA deve ser preparado (diluído) antes de ser administrado. Com este prospecto é fornecida informação prática para a manipulação e administração de JEVTANA para médicos, enfermeiras e farmacêuticos.
- JEVTANA será administrado no hospital mediante um gotejamento (perfusão) numa das suas veias (via intravenosa) durante aproximadamente 1 hora.
- Como parte do seu tratamento, tomará também um medicamento corticosteroide (prednisona ou prednisolona) por via oral todos os dias.
Quanto e com que frequência é administrado
- A dose habitual depende da sua área de superfície corporal. O seu médico calculará a sua área de superfície corporal em metros quadrados (m2) e decidirá a dose que deve receber.
- Normalmente receberá uma perfusão cada 3 semanas.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeira.
4. Efeitos adversos possíveis
Como todos os medicamentos, JEVTANA pode produzir efeitos adversos, embora nem todas as pessoas os sofram. O seu médico comentará isto consigo e explicará os riscos e os benefícios potenciais do seu tratamento.
Dirija-se imediatamente ao médico se notar algum dos seguintes efeitos adversos:
- febre (temperatura alta). Isto é frequente (podia afectar até 1 em cada 10 pessoas).
- perda grave de fluidos corporais (desidratação). Isto é frequente (podia afectar até 1 em cada 10 pessoas). Isto pode ocorrer se tiver diarreia grave ou duradoura, ou febre, ou se tem estado a vomitar.
- dor de estômago grave ou dor de estômago que não se resolve. Isto pode suceder se tiver uma perfuração no estômago, esófago, intestino (perfuração gastrointestinal). Isto pode causar a morte.
Se lhe suceder alguma das circunstâncias acima, comunique ao seu médico imediatamente.
Outros efeitos adversos incluem:
Muito frequentes(podem afectar mais de 1 em cada 10 pessoas):
- redução do número de células sanguíneas vermelhas (anemia), ou brancas (que são importantes para combater as infecções)
- redução do número de plaquetas (o que resulta num aumento do risco de ter hemorragias)
- perda de apetite (anorexia)
- molestias de estômago, incluindo náuseas, vómitos, diarreia ou prisão de ventre
- dor de costas
- sangue na urina
- cansaço, fraqueza ou falta de energia.
Frequentes(podem afectar até 1 em cada 10 pessoas):
- alteração do gosto
- respiração entrecortada
- tosse
- dor abdominal
- perda de cabelo a curto prazo (na maioria dos casos o cabelo volta a crescer com normalidade)
- dor das articulações
- infecção do tracto urinário
- escassez de glóbulos brancos associada a febre e infecções
- sensação de insensibilidade, formigueiro, ardor ou diminuição das sensações em mãos e pés
- tontura
- dor de cabeça
- aumento ou diminuição da tensão arterial
- malestar de estômago, ardor de estômago ou arrotos
- dor de estômago
- hemorroides
- espasmos musculares
- urinar com frequência ou com dor
- incontinência urinária
- problemas ou alteração dos rins
- úlceras na boca ou nos lábios
- infecções ou risco de infecções
- nível de açúcar no sangue elevado
- insónia
- confusão mental
- sensação de ansiedade
- sensação rara ou perda de sensação ou dor em mãos e pés
- problemas de equilíbrio
- batimentos rápidos ou irregulares do coração
- coágulos de sangue nas pernas ou no pulmão
- sensação de sufocação na pele
- dor de boca ou garganta
- hemorragia rectal
- molestias, distúrbios, fraqueza ou dores musculares
- inflamação de pés ou pernas
- arrepios.
- distúrbios nas unhas (alteração da cor das suas unhas; as unhas podem desprender-se).
Pouco frequentes(podem afectar até 1 em cada 100 pessoas):
- nível de potássio no sangue baixo
- zumbidos nos ouvidos
- sensação de calor na pele
- pele enrubescida
- inflamação da bexiga, que pode ocorrer quando a bexiga foi previamente exposta a radioterapia (cistite devido a fenómenos de recorde de radiação).
Frequência não conhecida(não pode ser estimada a partir dos dados disponíveis)
- doença pulmonar intersticial (inflamação dos pulmões causando tosse e dificuldade para respirar).
Comunicação de efeitos adversos:
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de JEVTANA
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase e na etiqueta dos frascos após CAD. A data de validade é o último dia do mês que se indica.
Não conserve a uma temperatura superior a 30ºC. Não refrigerar.
Na secção “INFORMAÇÃO PRÁTICA PARA MÉDICOS OU PROFISSIONAIS DE SAÚDE SOBRE A PREPARAÇÃO, ADMINISTRAÇÃO E MANIPULAÇÃO DE JEVTANA” é incluída informação sobre a conservação e o tempo de uso de JEVTANA, uma vez que foi diluído e está pronto para usar.
A eliminação do medicamento não utilizado e de todos os materiais que estiveram em contacto com ele, será realizada de acordo com a normativa local. Estas medidas ajudarão a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de JEVTANA
O princípio ativo é cabazitaxel. Um ml de concentrado contém 40 mg de cabazitaxel. Um frasco de concentrado contém 60 mg de cabazitaxel.
Os outros componentes são polissorbato 80 e ácido cítrico no concentrado, e etanol 96% e água para preparações injetáveis no diluente (ver seção 2 “JEVTANA contém etanol (álcool)”).
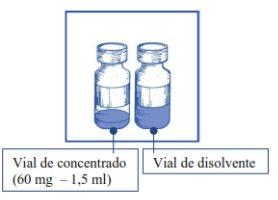
Nota: tanto o frasco do concentrado de JEVTANA 60 mg/1,5 ml (volume de enchimento: 73,2 mg de cabazitaxel/1,83 ml) como o do frasco de diluente (volume de enchimento: 5,67 ml) contêm um excesso de enchimento para compensar a perda de líquido durante a preparação. Este excesso de enchimento assegura que, após a diluição com o conteúdo COMPLETOdo diluente fornecido, haja uma solução contendo 10 mg/ml de cabazitaxel.
Aspecto do produto e conteúdo do envase
JEVTANA é um concentrado e diluente para solução para perfusão (concentrado estéril).
O concentrado é uma solução oleosa transparente, de cor amarela a amarelado-marronácea.
O diluente é uma solução transparente e incolor.
Um envase de JEVTANA contém:
- Um frasco de uso único de vidro transparente, fechado com um tampão de borracha de cor cinza, selado com uma cápsula de alumínio, coberto com um tampão expulsor flip-off de plástico de cor verde claro, contendo 1,5 ml (volume nominal) de concentrado.
- Um frasco de uso único de vidro transparente, fechado com um tampão de borracha de cor cinza, selado com uma cápsula de alumínio dourada, coberto com um tampão expulsor flip-off de plástico incolor, contendo 4,5 ml (volume nominal) de diluente.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
França
Responsável pela fabricação
Sanofi-Aventis Deutschland GmbH
Industriepark Höchst
65926 Frankfurt am Main
Alemanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Sanofi Belgium Tel.: +32 (0)2 710 54 00 | Luxemburgo Sanofi Belgium Tel.: +32 (0)2 710 54 00 (Bélgica) |
| Hungria sanofi-aventis zrt Tel.: +36 1 505 0050 |
República Tcheca Sanofi s.r.o. Tel.: +420 233 086 111 | Malta Sanofi S.r.l. Tel: +39 02 39394275 |
Dinamarca Sanofi A/S Tel.: +45 45 16 70 00 | Países Baixos Sanofi B.V. Tel.: +31 20 245 4000 |
Alemanha sanofi-aventis Deutschland GmbH Tel.: 0800 04 36 996 Tel. do exterior: +49 69 305 70 13 | Noruega sanofi-aventis Norge AS Tel.: +47 67 10 71 00 |
Estônia Swixx Biopharma OÜ Tel: +372 640 10 30 | Áustria sanofi-aventis GmbH Tel.: +43 1 80 185 – 0 |
Grécia Sanofi-Aventis Μονοπρ?σωπη AEBE Tel.: +30 210 900 16 00 | Polônia Sanofi Sp. z.o.o. Tel.: +48 22 280 00 00 |
Espanha sanofi-aventis, S.A. Tel.: +34 93 485 94 00 | Portugal Sanofi – Produtos Farmacêuticos, Lda. Tel.: +351 21 35 89 400 |
França Sanofi Winthrop Industrie Tel.: 0 800 222 555 Ligar após para o exterior: +33 1 57 63 23 23 | Romênia Sanofi Romania SRL Tel.: +40 (0)21 317 31 36 |
Croácia Swixx Biopharma d.o.o. Tel: +385 1 2078 500 | |
Irlanda sanofi-aventis Ireland Ltd. T/A SANOFI Tel.: +353 (0) 1 403 56 00 | Eslovênia Swixx Biopharma d.o.o. Tel: +386 1 235 51 00 |
Islândia Vistor hf. Tel.: +354 535 7000 | República Eslovaca Swixx Biopharma s.r.o. Tel: +421 2 208 33 600 |
Itália Sanofi S.r.l. Tel.: +39.800.536389 | Finlândia Sanofi Oy Tel.: +358 (0) 201 200 300 |
Chipre C.A. Papaellinas Ltd. Tel: +357 22 741741 | Suécia Sanofi AB Tel.: +357 22 871600 |
Letônia Swixx Biopharma SIA Tel: +371 6 616 47 50 | Reino Unido (Irlanda do Norte) sanofi-aventis Ireland Ltd. T/A SANOFI Tel: +44 (0) 800 035 2525 |
Lituânia Swixx Biopharma UAB Tel: +370 5 236 91 40 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
A seguinte informação é destinada apenas a profissionais de saúde.
INFORMAÇÃO PRÁTICA PARA MÉDICOS OU PROFISSIONAIS DE SAÚDE SOBRE A PREPARAÇÃO, ADMINISTRAÇÃO E MANIPULAÇÃO DE JEVTANA 60 mg CONCENTRADO E DILUENTE PARA SOLUÇÃO PARA PERFUSÃO
Esta informação complementa as seções 3 e 5 para o usuário.
É importante que leia o conteúdo completo deste procedimento antes de preparar a solução para perfusão.
Incompatibilidades
Este medicamento não deve ser misturado com outros medicamentos, exceto os utilizados para as diluições.
Período de validade e precauções especiais de conservação
Para o envase de JEVTANA 60 mg concentrado e diluente
Não conservar a temperatura superior a 30ºC.
Não refrigerar.
Após a abertura do frasco
Os frascos de concentrado e diluente devem ser utilizados imediatamente. Se não forem utilizados imediatamente, o tempo e as condições de conservação são responsabilidade do usuário. Do ponto de vista microbiológico, o processo de diluição em duas etapas deve ser realizado em condições controladas e assépticas (ver a seguir “Precauções de preparação e administração”).
Após a diluição inicialde JEVTANA 60 mg concentrado com o conteúdo COMPLETOdo frasco de diluente:
foi demonstrada a estabilidade química e física em uso durante 1 hora a temperatura ambiente.
Após a diluição final na bolsa/botella de perfusão
Foi demonstrada a estabilidade química e física da solução de perfusão durante 8 horas a temperatura ambiente (15ºC - 30ºC) incluindo 1 hora de tempo de perfusão e durante 48 horas na geladeira incluindo a hora de tempo de perfusão.
Do ponto de vista microbiológico, a solução de perfusão deve ser utilizada imediatamente. Se não for utilizada imediatamente, os tempos e as condições de conservação são responsabilidade do usuário e normalmente não devem ser mais de 24 horas a 2ºC - 8ºC, a menos que a diluição tenha sido realizada em condições assépticas controladas e validadas.
Precauções de preparação e administração
Assim como outros agentes antineoplásicos, deve-se agir com precaução durante a preparação e administração das soluções de JEVTANA, tendo em conta o uso de dispositivos de segurança, equipamento de proteção individual (por exemplo, luvas) e procedimentos de preparação.
Se, em qualquer uma das etapas de preparação, JEVTANA entrar em contato com a pele, lavar imediatamente e minuciosamente com água e sabão. Se entrar em contato com membranas mucosas, lavar imediatamente e minuciosamente com água.
JEVTANA só deve ser preparado e administrado por pessoal treinado no manejo de agentes citotóxicos. As trabalhadoras grávidas não devem manipulá-lo.
Always diluir o concentrado para solução para perfusão com o diluente COMPLETOque é fornecido antes de adicioná-lo às soluções de perfusão.
Etapas da preparação
Leia atentamente TODAesta seção antes de misturar e diluir. JEVTANA requer DUASdiluições antes da administração. Siga as instruções de preparação que são fornecidas a seguir.
Nota: tanto o frasco do concentrado de JEVTANA 60 mg/1,5 ml (volume de enchimento: 73,2 mg de cabazitaxel/1,83 ml) como o frasco de diluente (volume de enchimento: 5,67 ml) contêm um excesso de enchimento para compensar a perda de líquido durante a preparação. Este excesso de enchimento assegura que, após a diluição com o conteúdo COMPLETOdo diluente fornecido, haja uma solução contendo 10 mg/ml de cabazitaxel.
Para preparar a solução para perfusão, o seguinte processo de diluição em duas etapas deve ser realizado de forma asséptica.
Etapa1: diluição inicial do concentrado de solução para perfusão com o diluente fornecido.
Etapa1.1 Inspecionar o frasco de concentrado e o diluente fornecido. A solução de concentrado e de diluente devem ser transparentes. |
|
Etapa1.2 Utilizando uma seringa provida de uma agulha fixa, extrair de forma asséptica o conteúdo COMPLETOdo diluente fornecido, invertendo parcialmente o frasco. |
|
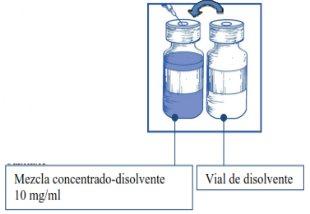
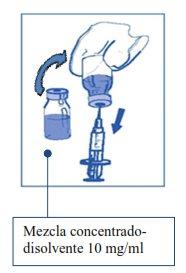
Etapa1.3 Injetar o conteúdo COMPLETOno correspondente frasco de concentrado. Para limitar todo o possível a formação de espuma ao injetar o diluente, dirigir a agulha para a parede interior do frasco de solução de concentrado e injetar lentamente. Uma vez reconstituído, a solução resultante contém 10 mg/ml de cabazitaxel. |
|
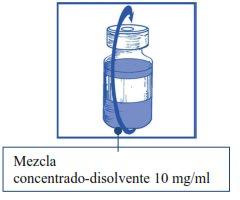
Etapa 1.4 Retirar a seringa e a agulha e misturar manualmente e suavemente, mediante inversões repetidas, até que se obtenha uma solução transparente e homogênea. Podem ser necessários cerca de 45 segundos. |
|
Etapa1.5 Deixar repousar a solução durante aproximadamente 5 minutos e, em seguida, verificar que a solução é homogênea e transparente. É normal que persista a espuma após este tempo. |
|
Esta mistura concentrado-diluente resultante contém 10 mg/ml de cabazitaxel (pelo menos 6 ml de volume liberado). A segunda diluição deve ser realizada imediatamente (antes de 1 hora) como detalhado na Etapa 2.
Pode ser necessário mais de um frasco de mistura concentrado-diluente para administrar a dose prescrita.
Etapa2: segunda diluição (final) para perfusão
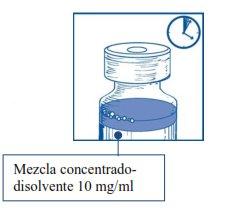
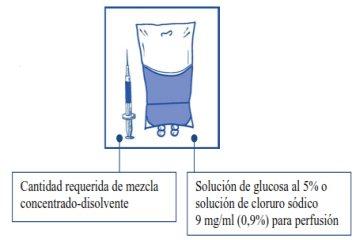
Etapa2.1 De forma asséptica, extrair a quantidade necessária de mistura concentrado-diluente (10 mg/ml de cabazitaxel), com uma seringa graduada provida de uma agulha fixa. Como exemplo, uma dose de 45 mg de JEVTANA requereria 4,5 ml da mistura de concentrado-diluente preparada na Etapa 1. Como pode haver espuma na parede do frasco desta solução, após a preparação descrita na Etapa 1, é preferível situar a agulha da seringa na metade do conteúdo durante a extração. |
|
Etapa 2.2 Injetar em um envase estéril sem PVC de solução de glicose a 5% ou solução de cloreto de sódio 9 mg/ml (0,9%) para perfusão. A concentração da solução para perfusão deve estar entre 0,10 mg/ml e 0,26 mg/ml. |
|
Etapa 2.3 Retirar a seringa e misturar o conteúdo da bolsa ou botella de perfusão manualmente, mediante movimento de balanço. |
|
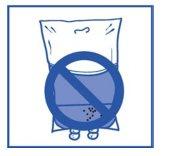
Etapa 2.4 Assim como todos os produtos parenterais, a solução de perfusão resultante deve ser inspecionada visualmente antes de usar. Como a solução de perfusão está sobressaturada, pode cristalizar com o tempo. Neste caso, não se deve usar a solução e deve ser eliminada. |
|
A solução para perfusão deve ser usada imediatamente. No entanto, o tempo de conservação em uso pode ser mais longo sob as condições específicas mencionadas na seção Período de validade e precauções especiais de conservação.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
Método de administração
JEVTANA é administrado em perfusão durante 1 hora.
Recomenda-se o uso de um filtro em linha de 0,22 micrómetros de tamanho de poro nominal (também denominado 0,2 micrómetros) durante a administração.
Não devem ser usados envases de perfusão de PVC ou conjuntos de perfusão de poliuretano para a preparação e administração da solução para perfusão.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a JEVTANA 60 mg Concentrado e Solvente para Solução para PerfusãoForma farmacêutica: PERFURAÇÃO INJETÁVEL, 20 mg/mlSubstância ativa: cabazitaxelFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 20 mgSubstância ativa: cabazitaxelFabricante: Eugia Pharma (Malta) LimitedRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 60 mgSubstância ativa: cabazitaxelFabricante: Reddy Pharma Iberia S.A.Requer receita médica
Alternativas a JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão em Polónia
Alternativa a JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão em Ukraine
Médicos online para JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de JEVTANA 60 mg Concentrado e Solvente para Solução para Perfusão – sujeita a avaliação médica e regras locais.