

HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE

Pergunte a um médico sobre a prescrição de HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE

Como usar HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE
Introdução
Prospecto: Informação para o utilizador
Hemosol B0 solução para hemodiálise e hemofiltrção
Cloruro de sódio/cloruro de cálcio dihidratado/cloruro de magnésio hexahidratado/ácido láctico/bicarbonato de sódio.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos não mencionados neste prospecto. Ver secção 4.
Neste prospecto:
- O que é Hemosol B0 e para que é utilizado
- O que precisa saber antes de começar a usar Hemosol B0
- Como usar Hemosol B0
- Possíveis efeitos adversos
- Conservação de Hemosol B0
- Conteúdo do envase e informação adicional
1. O que é Hemosol B0 e para que é utilizado
Hemosol B0 é utilizado em hospitais em tratamentos de cuidados intensivos para corrigir o desequilíbrio químico do sangue provocado pela insuficiência renal. O objetivo dos tratamentos é eliminar do sangue os produtos de resíduo que se acumulam quando os rins não funcionam bem.
Hemosol B0 é usado nestes tipos de tratamento para adultos e crianças de todas as idades:
- hemofiltrção,
- hemodiafiltração e
- hemodiálise.
2. Antes de usar Hemosol B0
Não use Hemosol B0:
Se é alérgico a um dos princípios ativos ou a algum dos outros componentes (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Hemosol B0.
Hemosol B0 é um produto de uso hospitalar que só deve ser administrado por profissionais médicos. Estes assegurarão que o medicamento seja utilizado de forma segura.
O estado do sangue será verificado antes e durante o tratamento. Será controlado, por exemplo, o equilíbrio ácido-básico e a concentração de sais no sangue (electrolitos), incluindo todas as entradas (perfusão intravenosa) e saídas (diurese) de líquidos, mesmo as que não estejam relacionadas diretamente com o tratamento.
Como Hemosol B0 não contém potássio, é necessário prestar especial atenção aos níveis de potássio no sangue. Se os níveis forem baixos, pode ser necessário administrar um suplemento potássico.
Crianças
Não existem advertências nem precauções específicas para as crianças derivadas do uso deste medicamento.
Uso de Hemosol B0 com outros medicamentos
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Deve fazê-lo porque os níveis de concentração no sangue de alguns medicamentos podem reduzir-se durante o tratamento com Hemosol B0. O seu médico decidirá se é necessário alterar algum dos medicamentos que toma.
Em concreto, fale com o seu médico se tomar algum destes medicamentos:
- Medicamentos digitálicos (para o tratamento de algumas insuficiências cardíacas) pois o risco de arritmias cardíacas induzidas por estes medicamentos aumenta quando os níveis de concentração de potássio no sangue são baixos (hipopotasemia).
- Vitamina D e medicamentos que contenham cálcio pois podem aumentar o risco de concentração alta de cálcio no sangue (hipercalcemia).
- Qualquer suplemento de solução de bicarbonato de sódio (ou outra fonte tamponada) pois pode incrementar o risco de composto básico no sangue (alcalose metabólica).
Quando se usa citrato como anticoagulante, pode reduzir os níveis de cálcio no plasma.
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento. Não se prevêem efeitos na fertilidade, na gravidez nem nos recém-nascidos/bebês lactantes. O seu médico decidirá se se lhe deve administrar Hemosol B0 em caso de estar grávida ou em período de lactação.
Condução e uso de máquinas
Hemosol B0 não afeta a capacidade para conduzir veículos ou manejar maquinaria.
3. Como usar Hemosol B0
Hemosol B0 é um produto que só deve ser administrado por profissionais médicos.
O volume de Hemosol B0 e, por conseguinte, a dose empregada, dependerá das suas condições. O volume da dose será determinado pelo médico responsável pelo tratamento.
Hemosol B0 pode ser administrado directamente no torrente sanguíneo (por via intravenosa) ou mediante hemodiálise, uma técnica em que a solução flui de um lado da membrana de diálise enquanto o sangue o faz pelo outro.
Se usar mais Hemosol B0 do que deve
Hemosol B0 é um produto de uso hospitalar que só deve ser administrado por profissionais médicos. Além disso, é realizado um controlo exhaustivo do balanço hídrico, equilíbrio electrolítico e ácido-básico.
Por conseguinte, é improvável que use mais Hemosol B0 do que deve.
No caso improvável de que lhe seja administrada uma sobredose, o médico adoptará as medidas correctivas necessárias e ajustará a dose.
A sobredose pode derivar em:
- sobrecarga de líquidos no sangue,
- elevação do nível de bicarbonato no sangue (alcalose metabólica),
- e/ou redução dos níveis de sais no sangue (hipofosfatemia, hipopotasemia).
Para consultar as instruções de uso, ver secção “Esta informação está destinada unicamente a profissionais do sector sanitário”.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Foram notificados os seguintes efeitos adversos:
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis)
- Variações nos níveis de sais no sangue (desequilíbrios electrolíticos, como, por exemplo, hipofosfatemia, hipopotasemia).
- Aumento da concentração de bicarbonato no plasma (alcalose metabólica) ou redução da concentração de bicarbonato no plasma (acidose metabólica).
- Volume de água no corpo anormalmente elevado ou reduzido (hiper ou hipovolemia).
- Náuseas.
- Vómitos.
- Cãibras musculares,
- Pressão sanguínea baixa (hipotensão).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es.
Ao comunicar efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Hemosol B0
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na parte posterior da bolsa e na etiqueta após CAD. A data de validade é o último dia do mês que se indica.
Não conserve a temperaturas inferiores a 4°C.
Foi demonstrada a estabilidade física e química da solução reconstituída durante 24 horas mantida a 22°C. Desde um ponto de vista microbiológico, a solução reconstituída deve ser utilizada imediatamente. O uso da solução armazenada em outras condições e com outros tempos é responsabilidade do utilizador e não deve ser superior a 24 horas, incluindo a duração do tratamento.
Os medicamentos não devem ser deitados fora pelos desagües nem para a lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Deste modo, ajudará a proteger o meio ambiente.
6. Informação adicional
HEMOSOL B0 – PVC COM CONECTOR LUER E VÁLVULA
Composição de Hemosol B0
Os princípios ativos antes e após a reconstituição são:
Princípios ativos antes da reconstituição:
1000 ml de solução do compartimento pequeno (A)contêm:
Cloruro de cálcio, 2H2O 5,145 g
Cloruro de magnésio, 6 H2O 2,033 g
Ácido láctico 5,4 g
1000 ml de solução do compartimento grande (B)contêm:
Bicarbonato de sódio 3,09 g
Cloruro de sódio 6,45 g
Princípios ativos após a reconstituição:
As soluções dos compartimentos A (250 ml) e B (4750 ml) se misturam para produzir uma solução reconstituída (5000 ml) com a seguinte composição:
mmol/l
Cálcio, Ca2+ 1,75
Magnésio, Mg2+ 0,5
Sódio, Na+ 140
Cloruro Cl- 109,5
Lactato 3
Bicarbonato, HCO3- 32
Osmolaridade teórica: 287 mOsm/l
Os demais componentes são:dióxido de carbono (E-290) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Hemosol B0 é apresentado em uma bolsa de dois compartimentos. A bolsa está recoberta por um envoltório transparente.
A solução final reconstituída é obtida após quebrar o vástago quebrável e misturar ambas as soluções.
A solução reconstituída é transparente e incolor. Cada bolsa (A+B) contém 5000 ml de solução para hemofiltração, hemodiafiltrção e/ou hemodiálise.
Cada caixa contém duas bolsas e um prospecto.
Título da autorização de comercialização:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.P.A.
Via Stelvio 94,
23035 Sondalo (SO),
Itália
ou
Vantive Manufacturing Limited
Moneen Road,
Castlebar, Co. Mayo F23 XR63
Irlanda
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Vantive Health, S.L.
Polígono industrial setor 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valência
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Bulgária, Croácia, Chipre, Dinamarca, Eslováquia, Eslovênia, Espanha, Estônia, Finlândia, França, Grécia, Islândia, Irlanda, Letônia, Lituânia, Luxemburgo, Malta, Noruega, Países Baixos, Polônia, Portugal, Reino Unido (Irlanda do Norte), República Checa e Suécia: Hemosol B0.
Data da última revisão deste prospecto: 11/2018
__________________________________________________________________________
Esta informação está destinada apenas a profissionais do setor sanitário
Hemosol B0 solução para hemodiálise e hemofiltrção
Precauções
Deve seguir com exatidão as instruções de uso e manipulação de Hemosol B0.
As soluções dos dois compartimentos devemser misturadas antes de usá-las.O uso de uma solução de hemofiltrção contaminada pode produzir sepse, choque e distúrbios mortais.
Para aumentar a comodidade do paciente, pode-se aquecer Hemosol B0 até atingir os 37°C. O aquecimento prévio ao uso da solução deve ser realizado antes da reconstituição utilizando apenas calor seco. As soluções não devem ser aquecidas em água nem em um forno micro-ondas. Antes da administração e sempre que a solução e o recipiente o permitam, deve-se verificar visualmente que a solução não contenha partículas nem tenha perdido a cor original. Não administre a solução a menos que esta seja transparente e o precinto esteja intacto.
A adição de bicarbonato de sódio de substituição pode aumentar o risco de alcalose metabólica.
Antes e durante o tratamento, deve-se controlar cuidadosamente o equilíbrio eletrolítico e ácido-básico. Como Hemosol B0 não contém potássio, deve-se controlar a concentração de potássio no soro antes e após a hemofiltrção e/ou hemodiálise. Pode ser necessária a adição de potássio.
Pode-se adicionar até 1,2 mmol/l de fosfato à solução. Se for adicionado fosfato potássico, a concentração de potássio total não deve superar os 4 mEq/l (4 mmol/l).
O volume e a velocidade com que se usa Hemosol B0 dependerão da concentração de eletrólitos no sangue, do equilíbrio ácido-básico e do estado clínico geral do paciente. A posologia (dose, velocidade de perfusão e volume acumulado) de Hemosol B0 deve ser determinada por um médico. A aplicação contínua de hemofiltrção eliminará o excesso de líquidos e eletrólitos.
Em caso de desequilíbrio hídrico, deve-se controlar estreitamente a situação clínica e corrigir o equilíbrio de líquidos conforme necessário.
A sobredose dará como resultado sobrecarga de líquidos em pacientes com insuficiência renal, o que poderia ter consequências muito graves, como, por exemplo, insuficiência cardíaca congestiva ou alterações do equilíbrio ácido-básico ou eletrolítico.
A solução não contém glicose, por isso sua administração pode provocar hipoglicemia. Os níveis de glicose no sangue devem ser supervisionados regularmente.
Hemosol B0 contém bicarbonato e lactato (um precursor do bicarbonato), que podem afetar o equilíbrio ácido-básico do paciente. Se durante o tratamento com a solução aparecer alcalose metabólica ou esta piorar, pode ser necessário reduzir a velocidade de perfusão ou suspender a administração.
Posologia
As velocidades de fluxo comumente utilizadas para a solução de substituição em hemofiltrção e hemodiafiltrção são:
Adultos: 500–3.000 ml/hora
As velocidades de fluxo comumente utilizadas para a solução de diálise (dializado) em hemodiálise contínua são:
Adultos: 500–2.500 ml/hora
As velocidades de fluxo comumente utilizadas em adultos são de entre 2.000 e 2.500 ml/h aproximadamente, o que corresponde a um volume de líquido diário aproximado de entre 48 e 60 L.
População pediátrica
O intervalo de velocidade de fluxo para a solução de substituição em hemofiltrção e hemodiafiltrção e para a solução de diálise (dializado) em hemodiálise contínua é:
Crianças (desde neonatos até adolescentes de até 18 anos): de 1.000 a 2.000 ml/h/1,73 m2.
Podem ser necessárias velocidades de fluxo até 4.000 ml/h/1,73 m2, especialmente em crianças de menor idade (≤ 10 kg). Em geral, a velocidade de fluxo absoluta (em ml/h) na população pediátrica não deve superar a velocidade de fluxo máxima para adultos.
Instruções de uso e manipulação
A solução de eletrólitos (compartimento A pequeno) é adicionada à solução tampão (compartimento B grande) após quebrar o vástago quebrável imediatamente antes de usá-la para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve-se empregar uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Use a solução se o envoltório não estiver danificado, todos os precintos estiverem intactos, o vástago quebrável não estiver quebrado e a solução for transparente. Aperte a bolsa para garantir que não haja vazamentos. Se for descoberto algum vazamento, descarte a solução imediatamente, pois não se pode garantir sua esterilidade.
O compartimento grande B tem um puerto de injeção para adicionar outros medicamentos que sejam necessários uma vez reconstituída a solução.
É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado à solução de Hemosol B0. Para isso, deve-se verificar possíveis alterações de cor e/ou uma possível precipitação, complexos insolúveis ou cristais. Antes de adicionar um medicamento, verificar se é solúvel e estável em água dentro dos limites de pH do Hemosol B0 (o intervalo de pH da solução reconstituída é de 7,0 a 8,5). Os aditivos podem não ser compatíveis. Devem-se consultar as instruções de uso do medicamento que será adicionado.
Elimine qualquer líquido do puerto de injeção, segure a bolsa em posição vertical para baixo, adicione o medicamento através do puerto de injeção e misture completamente. A solução deve ser administrada imediatamente. A introdução e o mistura dos aditivos sempre devem ser realizados antes de conectar a bolsa da solução ao circuito extracorpóreo.
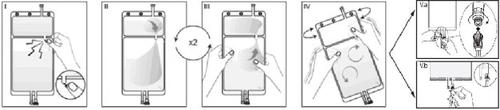
IRetire o envoltório da bolsa imediatamente antes de usá-la e descarte os demais materiais de embalagem. Abra o selo quebrando o vástago situado entre os dois compartimentos da bolsa. O vástago ficará dentro da bolsa (veja a figura I, a seguir).
IICertifique-se de que todo o líquido do compartimento pequeno A passe para o compartimento grande B (veja a figura II, a seguir).
IIIClarifique duas vezeso compartimento pequeno A levando a solução misturada de volta a este compartimento e de novo ao compartimento grande B (veja a figura III, a seguir).
IVUma vez esvaziado o compartimento pequeno A, agite o compartimento grande B para que se misture completamente seu conteúdo. A solução já está pronta para uso e a bolsa pode ser pendurada no equipamento (veja a figura IV, a seguir).
VA linha de diálise ou de substituição pode ser conectada a qualquer um dos dois portos de acesso.
V.aSe for utilizado o conector luer, retire a tampa mediante um movimento de giro e extração e conecte o conector luer macho da linha de diálise ou substituição no receptor luer fêmea da bolsa mediante um movimento de empurrar e giro. Certifique-se de que a conexão está bem feita e apertada. A conexão se abrirá. Verifique se o líquido circula livremente (veja a figura V.a, a seguir).
Se a linha de diálise ou substituição for desconectada do conector luer, o conector se fechará e o fluxo da solução se deterá. O puerto luer é um puerto sem agulha que pode ser limpo.
V.bSe for utilizado o puerto de injeção, retire primeiro a tampa levantando-a. O puerto de injeção é um puerto que pode ser desinfetado com torunda. Introduza depois o espigão através da parede de borracha. Verifique se o líquido circula livremente (veja a figura V.b, a seguir)
A solução deve ser usada imediatamente após retirar o envoltório. Se não for usada imediatamente, a solução reconstituída deve ser usada dentro de 24 horas após a adição da solução de eletrólitos à solução tampão, incluindo a duração do tratamento.
A solução reconstituída é de uso único. Descarte a solução sobrante imediatamente após o uso.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
----------------------------------------------------------------------------------------------------------------------
HEMOSOL B0 – PVC COM CONECTOR LUER E VÁSTAGO ROMPÍVEL
Composição de Hemosol B0
Os princípios ativos antes e após a reconstituição são:
Princípios ativos antes da reconstituição:
1000 ml de solução do compartimento pequeno (A)contêm:
Cloruro de cálcio, 2H2O 5,145 g
Cloruro de magnésio, 6 H2O 2,033 g
Ácido láctico 5,4 g
1000 ml de solução do compartimento grande (B)contêm:
Bicarbonato de sódio 3,09 g
Cloruro de sódio 6,45 g
Princípios ativos após a reconstituição:
As soluções dos compartimentos A (250 ml) e B (4750 ml) se misturam para produzir uma solução reconstituída (5000 ml) com a seguinte composição:
mmol/l
Cálcio, Ca2+ 1,75
Magnésio, Mg2+ 0,5
Sódio, Na+ 140
Cloruro Cl- 109,5
Lactato 3
Bicarbonato, HCO3- 32
Osmolaridade teórica: 287 mOsm/l
Os demais componentes são:dióxido de carbono (E-290) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Hemosol B0 é apresentado em uma bolsa de dois compartimentos. A bolsa está recoberta por um envoltório transparente.
A solução final reconstituída é obtida após quebrar o vástago quebrável e misturar ambas as soluções.
A solução reconstituída é transparente e incolor. Cada bolsa (A+B) contém 5000 ml de solução para hemofiltrção, hemodiafiltrção e/ou hemodiálise.
Cada caixa contém duas bolsas e um prospecto.
Título da autorização de comercialização:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.P.A.
Via Stelvio 94,
23035 Sondalo (SO),
Itália
ou
Vantive Manufacturing Limited
Moneen Road,
Castlebar, Co. Mayo F23 XR63
Irlanda
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Vantive Health, S.L.
Polígono industrial setor 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valência
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Bulgária, Croácia, Chipre, Dinamarca, Eslováquia, Eslovênia, Espanha, Estônia, Finlândia, França, Grécia, Islândia, Irlanda, Letônia, Lituânia, Luxemburgo, Malta, Noruega, Países Baixos, Polônia, Portugal, Reino Unido (Irlanda do Norte), República Checa e Suécia: Hemosol B0.
Data da última revisão deste prospecto: 11/2018
__________________________________________________________________________
Esta informação está destinada apenas a profissionais do setor sanitário
Hemosol B0 solução para hemodiálise e hemofiltrção
Precauções
Deve seguir com exatidão as instruções de uso e manipulação de Hemosol B0.
As soluções dos dois compartimentos devemser misturadas antes de usá-las.O uso de uma solução de hemofiltrção contaminada pode produzir sepse, choque e distúrbios mortais.
Para aumentar a comodidade do paciente, pode-se aquecer Hemosol B0 até atingir os 37°C. O aquecimento prévio ao uso da solução deve ser realizado antes da reconstituição utilizando apenas calor seco. As soluções não devem ser aquecidas em água nem em um forno micro-ondas. Antes da administração e sempre que a solução e o recipiente o permitam, deve-se verificar visualmente que a solução não contenha partículas nem tenha perdido a cor original. Não administre a solução a menos que esta seja transparente e o precinto esteja intacto.
A adição de bicarbonato de sódio de substituição pode aumentar o risco de alcalose metabólica.
Antes e durante o tratamento, deve-se controlar cuidadosamente o equilíbrio eletrolítico e ácido-básico. Como Hemosol B0 não contém potássio, deve-se controlar a concentração de potássio no soro antes e após a hemofiltrção e/ou hemodiálise. Pode ser necessária a adição de potássio.
Pode-se adicionar até 1,2 mmol/l de fosfato à solução. Se for adicionado fosfato potássico, a concentração de potássio total não deve superar os 4 mEq/l (4 mmol/l).
O volume e a velocidade com que se usa Hemosol B0 dependerão da concentração de eletrólitos no sangue, do equilíbrio ácido-básico e do estado clínico geral do paciente. A posologia (dose, velocidade de perfusão e volume acumulado) de Hemosol B0 deve ser determinada por um médico. A aplicação contínua de hemofiltrção eliminará o excesso de líquidos e eletrólitos.
Em caso de desequilíbrio hídrico, deve-se controlar estreitamente a situação clínica e corrigir o equilíbrio de líquidos conforme necessário.
A sobredose dará como resultado sobrecarga de líquidos em pacientes com insuficiência renal, o que poderia ter consequências muito graves, como, por exemplo, insuficiência cardíaca congestiva ou alterações do equilíbrio ácido-básico ou eletrolítico.
A solução não contém glicose, por isso sua administração pode provocar hipoglicemia. Os níveis de glicose no sangue devem ser supervisionados regularmente.
Hemosol B0 contém bicarbonato e lactato (um precursor do bicarbonato), que podem afetar o equilíbrio ácido-básico do paciente. Se durante o tratamento com a solução aparecer alcalose metabólica ou esta piorar, pode ser necessário reduzir a velocidade de perfusão ou suspender a administração.
Posologia
As velocidades de fluxo comumente utilizadas para a solução de substituição em hemofiltrção e hemodiafiltrção são:
Adultos: 500–3.000 ml/hora
As velocidades de fluxo comumente utilizadas para a solução de diálise (dializado) em hemodiálise contínua são:
Adultos: 500–2.500 ml/hora
As velocidades de fluxo comumente utilizadas em adultos são de entre 2.000 e 2.500 ml/h aproximadamente, o que corresponde a um volume de líquido diário aproximado de entre 48 e 60 L.
População pediátrica
O intervalo de velocidade de fluxo para a solução de substituição em hemofiltrção e hemodiafiltrção e para a solução de diálise (dializado) em hemodiálise contínua é:
Crianças (desde neonatos até adolescentes de até 18 anos): de 1.000 a 2.000 ml/h/1,73 m2.
Podem ser necessárias velocidades de fluxo até 4.000 ml/h/1,73 m2, especialmente em crianças de menor idade (≤ 10 kg). Em geral, a velocidade de fluxo absoluta (em ml/h) na população pediátrica não deve superar a velocidade de fluxo máxima para adultos.
Instruções de uso e manipulação
A solução de eletrólitos (compartimento A pequeno) é adicionada à solução tampão (compartimento B grande) após quebrar o vástago quebrável imediatamente antes de usá-la para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve-se empregar uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Use a solução se o envoltório não estiver danificado, todos os precintos estiverem intactos, o vástago quebrável não estiver quebrado e a solução for transparente. Aperte a bolsa para garantir que não haja vazamentos. Se for descoberto algum vazamento, descarte a solução imediatamente, pois não se pode garantir sua esterilidade.
O compartimento grande B tem um puerto de injeção para adicionar outros medicamentos que sejam necessários uma vez reconstituída a solução.
É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado à solução de Hemosol B0. Para isso, deve-se verificar possíveis alterações de cor e/ou uma possível precipitação, complexos insolúveis ou cristais. Antes de adicionar um medicamento, verificar se é solúvel e estável em água dentro dos limites de pH do Hemosol B0 (o intervalo de pH da solução reconstituída é de 7,0 a 8,5). Os aditivos podem não ser compatíveis. Devem-se consultar as instruções de uso do medicamento que será adicionado.
Elimine qualquer líquido do puerto de injeção, segure a bolsa em posição vertical para baixo, adicione o medicamento através do puerto de injeção e misture completamente. A solução deve ser administrada imediatamente. A introdução e o mistura dos aditivos sempre devem ser realizados antes de conectar a bolsa da solução ao circuito extracorpóreo.
IRetire o envoltório da bolsa imediatamente antes de usá-la e descarte os demais materiais de embalagem. Abra o selo quebrando o vástago situado entre os dois compartimentos da bolsa. O vástago ficará dentro da bolsa (veja a figura I, a seguir).
IICertifique-se de que todo o líquido do compartimento pequeno A passe para o compartimento grande B (veja a figura II, a seguir).
IIIClarifique duas vezeso compartimento pequeno A levando a solução misturada de volta a este compartimento e de novo ao compartimento grande B (veja a figura III, a seguir).
IVUma vez esvaziado o compartimento pequeno A, agite o compartimento grande B para que se misture completamente seu conteúdo. A solução já está pronta para uso e a bolsa pode ser pendurada no equipamento (veja a figura IV, a seguir).
VA linha de diálise ou de substituição pode ser conectada a qualquer um dos dois portos de acesso.
V.aSe for utilizado o conector luer, retire a tampa mediante um movimento de giro e extração e conecte o conector luer macho da linha de diálise ou substituição no receptor luer fêmea da bolsa mediante um movimento de empurrar e giro. Certifique-se de que a conexão está bem feita e apertada. A conexão se abrirá. Verifique se o líquido circula livremente (veja a figura V.a, a seguir).
Se a linha de diálise ou substituição for desconectada do conector luer, o conector se fechará e o fluxo da solução se deterá. O puerto luer é um puerto sem agulha que pode ser limpo.
V.bSe for utilizado o puerto de injeção, retire primeiro a tampa levantando-a. O puerto de injeção é um puerto que pode ser desinfetado com torunda. Introduza depois o espigão através da parede de borracha. Verifique se o líquido circula livremente (veja a figura V.b, a seguir)
A solução deve ser usada imediatamente após retirar o envoltório. Se não for usada imediatamente, a solução reconstituída deve ser usada dentro de 24 horas após a adição da solução de eletrólitos à solução tampão, incluindo a duração do tratamento.
A solução reconstituída é de uso único. Descarte a solução sobrante imediatamente após o uso.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.

esterilidade.
O compartimento grande B tem um porto de injeção para adicionar outros fármacos que sejam necessários uma vez reconstituída a solução.
É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado à solução de Hemosol B0. Para isso, deverá verificar possíveis alterações de cor e/ou uma possível precipitação, complexos insolúveis ou cristais.
Antes de adicionar um medicamento, verificar se é solúvel e estável em água dentro dos limites de pH do Hemosol B0 (a faixa de pH da solução reconstituída é de 7,0 a 8,5). Os aditivos podem não ser compatíveis. Devem ser consultadas as instruções de uso do medicamento que se vai adicionar.
Elimine qualquer líquido do porto de injeção, segure a bolsa em posição vertical para baixo, adicione o fármaco através do porto de injeção e misture completamente. A solução deve ser administrada imediatamente. A introdução e a mistura dos aditivos sempre devem ser realizadas antes de conectar a bolsa da solução ao circuito extracorpóreo.
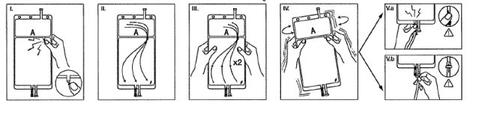
IRetire o envoltório da bolsa imediatamente antes de usá-la e descarte os demais materiais de embalagem. Abra o lacre rompendo o vástago rompível situado entre os dois compartimentos da bolsa. O vástago permanecerá dentro da bolsa (ver a figura I, a seguir).
IICertifique-se de que todo o líquido do compartimento pequeno A passe para o compartimento grande B (ver a figura II, a seguir).
IIIClarifique duas vezeso compartimento pequeno A forçando a solução misturada a voltar a este compartimento e, em seguida, outra vez ao compartimento grande B (ver a figura III, a seguir).
IVUma vez esvaziado o compartimento pequeno A, agite o compartimento grande B para que se misture completamente o seu conteúdo. A solução já está preparada para uso e a bolsa pode ser pendurada no equipamento (ver a figura IV, a seguir).
VA linha de líquido de diálise ou de substituição pode ser conectada a qualquer um dos dois portos de acesso.
V.aSe for utilizado o acesso luer, retire o tampão e conecte o conector luer macho da linha de líquido de diálise ou substituição no receptor luer fêmea da bolsa; faça-o firmemente. Rompa com os dedos o vástago rompível de cor por sua base e mova-o para a frente e para trás. Não utilize ferramentas. Verifique se o vástago está completamente separado e se o líquido circula livremente. O vástago permanecerá no porto luer durante o tratamento (ver a figura V.a, a seguir)
V.bSe for utilizado o porto de injeção, retire primeiro o tampão levantando-o. O porto de injeção é um porto que pode ser desinfetado com torunda. Introduza, em seguida, o espigão através da parede de borracha. Verifique se o líquido circula livremente (ver a figura V.b, a seguir)
A solução deve ser usada imediatamente após retirar o envoltório. Se não for usada imediatamente, a solução reconstituída deve ser usada dentro de 24 horas subsequentes, incluindo a duração do tratamento, após a adição da solução de eletrólitos à solução tampão.
A solução reconstituída é de uso único. Descarte a solução sobrante imediatamente após o uso.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
-----------------------------------------------------------------------------------------------------------------------
HEMOSOL B0 – POLIOLEFINA COM CONECTOR LUER E VÁLVULA
Composição de Hemosol B0
Os princípios ativos antes e após a reconstituição são:
Princípios ativos antes da reconstituição:
1000 ml de solução do compartimento pequeno (A)contêm:
Cloreto de cálcio, 2H2O 5,145 g
Cloreto de magnésio, 6 H2O 2,033 g
Ácido láctico 5,4 g
1000 ml de solução do compartimento grande (B)contêm:
Bicarbonato de sódio 3,09 g
Cloreto de sódio 6,45 g
Princípios ativos após a reconstituição:
As soluções dos compartimentos A (250 ml) e B (4750 ml) são misturadas para produzir uma solução reconstituída (5000 ml) com a seguinte composição:
mmol/l
Cálcio, Ca2+ 1,75
Magnésio, Mg2+ 0,5
Sódio, Na+ 140
Cloreto Cl- 109,5
Lactato 3
Bicarbonato, HCO3- 32
Osmolaridade teórica: 287 mOsm/l
Os demais componentes são:dióxido de carbono (E-290) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Hemosol B0 é apresentado em uma bolsa de dois compartimentos. A bolsa está recoberta por um envoltório transparente.
A solução final reconstituída é obtida após romper o lacre despegável e misturar ambas as soluções.
A solução reconstituída é transparente e incolor. Cada bolsa (A+B) contém 5000 ml de solução para hemofiltración, hemodiafiltración e/ou hemodiálise.
Cada caixa contém duas bolsas e um prospecto.
Titular da autorização de comercialização:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.P.A.
Via Stelvio 94,
23035 Sondalo (SO),
Itália
ou
Vantive Manufacturing Limited
Moneen Road,
Castlebar, Co. Mayo F23 XR63
Irlanda
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Vantive Health, S.L.
Polígono industrial setor 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valência
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Bulgária, Croácia, Chipre, Dinamarca, Eslováquia, Eslovênia, Espanha, Estônia, Finlândia, França, Grécia, Islândia, Irlanda, Letônia, Lituânia, Luxemburgo, Malta, Noruega, Países Baixos, Polônia, Portugal, Reino Unido (Irlanda do Norte), República Checa e Suécia: Hemosol B0.
Data da última revisão deste prospecto: 11/2018
__________________________________________________________________________
Esta informação está destinada unicamente a profissionais do setor sanitário
Hemosol B0 solução para hemodiálise e hemofiltración
Precauções
Deve seguir com exatidão as instruções de uso e manipulação de Hemosol B0.
As soluções dos dois compartimentos devemser misturadas antes de serem usadas.O uso de uma solução de hemofiltración contaminada pode produzir sepsis, choque e distúrbios mortais.
Para aumentar a comodidade do paciente, pode-se aquecer Hemosol B0 até atingir os 37°C. O aquecimento prévio ao uso da solução deve ser realizado antes da reconstituição utilizando apenas calor seco. As soluções não devem ser aquecidas em água nem em um forno micro-ondas. Antes da administração e sempre que a solução e o recipiente o permitam, deve-se verificar visualmente que a solução não contenha partículas nem tenha perdido a cor original. Não administre a solução a menos que esta seja transparente e o lacre esteja intacto.
A adição de bicarbonato de sódio de substituição pode aumentar o risco de alcalose metabólica.
Antes e durante o tratamento, deve-se controlar cuidadosamente o equilíbrio eletrolítico e ácido-básico. Uma vez que Hemosol B0 não contém potássio, deve-se controlar a concentração de potássio no soro antes e após a hemofiltración e/ou hemodiálise. Pode ser necessária a adição de potássio.
Pode-se adicionar até 1,2 mmol/l de fosfato à solução. Se for adicionado fosfato potássico, a concentração de potássio total não deve superar os 4 mEq/l (4 mmol/l).
O volume e a velocidade com que se usa Hemosol B0 dependerão da concentração de eletrólitos no sangue, do equilíbrio ácido-base e do estado clínico geral. A posologia (dose, velocidade da perfusão e volume acumulado) de Hemosol B0 deve ser determinada por um médico. A aplicação contínua de hemofiltración eliminará o excesso de líquidos e eletrólitos.
Em caso de desequilíbrio hídrico, deve-se controlar estreitamente a situação clínica e corrigir o equilíbrio de líquidos conforme necessário.
A sobredose dará como resultado sobrecarga de líquidos em pacientes com insuficiência renal, o que poderia ter consequências muito graves, como, por exemplo, insuficiência cardíaca congestiva ou alterações do equilíbrio ácido-básico ou eletrolítico.
A solução não contém glicose, por isso sua administração pode provocar hipoglicemia. Os níveis de glicose no sangue devem ser supervisionados regularmente.
Hemosol B0 contém bicarbonato e lactato (um precursor do bicarbonato), que podem afetar o equilíbrio ácido-básico do paciente. Se durante o tratamento com a solução aparecer alcalose metabólica ou esta piorar, pode ser necessário reduzir a velocidade de perfusão ou suspender a administração.
Posologia
As velocidades de fluxo comumente utilizadas para a solução de substituição em hemofiltración e hemodiafiltración são:
Adultos: 500‑3.000 ml/hora
As velocidades de fluxo comumente utilizadas para a solução de diálise (dializado) em hemodiálise contínua são:
Adultos: 500‑2.500 ml/hora
As velocidades de fluxo comumente utilizadas em adultos são de entre 2.000 e 2.500 ml/h aproximadamente, o que corresponde a um volume de líquido diário aproximado de entre 48 e 60 L.
População pediátrica
O intervalo de velocidade de fluxo para a solução de substituição em hemofiltración e hemodiafiltración e para a solução de diálise (dializado) em hemodiálise contínua é:
Crianças (desde neonatos até adolescentes de até 18 anos): de 1.000 a 2.000 ml/h/1,73 m2.
Podem ser necessárias velocidades de fluxo até 4.000 ml/h/1,73 m2, especialmente nas crianças de menor idade (≤ 10 kg). Em geral, a velocidade de fluxo absoluta (em ml/h) na população pediátrica não deve superar a velocidade de fluxo máxima para adultos.
Instruções de emprego e manipulação
A solução de eletrólitos (compartimento A pequeno) é adicionada à solução tampão (compartimento B grande) após romper o lacre despegável imediatamente antes de usá-la para obter a solução reconstituída.
Utilizar apenas com equipamentos de substituição renal extracorpórea adequados.
Deve-se empregar uma técnica asséptica durante todo o processo de manipulação e administração ao paciente.
Use a solução se o envoltório não estiver danificado, todos os lacres estiverem intactos, o lacre despegável não estiver quebrado e a solução for transparente. Aperte a bolsa para se certificar de que não há vazamentos. Se for descoberto algum vazamento, descarte a solução imediatamente, pois não se pode garantir sua esterilidade.
O compartimento grande B tem um porto de injeção para adicionar outros fármacos que sejam necessários uma vez reconstituída a solução.
É responsabilidade do médico julgar a compatibilidade de um medicamento adicionado à solução de Hemosol B0. Para isso, deverá verificar possíveis alterações de cor e/ou uma possível precipitação, complexos insolúveis ou cristais.
Antes de adicionar um medicamento, verificar se é solúvel e estável em água dentro dos limites de pH do Hemosol B0 (a faixa de pH da solução reconstituída é de 7,0 a 8,5). Os aditivos podem não ser compatíveis. Devem ser consultadas as instruções de uso do medicamento que se vai adicionar.
Elimine qualquer líquido do porto de injeção, segure a bolsa em posição vertical para baixo, adicione o fármaco através do porto de injeção e misture completamente. A solução deve ser administrada imediatamente. A introdução e a mistura dos aditivos sempre devem ser realizadas antes de conectar a bolsa da solução ao circuito extracorpóreo.
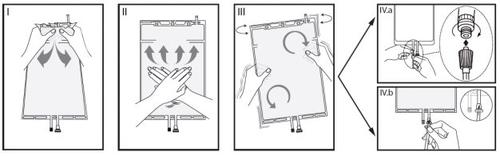
IRetire o envoltório da bolsa imediatamente antes de usá-la e descarte os demais materiais de embalagem. Abra o lacre segurando o compartimento pequeno entre as duas mãos e aperte até que se crie uma abertura no lacre despegável entre ambos os compartimentos (ver a figura I, a seguir).
IIPressione o compartimento grande com ambas as mãos até que o lacre despegável entre os dois compartimentos esteja totalmente aberto (ver a figura II, a seguir).
IIICertifique-se de que as soluções estejam completamente misturadas agitando a bolsa suavemente. A solução já está pronta para uso e a bolsa pode ser pendurada no equipamento (ver a figura III, a seguir).
IVA linha de diálise ou de substituição pode ser conectada a qualquer um dos dois portos de acesso.
IV.aSe for utilizado o conector luer, retire o tampão com um movimento de giro e extração e conecte o conector luer macho da linha de diálise ou substituição no receptor luer fêmea da bolsa mediante um movimento de empurrar e girar. Certifique-se de que a conexão está bem feita e apertada. O conector se abrirá. Verifique se o líquido circula livremente (ver a figura IV.a, a seguir).
Se a linha de diálise ou substituição for desconectada do conector luer, o conector se fechará e o fluxo da solução se deterá. O porto luer é um porto sem agulha que pode ser limpo.
IV.bSe for utilizado o porto de injeção, retire primeiro o tampão levantando-o. O porto de injeção é um porto que pode ser desinfetado com torunda. Introduza, em seguida, o espigão através da parede de borracha. Verifique se o líquido circula livremente (ver a figura IV.b, a seguir).
A solução deve ser usada imediatamente após retirar o envoltório. Se não for usada imediatamente, a solução reconstituída deve ser usada dentro de 24 horas subsequentes, incluindo a duração do tratamento, após a adição da solução de eletrólitos à solução tampão.
A solução reconstituída é de uso único. Descarte a solução sobrante imediatamente após o uso.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
- País de registo
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISEFabricante: Nikkiso BelgiumRequer receita médicaFabricante: Nikkiso BelgiumRequer receita médicaFabricante: Nikkiso BelgiumRequer receita médica
Alternativas a HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE em Polska
Alternativa a HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE em Ukraina
Médicos online para HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de HEMOSOL B0 SOLUÇÃO PARA HEMOFILTRAÇÃO E HEMODIÁLISE – sujeita a avaliação médica e regras locais.














