ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada


Como usar ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada
Introdução
Prospecto: informação para o utilizador
Astarté 0,25 mg/ 0,5 ml solução injetável em seringa precarregada EFG
ganirelix
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Astarté e para que é utilizado
- O que necessita de saber antes de começar a usar Astarté
- Como usar Astarté
- Possíveis efeitos adversos
- Conservação de Astarté
- Conteúdo do envase e informação adicional
1. O que é Astarté e para que é utilizado
Astarté contém o princípio ativo ganirelix e pertence a um grupo de medicamentos denominados “antagonistas da hormona liberadora de gonadotropinas” que actua contra a ação da hormona liberadora de gonadotropinas (GnRH) endógena. A GnRH regula a libertação de gonadotropinas (hormona luteinizante (LH) e hormona foliculoestimulante (FSH)). As gonadotropinas desempenham um papel importante na fertilidade e reprodução humanas. A FSH é necessária nas mulheres para o crescimento e desenvolvimento dos folículos nos ovários. Os folículos são pequenas vesículas redondas que contêm os ovos. A LH é necessária para que os ovos maduros sejam libertados dos folículos dos ovários (ou seja, a ovulação). Este medicamento inibe a ação da GnRH, o que causa a supressão da libertação especialmente da LH.
Para que é utilizado ganirelix
Nas mulheres em tratamento com técnicas de reprodução assistida, como a fecundação in vitro(FIV) e outros métodos, ocasionalmente pode produzir-se a ovulação prematura, o que causa uma redução significativa da probabilidade de engravidar. Este medicamento é utilizado para prevenir a libertação prematura de LH, que pode causar uma ovulação prematura.
Nos estudos clínicos, ganirelix foi utilizado com hormona foliculoestimulante (FSH) recombinante ou com corifolitropina alfa, um estimulante folicular de ação prolongada.
2. O que necessita de saber antes de começar a usar Astarté
Não use Astarté
- se é alérgico a ganirelix ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se é hipersensível à hormona liberadora de gonadotropinas (GnRH) ou aos seus análogos;
- se padece uma doença moderada ou grave do rim ou do fígado;
- se está grávida ou em período de amamentação.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar este medicamento
- se tem uma alergia ativa, comunique-o ao seu médico. O seu médico decidirá dependendo da gravidade se são necessários controles adicionais durante o tratamento. Foram observados casos de reações alérgicas, mesmo após a primeira dose.
- foram notificadas reações alérgicas, tanto generalizadas como locais, incluindo habões (urticária), inchaço da face, lábios, língua e/ou garganta que podem provocar dificuldade para respirar e/ou engolir (angioedema e/ou anafilaxia) (Ver também secção 4). Se tiver uma reação alérgica, pare de usar este medicamento e procure assistência médica imediatamente.
- durante ou após a estimulação hormonal dos ovários pode desenvolver-se o síndrome de hiperestimulação ovárica. Este síndrome está relacionado com o procedimento de estimulação com gonadotropinas. Recomendamos que leia o prospecto do medicamento com gonadotropina que lhe foi prescrito.
- a incidência de malformações congénitas (defeitos de nascimento) após o uso de técnicas de reprodução assistida pode ser ligeiramente superior do que após concepções espontâneas. Considera-se que esta incidência ligeiramente superior está relacionada com as características dos pacientes que seguem tratamentos de fertilidade (por exemplo, idade da mulher, características do sêmen) e com a maior incidência de gravidezes múltiplas (gravidez com mais de um bebê de cada vez) registada após o uso de técnicas de reprodução assistida. A incidência de defeitos de nascimento após o uso de técnicas de reprodução assistida com este medicamento não é diferente da incidência com o uso de outros análogos da GnRH, em técnicas de reprodução assistida.
- existe um ligeiro aumento do risco de uma gravidez fora do útero (uma gravidez ectópica) em mulheres com as trompas de Falópio danificadas.
- não foi estabelecida a eficácia e segurança deste medicamento em mulheres que pesam menos de 50 kg ou mais de 90 kg. Consulte o seu médico para mais informações.
Crianças e adolescentes
Não é apropriado o uso deste medicamento em crianças ou adolescentes
Outros medicamentos e Astarté
Informa ao seu médico ou farmacêutico se está a usar, usou recentemente ou pode ter que usar qualquer outro medicamento.
Gravidez, amamentaçãoe fertilidade
Se está grávida ou em período de amamentação, acha que pode estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de usar este medicamento.
Este medicamento deve ser usado durante a estimulação ovárica controlada para técnicas de reprodução assistida (TRA).
Não use este medicamento durante a gravidez e a amamentação.
Condução e uso de máquinas
Não foram estudados os efeitos sobre a capacidade para conduzir e utilizar máquinas.
Este medicamento contém sódio
Este medicamento contém menos de 1mmol de sódio (23 mg) por injeção; isto é, é essencialmente "isento de sódio".
3. Como usar Astarté
Este medicamento é usado como parte do tratamento nas técnicas de reprodução assistida (TRA), incluindo a fecundação in vitro(FIV).
Si mesmo se administrará as injeções, por isso, o seu médico deve explicar-lhe como fazer. Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
Fase 1
A estimulação ovárica com hormona foliculoestimulante (FSH) ou com corifolitropina pode começar no segundo ou terceiro dia da sua menstruação.
Fase 2
Deve ser injetado o conteúdo da seringa deste medicamento (0,25 mg) uma vez ao dia, justo abaixo da pele, começando no quinto ou sexto dia da estimulação. De acordo com a sua resposta ovárica, o seu médico pode decidir começar outro dia.
Este medicamento e a FSH devem ser administrados aproximadamente ao mesmo tempo. No entanto, estes medicamentos não devem ser misturados e devem ser injetados em locais diferentes.
O tratamento diário com este medicamento deve continuar até que existam folículos de tamanho adequado.
Fase 3
A maturação final dos ovos nos folículos pode ser induzida administrando gonadotropina coriónica humana (hCG). O tempo decorrido entre duas injeções deste medicamento e entre a última injeção deste medicamento e a injeção de hCG não deve exceder as 30 horas, caso contrário, pode apresentar-se uma ovulação prematura (ou seja, libertação dos ovos). Por isso, se a injeção deeste medicamentofor de manhã, o tratamento com este medicamento deve ser mantido durante todo o período de tratamento com gonadotropina, incluindo o dia em que se induz a ovulação. Se a injeção deeste medicamentofor de tarde, a última injeção de este medicamento deve ser administrada à tarde do dia anterior ao dia em que se induz a ovulação.
Instruções de uso
- Local da injeção
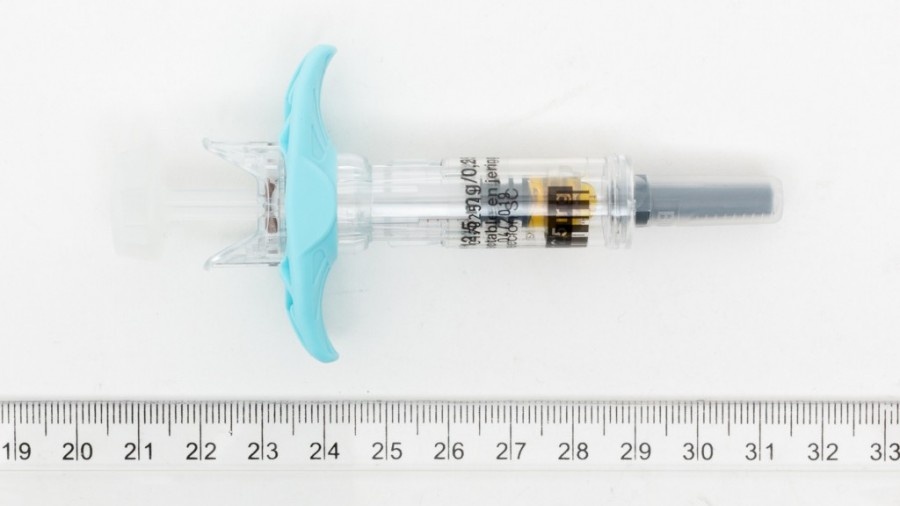
Este medicamento é apresentado em seringas precarregadas que contêm uma dose. O conteúdo da seringa deve ser injetado lentamente, justo abaixo da pele, preferencialmente na coxa. Verifique a solução antes de usar. Não use a solução se contém partículas ou não é transparente. Pode notar bolha(s) de ar na seringa precarregada. Que ocorra isso é de esperar e não é necessário eliminar a(s) bolha(s) de ar. Se administrar as injeções si mesmo ou sua parceira, siga cuidadosamente as instruções que aparecem a seguir. Não misture este medicamento com outros medicamentos.
- Preparação do local da injeção
Lave as mãos minuciosamente com água e sabão. O local da injeção deve ser limpo com um desinfetante (por exemplo, álcool) para eliminar as bactérias da superfície. Limpe uns 5 cm ao redor do ponto onde se picará e deixe secar o desinfetante pelo menos durante um minuto antes de injetar.
- Inserção da agulha
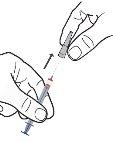
- Pegue 1 seringa do envase, agarrando-a pelo corpo. Não pegue a seringa pelo êmbolo.
- Mantenha a seringa em posição verticale retire o capuchão da agulha sem pressionar nem realizar movimentos rotatórios.
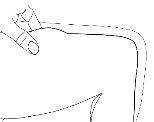
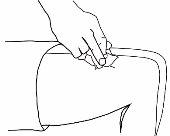
- Pegue uma área extensa de pele entre os dedos índice e polegar.
- Insira a agulha na base do local onde pegou a pele em um ângulo de 45º com relação à superfície da pele.
1 | 2 | 3 |
|
|
|
Em cada injeção, deve variar o local da injeção.
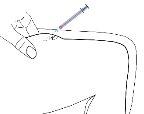
- Verificação da posição correta da agulha
Retire suavemente o êmbolo para verificar se a agulha está colocada corretamente.
Se entrar sangue na seringa, significa que a ponta da agulha penetrou em um vaso sanguíneo. Se isso ocorrer, não injete este medicamento. Retire a seringa, cubra o local da injeção com uma torunda com desinfetante e pressione; deve parar de sangrar após um ou dois minutos. Não use esta seringa e elimine-a adequadamente. Comece novamente com uma seringa nova.
- Injeção da solução
Uma vez que a agulha esteja colocada corretamente, pressione o êmbolo lentamente e constantemente para injetar a solução corretamente e que os tecidos da pele não sejam danificados.
- Retirada da seringa
Retire a seringa rapidamente.
Pressione no local da injeção com uma torunda com desinfetante. Use a seringa precarregada apenas uma vez.
Se usar mais Astarté do que deve
Consulte o seu médico.
Se esquecer de usar Astarté
Se se aperceber de que esqueceu de se injetar uma dose, administre-a o mais breve possível.
Não tome uma dose dupla para compensar as doses esquecidas.
Se se atrasar mais de 6 horas (portanto, o intervalo entre duas injeções se prolonga mais de 30 horas), administre a dose o mais breve possível e consulte o seu médico para que o aconselhe.
Se interromper o tratamento com Astarté
Não deixe de usar este medicamento, a não ser que o seu médico o indique, porque isso pode afetar o resultado do seu tratamento.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Muito frequentes (podem afetar até mais de 1 de cada 10 mulheres)
- Reações locais na pele no local da injeção (principalmente vermelhidão, com ou sem inchaço). A reação local normalmente desaparece em um prazo de 4 horas após a administração.
Pouco frequentes (podem afetar até 1 de cada 100 mulheres)
- dor de cabeça
- náuseas (sentir-se doente)
- malestar (sensação geral de estar doente, sentir-se mal)
Muito raros (podem afetar até 1 de cada 10.000 mulheres)
- foram observadas, mesmo após a primeira dose, reações alérgicas
- erupção
- inchaço facial
- dificuldade para respirar (dispneia)
- inchaço de face, lábios, língua e/ou garganta, que podem provocar dificuldade para respirar e/ou engolir (angioedema e/ou anafilaxia)
- habões (urticária).
Além disso, foram observados efeitos adversos relacionados com o tratamento de hiperestimulação ovárica controlada, por exemplo:
- dor abdominal,
- síndrome de hiperestimulação ovárica (SHO), (SHO ocorre quando os ovários reagem de forma exagerada aos medicamentos para a fertilidade que está tomando)
- gravidez ectópica (quando o embrião se desenvolve fora do útero)
- aborto (ver o prospecto do medicamento com FSH que está usando).
Após a primeira dose de ganirelix, foi comunicado o agravamento de um eczema que já apresentava uma paciente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Astarté
Mantenha este medicamento fora da vista e do alcance das crianças.
Não use este medicamento após a data de validade que aparece na etiqueta e na caixa após CAD. A data de validade é o último dia do mês que se indica.
Este medicamento não requer condições especiais de conservação.
Inspeccione a seringa antes de usar. A seringa apenas deve ser usada se a solução for transparente e sem partículas e o envase não estiver danificado.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Astarté
- O princípio ativo é ganirelix. Cada seringa precarregada contém 0,25 mg de ganirelix (como acetato) em 0,5 ml de solução aquosa.
- Os outros componentes são ácido acético glacial, manitol e água para preparações injetáveis. Pode ter sido ajustado o pH (medida de acidez) com hidróxido de sódio e ácido acético glacial.
Aspecto do produto e conteúdo do envase
Este medicamento é uma solução aquosa injetável transparente e incolor. A solução está pronta para usar, administrando-a por via subcutânea.
Este medicamento é apresentado em envases de 1 ou 5 seringas precarregadas com agulhas de injeção (27 G), como se especifica a seguir:
- 1 seringa precarregada
- 5 seringas precarregadas
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
GP-Pharm, S.A.
Pol. Ind. Els Vinyets – Els Fogars Sector 2
Carretera comarcal 244, km22
08777 Sant Quintí de Mediona, Barcelona
Espanha
Este medicamento está autorizado nos estados membros do Espaço Econômico Europeu com os seguintes nomes:
Portugal: Astarté
Espanha: Astarté 0,25 mg/ 0,5 ml solução injetável em seringa precarregada EFG
Data da última revisão desteprospecto:08/2023
A informação detalhada deste medicamento está disponível na página web da Agência Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/ .
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregadaForma farmacêutica: INJETÁVEL, 0,25 mg/0,5 mgSubstância ativa: ganirelixFabricante: Sun Pharmaceutical Industries (Europe) B.V.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,25 mg/0,5 mLSubstância ativa: ganirelixFabricante: Gedeon Richter Plc.Requer receita médicaForma farmacêutica: INJETÁVEL, DesconhecidaSubstância ativa: ganirelixFabricante: Organon N.V.Requer receita médica
Alternativas a ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada em Polónia
Alternativa a ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada em Ukraine
Médicos online para ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ASTARTE 0,25 mg/0,5 mL Solução injetável em seringa pré-carregada – sujeita a avaliação médica e regras locais.