

Xeomin

Pergunte a um médico sobre a prescrição de Xeomin

Como usar Xeomin
Folheto informativo: Informação para o utilizador
XEOMIN, 50 unidades, pó do preparo de solução injectável
XEOMIN, 100 unidades, pó do preparo de solução injectável
XEOMIN, 200 unidades, pó do preparo de solução injectável
Neurotoxina do Clostridium botulinumdo tipo A (150 kD), livre de proteínas complexantes
Deve ler atentamente o conteúdo do folheto antes de receber o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de alguma dúvida, deve consultar o médico ou farmacêutico.
- Se o doente apresentar algum efeito secundário, incluindo qualquer efeito secundário não listado neste folheto, deve informar o médico ou farmacêutico. Ver secção 4.
Índice do folheto:
- 1. O que é o medicamento XEOMIN e para que é utilizado
- 2. Informações importantes antes de utilizar o medicamento XEOMIN
- 3. Como utilizar o medicamento XEOMIN
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento XEOMIN
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento XEOMIN e para que é utilizado
XEOMIN é um medicamento que contém a substância ativa neurotoxina botulínica do tipo A, que, dependendo do local de administração, relaxa os músculos ou diminui a produção de saliva.
XEOMIN é utilizado para tratar os seguintes estados em adultos
- blefarospasmo (contracção involuntária das pálpebras) e contracção facial unilateral (contracção facial hemifacial),
- torcicolo espasmódico (torcicolo contrátil),
- aumento da tensão muscular/não controlada rigidez muscular dos braços, mãos e (ou) dedos (espasticidade do membro superior),
- salivação crónica (sialorreia) devido a distúrbios neurológicos.
XEOMIN é utilizado para tratar o seguinte estado em crianças e jovens com idades entre 2 e 17 anos, com peso corporal ≥ 12 kg:
- salivação crónica (sialorreia) devido a distúrbios neurológicos e (ou) do desenvolvimento neurológico.
2. Informações importantes antes de utilizar o medicamento XEOMIN
Quando não utilizar o medicamento XEOMIN
- se o doente for alérgico à neurotoxina botulínica do tipo A ou a qualquer um dos outros componentes deste medicamento (listados na secção 6),
- se o doente tiver uma doença generalizada do músculo (por exemplo, miastenia gravis, síndrome de Lambert-Eaton),
- se o doente tiver uma infecção ou inflamação no local da injeção planeada.
Precauções e advertências
Os efeitos secundários podem ser resultado da injeção da neurotoxina botulínica do tipo A no local incorreto, resultando em paralisia temporária dos grupos musculares adjacentes. Raramente, foram relatados efeitos secundários associados à disseminação da toxina para locais distantes do local da injeção, causando sintomas compatíveis com a ação da toxina botulínica do tipo A (por exemplo, fraqueza muscular excessiva, distúrbios da deglutição e (ou) engasgo acidental com alimentos ou líquidos). Doentes que recebem doses recomendadas podem experimentar fraqueza muscular excessiva.
Se a dose for demasiado grande ou o medicamento for administrado com demasiada frequência, o risco de formação de anticorpos pode aumentar. A formação de anticorpos pode resultar em falha da terapia com toxina botulínica do tipo A, independentemente da razão para a administração do medicamento.
Antes de iniciar o tratamento com o medicamento XEOMIN, deve discutir com o médico ou farmacêutico:
- se o doente tiver uma doença da coagulação,
- se o doente estiver a tomar substâncias que previnam a formação de coágulos (por exemplo, cumarina, heparina, ácido acetilsalicílico, clopidogrel),
- se o doente tiver fraqueza ou atrofia muscular significativa no músculo para o qual o medicamento será administrado,
- se o doente tiver esclerose lateral amiotrófica (ELA), que pode levar à atrofia muscular generalizada,
- se o doente tiver qualquer doença que afete a interação entre os nervos e os músculos esqueléticos (distúrbio da função neuromuscular),
- se o doente tiver dificuldades de deglutição,
- se o doente tiver convulsões,
- se o doente tiver tido problemas anteriormente relacionados com a injeção de toxina botulínica do tipo A,
- se o doente estiver a ser submetido a uma cirurgia planeada.
Deve contactar o médico ou procurar assistência médica se o doente observar os seguintes sintomas:
- dificuldades de respiração, deglutição ou fala,
- urticária, edema, incluindo edema facial ou de garganta, respiração sibilante, sensação de fraqueza e curto-circuito respiratório (possíveis sintomas de reação alérgica grave).
Injeções repetidas de medicamento XEOMIN
Em casos de injeções repetidas de medicamento XEOMIN, a força do medicamento pode aumentar ou diminuir. As possíveis causas incluem:
- diferentes procedimentos de preparo da solução para injeção pelo médico,
- diferentes intervalos de tempo entre as sessões de tratamento,
- injeções em diferentes músculos,
- mudanças marginais na eficácia da substância ativa do medicamento XEOMIN,
- falta de resposta ao tratamento. Blefarospasmoe contracção facial hemifacialDeve consultar o médico antes de utilizar o medicamento XEOMIN, se:
- o doente tiver sido submetido a uma cirurgia ocular. O médico tomará precauções adicionais,
- o doente estiver em risco de detecção de uma doença chamada glaucoma de ângulo fechado. Esta doença pode causar aumento da pressão intraocular, o que pode levar a danos ao nervo óptico. O médico deve saber se o doente está em risco.
Durante o tratamento, podem ocorrer pequenas equimoses hemorrágicas nos tecidos moles da pálpebra. O médico pode reduzir o risco de ocorrência delas aplicando pressão suave no local da injeção imediatamente após a sua realização.
Após a injeção do medicamento XEOMIN no músculo ocular, a frequência de piscar pode diminuir, o que pode levar a uma exposição prolongada da córnea. Esta exposição pode causar danos à sua superfície e inflamação (úlcera da córnea).
Torcicolo espasmódico
Após a injeção, o doente pode experimentar distúrbios da deglutição, desde leves até graves. Isso pode levar a problemas de respiração e a um maior risco de aspiração de substâncias estranhas ou líquidos. Substâncias estranhas nos pulmões podem causar inflamação ou infecção (pneumonia). O médico pode aplicar um tratamento especial, se necessário (por exemplo, alimentação artificial).
Os distúrbios da deglutição podem durar até duas ou três semanas após a injeção, e em um caso, foram relatados até cinco meses.
Se o doente não estiver ativo por um longo período, a sua atividade deve começar gradualmente após a injeção do medicamento XEOMIN.
Aumento da tensão muscular/não controlada rigidez muscular
O medicamento XEOMIN pode ser utilizado para tratar o aumento da tensão muscular/não controlada rigidez muscular em diferentes partes do membro superior, por exemplo, no braço ou na mão.
O medicamento XEOMIN é eficaz em combinação com os métodos padrão de tratamento.
O medicamento XEOMIN deve ser utilizado com esses outros métodos.
É pouco provável que o medicamento melhore o alcance de movimento nas articulações, se os músculos circundantes perderem a sua capacidade de esticar.
Se o doente não estiver ativo por um longo período, a sua atividade deve começar gradualmente após a injeção do medicamento XEOMIN.
Salivação crónica
Alguns medicamentos (por exemplo, clozapina, aripiprazol, piridostigmina) podem causar salivação excessiva. Deve considerar a possibilidade de substituir, reduzir ou interromper o tratamento com o medicamento que causa salivação antes de utilizar o medicamento XEOMIN para tratar a salivação.
Não foi estudada a eficácia e segurança do uso do medicamento XEOMIN em doentes com salivação causada por medicamentos.
Em caso de secura na boca associada ao uso do medicamento XEOMIN, o médico pode considerar a redução da dose.
Devido à diminuição da quantidade de saliva produzida após a administração do medicamento XEOMIN, podem ocorrer problemas de saúde na boca, como cáries dentárias ou agravamento de problemas existentes.
Antes de iniciar o tratamento com o medicamento XEOMIN para a salivação crónica, deve contactar um dentista. O dentista pode decidir aplicar medidas preventivas contra cáries, se necessário.
Crianças e jovens
Não deve ser utilizado em crianças com menos de 2 anos, em crianças com peso corporal inferior a 12 kg ou em crianças e jovens para tratar outros estados além da salivação crónica, pois não foi estudado o uso do medicamento XEOMIN nesses grupos de doentes. Por isso, não é recomendado o seu uso nesses doentes.
Medicamento XEOMIN e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
A ação do medicamento XEOMIN pode ser aumentada:
- por medicamentos utilizados em certas doenças infecciosas (espectinomicina ou antibióticos aminoglicosídicos [por exemplo, neomicina, canamicina, tobramicina]),
- por outros medicamentos que relaxam os músculos (por exemplo, medicamentos relaxantes musculares do tipo tubocurárico). Este tipo de medicamentos é utilizado, por exemplo, na anestesia geral. Antes da cirurgia, deve informar o anestesista de que o doente tomou o medicamento XEOMIN.
- no caso da salivação crónica: por outros medicamentos que causam diminuição da produção de saliva (por exemplo, medicamentos anticolinérgicos, como a tropina, glicopirronio ou escopolamina) ou devido à radiação terapêutica na cabeça e pescoço, incluindo as glândulas salivares. Deve informar o médico se o doente está ou será submetido a radioterapia.
Nestes casos, a administração do medicamento XEOMIN requer precaução especial.
A ação do medicamento XEOMIN pode ser diminuída por:
- certos medicamentos contra a malária e reumáticos (conhecidos como aminocinolinas).
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de utilizar este medicamento.
O medicamento XEOMIN não deve ser utilizado durante a gravidez, a menos que o médico decida que é absolutamente necessário e que os benefícios esperados para a mãe sejam maiores do que os possíveis riscos para o feto.
Não é recomendado o uso do medicamento XEOMIN em mulheres que amamentam.
Condução de veículos e utilização de máquinas
Não deve conduzir veículos ou realizar outras atividades potencialmente perigosas se ocorrerem ptose palpebral, fraqueza (astenia), fraqueza muscular, tontura ou distúrbios da visão. Em caso de dúvida, deve consultar o médico.
3. Como utilizar o medicamento XEOMIN
O medicamento XEOMIN só pode ser administrado por médicos com conhecimento especializado no uso da neurotoxina botulínica do tipo A.
A dose óptima, a frequência de administração e o número de locais de injeção serão determinados pelo médico para cada doente. Deve avaliar o efeito do tratamento inicial com o medicamento XEOMIN, o que pode levar a uma ajuste da dose, até que se obtenha o efeito desejado do medicamento. Os intervalos entre as sessões de tratamento serão determinados pelo médico com base nas necessidades reais do doente.
Se o doente achar que a ação do medicamento XEOMIN é muito forte ou muito fraca, deve contactar o médico. Se não houver efeito, deve considerar outros tratamentos.
Blefarospasmoe contracção facial hemifacial
A dose recomendada inicial é de até 25 unidades por olho, e a dose total recomendada para as sessões de tratamento subsequentes é de até 50 unidades por olho. O início da ação do medicamento é geralmente observado dentro de quatro dias após a injeção. A ação do medicamento dura cerca de 3-5 meses após cada administração, mas pode durar muito mais ou menos. O intervalo de tempo entre as sessões de tratamento não deve ser inferior a 12 semanas.
Geralmente, a administração do medicamento com mais frequência do que a cada três meses não proporciona benefícios adicionais.
Se o doente tiver contracção facial hemifacial, o médico seguirá as recomendações para o tratamento do blefarospasmo limitado a um lado da face. O tratamento da contracção facial hemifacial será direcionado para a parte superior da face, pois a injeção do medicamento XEOMIN na parte inferior da face pode aumentar o risco de efeitos secundários, como um risco local de fraqueza muscular.
Torcicolo espasmódico
A dose recomendada por local de injeção é de até 50 unidades, e a dose máxima recomendada para a primeira sessão de tratamento é de até 200 unidades. O médico pode administrar doses de até 300 unidades nas sessões de tratamento subsequentes, dependendo da resposta ao tratamento. O início da ação do medicamento é geralmente observado dentro de sete dias após a injeção. A ação do medicamento dura geralmente 3-4 meses após cada administração, mas pode durar muito mais ou menos. O tratamento pode ser repetido não antes de 10 semanas.
Aumento da tensão muscular/não controlada rigidez muscular
do membro superior
A dose recomendada é de até 500 unidades por sessão de tratamento. Não deve ser administrado mais de 250 unidades nos músculos do braço. Os doentes relataram que o início da ação foi sentido dentro de quatro dias após a administração. A redução da tensão muscular foi sentida dentro de quatro semanas. Em geral, o efeito do tratamento durou 12 semanas, mas pode durar muito mais ou menos. O intervalo de tempo entre as sessões de tratamento deve ser de pelo menos 12 semanas.
Salivação crónica (sialorreia) em adultos
A dose recomendada é de até 100 unidades por sessão de tratamento. Não deve ser ultrapassada a dose recomendada. O intervalo de tempo entre as sessões de tratamento deve ser de pelo menos 16 semanas.
Salivação crónica (sialorreia) em crianças e jovens
A dose recomendada por sessão de tratamento depende do peso corporal. Não deve ser ultrapassada a dose máxima de 75 unidades. O intervalo de tempo entre as sessões de tratamento deve ser de pelo menos 16 semanas.
Método de administração
XEOMIN em forma de pó é utilizado para injeções intramusculares (injeção intramuscular) ou para a glândula (para a glândula salivar) (ver informações destinadas aos profissionais de saúde no final deste folheto). Em adultos, as glândulas salivares podem ser localizadas com a ajuda de pontos de referência anatômicos ou ultrassom, mas, por razões de segurança, o método de ultrassom é preferido. Em crianças e jovens, deve ser utilizado o método de ultrassom.
Antes da injeção, as crianças e jovens podem receber um medicamento anestésico local (por exemplo, creme anestésico local), um medicamento sedativo ou um medicamento anestésico em combinação com um medicamento sedativo.
Uso de dose maior do que a recomendada do medicamento XEOMIN
Sintomas de sobredose
Os sintomas de sobredose não ocorrem imediatamente após a injeção e podem incluir fraqueza geral, ptose palpebral, visão dupla, distúrbios da respiração, distúrbios da fala e paralisia muscular respiratória ou distúrbios da deglutição, que podem levar à pneumonia.
Procedimento em caso de sobredose
Se ocorrerem sintomas de sobredose, o doente ou alguém da sua equipa deve chamar imediatamente os serviços de emergência, pois pode ser necessária hospitalização. Pode ser necessária uma assistência médica por vários dias e suporte respiratório.
Em caso de dúvida adicional sobre o uso deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não ocorram em todos.
Em geral, os efeitos secundários ocorrem dentro da primeira semana após a administração do tratamento e são temporários. Os efeitos secundários podem estar relacionados com o medicamento, o procedimento de injeção ou ambos. Os efeitos secundários podem ser limitados à área ao redor do local da injeção do medicamento (por exemplo, fraqueza muscular local, dor local, inflamação, sensação de formigamento (parestesia), sensação de entorpecimento (anestesia), sensibilidade aumentada ao toque, inchaço (edema), inchaço dos tecidos moles (edema), vermelhidão da pele (eritema), coceira, infecção local, hematoma, sangramento e (ou) equimose).
A injeção do medicamento pode causar dor. A dor ou o medo da picada podem levar a desmaio, náuseas, zumbido nos ouvidos (tinido) ou hipotensão.
Os efeitos secundários, como fraqueza muscular excessiva ou distúrbios da deglutição, podem ser causados pela diminuição da tensão muscular em locais distantes do local da injeção do medicamento XEOMIN.
Os distúrbios da deglutição podem causar aspiração de substâncias estranhas para o sistema respiratório, resultando em pneumonia, que pode ser fatal.
O medicamento XEOMIN pode causar uma reação alérgica. Raramente, foram relatadas reações alérgicas graves e (ou) súbitas (choque anafilático) ou reações alérgicas à serosa presente no medicamento (doença sérica), causando, por exemplo, distúrbios da respiração (dificuldade respiratória), erupção cutânea (urticária) ou inchaço dos tecidos moles (edema). Algumas dessas reações foram observadas após a administração do complexo convencional de toxina botulínica do tipo A. Ocorreram quando a toxina foi administrada isoladamente ou em combinação com outros medicamentos que causam reações semelhantes. Uma reação alérgica pode causar os seguintes sintomas:
- distúrbios da respiração, deglutição ou fala devido ao edema da face, lábios, boca ou garganta,
- inchaço das mãos, pés ou tornozelos.
Em caso de ocorrência de qualquer um dos sintomas acima, deve informar imediatamente o seu médico ou pedir ajuda aos seus familiares e dirigir-se ao serviço de urgência do hospital mais próximo.
Durante o uso do medicamento XEOMIN, foram observados os seguintes efeitos secundários.
Blefarospasmo
Muito frequentes (podem ocorrer em mais de 1 em cada 10 doentes):
ptose palpebral
Frequentes (podem ocorrer em até 1 em cada 10 doentes):
síndrome do olho seco, visão turva, distúrbios da visão, sensação de secura na boca, dor no local da injeção
Pouco frequentes (podem ocorrer em até 1 em cada 100 doentes):
dor de cabeça, fraqueza muscular facial (paralisia do nervo facial), visão dupla, lacrimejamento excessivo, distúrbios da deglutição (disfagia), fadiga, fraqueza muscular, erupção cutânea
Contracção facial hemifacial
Durante o tratamento da contracção facial hemifacial, podem ocorrer os mesmos efeitos secundários que no blefarospasmo.
Torcicolo espasmódico
Muito frequentes (podem ocorrer em mais de 1 em cada 10 doentes):
distúrbios da deglutição (disfagia)
Frequentes (podem ocorrer em até 1 em cada 10 doentes):
dor no pescoço, fraqueza muscular, dor muscular (mialgia), rigidez muscular e articular, espasmo muscular, dor de cabeça, tontura, dor no local da injeção, fraqueza (astenia), secura na boca, náuseas, suor excessivo, infecções do trato respiratório superior, fraqueza (estado pré-síncope)
Pouco frequentes (podem ocorrer em até 1 em cada 100 doentes):
distúrbios da fala (disfonia), curto-circuito respiratório (dificuldade respiratória), erupção cutânea
O tratamento do torcicolo espasmódico pode causar distúrbios da deglutição de diferentes graus. Isso pode levar à aspiração de substâncias estranhas para os pulmões, o que pode exigir intervenção médica. Os distúrbios da deglutição podem durar até duas ou três semanas após a injeção, mas foi relatado um caso de duração de cinco meses. A ocorrência de distúrbios da deglutição parece estar relacionada com a dose do medicamento.
Aumento da tensão muscular/não controlada rigidez muscular do membro superior
Frequentes (podem ocorrer em até 1 em cada 10 doentes):
secura na boca
Pouco frequentes (podem ocorrer em até 1 em cada 100 doentes):
dor de cabeça, diminuição da sensação de toque (anestesia), fraqueza muscular, dor no membro, fraqueza geral (astenia), dor muscular, distúrbios da deglutição (disfagia), náuseas
Frequência desconhecida (frequência não pode ser estimada com base nos dados disponíveis):
dor no local da injeção
Salivação crónica (sialorreia) em adultos
Frequentes (podem ocorrer em até 1 em cada 10 doentes):
secura na boca, distúrbios da deglutição (disfagia), sensação de formigamento (parestesia)
Pouco frequentes (podem ocorrer em até 1 em cada 100 doentes):
saliva espessa, distúrbios da fala, distúrbios do paladar
Foram relatados casos de secura na boca grave e prolongada (mais de 110 dias), que pode levar a distúrbios adicionais, como gengivite, distúrbios da deglutição e cáries dentárias.
Salivação crónica (sialorreia) em crianças e jovens
Pouco frequentes (podem ocorrer em até 1 em cada 100 doentes):
distúrbios da deglutição (disfagia)
Frequência desconhecida (frequência não pode ser estimada com base nos dados disponíveis):
secura na boca, saliva espessa, dor na boca, cáries dentárias
Experiências após a comercialização
Após a comercialização, durante o uso do medicamento XEOMIN, foram observados os seguintes efeitos secundários com frequência desconhecida, independentemente do local de tratamento: sintomas semelhantes à gripe, diminuição do músculo após a injeção e reações de hipersensibilidade, como: inchaço, inchaço dos tecidos moles (edema, incluindo edema em locais distantes do local da injeção), vermelhidão, coceira, erupção cutânea (local e generalizada), dificuldade respiratória.
Notificação de efeitos secundários
Se ocorrerem efeitos secundários, incluindo qualquer efeito secundário não listado neste folheto, deve informar o médico ou farmacêutico. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos, Produtos para a Saúde e Produtos Biocidas
Rua Jerozolimskie 181C
- 02 - 222 Varsóvia Tel.: + 48 22 49 21 301 Fax: + 48 22 49 21 309 Site da internet: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento XEOMIN
Deve conservar o medicamento em um local seguro e fora do alcance das crianças.
Não utilize este medicamento após o prazo de validade impresso na embalagem exterior e na etiqueta da ampola após "EXP". O prazo de validade é o último dia do mês indicado.
O código de lote impresso na embalagem é o número do lote.
Não armazene a ampola aberta. Armazenamento da solução reconstituída: A estabilidade química e física da solução foi demonstrada por 24 horas a uma temperatura entre 2°C e 8°C.
Do ponto de vista microbiológico, o medicamento deve ser utilizado imediatamente. Se não for utilizado imediatamente, a responsabilidade pelo tempo e condições de armazenamento antes da reutilização é do utilizador, e esse tempo não deve exceder 24 horas a uma temperatura entre 2°C e 8°C, a menos que a reconstituição tenha ocorrido em condições assépticas controladas.
O médico não deve utilizar o medicamento XEOMIN se a solução estiver turva ou contiver resíduos do medicamento que não se dissolveram.
Para obter informações sobre como eliminar o medicamento, procure a seção destinada aos profissionais de saúde no final deste folheto.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento XEOMIN
- A substância ativa do medicamento é a neurotoxina Clostridium botulinumdo tipo A (150 kD), livre de proteínas complexantes. XEOMIN, 50 unidades, pó para solução injectávelUma ampola contém 50 unidades de neurotoxina Clostridium botulinumdo tipo A (150 kD), livre de proteínas complexantes*. XEOMIN, 100 unidades, pó para solução injectávelUma ampola contém 100 unidades de neurotoxina Clostridium botulinumdo tipo A (150 kD), livre de proteínas complexantes*. XEOMIN, 200 unidades, pó para solução injectávelUma ampola contém 200 unidades de neurotoxina Clostridium botulinumdo tipo A (150 kD), livre de proteínas complexantes*. * Neurotoxina botulínica do tipo A, purificada a partir de culturas de bactérias Clostridium botulinum(cepa Hall).
- Os outros componentes do medicamento são: albumina humana, sacarose.
Como é o medicamento XEOMIN e que conteúdo tem a embalagem
XEOMIN é um pó para solução injectável. O pó é branco.
Após a reconstituição do pó, a solução é clara e incolor.
XEOMIN, 50 unidades, pó para solução injectável:
Tamanhos da embalagem: 1, 2, 3 ou 6 ampolas.
XEOMIN, 100 unidades, pó para solução injectável:
Tamanhos da embalagem: 1, 2, 3, 4 ou 6 ampolas.
XEOMIN, 200 unidades, pó para solução injectável:
Tamanhos da embalagem: 1, 2, 3, 4 ou 6 ampolas.
Nem todos os tamanhos da embalagem podem estar disponíveis.
Titular da autorização de comercialização
Merz Pharmaceuticals GmbH
Rua Eckenheimer Landstrasse 100
60318 Frankfurt/Main
Alemanha
Tel: +49-69/1503-1
Fax: +49-69/1503-200
Fabricante
Merz Pharma GmbH & Co. KGaA
Rua Eckenheimer Landstrasse 100
60318 Frankfurt/Main
Alemanha
Tel: +49-69/1503-1
Fax: +49-69/1503-200
Este medicamento está autorizado nos países membros da Área Económica Europeia sob os seguintes nomes:
XEOMIN: Áustria, Bulgária, Chipre, Croácia, República Checa, Dinamarca, Estónia, Alemanha, Grécia, Finlândia, França, Hungria, Irlanda, Islândia, Itália, Letónia, Liechtenstein, Lituânia, Luxemburgo, Malta, Países Baixos, Noruega, Polónia, Portugal, Roménia, Eslováquia, Eslovénia, Espanha, Suécia
XEOMEEN: Bélgica
Data da última revisão do folheto: 22.04.2024
Informações destinadas apenas aos profissionais de saúde: Instruções para a reconstituição da solução injectável:
O medicamento XEOMIN é reconstituído antes da administração utilizando uma solução de cloreto de sódio a 9 mg/ml (0,9%) para injeção.
XEOMIN só pode ser utilizado para tratar um doente por sessão de tratamento.
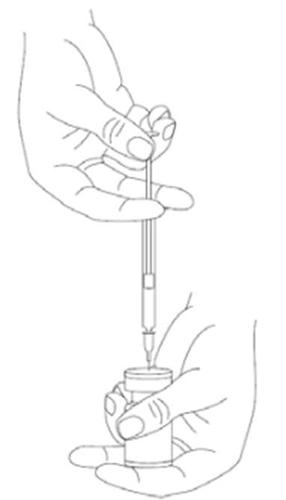
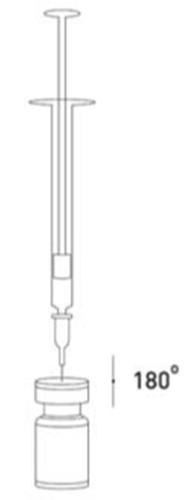
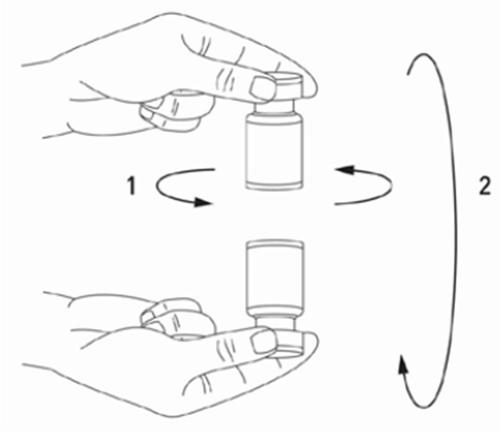
É uma boa prática reconstituir a solução e preparar a seringa sobre um pano de papel revestido com plástico, no caso de derramamento do medicamento. Deve aspirar a quantidade adequada da solução de cloreto de sódio para a seringa (ver tabela de diluições). Para preparar a solução, é recomendado utilizar uma agulha curta e cortada com um ângulo de 20-27 G. A agulha deve ser inserida no batoque da ampola a um ângulo reto, permitindo que o solvente seja aspirado automaticamente para a ampola. Deve descartar a ampola se o solvente não for aspirado para a ampola devido ao vácuo. Deve separar a seringa da ampola e misturar o XEOMIN com o solvente, agitando suavemente a ampola e girando-a/batendo nela - não deve fazer movimentos bruscos. Se necessário, a agulha utilizada para reconstituir a solução deve permanecer na ampola, e a quantidade adequada da solução deve ser aspirada com uma seringa estéril e nova, adequada para a injeção do medicamento.
Após a reconstituição, o medicamento XEOMIN é uma solução clara e incolor.
Não deve utilizar o medicamento XEOMIN se a solução preparada (preparada como descrito acima) estiver turva ou contiver resíduos do medicamento que não se dissolveram.
Deve ter cuidado para utilizar o volume correto do solvente necessário para preparar a dose adequada, para evitar uma sobredose acidental. Se forem utilizadas diferentes apresentações de XEOMIN durante uma sessão de tratamento, deve ter cuidado para utilizar a quantidade correta do solvente necessária para obter o número de unidades desejado por 0,1 ml. A quantidade do solvente é diferente para XEOMIN 50 unidades, XEOMIN 100 unidades e XEOMIN 200 unidades. Cada seringa também deve ser devidamente rotulada.
As concentrações possíveis para XEOMIN 50, 100 e 200 unidades estão na tabela abaixo:
| Dose obtida (unidades por 0,1 ml) | Solvente adicionado (solução de cloreto de sódio 9 mg/ml (0,9%) para injeção) | ||
| Ampola contendo 50 unidades | Ampola contendo 100 unidades | Ampola contendo 200 unidades | |
| 20 unidades | 0,25 ml | 0,5 ml | 1 ml |
| 10 unidades | 0,5 ml | 1 ml | 2 ml |
| 8 unidades | 0,625 ml | 1,25 ml | 2,5 ml |
| 5 unidades | 1 ml | 2 ml | 4 ml |
| 4 unidades | 1,25 ml | 2,5 ml | 5 ml |
| 2,5 unidades | 2 ml | 4 ml | não aplicável |
| 2 unidades | 2,5 ml | 5 ml | não aplicável |
| 1,25 unidades | 4 ml | não aplicável | não aplicável |
Instruções para a eliminação
A solução para injeção armazenada por mais de 24 horas e a solução para injeção não utilizada devem ser eliminadas.
Procedimentos para a eliminação segura das ampolas, seringas e materiais utilizados
Não utilizadas, resíduos da solução reconstituída e/ou seringas devem ser esterilizados em um autoclave. Alternativamente, pode ser inativada qualquer resíduo do medicamento XEOMIN adicionando uma das seguintes soluções: 70% de etanol, 50% de isopropanol, 0,1% de SDS (detergente aniônico), solução diluída de hidróxido de sódio (0,1 N NaOH) ou solução diluída de hipoclorito de sódio (pelo menos 0,1% NaOCl).
Após a inativação, os materiais utilizados, seringas e ampolas não devem ser esvaziados, mas devem ser colocados em recipientes adequados e eliminados de acordo com as regulamentações locais.
Recomendações para procedimentos em caso de incidentes imprevistos durante a administração da toxina botulínica do tipo A
- Qualquer vazamento do medicamento deve ser eliminado imediatamente: no caso do pó, com um material absorvente, impregnado com uma das soluções acima mencionadas, ou no caso do medicamento reconstituído, com um material absorvente seco.
- A superfície contaminada deve ser limpa com um material absorvente, impregnado com uma das soluções acima mencionadas, e depois seca.
- Se a ampola for quebrada, deve proceder de acordo com as instruções acima. Deve recolher cuidadosamente os cacos de vidro quebrado e evitar cortes, esfregando os resíduos do medicamento.
- Se o medicamento entrar em contato com a pele, deve lavar a área de contato com uma grande quantidade de água.
- Se o medicamento entrar em contato com os olhos, deve lavar os olhos com uma grande quantidade de água ou uma solução para lavar os olhos.
- Se o medicamento entrar em contato com uma ferida, corte ou fenda na pele, deve lavar a área com uma grande quantidade de água. Deve tomar as medidas médicas apropriadas, dependendo da dose injetada. Deve seguir estritamente as instruções para a preparação e eliminação do medicamento.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorMerz Pharma GmbH & Co. KG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a XeominForma farmacêutica: Solução, 200 U Speywood/mlSubstância ativa: botulinum toxinRequer receita médicaForma farmacêutica: Pó, 125 unidades SpeywoodSubstância ativa: botulinum toxinRequer receita médicaForma farmacêutica: Pó, 125 unidades SpeywoodSubstância ativa: botulinum toxinRequer receita médica
Alternativas a Xeomin noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Xeomin em Ukraine
Alternativa a Xeomin em Espanha
Médicos online para Xeomin
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Xeomin – sujeita a avaliação médica e regras locais.














