
LETYBO 50 unidades pó para solução injetável

Pergunte a um médico sobre a prescrição de LETYBO 50 unidades pó para solução injetável

Como usar LETYBO 50 unidades pó para solução injetável
Introdução
Prospecto: informação para o utilizador
Letybo 50unidades pó para solução injectável
toxina botulínica tipo A
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conservar este prospecto, porque pode ter que o ler novamente.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Letybo e para que é utilizado
- O que necessita saber antes de começar a usar Letybo
- Como usar Letybo
- Possíveis efeitos adversos
- Conservação de Letybo
- Conteúdo do envase e informação adicional
1. O que é Letybo e para que é utilizado
Letybo contém o princípio ativo toxina botulínica tipo A. Actua bloqueando os impulsos nervosos que vão para os músculos nos quais foi injectado. Desta forma, evita que os músculos se contraiam, causando uma paralisia temporária.
Letybo é utilizado em adultos com menos de 75 anos para melhorar temporariamente as linhas verticais entre as sobrancelhasde moderadas a graves, quando a sua presença tem um impacto psicológico importante nestas pessoas.
2. O que necessita saber antes de começar a usar Letybo
Não use Letybo:
- se é alérgico à toxina botulínica tipo A ou a algum dos outros componentes deste medicamento (incluídos na secção 6)
- se padece algum distúrbio da actividade muscular, como miastenia grave, síndrome de Lambert-Eaton ou esclerose lateral amiotrófica
- se tem uma infecção aguda ou inflamação nas zonas de injeção propostas
Advertências e precauções
Consulte o seu médico antes de começar a usar Letybo se tiver:
- algum distúrbio que afecte os músculos e/ou o seu controlo directo por parte do sistema nervoso
- dificuldades para engolir ou respirar, ou se as teve anteriormente
- um distúrbio relacionado com o sangramento
Se tiver antecedentes destes problemas, não se recomenda que utilize Letybo.
A dor relacionada com as agulhas ou o medo das injeções podem causar uma sensação de perda de conhecimento devido a uma repentina queda da pressão arterial.
Foram notificados muito raramente efeitos adversos causados pela difusão da toxina botulínica longe da zona de injeção, por exemplo, fraqueza muscular excessiva. As dificuldades para respirar e engolir são graves e podem causar a morte.
Se tiver problemas para engolir, falar ou respirar, solicite ajuda médica imediatamente.
Crianças e adolescentes
Letybo não é recomendado para crianças e adolescentes com menos de 18 anos.
Outros medicamentos e Letybo
Informar o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Os seguintes medicamentos poderiam afectar ou ser afectados por Letybo:
- medicamentos que afectam a transferência de impulsos nervosos para os músculos
- alguns medicamentos que se usam para tratar infecções bacterianas, como a espectinomicina ou os antibióticos denominados aminoglicósidos
- outros medicamentos que contenham uma toxina botulínica.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento.
Não se recomenda utilizar Letybo durante a gravidez ou a amamentação, nem em mulheres em idade fértil que não estejam a utilizar métodos anticoncepcionais.
Condução e uso de máquinas
A toxina botulínica tipo A pode provocar fraqueza, tontura e distúrbios visuais. Não conduza nem utilize máquinas se a sua capacidade para reagir se vir reduzida.
Letybo contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
3. Como usar Letybo
Esta unidade de toxina botulínica é específica de Letybo. Isto quer dizer que é distinta de outras unidades de toxina botulínica e não pode ser trocada pelas que se usam em outras preparações de toxina botulínica.
Letybo foi prescrito exclusivamente para si por um médico devidamente competente que conta com o equipamento correcto para este tratamento. A descrição detalhada da preparação da solução e as instruções de uso são descritas na secção “Esta informação está destinada apenas a profissionais de saúde” no final do prospecto.
A dose recomendada é
20 unidades divididas em cinco injeções de 0,1 ml (4 unidades). Cada injeção é administrada nos músculos situados acima ou entre as sobrancelhas.
Letybo é administrado por via intramuscular (via IM).
Uma vez que a solução foi reconstituída, o frasco só deve ser utilizado em uma sessão por paciente. Qualquer solução não utilizada deve ser eliminada, tal como se explica após a secção 6 da informação para profissionais de saúde.
Recomenda-se deixar passar um mínimo de 3 meses entre dois tratamentos com Letybo.
Se lhe foi administrado mais Letybo do que o deve
As sobredoses podem causar paralisia dos músculos e/ou dos nervos. É possível que os sinais de sobredose não apareçam imediatamente após a injeção.
Em caso de sobredose, o médico o terá em observação por si apresentar sintomas, como fraqueza geral ou paralisia muscular. Será internado no hospital se apresentar sintomas de intoxicação com toxina botulínica tipo A, tais como:
- fraqueza generalizada
- queda do párpado superior ou visão dupla
- distúrbios da fala ou ao engolir
- paralisia parcial dos músculos que controlam a respiração.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
A maioria dos efeitos adversos é de intensidade leve a moderada, produz-se nos primeiros dias após a injeção e são passageiros.
Alguns efeitos adversos podem ser muito graves. Se experimentar algum dos seguintes efeitos adversos, informe o seu médico imediatamente ou peça aos seus familiares que informem o seu médico e acuda ao serviço de urgências mais próximo:
Pouco frequentes, podem afectar 1 de cada 100 pessoas
- queda do párpado superior, espasmo do párpado
Raros, podem afectar 1 de cada 1 000 pessoas
- distúrbio sensitivo do párpado, queda da sobrancelha
- sangramento na conjuntiva
- dor ocular, olho seco, defeito do campo visual, visão borrosa
- sensibilidade reduzida na garganta
- prisão de ventre
- distúrbio da articulação
Muito raros, podem afectar 1 de cada 10 000 pessoas
- fraqueza muscular
- dificuldade para engolir
- infecção das vias respiratórias ou pulmões causada pela aspiração de alimentos ou líquido
- dificuldade para respirar
Além destes possíveis efeitos adversos, uma reacção alérgica grave poderia causar os seguintes sintomas:
- dificuldade para engolir, respirar ou falar devido a inchaço na face, os lábios, a boca ou a garganta; além destes sintomas, poderiam produzir-se habones urticariais (ver secção 2)
Outros efeitos adversos conhecidos podem produzir-se com as seguintes frequências. Informe o seu médico ou farmacêutico se são graves:
Frequentes, podem afectar 1 de cada 10 pessoas
- cefaleia
- reações na zona de injeção
Pouco frequentes, podem afectar 1 de cada 100 pessoas
- moléstias de cabeça
- inchaço local, por exemplo no párpado, na face ou à volta dos olhos
- dor, cardenales, inchaço, picazón, aumento do volume ou pressão na zona de injeção
- cardenales, por exemplo à volta dos olhos
- infecção, como uma infecção vírica das vias respiratórias altas, p. ex.: resfriado
- efeito Mefisto (elevação lateral das sobrancelhas)
Raros, podem afectar 1 de cada 1 000 pessoas
- migraña
- inflamação dos folículos pilosos
- tontura
- sensações anormais, como picazón, sensação de formigueiro e picazón
- náuseas
- pele seca, erupção, picazón
- dor facial
- febre
- herpes oral
- potássio no sangue elevado
- síndrome pseudogripal
Comunicação de efeitos adversos
Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano, https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Letybo
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa após “CAD” ou “EXP”. A data de validade é o último dia do mês que se indica.
Conservar e transportar refrigerado (2 °C – 8 °C).
Solução reconstituída
Demonstrou-se a estabilidade química e física em uso durante 24 horas a 2°C.
Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se não for utilizado de imediato, os tempos de conservação durante o uso e as condições prévias ao uso são responsabilidade do utilizador e normalmente não passarão de 24 horas a uma temperatura de entre 2 e 8 °C, a menos que a reconstituição/diluição (etc.) tenha sido realizada em condições assépticas controladas e validadas.
Os medicamentos não devem ser deitados fora pelas águas residuais nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Letybo
- O princípio ativo é toxina botulínica tipo A.
- Um frasco contém 50 unidades de toxina botulínica tipo A produzida por Clostridium botulinum.
- Após a reconstituição, a solução contém 4 unidades por cada 0,1 ml.
- Os outros excipientes são albúmina humana, cloreto de sódio.
Aspecto do produto e conteúdo do envase
Letybo é um pó para solução injectável de cor branca fornecido em um frasco de vidro transparente com um tampão de borracha e um precinto de segurança de alumínio.
O envase individual contém 1 ou 2 frascos.
O envase múltiplo contém 2 caixas, cada uma com um frasco.
O envase múltiplo contém 6 caixas, cada uma com um frasco.
Pode ser que apenas alguns tamanhos de envases estejam comercializados
Titular da autorização de comercialização
CROMA-PHARMA GmbH
Industriezeile 6
2100 Leobendorf
Áustria
Responsável pela fabricação
Croma-Pharma GmbH
Cromazeile 2
2100 Leobendorf
Áustria
Data da última revisão deste prospecto:Julho 2023
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Esta informação está destinada apenas a profissionais de saúde:
As unidades de toxina botulínica não podem ser trocadas de um produto para outro. As doses recomendadas em unidades são distintas das de outras preparações com toxina botulínica.
Devem ser seguidas de forma estrita as instruções de uso, manipulação e eliminação.
Preparação da solução
A reconstituição deve ser realizada de acordo com as normas de boas práticas, especialmente com respeito à assepsia.
Para a reconstituição de Letybo, deve ser utilizado como diluente uma solução injectável de 9 mg/ml (0,9 %) de cloreto de sódio e deve ser adicionado a um volume de 1,25 ml.
A prática recomendada é reconstituir o conteúdo do frasco e preparar a seringa sobre toalhas de papel revestidas com plástico para recolher qualquer derrame. A solução injectável de 9 mg/ml (0,9 %) de cloreto de sódio é introduzida na seringa e deve ser injectada suavemente no frasco, para evitar a formação de espuma/bolhas ou uma agitação vigorosa que poderia causar desnaturação. O frasco deve ser descartado se o vácuo não absorver o solvente para o interior do frasco. Uma vez reconstituído, Letybo é uma solução transparente e incolor, livre de partículas. Antes do seu uso, deve ser feita uma inspeção visual do frasco para garantir que o produto esteja livre de partículas estranhas.
Letybo não deve ser utilizado se a solução reconstituída tiver uma aparência turva ou contiver partículas.
Solução reconstituída
Demonstrou-se a estabilidade química e física em uso durante 24 horas a 2°C.
Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se não for utilizado de imediato, os tempos de conservação durante o uso e as condições prévias ao uso são responsabilidade do utilizador e normalmente não passarão de 24 horas a uma temperatura de entre 2 e 8 °C, a menos que a reconstituição/diluição (etc.) tenha sido realizada em condições assépticas controladas e validadas.
Deve ser descartada qualquer solução injectável que tenha sido conservada por mais de 24 horas.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele será realizada de acordo com a normativa local.
Instruções de uso
As injeções intramusculares devem ser realizadas com uma seringa estéril de insulina ou tuberculina de 1 ml, com graduação de 0,01 ml e uma agulha com calibre de 30 a 31 G.
Deve ser introduzido na seringa estéril um volume de 0,5 ml da solução de Letybo, já reconstituída adequadamente, e devem ser expulsas as bolhas de ar presentes no barril da seringa. A agulha utilizada para reconstituir o medicamento deve ser retirada e substituída por outra para a administração.
Deve ter cuidado para não injectar Letybo em um vaso sanguíneo.
Para reduzir as complicações por blefaroptose, devem ser evitadas as injeções perto do levator palpebrae superioris, especialmente em pacientes com complexo ceja-depressor grande. Ao injectar em duas zonas de cada músculo corrugator supercilii, a primeira injeção deve ser feita justo acima do margem médio das sobrancelhas. A segunda injeção será feita aproximadamente 1 cm acima do arco superciliar (limites ósseos rígidos palpáveis sobre a parte superior do párpado superior), onde se juntam as linhas médias das sobrancelhas. A zona de injeção do músculo procerusé justo acima da linha média do puente nasal, onde se formam rugas horizontais entre os extremos mediais das sobrancelhas. Ao injectar nos extremos mediais dos músculos corrugator superciliie nas linhas médias das sobrancelhas, as zonas de injeção devem estar ao menos a 1 cm de distância do arco superciliar (limites ósseos rígidos palpáveis sobre a parte superior do párpado superior).
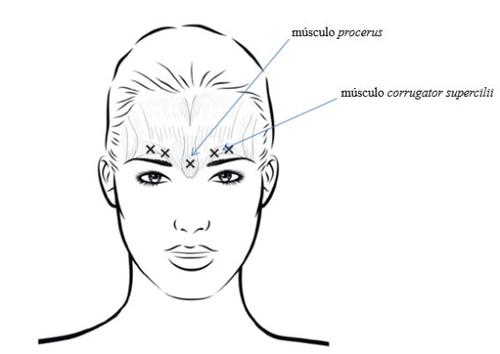
As injeções devem ser administradas com cuidado para evitar uma injeção intravascular. Antes da injeção, pode ser colocado com firmeza o dedo polegar ou índice sob o arco superciliar para evitar o derrame do medicamento para essa zona. A agulha deve ser orientada em direção superior e medial.
Em caso de tratamento falhado um mês após uma sessão previa, ou seja, na ausência de uma melhoria significativa em relação ao início, podem ser consideradas as seguintes estratégias:
- Análise das causas do falho; p. ex. injeção nos músculos incorrectos, técnica de injeção, formação de anticorpos neutralizantes da toxina, dose insuficiente
- Voltar a avaliar se é apropriado o tratamento com toxina botulínica tipo A
Na ausência de efeitos secundários não desejados como resultado de uma sessão de tratamento anterior, é possível iniciar outra sessão de tratamento com um intervalo mínimo de três meses entre as sessões de tratamento.
Procedimento a seguir para a eliminação segura dos frascos, das seringas e dos materiais utilizados
Para a eliminação segura, Letybo sem reconstituir deve ser reconstituído no frasco com uma pequena quantidade de água e, após, esterilizado com autoclave. Os frascos vazios, frascos que contenham restos da solução, seringas ou derrames devem ser esterilizados com autoclave. Como alternativa, o Letybo restante pode ser inactivado com uma solução de hidróxido de sódio diluída (0,1 N NaOH) ou com uma solução de hipoclorito de sódio diluída (0,5 % ou 1 % NaOCl).
Após a inactivação, os frascos, seringas e materiais utilizados não devem ser esvaziados e devem ser descartados em contentores apropriados e eliminados de acordo com as normativas locais.
Recomendações em caso de que se produzisse algum incidente durante a manipulação de toxina botulínica
- Qualquer derrame do produto deve ser recolhido: com material absorbente impregnado com uma solução de hipoclorito de sódio no caso do pó, ou com material absorbente seco no caso do produto reconstituído.
- As superfícies contaminadas devem ser limpas com material absorbente impregnado com uma solução de hipoclorito de sódio e, a seguir, secas.
- Se um frasco se partir, proceda da forma indicada anteriormente recolhendo com cuidado os pedaços de vidro partido e limpando o produto. Evite fazer-se cortes na pele.
- Se o medicamento entrar em contacto com a pele, lave a zona afectada com uma solução de hipoclorito de sódio e enxágue-a com água abundante.
- Se o medicamento entrar em contacto com os olhos, lave-os concienzudamente com água abundante ou com uma solução oftálmica para lavagem de olhos.
Se o medicamento entrar em contacto com uma ferida ou pele cortada ou lacerada, lave-a concienzudamente com água abundante e tome as medidas médicas apropriadas conforme a dose injectada.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a LETYBO 50 unidades pó para solução injetávelForma farmacêutica: INJETÁVEL, 200 U/mlSubstância ativa: botulinum toxinFabricante: Ipsen PharmaRequer receita médicaForma farmacêutica: INJETÁVEL, 125 Unidades SpeywoodSubstância ativa: botulinum toxinFabricante: Ipsen Pharma S.A.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 100 unidadesSubstância ativa: botulinum toxinFabricante: Merz Pharmaceuticals GmbhRequer receita médica
Alternativas a LETYBO 50 unidades pó para solução injetável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a LETYBO 50 unidades pó para solução injetável em Polónia
Alternativa a LETYBO 50 unidades pó para solução injetável em Ukraine
Médicos online para LETYBO 50 unidades pó para solução injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de LETYBO 50 unidades pó para solução injetável – sujeita a avaliação médica e regras locais.














