

Xeomin

Pergunte a um médico sobre a prescrição de Xeomin

Como usar Xeomin
Folheto informativo: Informação para o utilizador
XEOMIN, 50 unidades, pó de clostrídio para solução injectável
XEOMIN, 100 unidades, pó de clostrídio para solução injectável
XEOMIN, 200 unidades, pó de clostrídio para solução injectável
A neurotoxina do Clostridium botulinum tipo A (150 kD), livre de proteínas complexantes
Deve ler atentamente o conteúdo do folheto antes de receber o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para o poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Se o doente apresentar algum efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento XEOMIN e para que é utilizado
- 2. Informações importantes antes de utilizar o medicamento XEOMIN
- 3. Como utilizar o medicamento XEOMIN
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento XEOMIN
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento XEOMIN e para que é utilizado
XEOMIN é um medicamento que contém a substância ativa neurotoxina botulínica tipo A, que, dependendo do local de administração, relaxa os músculos ou diminui a produção de saliva.
XEOMIN é utilizado para tratar os seguintes estados em adultos:
- blefarospasmo (contracção involuntária das pálpebras) e contracção facial hemifacial (contracção de um lado da face),
- torcicolo espasmódico (contracção involuntária do pescoço),
- aumento da tensão muscular/não controlada rigidez muscular dos braços, mãos e (ou) dedos (espasticidade do membro superior),
- salivação crónica (sialorreia) devido a distúrbios neurológicos.
XEOMIN é utilizado para tratar o seguinte estado em crianças e jovens com idades entre 2 e 17 anos, com peso corporal ≥ 12 kg:
- salivação crónica (sialorreia) devido a distúrbios neurológicos e (ou) do desenvolvimento neurológico.
2. Informações importantes antes de utilizar o medicamento XEOMIN
Quando não utilizar o medicamento XEOMIN
- se o doente for alérgico à neurotoxina botulínica tipo A ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6),
- se o doente tiver uma doença generalizada que afeta a função muscular (por exemplo, miastenia gravis, síndrome de Lambert-Eaton),
- se o doente tiver uma infecção ou inflamação no local da injeção planeada.
Precauções e advertências
Os efeitos secundários podem ser causados pela injeção da neurotoxina botulínica tipo A no local incorreto, resultando em paralisia temporária dos músculos adjacentes.
Muito raramente, foram relatados efeitos secundários associados à disseminação da toxina para locais distantes do local da injeção, causando sintomas consistentes com a ação da toxina botulínica tipo A (por exemplo, fraqueza muscular excessiva, distúrbios da deglutição e (ou) aspiração acidental de alimentos ou líquidos).
Os doentes que recebem as doses recomendadas podem experimentar fraqueza muscular excessiva.
Se a dose for muito alta ou o medicamento for administrado com frequência excessiva, o risco de formação de anticorpos pode aumentar.
A formação de anticorpos pode resultar em falha da terapia com toxina botulínica tipo A, independentemente da razão para a administração do medicamento.
Antes de iniciar o tratamento com o medicamento XEOMIN, deve discutir com o médico ou farmacêutico:
- se o doente tiver uma doença que afeta a coagulação do sangue,
- se o doente estiver a tomar substâncias que previnem a formação de coágulos (por exemplo, cumarina, heparina, ácido acetilsalicílico, clopidogrel),
- se o doente tiver fraqueza ou perda de massa muscular significativa no músculo que será injetado,
- se o doente tiver esclerose lateral amiotrófica (ELA), que pode levar à atrofia muscular generalizada,
- se o doente tiver uma doença que afeta a interação entre os nervos e os músculos esqueléticos (distúrbio da função neuromuscular),
- se o doente tiver dificuldades de deglutição,
- se o doente tiver convulsões,
- se o doente tiver tido problemas anteriormente com a injeção de toxina botulínica tipo A,
- se o doente estiver a ser submetido a uma cirurgia planeada.
Deve contactar o médico ou procurar assistência médica se o doente observar os seguintes sintomas:
- dificuldades de respiração, deglutição ou fala,
- urticária, inchaço, incluindo inchaço facial ou de garganta, respiração sibilante, sensação de fraqueza e falta de ar (possíveis sintomas de reação alérgica grave).
Injeções repetidas de medicamento XEOMIN
Em casos de injeções repetidas de medicamento XEOMIN, a força do medicamento pode aumentar ou diminuir.
As possíveis causas incluem:
- diferentes procedimentos de preparação da solução para injeção pelo médico,
- diferentes intervalos de tempo entre as sessões de tratamento,
- injeções em músculos diferentes,
- mudanças marginais na eficácia da substância ativa do medicamento XEOMIN,
- falta de resposta ao tratamento.
Deve consultar o médico antes de utilizar o medicamento XEOMIN se:
- o doente teve uma cirurgia ocular.
- o doente está em risco de desenvolver glaucoma de ângulo fechado.
Durante o tratamento, podem ocorrer pequenas hemorragias na pele ao redor do local da injeção.
O médico pode reduzir o risco de ocorrência dessas hemorragias aplicando pressão suave no local da injeção imediatamente após a injeção.
Após a injeção do medicamento XEOMIN no músculo ocular, a frequência de piscar pode diminuir,
o que pode levar a uma exposição prolongada da córnea.
Essa exposição pode causar danos à superfície da córnea e inflamação (úlcera da córnea).
Após a injeção, o doente pode experimentar distúrbios da deglutição, que podem variar de leves a graves.
Isso pode levar a problemas de respiração e a um risco aumentado de aspiração de substâncias estranhas ou líquidos.
Substâncias estranhas nos pulmões podem causar inflamação ou infecção (pneumonia).
O médico pode precisar de tratamento especial se necessário (por exemplo, alimentação artificial).
Os distúrbios da deglutição podem durar até duas ou três semanas após a injeção,
embora tenham sido relatados casos de duração de até cinco meses.
Se o doente não estiver ativo por um longo período, a atividade deve ser iniciada gradualmente após a injeção do medicamento XEOMIN.
XEOMIN pode ser utilizado para tratar o aumento da tensão muscular/não controlada rigidez muscular em diferentes partes do membro superior, como o braço ou a mão.
XEOMIN é eficaz em combinação com os métodos de tratamento padrão.
XEOMIN deve ser utilizado com esses outros métodos.
É improvável que o medicamento melhore o alcance de movimento nas articulações se os músculos adjacentes perderem a capacidade de esticar.
Se o doente não estiver ativo por um longo período, a atividade deve ser iniciada gradualmente após a injeção do medicamento XEOMIN.
Algumas substâncias (por exemplo, clozapina, aripiprazol, piridostigmina) podem causar salivação excessiva.
Deve considerar a possibilidade de substituir, reduzir ou interromper o tratamento com a substância que causa salivação antes de utilizar o medicamento XEOMIN para tratar a salivação.
Não foi estudada a eficácia e segurança do uso do medicamento XEOMIN em doentes com salivação causada por substâncias.
Se ocorrer secura na boca devido ao uso do medicamento XEOMIN, o médico pode considerar reduzir a dose.
Devido à redução da quantidade de saliva produzida após o uso do medicamento XEOMIN, podem ocorrer problemas de saúde bucal, como cáries dentárias ou agravamento de problemas bucais existentes.
Antes de iniciar o tratamento com o medicamento XEOMIN para tratar a salivação crónica, deve consultar um dentista.
O dentista pode decidir usar medidas preventivas para cáries, se necessário.
Crianças e jovens
Não deve ser utilizado em crianças com menos de 2 anos, com peso corporal inferior a 12 kg ou em crianças e jovens para tratar outros estados além da salivação crónica, pois não foi estudado o uso do medicamento XEOMIN nesses grupos de doentes.
Por isso, não é recomendado o uso do medicamento XEOMIN nesses doentes.
XEOMIN e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
A ação do medicamento XEOMIN pode ser aumentada:
- por medicamentos utilizados em certas infecções (espectinomicina ou antibióticos aminoglicosídicos [por exemplo, neomicina, canamicina, tobramicina]),
- por outros medicamentos que relaxam os músculos (por exemplo, medicamentos relaxantes musculares do tipo tubocurárico).
Esse tipo de medicamentos é utilizado, por exemplo, na anestesia geral.
Antes da cirurgia, deve informar o anestesista de que o doente recebeu o medicamento XEOMIN.
Em caso de tratamento da salivação crónica:
- por outros medicamentos que causam diminuição da produção de saliva (por exemplo, medicamentos anticolinérgicos, como a tropina, glicopirronio ou escopolamina) ou devido à radiação terapêutica na cabeça e pescoço, incluindo as glândulas salivares.
Deve informar o médico se o doente está ou será submetido a radioterapia.
Nessas situações, o uso do medicamento XEOMIN requer precaução especial.
A ação do medicamento XEOMIN pode ser diminuída por:
- certos medicamentos antimaláricos e antirreumáticos (conhecidos como aminocinolinas).
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de utilizar este medicamento.
O medicamento XEOMIN não deve ser utilizado durante a gravidez, a menos que o médico decida que é absolutamente necessário e que os benefícios esperados para a mãe superam os possíveis riscos para o feto.
Não é recomendado o uso do medicamento XEOMIN em mulheres que amamentam.
Condução de veículos e utilização de máquinas
Não deve conduzir veículos ou realizar outras atividades potencialmente perigosas se ocorrerem sintomas como ptose, fraqueza (astenia), fraqueza muscular, tontura ou distúrbios da visão.
Em caso de dúvida, deve consultar o médico.
3. Como utilizar o medicamento XEOMIN
O medicamento XEOMIN só pode ser administrado por médicos com conhecimento especializado no uso da neurotoxina botulínica tipo A.
A dose óptima, a frequência de administração e o número de locais de injeção serão determinados pelo médico para cada doente.
Deve ser avaliado o efeito do tratamento inicial com o medicamento XEOMIN, o que pode levar a uma ajuste da dose até que se obtenha o efeito desejado.
O intervalo de tempo entre as sessões de tratamento será determinado pelo médico com base nas necessidades reais do doente.
Se o doente achar que a ação do medicamento XEOMIN é muito forte ou muito fraca, deve contactar o médico.
Se não ocorrer nenhum efeito, deve considerar outros tratamentos.
A dose recomendada inicial para o blefarospasmo é de até 25 unidades por olho, e a dose total recomendada para as sessões subsequentes é de até 50 unidades por olho.
O início da ação do medicamento geralmente é observado dentro de 4 dias após a injeção.
A ação do medicamento dura aproximadamente 3 a 5 meses após cada administração, mas pode durar muito mais ou menos.
O intervalo de tempo entre as sessões de tratamento não deve ser inferior a 12 semanas.
Normalmente, a administração do medicamento com frequência superior a uma vez every 3 meses não proporciona benefícios adicionais.
Se o doente tiver contracção facial hemifacial, o médico seguirá as recomendações para o tratamento do blefarospasmo limitado a um lado da face.
O tratamento da contracção facial hemifacial será direcionado para a parte superior da face, pois a injeção do medicamento XEOMIN na parte inferior da face pode aumentar o risco de efeitos secundários, como um risco local de fraqueza muscular.
A dose recomendada por local de injeção é de até 50 unidades, e a dose máxima recomendada para a primeira sessão de tratamento é de até 200 unidades.
O médico pode administrar doses de até 300 unidades nas sessões subsequentes, dependendo da resposta ao tratamento.
O início da ação do medicamento geralmente é observado dentro de 7 dias após a injeção.
A ação do medicamento dura aproximadamente 3 a 4 meses após cada administração, mas pode durar muito mais ou menos.
O tratamento pode ser repetido não antes de 10 semanas.
A dose recomendada é de até 500 unidades por sessão de tratamento.
Não deve ser administrado mais de 250 unidades nos músculos dos braços.
Os doentes relataram que o início da ação do medicamento ocorreu dentro de 4 dias após a administração.
A redução da tensão muscular foi observada dentro de 4 semanas.
Em geral, o efeito do tratamento durou 12 semanas, mas pode durar muito mais ou menos.
O intervalo de tempo entre as sessões de tratamento deve ser de pelo menos 12 semanas.
A dose recomendada é de até 100 unidades por sessão de tratamento.
Não deve ser ultrapassada a dose recomendada.
O intervalo de tempo entre as sessões de tratamento deve ser de pelo menos 16 semanas.
A dose recomendada por sessão de tratamento depende do peso corporal.
Não deve ser ultrapassada a dose máxima de 75 unidades.
O intervalo de tempo entre as sessões de tratamento deve ser de pelo menos 16 semanas.
XEOMIN, sob a forma de solução, é administrado por injeção intramuscular (injeção no músculo) ou na glândula (na glândula salivar) (ver informações destinadas aos profissionais de saúde no final deste folheto).
Em adultos, as glândulas salivares podem ser localizadas com a ajuda de pontos de referência anatômicos ou ultrassom, mas, por razões de segurança, o método de ultrassom é preferido.
Em crianças e jovens, deve ser utilizado o método de ultrassom.
Antes da injeção, podem ser administrados anestésicos locais (por exemplo, creme anestésico local), sedativos ou anestésicos em combinação com sedativos às crianças e jovens.
Uso de dose maior do que a recomendada de medicamento XEOMIN
Sintomas de sobredose
Os sintomas de sobredose podem não ocorrer imediatamente após a injeção e podem incluir fraqueza generalizada, ptose, visão dupla, distúrbios da respiração, distúrbios da fala e paralisia muscular respiratória ou distúrbios da deglutição, que podem levar à pneumonia.
Procedimento em caso de sobredose
Se ocorrerem sintomas de sobredose, o doente ou alguém de sua família deve chamar imediatamente os serviços de emergência, pois pode ser necessária hospitalização.
Pode ser necessária assistência médica e suporte respiratório por vários dias.
Em caso de dúvida adicional sobre o uso deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como qualquer medicamento, o medicamento XEOMIN pode causar efeitos secundários, embora não todos os doentes os experimentem.
Em geral, os efeitos secundários ocorrem dentro de uma semana após a administração do medicamento e são temporários.
Os efeitos secundários podem estar relacionados ao medicamento, ao procedimento de injeção ou a ambos.
Os efeitos secundários podem ser limitados à área ao redor do local da injeção (por exemplo, fraqueza muscular local, dor local, inflamação, sensação de formigamento, diminuição da sensibilidade ao toque, hipersensibilidade ao toque, inchaço, vermelhidão, coceira, infecção local, hematoma, sangramento e (ou) equimose).
A injeção do medicamento pode causar dor.
A dor ou o medo da injeção podem levar a sintomas como tontura, náusea, zumbido ou diminuição da pressão arterial.
Os efeitos secundários, como fraqueza muscular excessiva ou distúrbios da deglutição, podem ser causados pela diminuição da tensão muscular em locais distantes do local da injeção do medicamento XEOMIN.
Os distúrbios da deglutição podem levar à aspiração de substâncias estranhas para o sistema respiratório, resultando em pneumonia, que pode ser fatal.
O medicamento XEOMIN pode causar uma reação alérgica.
Foram relatados casos de reações alérgicas graves e (ou) súbitas (choque anafilático) ou reações alérgicas à serosa presente no medicamento (doença serosa), que podem causar sintomas como:
- distúrbios da respiração, deglutição ou fala devido ao inchaço facial, lábios, boca ou garganta,
- inchaço das mãos, pés ou tornozelos.
Em caso de ocorrência de qualquer um dos sintomas acima, deve informar imediatamente o médico ou procurar assistência médica.
Foram observados os seguintes efeitos secundários durante o uso do medicamento XEOMIN:
Muito frequentes (podem ocorrer em mais de 1 em cada 10 doentes):
ptose
Frequentes (podem ocorrer em até 1 em cada 10 doentes):
síndrome do olho seco, visão turva, distúrbios da visão, secura na boca, dor no local da injeção
Pouco frequentes (podem ocorrer em até 1 em cada 100 doentes):
dor de cabeça, fraqueza muscular facial (paralisia do nervo facial), visão dupla, lacrimejamento excessivo, distúrbios da deglutição (disfagia), fadiga, fraqueza muscular, erupção cutânea
Em caso de ocorrência de qualquer efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou farmacêutico.
Os efeitos secundários podem ser relatados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos.
- Endereço: Al. Jerozolimskie 181C, 02-222 Varsóvia, Tel.: +48 22 49 21 301, Fax: +48 22 49 21 309, Site: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser relatados ao titular da autorização de comercialização.
Ao relatar os efeitos secundários, pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento XEOMIN
Deve manter o medicamento fora do alcance e da vista das crianças.
Não utilize o medicamento após o prazo de validade impresso na embalagem e na etiqueta da ampola após "EXP".
O prazo de validade é o último dia do mês indicado.
A abreviatura "Lote" na embalagem indica o número do lote.
Ampola não aberta: Não armazenar acima de 25°C.
Solução reconstituída: A estabilidade química e física da solução foi demonstrada por 24 horas a uma temperatura entre 2°C e 8°C.
Do ponto de vista microbiológico, o medicamento deve ser utilizado imediatamente.
Se não for utilizado imediatamente, a responsabilidade pela conservação e utilização antes da próxima administração cabe ao utilizador, e o tempo não deve exceder 24 horas a uma temperatura entre 2°C e 8°C, a menos que a reconstituição tenha ocorrido em condições assépticas controladas.
O médico não deve utilizar o medicamento XEOMIN se a solução estiver turva ou contiver resíduos do medicamento que não se dissolveram.
Para obter informações sobre como eliminar o medicamento, procure no capítulo destinado aos profissionais de saúde no final deste folheto.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento XEOMIN
- A substância ativa do medicamento é a neurotoxina do Clostridium botulinum tipo A (150 kD), livre de proteínas complexantes.
- XEOMIN, 50 unidades, pó de clostrídio para solução injectável
- Uma ampola contém 50 unidades de neurotoxina do Clostridium botulinum tipo A (150 kD), livre de proteínas complexantes.
- XEOMIN, 100 unidades, pó de clostrídio para solução injectável
- Uma ampola contém 100 unidades de neurotoxina do Clostridium botulinum tipo A (150 kD), livre de proteínas complexantes.
- XEOMIN, 200 unidades, pó de clostrídio para solução injectável
- Uma ampola contém 200 unidades de neurotoxina do Clostridium botulinum tipo A (150 kD), livre de proteínas complexantes.
- Os outros componentes do medicamento são albumina humana e sacarose.
Como é o medicamento XEOMIN e conteúdo da embalagem
XEOMIN é um pó de clostrídio para solução injectável.
O pó é branco.
Após a reconstituição, a solução é clara e incolor.
XEOMIN, 50 unidades, pó de clostrídio para solução injectável:
Tamanhos da embalagem: 1, 2, 3 ou 6 ampolas.
XEOMIN, 100 unidades, pó de clostrídio para solução injectável:
Tamanhos da embalagem: 1, 2, 3, 4 ou 6 ampolas.
XEOMIN, 200 unidades, pó de clostrídio para solução injectável:
Tamanhos da embalagem: 1, 2, 3, 4 ou 6 ampolas.
Nem todos os tamanhos da embalagem podem estar disponíveis no mercado.
Titular da autorização de comercialização
Merz Pharmaceuticals GmbH
Eckenheimer Landstrasse 100
60318 Frankfurt/Main
Alemanha
Tel: +49-69/1503-1
Fax: +49-69/1503-200
Fabricante
Merz Pharma GmbH & Co. KGaA
Eckenheimer Landstrasse 100
60318 Frankfurt/Main
Alemanha
Tel: +49-69/1503-1
Fax: +49-69/1503-200
Este medicamento está autorizado nos Estados-Membros do Espaço Económico Europeu sob os seguintes nomes:
XEOMIN: Áustria, Bulgária, Chipre, Croácia, República Checa, Dinamarca, Estónia, Alemanha, Grécia, Finlândia, França, Hungria, Irlanda, Islândia, Itália, Letónia, Liechtenstein, Lituânia, Luxemburgo, Malta, Países Baixos, Noruega, Polónia, Portugal, Roménia, Eslováquia, Eslovénia, Espanha, Suécia
XEOMEEN: Bélgica
Data da última revisão do folheto: 22.04.2024
Informações destinadas exclusivamente aos profissionais de saúde: Instruções para a reconstituição da solução injectável:
O medicamento XEOMIN é reconstituído antes da administração utilizando uma solução de cloreto de sódio a 9 mg/ml (0,9%) para injeção.
XEOMIN só pode ser utilizado para tratar um doente por sessão de tratamento.
É uma boa prática reconstituir a solução e preparar a seringa sobre um pano de papel revestido com plástico no caso de derramamento do medicamento.
Deve ser aspirada a quantidade adequada de solução de cloreto de sódio (ver tabela de diluições).
Recomenda-se utilizar uma agulha curta e cortada (20-27 G) para reconstituir a solução.
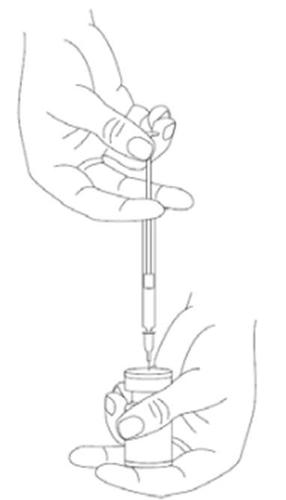
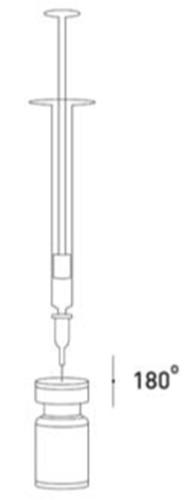
A agulha deve ser inserida no bung atentamente, sob um ângulo de 90 graus, permitindo que o solvente seja aspirado lentamente para a ampola.
Deve ser descartada a ampola se o solvente não for aspirado para a ampola devido à pressão de vácuo.
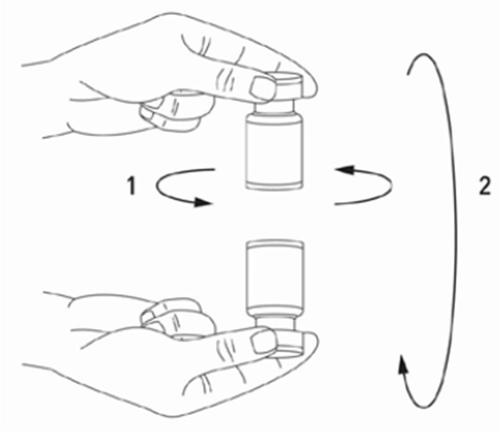
Deve ser separada a seringa da ampola e misturada a solução de XEOMIN com o solvente, agitando suavemente a ampola e girando-a/pressionando-a - não deve ser feito movimento brusco.
Se necessário, a agulha utilizada para reconstituir a solução deve permanecer na ampola, e a quantidade adequada da solução deve ser aspirada utilizando uma seringa estéril e nova.
Após a reconstituição, o medicamento XEOMIN é uma solução clara e incolor.
Não deve ser utilizado o medicamento XEOMIN se a solução reconstituída (preparada como descrito acima) estiver turva ou contiver resíduos do medicamento que não se dissolveram.
Deve ser feito um esforço para utilizar o volume correto de solvente necessário para preparar a dose desejada, a fim de evitar a administração acidental de uma dose excessiva.
Se forem utilizadas diferentes apresentações de XEOMIN durante um procedimento de injeção, deve-se ter cuidado para utilizar a quantidade correta de solvente necessária para obter o número desejado de unidades por 0,1 ml.
A quantidade de solvente é diferente para XEOMIN 50 unidades, XEOMIN 100 unidades e XEOMIN 200 unidades.
Cada seringa também deve ser adequadamente rotulada.
As concentrações possíveis para XEOMIN 50, 100 e 200 unidades estão na tabela abaixo:
| Dose obtida (unidades por 0,1 ml) | Solvente adicionado (solução de cloreto de sódio 9 mg/ml (0,9%) para injeção) | ||
| Ampola contendo 50 unidades | Ampola contendo 100 unidades | Ampola contendo 200 unidades | |
| 20 unidades | 0,25 ml | 0,5 ml | 1 ml |
| 10 unidades | 0,5 ml | 1 ml | 2 ml |
| 8 unidades | 0,625 ml | 1,25 ml | 2,5 ml |
| 5 unidades | 1 ml | 2 ml | 4 ml |
| 4 unidades | 1,25 ml | 2,5 ml | 5 ml |
| 2,5 unidades | 2 ml | 4 ml | não aplicável |
| 2 unidades | 2,5 ml | 5 ml | não aplicável |
| 1,25 unidades | 4 ml | não aplicável | não aplicável |
Instruções para a eliminação
A solução para injeção armazenada por mais de 24 horas e a solução para injeção não utilizada devem ser eliminadas.
Procedimentos para a eliminação segura de ampolas, seringas e materiais utilizados
As ampolas não utilizadas, os resíduos da solução reconstituída e (ou) as seringas devem ser esterilizados em um autoclave.
Alternativamente, a inativação de qualquer resíduo do medicamento XEOMIN pode ser realizada adicionando uma das seguintes soluções: 70% de etanol, 50% de isopropanol, 0,1% de SDS (detergente aniônico), solução diluída de hidróxido de sódio (0,1 N NaOH) ou solução diluída de hipoclorito de sódio (pelo menos 0,1% NaOCl).
Após a inativação, as ampolas utilizadas, as seringas e os materiais não devem ser esvaziados, mas devem ser colocados em recipientes adequados e eliminados de acordo com as regulamentações locais.
Recomendações para procedimentos em caso de incidentes imprevistos durante a administração da toxina botulínica tipo A
- Qualquer vazamento do medicamento deve ser limpo imediatamente: no caso do pó, com um material absorvente, embebido em uma das soluções acima, ou no caso do medicamento reconstituído, com um material absorvente seco.
- A superfície contaminada deve ser limpa com um material absorvente embebido em uma das soluções acima e, em seguida, seca.
- Se a ampola estiver quebrada, siga as instruções acima. Tenha cuidado para recolher os pedaços de vidro quebrado e evitar cortes.
- Se o medicamento entrar em contato com a pele, lave o local de contato com muita água.
- Se o medicamento entrar em contato com os olhos, lave os olhos com muita água ou com uma solução de lavagem de olhos.
- Se o medicamento entrar em contato com uma ferida, corte ou fenda na pele, lave o local com muita água.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorMerz Pharma GmbH & Co. KGaA
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a XeominForma farmacêutica: Solução, 200 U Speywood/mlSubstância ativa: botulinum toxinRequer receita médicaForma farmacêutica: Pó, 125 unidades SpeywoodSubstância ativa: botulinum toxinRequer receita médicaForma farmacêutica: Pó, 125 unidades SpeywoodSubstância ativa: botulinum toxinRequer receita médica
Alternativas a Xeomin noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Xeomin em Ukraine
Alternativa a Xeomin em Espanha
Médicos online para Xeomin
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Xeomin – sujeita a avaliação médica e regras locais.














