
Urapidil Kalceks

Pergunte a um médico sobre a prescrição de Urapidil Kalceks

Como usar Urapidil Kalceks
Folheto informativo: informação para o utilizador
Urapidil KALCEKS, 25 mg, solução para injeção/infusão
Urapidil KALCEKS, 50 mg, solução para injeção/infusão
Urapidil
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Se tiver alguma dúvida adicional, deve consultar um médico ou enfermeiro.
- Se o doente apresentar algum efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é Urapidil KALCEKS e para que é utilizado
- 2. Informações importantes antes de tomar Urapidil KALCEKS
- 3. Como tomar Urapidil KALCEKS
- 4. Efeitos secundários possíveis
- 5. Como conservar Urapidil KALCEKS
- 6. Conteúdo da embalagem e outras informações
1. O que é Urapidil KALCEKS e para que é utilizado
Urapidil KALCEKS contém a substância ativa urapidil. Urapidil é um medicamento que baixa a pressão arterial (anti-hipertensivo), que pertence a um grupo de medicamentos chamados "alfa-adrenolíticos". Este medicamento tem um efeito nos vasos sanguíneos (ou seja, artérias e veias). Baixa a pressão arterial reduzindo a tensão dos vasos sanguíneos.
Este medicamento é utilizado em adultos:
- em situações de aumento súbito da pressão arterial (por exemplo, aumento súbito e grave da pressão arterial chamado "crise hipertensiva");
- no tratamento de hipertensão arterial grave a muito grave ou hipertensão arterial resistente ao tratamento;
- para reduzir a pressão arterial elevada durante e após operações cirúrgicas.
2. Informações importantes antes de tomar Urapidil KALCEKS
Quando não tomar Urapidil KALCEKS
- se o doente tiver alergia a urapidil ou a qualquer outro componente deste medicamento (listado no ponto 6);
- se o doente tiver estreitamento da artéria principal (estenose aórtica) ou anomalias dos vasos sanguíneos, chamadas "fístula vascular" (com exceção de fístula arteriovenosa em doentes em diálise);
- se a doente estiver a amamentar.
Precauções e advertências
Se a pressão arterial cair muito rapidamente, podem ocorrer diminuição da frequência cardíaca ou paragem cardíaca.
Antes de tomar este medicamento, deve discutir com o médico ou enfermeiro se algum dos seguintes pontos se aplica ao doente, pois é recomendada uma precaução especial:
- se o doente tiver apresentado diarreia ou vómitos (ou outros estados que causem diminuição do volume de líquidos no organismo);
- em doentes com insuficiência cardíaca, cuja causa é lesão mecânica, por exemplo, estreitamento da válvula cardíaca (estenose da válvula aórtica ou mitral);
- em doentes com obstrução da artéria pulmonar (embolia pulmonar);
- em doentes com distúrbios da função cardíaca causados por inflamação do saco que rodeia o coração (doença do saco do coração);
- em doentes com distúrbios do fígado;
- em doentes com distúrbios moderados a graves da função renal;
- em doentes idosos;
- em doentes que tomam cimetidina (medicamento que inibe a produção de ácido estomacal). Se o doente não tiver certeza se algum dos pontos acima se aplica, deve consultar um médico ou enfermeiro.
Se o doente for submeter a uma operação ocular de catarata (opacidade do cristalino), deve informar o oftalmologista de que está a tomar ou tomou anteriormente urapidil. Isto porque o urapidil pode causar complicações durante a operação que podem ser evitadas se o especialista estiver preparado para tal.
Se antes da administração de urapidil for administrado outro medicamento para baixar a pressão arterial, o médico deve esperar o tempo necessário para que o medicamento anterior tenha efeito. O médico reduzirá a dose de urapidil. A queda demasiado rápida da pressão arterial pode levar a uma diminuição ou paragem da frequência cardíaca.
Crianças e jovens
Este medicamento não deve ser utilizado em crianças e jovens.
Urapidil KALCEKS e outros medicamentos
Deve informar o médico ou enfermeiro de todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como de qualquer medicamento que o doente planeie tomar.
Antes de tomar este medicamento, deve informar o médico ou enfermeiro se o doente está a tomar algum dos seguintes medicamentos, pois podem interagir com Urapidil KALCEKS, alterando a ação dos medicamentos ou aumentando a probabilidade de efeitos secundários:
- alfa-adrenolíticos (utilizados no tratamento de doenças do trato urinário relacionadas com a doença da próstata);
- qualquer medicamento para baixar a pressão arterial;
- cimetidina (utilizada para inibir a produção de ácido estomacal);
- barbitúricos (medicamentos utilizados no tratamento de epilepsia).
Urapidil KALCEKS e álcool
O álcool pode aumentar a ação deste medicamento.
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeite que possa estar grávida ou planeie ter um filho, deve consultar um médico antes de tomar este medicamento.
Não há dados suficientes para avaliar a segurança do uso de urapidil em mulheres grávidas.
Não deve ser utilizado durante a gravidez, a menos que seja absolutamente necessário devido ao estado clínico da mulher. Se durante a gravidez ocorrer hipertensão arterial e for necessário tratar com este medicamento, a redução da pressão arterial deve ser gradual e sempre controlada por um médico.
Não se sabe se o medicamento passa para o leite materno. Por razões de segurança, não deve ser utilizado durante a amamentação.
Este medicamento não é recomendado para mulheres em idade fértil que não usem métodos anticoncepcionais.
Estudos em animais mostraram que o urapidil afeta a fertilidade. No entanto, o significado deste efeito para humanos não é conhecido.
Condução de veículos e utilização de máquinas
Este medicamento pode afetar a capacidade de conduzir veículos e utilizar máquinas, especialmente durante o início do tratamento, quando a dose for aumentada, quando o tratamento for alterado ou em combinação com álcool.
Urapidil KALCEKS contém propilenoglicol (E1520) e sódio
Propilenoglicol:
- Este medicamento contém 500 mg de propilenoglicol por 5 ml de solução e 1.000 mg de propilenoglicol por 10 ml de solução, o que corresponde a 100 mg/ml.
- Se a doente estiver grávida ou a amamentar, não deve ser administrado este medicamento, a menos que seja recomendado pelo médico. O médico pode realizar controles adicionais durante a administração deste medicamento.
- Se o doente tiver doenças do fígado ou rins, não deve tomar este medicamento, a menos que seja recomendado pelo médico. O médico pode realizar controles adicionais durante a administração deste medicamento.
- O propilenoglicol contido neste medicamento pode causar sintomas como após a ingestão de álcool e aumentar a probabilidade de efeitos secundários. Sódio:
- O medicamento contém menos de 1 mmol (23 mg) de sódio por ml, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar Urapidil KALCEKS
Como tomar o medicamento
- Este medicamento será administrado por pessoal médico qualificado.
- Este medicamento será administrado por injeção ou infusão intravenosa. Pode ser administrado como injeções únicas ou múltiplas ou como infusões prolongadas. As injeções podem ser seguidas de infusões prolongadas.
- Durante a administração deste medicamento, o doente deve estar deitado.
- Durante o tratamento, a pressão arterial do doente será constantemente controlada.
Dosagem
O médico decidirá a dose adequada com base no estado do doente.
Crise hipertensiva e hipertensão arterial grave a muito grave ou hipertensão arterial resistente ao tratamento
Injeção intravenosa
É administrado lentamente 10-50 mg de urapidil - com monitorização constante da pressão arterial. A redução da pressão arterial pode ser esperada dentro de 5 minutos após a injeção. Dependendo da resposta da pressão arterial, a injeção de urapidil pode ser repetida.
Infusão intravenosa (por gotejamento ou por bomba de infusão)
Na infusão intravenosa contínua, 250 mg de urapidil são adicionados a 500 ml de solução de infusão compatível (0,9% de solução de cloreto de sódio ou 5% ou 10% de solução de glicose).
Na bomba de infusão, 100 mg de urapidil são retirados para a bomba de infusão e diluídos em 50 ml de solução de infusão compatível (ver acima) (máximo 4 mg de urapidil por ml de solução de infusão).
A velocidade inicial de infusão é de 2 mg/min. A dose de manutenção é de 9 mg/hora. O grau de redução da pressão arterial é determinado com base na dose administrada nos primeiros 15 minutos. Em seguida, o nível desejado de pressão arterial pode ser mantido com doses significativamente menores.
Redução da pressão arterial elevada durante e após operações cirúrgicas
A fim de manter o nível de pressão arterial alcançado com a injeção, é utilizada infusão contínua por bomba de infusão ou infusão intravenosa contínua.
Por injeção intravenosa
Inicialmente, é administrado 25 mg de urapidil. Esta dose será repetida se, após 2 minutos, não for alcançada uma redução suficiente da pressão arterial. Se, após 2 minutos da segunda dose, a queda da pressão arterial for ainda insuficiente, é administrado 50 mg de urapidil.
Se a redução da pressão arterial após 2 minutos da dose for suficiente, o doente receberá uma dose de manutenção.
Infusão intravenosa (por gotejamento ou por bomba de infusão)
Inicialmente, é administrado até 6 mg em 1-2 minutos. Em seguida, a dose é reduzida.
Grupos especiais de doentes
Em doentes com doenças do fígado e/ou rins, pode ser necessário reduzir a dose.
Em doentes idosos, este medicamento deve ser administrado com precaução especial, inicialmente em doses pequenas, devido à sensibilidade alterada desses doentes a medicamentos desta classe.
Duração do tratamento
A duração do tratamento com este medicamento não deve exceder 7 dias.
Uso de mais do que a dose recomendada de Urapidil KALCEKS
Se o doente receber uma dose excessiva deste medicamento, podem ocorrer tonturas, sensação de vazio na cabeça ou desmaio ao levantar-se, fadiga e tempo de reação prolongado. Nesse caso, o doente deve deitar-se de costas com as pernas elevadas. Se os sintomas não desaparecerem, deve informar imediatamente o médico ou enfermeiro.
Se tiver alguma dúvida sobre a utilização deste medicamento, deve consultar um médico ou enfermeiro.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não em todos os doentes.
Na maioria dos casos, os efeitos secundários mencionados abaixo estavam relacionados com a queda demasiado rápida da pressão arterial, no entanto, a experiência até ao momento mostra que mesmo durante a infusão lenta desaparecem dentro de alguns minutos. O médico decidirá se deve interromper ou não o tratamento, dependendo da gravidade dos efeitos secundários.
Frequentes(podem ocorrer em até 1 em cada 10 doentes)
Tonturas, dor de cabeça, náuseas.
Pouco frequentes(podem ocorrer em até 1 em cada 100 doentes)
Distúrbios do sono, palpitações, diminuição ou aumento da frequência cardíaca, sensação de aperto ou dor no peito (como na angina de peito), dificuldade em respirar, queda da pressão arterial ao levantar-se da posição sentada ou deitada (hipotensão ortostática), vómitos, diarreia, secura na boca, suor, fadiga, batimentos cardíacos irregulares.
Raros(podem ocorrer em até 1 em cada 1.000 doentes)
Congestão nasal, reações alérgicas (coceira, vermelhidão da pele, erupções cutâneas), ereção prolongada e dolorosa.
Muito raros(podem ocorrer em até 1 em cada 10.000 doentes)
Ansiedade, aumento da necessidade de urinar, incontinência urinária acentuada, diminuição do número de plaquetas (células sanguíneas que participam da coagulação do sangue).
Frequência não conhecida(frequência não pode ser estimada com base nos dados disponíveis)
Urticária, reação alérgica grave com inchaço do rosto, lábios, língua e garganta.
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, deve informar o médico ou enfermeiro.
Isto inclui quaisquer efeitos secundários não mencionados neste folheto.
Os efeitos secundários também podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde
Rua Jerozolimskie 181C
PL-02 222 Varsóvia
Telefone: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio da Internet: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários ajudará a obter mais informações sobre a segurança do medicamento.
5. Como conservar Urapidil KALCEKS
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não há recomendações especiais para a conservação do medicamento.
Após a diluição
Verificou-se a estabilidade química e física durante 50 horas a 25°C e a 2-8°C após a diluição em 9 mg/ml (0,9%) de solução de cloreto de sódio ou 50 mg/ml (5%) ou 100 mg/ml (10%) de solução de glicose para infusão.
Do ponto de vista microbiológico, a solução diluída deve ser utilizada imediatamente. Se não for utilizada imediatamente, o utilizador é responsável pelo tempo e condições de conservação antes da utilização, que normalmente não deve exceder 24 horas a 2-8°C, a menos que a diluição tenha sido feita em condições assépticas controladas e validadas..
Não deve ser utilizado após o prazo de validade impresso na caixa de cartão após "Validade" e na ampola após "EXP". O prazo de validade é o último dia do mês indicado.
Os medicamentos não devem ser eliminados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam necessários. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Urapidil KALCEKS
- A substância ativa é urapidil. 1 ml de solução contém 5 mg de urapidil. Cada ampola de 5 ml de solução contém 25 mg de urapidil. Cada ampola de 10 ml de solução contém 50 mg de urapidil.
- Os outros componentes são: ácido clorídrico concentrado, fosfato de sódio di-hidratado, fosfato de sódio di-hidratado, propilenoglicol, hidróxido de sódio (para ajustar o pH), água para injeção.
Como é Urapidil KALCEKS e que conteúdo tem a embalagem
As ampolas são de vidro incolor tipo I, com capacidade de 5 ml ou 10 ml com ponto de ruptura ( one point
cut). 5 ampolas são embaladas em uma embalagem. O conjunto é embalado em uma caixa de cartão.
Nem todos os tipos de embalagens podem estar disponíveis no mercado.
Titular da autorização de comercialização e fabricante
AS KALCEKS
Rua Krustpils 71E
LV-1057 Riga
Letônia
Este medicamento está autorizado para comercialização nos países membros da Área Econômica Europeia sob as seguintes denominações:
Estônia, República Checa, Itália, Portugal
Urapidil Kalceks
Áustria
Urapidil Kalceks 25 mg, 50 mg Injektions-/Infusionslösung
Alemanha
Urapidil Ethypharm 25 mg, 50 mg Injektions-/Infusionslösung
Espanha
Urapidil Kalceks 5 mg/ml solución inyectable y para perfusión
França
URAPIDIL KALCEKS 25 mg/5 ml, solution injectable/pour perfusion
URAPIDIL KALCEKS 50 mg/10 ml, solution injectable/pour perfusion
Hungria
Urapidil Kalceks 25 mg, 50 mg oldatos injekció vagy infúzió
Letônia
Urapidil Kalceks 25 mg, 50 mg šķīdums injekcijām/infūzijām
Países Baixos
Urapidil Kalceks 25 mg, 50 mg oplossing voor injectie/infusie
Polônia
Urapidil KALCEKS
Romênia
Urapidil Kalceks 25 mg, 50 mg soluție injectabilă/perfuzabilă
Eslováquia
Urapidil Kalceks 25 mg, 50 mg injekčný/infúzny roztok
Data da última revisão do folheto: 01/2022
---------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Dosagem
Crise hipertensiva e hipertensão arterial grave a muito grave ou hipertensão arterial resistente ao tratamento
- Injeção intravenosaÉ administrado lentamente 10-50 mg de urapidil - com monitorização constante da pressão arterial. A redução da pressão arterial pode ser esperada dentro de 5 minutos após a injeção. Dependendo da resposta da pressão arterial, a injeção de urapidil pode ser repetida.
- Infusão intravenosa ou infusão contínua com bomba de infusão
A infusão intravenosa contínua é utilizada para manter a pressão arterial alcançada com a injeção do medicamento. Para obter as instruções de preparo da solução diluída, ver "Instruções de uso e eliminação" e "Preparo da solução diluída" abaixo.
A quantidade máxima de urapidil é de 4 mg por ml de solução de infusão.
Velocidade de administração
A velocidade de infusão depende dos valores individuais de pressão arterial do doente.
A velocidade inicial de administração é de 2 mg/min.
O grau de redução da pressão arterial depende da dose administrada nos primeiros 15 minutos. Em seguida, o nível desejado de pressão arterial pode ser mantido com doses significativamente menores.
Dose de manutenção: 9 mg/hora, correspondente a 250 mg de urapidil adicionados a 500 ml de solução de infusão, o que corresponde a 1 mg = 44 gotas = 2,2 ml.
Controle da redução da pressão arterial em caso de aumento da pressão durante e (ou) após a operação cirúrgica
Modo de administração
Administração intravenosa.
Urapidil KALCEKS é administrado intravenosamente por injeção ou infusão, e o doente deve estar deitado. A dose é administrada como injeção única ou múltipla, bem como infusão lenta. As injeções podem ser seguidas de infusões lentas.
Na superposição com a terapia parenteral aguda, é possível mudar para a terapia de manutenção com medicamentos anti-hipertensivos orais.
Para evitar efeitos tóxicos, o tratamento não deve ser utilizado por mais de 7 dias, o que também se aplica à terapia parenteral anti-hipertensiva.
Em caso de recorrência da hipertensão, o tratamento parenteral pode ser repetido.
Incompatibilidades
Este medicamento não deve ser misturado com soluções alcalinas para injeção ou infusão, pois pode ocorrer turvação ou floculação devido às propriedades ácidas da solução.
Este medicamento não deve ser misturado com outros medicamentos, exceto os mencionados abaixo.
Instruções de uso e eliminação
Apenas para uso único.
Deve ser utilizado imediatamente após a abertura da ampola. Deve ser eliminado todo o conteúdo não utilizado.
Este medicamento deve ser verificado visualmente antes do uso. Apenas pode ser administrado se a solução for transparente e livre de partículas.
Preparo da solução diluída
- Injeção intravenosa:deve ser adicionado 250 mg de urapidil a 500 ml de uma das soluções de infusão compatíveis (ver abaixo).
- Bomba de infusão:20 ml de solução para injeção/infusão (= 100 mg de urapidil) deve ser retirado para a bomba de infusão e diluído em 50 ml de solução de infusão compatível (ver abaixo).
Pode ser diluído com:
- 9 mg/ml (0,9%) de solução de cloreto de sódio para infusão;
- 50 mg/ml (5%) de solução de glicose para infusão;
- 100 mg/ml (10%) de solução de glicose para infusão.
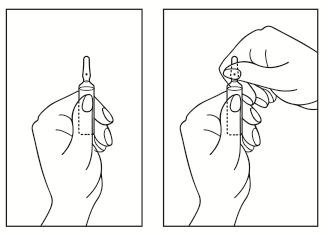
Instruções de abertura da ampola
- 1) Girar a ampola com o ponto colorido para cima. Se no topo da ampola houver solução, deve-se bater levemente com o dedo para que toda a solução se desloque para a parte inferior da ampola.
- 2) Utilizar as duas mãos para abrir a ampola; segurando a parte inferior da ampola com uma mão, com a outra mão quebrar a parte superior da ampola na direção do ponto colorido (ver imagem abaixo).
Todos os resíduos não utilizados do medicamento ou seus dejetos devem ser eliminados de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorAS Kalceks
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Urapidil KalceksForma farmacêutica: Solução, 5 mg/mlSubstância ativa: urapidilFabricante: Takeda Austria GmbHNão requer receita médicaForma farmacêutica: Solução, 25 mgSubstância ativa: urapidilFabricante: Cenexi EVER Neuro Pharma GmbHRequer receita médicaForma farmacêutica: Solução, 50 mgSubstância ativa: urapidilFabricante: Cenexi EVER Neuro Pharma GmbHRequer receita médica
Alternativas a Urapidil Kalceks noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Urapidil Kalceks em Ukraine
Alternativa a Urapidil Kalceks em Espanha
Médicos online para Urapidil Kalceks
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Urapidil Kalceks – sujeita a avaliação médica e regras locais.










