
Prilotekal

Pergunte a um médico sobre a prescrição de Prilotekal

Como usar Prilotekal
Folheto informativo para o doente
Prilotekal
20 mg/ml, solução para injeção
Cloridrato de prilocaína
Deve ler atentamente o folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
Deve guardar este folheto para poder relê-lo se necessário.
Deve consultar um médico ou farmacêutico se tiver alguma dúvida adicional.
Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é Prilotekal e para que é utilizado
- 2. Informações importantes antes de tomar Prilotekal
- 3. Como tomar Prilotekal
- 4. Efeitos não desejados
- 5. Como conservar Prilotekal
- 6. Conteúdo da embalagem e outras informações
1. O que é Prilotekal e para que é utilizado
Prilotekal 20 mg/ml solução para injeção é um tipo de medicamento chamado de anestésico local,
pertence ao grupo dos amidas e é uma solução para injeção. Prilotekal solução para injeção é
utilizado para anestesiar certas partes do corpo e prevenir a dor durante a operação em adultos.
Prilotekal é injetado na parte inferior da espinha do doente. Ajuda a parar rapidamente a dor
no doente da cintura para baixo por um curto período de tempo (procedimentos cirúrgicos de curta duração).
2. Informações importantes antes de tomar Prilotekal
Quando não tomar Prilotekal
se o doente tiver alergia (hipersensibilidade) ao cloridrato de prilocaína, a outros medicamentos anestésicos locais do grupo das amidas ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6), se o doente tiver problemas graves de condução cardíaca, se o doente tiver anemia aguda, se o doente tiver insuficiência cardíaca descompensada, se o doente tiver choque hipovolêmico e cardiogênico, se o doente tiver metemoglobinemia congênita ou adquirida, se o doente tiver contraindicações gerais ou específicas para a técnica de anestesia subaracnoide. Não se deve administrar Prilotekal por via intravascular. Não se deve administrar Prilotekal a crianças menores de 6 meses.
- Prilotekal não é recomendado para uso em crianças e adolescentes. A eficácia e segurança de Prilotekal em crianças e adolescentes não foram estabelecidas.
Precauções e advertências
Se o doente tiver alguma das condições abaixo, deve informar o médico antes de tomar o medicamento.
se o doente já teve uma reação não desejada a um medicamento anestésico local
se o doente tiver uma infecção da pele no local da injeção ou perto dele
se o doente tiver alguma das seguintes condições:
- doenças do sistema nervoso central, como meningite, poliomielite e problemas com a medula espinhal devido à anemia,
- dor de cabeça forte,
- tumores cerebrais, medula ou outros,
- tuberculose da medula espinhal,
- lesão recente da medula espinhal,
- pressão arterial muito baixa ou volume de sangue reduzido,
- problemas de coagulação do sangue,
- porfiria aguda,
- líquido nos pulmões,
- septicemia (infecção do sangue).
- se o doente tiver doença cardíaca (por exemplo, bloqueio total ou parcial do coração, insuficiência cardíaca descompensada, arritmia)
- se o doente tiver problemas de fígado ou rins
- se o doente tiver doença neurológica, como esclerose múltipla, paralisia, paralisia transversa ou distúrbios neuromusculares
- se o doente tiver fraqueza geral do organismo. A anestesia espinhal só pode ser administrada por um médico com conhecimento e experiência necessários. O médico é responsável por tomar as medidas necessárias para evitar a injeção no vaso sanguíneo e ter as habilidades para diagnosticar e tratar efeitos não desejados.
Crianças e adolescentes
Prilotekal não é recomendado para uso em crianças e adolescentes. A eficácia e segurança de Prilotekal em crianças e adolescentes não foram estabelecidas. Dados sobre isso não estão disponíveis.
O uso de Prilotekal em crianças menores de 6 meses é contraindicado devido ao risco aumentado de desenvolver metemoglobinemia.
Interações com outros medicamentos
O doente deve informar o médico sobre todos os medicamentos que está tomando atualmente ou recentemente, e também sobre os medicamentos que planeja tomar, incluindo os medicamentos que são vendidos sem receita.
Em particular, quando se trata de medicamentos usados para tratar arritmias cardíacas (medicamentos antiarrítmicos da classe III) e analgésicos.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, achar que pode estar grávida ou planejar ter um filho, deve consultar um médico, que decidirá se deve ou não receber Prilotekal por injeção.
Não administrar prilocaína para anestesia local ou regional durante o parto.
Não se sabe se a prilocaína passa para o leite materno. A amamentação pode ser retomada após 24 horas da administração do medicamento.
Condução de veículos e uso de máquinas
Não se deve conduzir veículos ou operar máquinas, pois Prilotekal pode afetar as reações e a coordenação muscular por algum tempo.
Prilotekal contém sódio
O medicamento contém menos de 1 mmol (23 mg) de sódio por dose (dose máxima correspondente a 4 ml de solução para injeção de Prilotekal), ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar Prilotekal
Este medicamento é administrado ao doente por um médico, que determinará a dose adequada para o doente.
A dose usualmente administrada em adultos é de 40-60 mg de cloridrato de prilocaína (2-3 ml de Prilotekal);
a dose máxima é de 80 mg de cloridrato de prilocaína (4 ml de Prilotekal).
O médico injeta Prilotekal na parte inferior da espinha do doente, e o doente assume uma posição sentada ou deitada.
Prilotekal não é recomendado para uso em crianças e adolescentes. A segurança e eficácia de Prilotekal em crianças e adolescentes não foram estabelecidas.
O uso de Prilotekal em crianças menores de 6 meses é contraindicado devido ao risco aumentado de desenvolver metemoglobinemia.
Em doentes com mau estado geral e doenças concomitantes (por exemplo, doença vascular, aterosclerose, neuropatia diabética e mau estado do fígado ou rins), uma dose reduzida é recomendada.
Em caso de disfunção renal ou hepática, é recomendada a administração de doses mais baixas.
Prilotekal é administrado por via subaracnoide.
O equipamento, medicamentos e pessoal capacitado para lidar com situações de emergência devem estar disponíveis imediatamente.
Em casos raros, após a administração de medicamentos anestésicos locais, foram relatados efeitos graves, mesmo na ausência de hipersensibilidade no histórico do doente.
Superdose de Prilotekal
É improvável que o doente receba uma dose excessiva de Prilotekal se o medicamento for administrado por um médico experiente em anestesia espinhal.
No entanto, se uma dose for administrada acidentalmente por via intravascular, o doente pode desenvolver problemas de visão ou audição, tremores musculares, convulsões e perda de consciência em um curto período de tempo.
Em qualquer caso, se o doente receber Prilotekal, o equipamento adequado para o tratamento deve estar disponível em caso de superdose.
Se tiver alguma dúvida adicional sobre a administração deste medicamento, deve consultar um médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, Prilotekal pode causar efeitos não desejados, embora não todos os doentes os experimentem.
Como ocorre com todos os medicamentos anestésicos locais, podem ocorrer frequentemente hipotensão e bradicardia.
O doente pode sentir náuseas, ter pressão arterial baixa ou frequência cardíaca lenta.
Outros efeitos não desejados possíveis incluem: dor de cabeça pós-operatória, vômitos e dificuldade para urinar.
Efeitos não desejados possíveis incluem:
Muito frequentes: podem ocorrer em mais de 1 em 10 doentes
Hipotensão, náuseas.
Frequentes: podem ocorrer em até 1 em 10 doentes
Parestesias, tontura, vômitos.
Pouco frequentes: podem ocorrer em até 1 em 100 doentes
Convulsões, parestesias ao redor da boca, perda de consciência, tremores, sensação de formigamento na língua, dificuldade para falar, problemas de audição, zumbido, problemas de visão, dor nas costas, fraqueza muscular transitória.
Bradicardia, hipertensão.
Raros: podem ocorrer em até 1 em 1.000 doentes
Metemoglobinemia, cianose, choque anafilático, reações anafiláticas, reações alérgicas, prurido.
Aracnoidite, neuropatia, alterações nos nervos periféricos.
Visão dupla.
Parada cardíaca, arritmia.
Depressão respiratória.
É improvável que a solução para injeção de Prilotekal cause efeitos graves, a menos que tenha sido administrada incorretamente ou em combinação com outros medicamentos anestésicos locais.
Nesse caso, podem ocorrer: formigamento na língua, tontura, confusão, tremores e convulsões.
Em casos muito raros, após a administração de prilocaína, podem ocorrer: infarto do miocárdio, problemas respiratórios, perda de sensação nas partes inferiores do corpo e reações alérgicas, que podem causar erupções cutâneas, edema ou hipotensão grave.
Um efeito não desejado raro, mas grave, na anestesia espinhal é a bloqueio alto ou total da medula espinhal, com depressão concomitante da função cardiovascular e respiratória.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, o doente deve informar o médico ou farmacêutico.
Efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Al. Jerozolimskie 181C, 02-222 Varsóvia, Tel.: + 48 22 49 21 301, Fax: + 48 22 49 21 309,
Site: https://smz.ezdrowie.gov.pl
Efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar Prilotekal
O medicamento deve ser conservado em um local seguro e fora do alcance das crianças.
Não use Prilotekal após a data de validade impressa nas ampolas e na embalagem exterior.
A data de validade (EXP) refere-se ao último dia do mês.
Não conserve em temperatura superior a 25°C.
Não conserve na geladeira ou congele.
Conservar na embalagem original para proteger da luz.
Use imediatamente após a primeira abertura.
Não use Prilotekal se o doente observar que a solução não é clara e livre de partículas.
Qualquer resíduo não utilizado do medicamento ou seus resíduos deve ser eliminado de acordo com as regulamentações locais.
Devido à restrição de uso em hospitais, a eliminação de resíduos de medicamentos é realizada diretamente pelo hospital.
Esse procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Prilotekal
A substância ativa do medicamento é o cloridrato de prilocaína.
1 ml de solução para injeção contém 20 mg de cloridrato de prilocaína (correspondente a 2%).
1 ampola de 5 ml de solução contém 100 mg de cloridrato de prilocaína.
Os outros componentes são: glicose anidra ou glicose monoidratada, água para injeção, hidróxido de sódio 1N (para ajuste de pH).
Como é Prilotekal e o que a embalagem contém
Solução para injeção.
Solução clara e incolor.
Prilotekal é fornecido em ampolas de vidro incolor tipo I.
Caixa com 10 ampolas, cada uma contendo 5 ml de solução para injeção.
Titular da autorização de comercialização
B.Braun Melsungen AG
Carl-Braun-Strasse 1
34212 Melsungen
Alemanha
Fabricante:
Sirton Pharmaceuticals SPA
Piazza XX Settembre 2
22079 Villa Guardia (CO)
Itália
Sintetica GmbH
Albersloher Weg 11
- 48155 - Münster Alemanha
Este medicamento é autorizado para comercialização nos países membros da Área Econômica Europeia sob as seguintes denominações:
Nome do país membro
Nome do medicamento
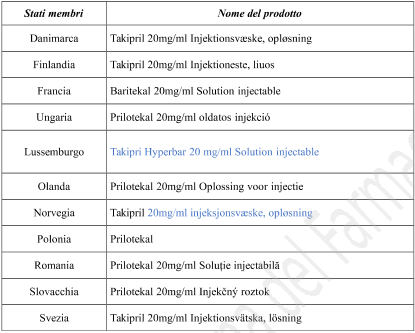
| Nome do País Membro | Nome do medicamento |
| Áustria | Takipril hyperbar 2% Injektionslösung |
| Alemanha | Takipril 20 mg/ml Injektionslösung |
| Itália | Prilotekal |
| Espanha | Takipril hiperbárica, 20mg/ml solución inyectable |
| Reino Unido | Prilotekal 20mg/ml solution for injection |
| Bélgica | Tachipri Hyperbar 20 mg/ml Oplossing voor injectie Tachipri Hyperbar 20 mg/ml Solution injectable Tachipri Hyperbar 20 mg/ml Injektionslösung |
| Bulgária | Takipril 20 mg/ml Инжекционен разтвор |
| República Tcheca | Takiprin |
| Dinamarca | Takipril 20 mg/ml Injektionsvæske, opløsning |
| Finlândia | Takipril 20 mg/ml Injektioneste, liuos |
| França | Baritekal 20 mg/ml Solution injectable |
| Hungria | Prilotekal 20 mg/ml oldatos injekció |
| Luxemburgo | Tachipri Hyperbar 20 mg/ml Solution injectable |
| Países Baixos | Prilotekal 20 mg/ml Oplossing voor injectie |
| Noruega | Takipril 20 mg/ml injeksjonsvæske, oppløsning |
| Polônia | Prilotekal |
| Romênia | Prilotekal 20 mg/ml Soluţie injectabilă |
| Eslováquia | Prilotekal 20 mg/ml Injekčný roztok |
| Suécia | Takipril 20 mg/ml Injektionsvätska, lösning |
Data da última atualização do folheto: setembro de 2020
As seguintes informações são destinadas apenas ao pessoal médico especializado:
{ O ChPL é adicionado no final do folheto impresso, como parte a ser destacada. }
- País de registo
- Substância ativa
- Requer receita médicaNão
- ImportadorSintetica GmbH Sirton Pharmaceuticals SpA.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PrilotekalForma farmacêutica: Creme, (25 mg + 25 mg)/gSubstância ativa: lidocaine, combinationsFabricante: Pierre Fabre Medicament ProductionRequer receita médicaForma farmacêutica: Gel, 0.5 g/100 gSubstância ativa: lidocaineNão requer receita médicaForma farmacêutica: Aerossol, 96 mg/gSubstância ativa: lidocaineFabricante: Aflofarm Farmacja Polska Sp. z o.o.Não requer receita médica
Alternativas a Prilotekal noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Prilotekal em Espanha
Médicos online para Prilotekal
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Prilotekal – sujeita a avaliação médica e regras locais.














