
Furosemid Laboraturios Basi
Pergunte a um médico sobre a prescrição de Furosemid Laboraturios Basi

Como usar Furosemid Laboraturios Basi
Folheto informativo: Informação para o utilizador
Furosemida Laboratórios Basi, 10 mg/mL, solução para injeção/infusão
Furosemida
Deve ler atentamente o conteúdo do folheto antes de administrar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para o poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outras pessoas, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não listados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver secção 4.
Índice do folheto
- 1. O que é Furosemida Laboratórios Basi e para que é utilizado
- 2. Informações importantes antes de receber Furosemida Laboratórios Basi
- 3. Como é administrada a Furosemida Laboratórios Basi
- 4. Efeitos não desejados
- 5. Como conservar Furosemida Laboratórios Basi
- 6. Conteúdo da embalagem e outras informações
1. O que é Furosemida Laboratórios Basi e para que é utilizado
A Furosemida Laboratórios Basi 10 mg/mL solução para injeção/infusão contém a substância ativa furosemida. A furosemida pertence a um grupo de medicamentos conhecidos como diuréticos.
A Furosemida Laboratórios Basi é utilizado no:
- 1. Tratamento de edemas (edema causado por excesso de líquidos no organismo), que ocorrem em doentes com:
- doença hepática
- doença cardíaca (por exemplo, edema pulmonar)
- doença renal
- 2. Tratamento de hipertensão arterial muito elevada (crise hipertensiva).
A Furosemida Laboratórios Basi é indicada para uso em adultos e jovens a partir dos 15 anos de idade. O medicamento pode ser utilizado em lactentes e crianças com menos de 15 anos apenas em casos excepcionais.
Como funciona a Furosemida Laboratórios Basi solução para injeção/infusão
- A solução de Furosemida Laboratórios Basi para injeção/infusão ajuda a eliminar mais água (urina) do que o habitual. Se o excesso de água no organismo não for eliminado, pode causar sobrecarga no coração, vasos sanguíneos, pulmões, rins ou fígado.
2. Informações importantes antes de receber Furosemida Laboratórios Basi
Não deve ser administrada a Furosemida Laboratórios Basi
- se o doente for alérgico à furosemida ou a qualquer outro componente deste medicamento (listados na secção 6).
- se o doente for alérgico a antibióticos da classe das sulfonamidas, como a sulfadiazina e a cotrimoxazol;
- se o doente tiver problemas renais. Em alguns tipos de insuficiência renal, ainda pode ser administrado este medicamento. O médico poderá determinar se o doente pode receber este medicamento;
- se o doente não produzir urina;
- se o doente tiver doença hepática grave;
- se o doente tiver níveis muito baixos de potássio ou sódio no sangue (confirmados por análises ao sangue);
- se o doente tiver redução do volume de sangue (hipovolemia) ou desidratação;
- se a doente estiver a amamentar (ver secção "Gravidez e amamentação").
Advertências e precauções
Antes de receber a Furosemida Laboratórios Basi, deve discutir com o médico ou enfermeiro em caso de:
- baixa pressão arterial;
- diabetes;
- gotas (dor associada à inflamação das articulações) causada por níveis elevados de ácido úrico no sangue;
- obstrução das vias urinárias (por exemplo, próstata aumentada, inchaço do rim devido à retenção de urina, estreitamento do ureter);
- níveis muito baixos de proteínas no sangue, por exemplo, na síndrome nefrótica;
- doença hepática;
- doença renal grave em progressão rápida associada a doença hepática grave (por exemplo, cirrose hepática);
- risco de hipertensão arterial grave não desejada (por exemplo, se o doente tiver doenças vasculares cerebrais ou coronárias);
- doença inflamatória conhecida como "lúpus eritematoso sistémico (LES)";
- doentes idosos que tomam outros medicamentos que podem causar baixa pressão arterial, ou se existirem outras condições associadas ao risco de baixa pressão arterial.
Em particular, durante o tratamento de longa duração, o médico pode controlar regularmente os níveis de potássio, sódio, cálcio, bicarbonato, creatinina, ureia, ácido úrico e glicose no sangue.
A perda de peso devido à perda de líquidos corporais não deve ser superior a 1 kg de peso corporal por dia.
Crianças
Em caso de administração de furosemida a prematuros, pode causar cálculos renais ou calcificações.
Em prematuros, o canal entre a artéria pulmonar e a aorta, que está aberto no feto, pode permanecer aberto.
Furosemida Laboratórios Basi e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
É importante, pois alguns medicamentos não devem ser tomados com furosemida ou pode ser necessário ajustar a dose de furosemida ou de outro medicamento tomado concomitantemente.
Em particular, deve informar o médico ou enfermeiro sobre o uso de:
- lítio (usado no tratamento de distúrbios do humor);
- medicamentos cardíacos (por exemplo, digoxina);
- terfenadina (usada no tratamento de alergias);
- levotiroxina (usada no tratamento de hipotireoidismo);
- medicamentos usados no tratamento da hipertensão arterial, incluindo diuréticos tiazídicos (por exemplo, bendroflumetiazida ou hidroclorotiazida), inibidores da enzima conversora de angiotensina (por exemplo, lisinopril), antagonistas da angiotensina II (por exemplo, losartan);
- medicamentos usados no tratamento da diabetes (por exemplo, metformina e insulina);
- medicamentos anti-inflamatórios, incluindo AINEs (usados no tratamento de dor e inflamação, como diclofenaco, ibuprofeno, indometacina, celecoxibe) e ácido acetilsalicílico em doses elevadas (aspirina);
- corticosteroides (medicamentos usados no tratamento de inflamação ou alergias, por exemplo, prednisolona, dexametasona);
- carbenoxolona (usada no tratamento de úlceras gástricas);
- laxantes;
- cloral hidratado (usado no tratamento de distúrbios do sono);
- fenitoína (usada no tratamento de epilepsia);
- teofilina (usada no tratamento de asma);
- probenecida (usada no tratamento de gota);
- metotrexato (usado no tratamento de alguns tipos de cancro ou artrite reumatoide grave);
- ciclosporina (usada para prevenir a rejeição de transplantes);
- medicamentos que aumentam a pressão arterial (aminas pressoras, como adrenalina, noradrenalina), pois podem não funcionar corretamente quando tomados com furosemida;
- antibióticos (como cefalosporinas, aminoglicosídeos, polimixinas, quinolonas). O efeito dos antibióticos aminoglicosídeos (por exemplo, canamicina, gentamicina e tobramicina) no ouvido pode ser aumentado pela furosemida, especialmente em doentes com problemas renais;
- foscarto (usado no tratamento de doenças causadas por organismos unicelulares conhecidos como protozoários);
- meios de contraste iodados;
- cisplatina (usada na quimioterapia anticancro);
- risperidona (usada no tratamento de distúrbios psiquiátricos).
Furosemida Laboratórios Basi com alimentos
Quantidades elevadas de licorice em combinação com furosemida podem levar a uma perda aumentada de potássio.
Gravidez e amamentação
Se a doente estiver grávida ou a amamentar, suspeitar que pode estar grávida ou planeiar ter um filho, deve consultar o médico antes de administrar este medicamento.
A furosemida não deve ser usada durante a gravidez, a não ser que existam razões médicas claras para isso, pois a furosemida atravessa a barreira placentária. A administração de furosemida durante a gravidez pode levar a um aumento dos níveis de bilirrubina no feto, e consequentemente icterícia e lesões cerebrais no bebê.
A furosemida é excretada no leite materno. Não deve amamentar durante o tratamento com furosemida.
Condução de veículos e utilização de máquinas
Este medicamento pode alterar a capacidade de reação a um grau tal que a capacidade de conduzir veículos, operar máquinas ou realizar tarefas perigosas pode ser prejudicada.
Isso é particularmente verdadeiro no início do tratamento, aumento da dose ou mudança de medicamentos, bem como no caso de consumo de álcool.
Furosemida Laboratórios Basi contém sódio
O medicamento contém menos de 1 mmol (23 mg) de sódio por ampola, ou seja, o medicamento é considerado "livre de sódio".
3. Como é administrada a Furosemida Laboratórios Basi
O médico decidirá a quantidade de medicamento que o doente precisa, quando deve ser administrado e por quanto tempo dura o tratamento.
Isso dependerá da idade, peso, histórico médico, outros medicamentos utilizados e natureza e gravidade da doença.
Sempre será usada a dose mais baixa na qual o efeito desejado é alcançado.
A injeção de furosemida é geralmente administrada por um médico ou enfermeiro:
- como injeção lenta na veia ou
- excepcionalmente no músculo.
Em alguns casos, em vez de injeções, o médico pode recomendar a administração deste medicamento em infusão intravenosa contínua (gotejamento).
Assim que o estado do doente o permitir, será iniciada a administração oral.
Adultos
No tratamento de retenção de líquidos nos tecidos (edema) e (ou) acúmulo de líquido na cavidade abdominal (ascite) devido à doença cardíaca ou hepática, edema causado pela doença renal ou edema pulmonar, a dose inicial é de 20 mg a 40 mg de furosemida.
Em seguida, a dose será gradualmente aumentada para uma dose máxima de 1500 mg por dia.
No tratamento de hipertensão arterial muito elevada, a dose única é de 20 mg a 40 mg de furosemida.
Em adultos, a dose diária máxima de furosemida não deve exceder 1500 mg.
Pessoas idosas
A dose inicial geralmente utilizada em pessoas idosas é de 20 mg por dia.
Adultos com distúrbios renais
Em doentes com distúrbios renais graves (nível de creatinina no sangue > 5 mg/dL), recomenda-se não exceder a velocidade de infusão de 2,5 mg de furosemida por minuto.
Uso em crianças
A dose média geralmente utilizada em crianças é de 0,5 mg de furosemida/kg de peso corporal por dia.
Excepcionalmente, pode ser administrada até 1 mg de furosemida/kg de peso corporal por dia.
Administração de uma dose maior do que a recomendada de Furosemida
Se o doente achar que recebeu uma dose maior do que a recomendada deste medicamento, deve informar imediatamente o médico.
Os sintomas de overdose aguda ou crónica dependem do grau de perda de sal e líquidos.
Os sintomas de overdose incluem secura na boca, aumento da sede, batimentos cardíacos irregulares, alterações de humor, cãibras ou dor muscular, náuseas ou vómitos, fadiga ou fraqueza anormal, pulso fraco ou perda de apetite.
Em caso de dúvidas adicionais sobre a utilização deste medicamento, deve consultar o médico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Em doentes tratados com furosemida, pode ocorrer hipotensão com tonturas, desmaios ou perda de consciência.
Se ocorrerem os seguintes efeitos não desejados, deve contactar imediatamente o médico ou enfermeiro:
- Reação alérgica grave, que pode causar erupções cutâneas, inchaço do rosto, lábios, língua ou garganta, dificuldade em respirar e perda de consciência (reação anafilática ou anafilactoide) (pode ocorrer em menos de 1 em 1.000 doentes);
- Síndrome de Stevens-Johnson, necrólise tóxica epidermal; os sintomas incluem inicialmente manchas vermelhas, semelhantes a alvos ou manchas redondas, frequentemente com bolhas centrais no tronco. Também podem ocorrer úlceras na boca, garganta, nariz, genitálias e olhos (olhos vermelhos e inchados). Estas erupções cutâneas graves podem ser precedidas por febre e sintomas semelhantes aos da gripe. As erupções podem levar a descamação generalizada da pele e complicações que ameaçam a vida ou levar à morte (incidência desconhecida).
- rabdomiólise: doença rara caracterizada por dor, sensibilidade e fraqueza muscular; este dano muscular é frequentemente acompanhado por uma queda grave de potássio (incidência desconhecida).
Outros efeitos não desejados
Muito frequentes(podem ocorrer em mais de 1 em 10 doentes)
- Distúrbios electrolíticos (incluindo sintomáticos), desidratação e redução do volume de sangue circulante, especialmente em pessoas idosas (sintomas como aumento da sede, dor de cabeça, tonturas, desmaios, desorientação, dor ou fraqueza nas articulações ou músculos, cãibras ou espasmos, náuseas ou vómitos, fadiga ou fraqueza anormal, pulso fraco ou perda de apetite); aumento dos níveis de triglicérides no sangue
- Hipotensão, incluindo distúrbios da circulação durante a mudança de posição de deitado para erecto (após administração intravenosa)
- Aumento dos níveis de creatinina no sangue
Frequentes(podem ocorrer em menos de 1 em 10 doentes)
- Concentração do sangue (em caso de perda excessiva de urina)
- Redução dos níveis de sódio e cloreto no sangue, baixos níveis de potássio no sangue, aumento dos níveis de colesterol no sangue, aumento dos níveis de ácido úrico no sangue e agravamento da gota
- Distúrbios da função cerebral em doentes com doença hepática grave (encefalopatia hepática)
- Aumento da produção de urina
Pouco frequentes(podem ocorrer em menos de 1 em 100 doentes)
- Baixa contagem de plaquetas no sangue (trombocitopenia)
- Alteração da tolerância à glicose. Isso pode levar a um agravamento do estado metabólico em doentes com diabetes existente (diabetes manifesto). Pode revelar diabetes não diagnosticada (diabetes latente).
- Distúrbios da audição, embora geralmente sejam condições transitórias, especialmente em doentes com distúrbios renais ou baixos níveis de proteínas no sangue (por exemplo, na síndrome nefrótica) e (ou) se o medicamento for administrado por via intravenosa muito rapidamente
- Surdez (por vezes irreversível)
- Mal-estar
- Coceira, urticária, erupções cutâneas, pele
- Reações da mucosa com vermelhidão, formação de bolhas ou descamação (por exemplo, pênfigo bolhoso, eritema multiforme, pemfigoide, dermatite esfoliativa, líquen plano)
- Aumento da sensibilidade da pele à luz solar
Raros(podem ocorrer em menos de 1 em 1.000 doentes)
- Aumento do número de um tipo de glóbulos brancos (eosinofilia)
- Redução do número de glóbulos brancos (leucopenia)
- Formigamento, dormência ou dor ardente nos membros
- Zumbido nos ouvidos (zumbido)
- vasculite
- Vómitos, diarreia
- Lesões renais (nefrite intersticial)
- Febre
Muito raros(podem ocorrer em menos de 1 em 10.000 doentes)
- Anemia hemolítica devido à destruição anormal das células vermelhas do sangue
- Estado em que a medula óssea deixa de produzir células vermelhas do sangue em número suficiente (anemia aplástica)
- Redução grave do número de certos tipos de glóbulos brancos (agranulocitose). Os sintomas podem incluir febre com calafrios, alterações da mucosa e dor de garganta
- Pancreatite aguda
- Doença hepática conhecida como "colestase intra-hepática"
- Aumento da atividade das enzimas hepáticas no sangue, o que pode causar icterícia (amarelamento da pele, urina escura, fadiga)
Incidência desconhecida(a frequência não pode ser estimada com base nos dados disponíveis)
- Doença conhecida como "lúpus eritematoso sistémico (LES)" pode ser agravada ou reativada.
- Baixos níveis de cálcio no sangue, baixos níveis de magnésio no sangue, redução do pH do sangue (acidose metabólica), síndrome de pseudo-Bartter (insuficiência renal associada ao uso inadequado e (ou) prolongado de furosemida).
Os sintomas frequentemente observados de baixos níveis de sódio no sangue incluem apatia, cãibras nas panturrilhas, perda de apetite, fraqueza, sonolência, vómitos e desorientação.
Os baixos níveis de potássio no sangue podem manifestar-se como fraqueza muscular, distúrbios da sensação nos membros (formigamento, dormência ou dor ardente), incapacidade de mover parte do corpo (paralisia), sintomas gastrointestinais (vómitos, constipação, acúmulo excessivo de gases no trato gastrointestinal), sintomas renais (perda excessiva de urina, sede anormalmente aumentada) e sintomas cardíacos (batimentos cardíacos lentos ou irregulares). A perda grave de potássio pode levar à paralisia intestinal (íleus paralítico) ou distúrbios da consciência, e até à coma.
Os baixos níveis de cálcio no sangue podem, em casos raros, levar à tetania. Em casos raros, a redução do magnésio no sangue foi associada à tetania ou distúrbios do ritmo cardíaco.
- Tonturas, desmaios e perda de consciência, dor de cabeça
- Trombose, especialmente em doentes idosos
- Perda excessiva de urina, especialmente em doentes idosos e crianças
- Pode ocorrer problemas de circulação (até choque circulatório), manifestados principalmente por dor de cabeça, tonturas, visão turva, secura na boca e sede, hipotensão e distúrbios da circulação durante a mudança de posição de deitado para erecto.
- Reações cutâneas graves (que podem afetar também a mucosa), como erupção generalizada aguda pustulosa (AGEP), erupções medicamentosas com eosinofilia e sintomas sistémicos e reações liquenoides, que se manifestam como pequenas lesões vermelhas-púrpuras pruriginosas na pele, genitálias ou boca.
- Aumento dos níveis de sódio na urina, aumento dos níveis de cloreto na urina, aumento dos níveis de ureia no sangue, sintomas de obstrução das vias urinárias, e até retenção urinária;
- Deposição de cálcio nos rins e (ou) cálculos renais em prematuros, insuficiência renal
- Aumento do risco de persistência do ducto arterioso em prematuros tratados com furosemida nas primeiras semanas de vida
- Dor após injeção no músculo
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não listados neste folheto, deve informar o médico, farmacêutico ou enfermeiro.
Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde
Al. Jerozolimskie 181C
PL-02-222 Varsóvia
Telefone: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio da Internet: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar Furosemida Laboratórios Basi
O medicamento deve ser conservado em local não visível e inacessível às crianças.
Não conservar acima de 25°C.
Conservar na embalagem original para proteger da luz.
Não usar este medicamento após o prazo de validade impresso na caixa: "Prazo de validade EXP". O prazo de validade é o último dia do mês indicado.
Os medicamentos não devem ser eliminados na canalização ou nos contentores de lixo doméstico.
Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa.
Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém a Furosemida Laboratórios Basi
- A substância ativa do medicamento é a furosemida. Cada 1 mL de solução contém 10 mg de furosemida.
- Os outros componentes são cloreto de sódio, hidróxido de sódio (para ajustar o pH) e água para injeção.
Como é a Furosemida Laboratórios Basi e que conteúdo tem a embalagem
Solução clara e incolor, livre de partículas sólidas.
Ampola de vidro laranja tipo I, com ponto de quebra, contendo 2 mL de solução para injeção/infusão, em caixa de cartão.
Tamanhos da embalagem: 50 ampolas
Titular da autorização de comercialização
Laboratórios Basi – Indústria Farmacêutica, S.A.
Parque Industrial Manuel Lourenço Ferreira, Lote 15
3450-232 Mortágua, Portugal
Telefone: +351 231 920 250
Fax: +351 231 921 055
E-mail: [email protected]
Fabricante
Laboratórios Basi – Indústria Farmacêutica SA
Parque Industrial Manuel Lourenço Ferreira Lotes 8, 15 e 16
3450-232 Mortágua
Portugal
Este medicamento está autorizado para comercialização nos países membros do Espaço Económico Europeu sob as seguintes denominações:
Países:
Portugal
Furosemida Basi
República Checa
Furosemida Basi
Polónia
Furosemida Laboratórios Basi
Bulgária
Фуроземид Basi 10 mg//mL Инжекционен/инфузионен разтвор
Lituânia
Furosemide Basi 10 mg//mL Injekcinis ar infuzinis tirpalas
Roménia
Furosemid Basi 10 mg//mL soluţie injectabilă/perfuzabilă
Suécia
Furosemide Basi 10 mg//mL Injektions-/infusionsvätska, lösning
Finlândia
Furosemide Basi 10 mg//mL Injektio-/infuusioneste, liuos
Dinamarca
Furosemid Basi
Noruega
Furosemide Basi 10 mg//mL Injeksjons-/infusjonsvæske, oppløsning
Alemanha
Furosemid Basi 10 mg//mL Injektions-/Infusionslösung
Estónia
Furosemide Basi
Letónia
Furosemide Basi 10 mg//mL šķīdums injekcijām/infūzijām
Data da última revisão do folheto:
------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Incompatibilidades farmacêuticas
Soluções para injeção/infusão que apresentam reação ácida ou ligeiramente ácida e grande capacidade tampão na faixa de acidez, não devem ser misturadas com a solução para injeção/infusão de Furosemida Laboratórios Basi 10 mg/mL.
Em caso de mistura, o valor de pH é deslocado para a faixa ácida, e a furosemida, pouco solúvel, precipita na forma de depósito cristalino.
A solução para injeção/infusão de Furosemida Laboratórios Basi 10 mg//mL não deve ser administrada com outros medicamentos em uma mesma seringa.
Para instruções sobre a diluição do medicamento antes da administração, ver secção "Instruções para a eliminação e preparação do medicamento para uso".
No caso de síndrome nefrótica, a dose deve ser ajustada com cuidado devido ao risco de efeitos não desejados.
Prazo de validade
Após a primeira abertura:
Durante a utilização, o medicamento demonstrou estabilidade física e química por 24 horas à temperatura ambiente.
Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente. Caso contrário, o utilizador é responsável pelo prazo de validade e condições de uso antes da administração.
Prazo de validade após diluição:
Foi demonstrada estabilidade química e física por 24 horas a 25°C.
Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente. Se não for usado imediatamente, o utilizador é responsável pelo prazo de validade e condições de armazenamento durante a utilização.
Instruções para a eliminação e preparação do medicamento para uso
Apenas para uso único.
O medicamento deve ser usado imediatamente após a abertura da ampola. O conteúdo restante deve ser eliminado após a utilização.
O medicamento deve ser inspecionado antes da utilização. O medicamento não deve ser usado se houver sinais de deterioração (por exemplo, partículas ou descoloração).
Pode ser diluído com:
- cloreto de sódio 9 mg//mL (0,9%) solução para injeção,
- solução de Ringer,
- solução de Ringer com lactato.
Deve ter cuidado para que o pH da solução utilizada esteja dentro da faixa ligeiramente alcalina para neutra (pH não inferior a 7). Não devem ser utilizadas soluções ácidas, pois podem causar a precipitação da substância ativa (ver secção "Incompatibilidades farmacêuticas").
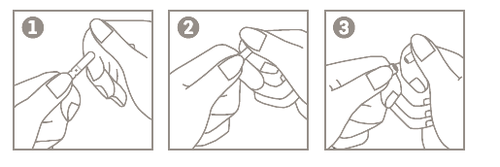
Instruções para abrir as ampolas (com corte em um ponto)
- 1. Segurar o corpo da ampola entre o polegar e o dedo indicador, com a ponta para cima;
- 2. Colocar o dedo indicador da outra mão, apoiando a parte superior da ampola. Posicionar o polegar sobre o ponto de quebra;
- 3. Aproximando os dedos indicadores, pressionar a área marcada com o ponto de quebra para abrir a ampola.
Qualquer resíduo não utilizado do medicamento ou resíduos deve ser eliminado de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorLaboratórios Basi – Indústria Farmaceutica, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Furosemid Laboraturios BasiForma farmacêutica: Solução, 10 mg/mlSubstância ativa: furosemideNão requer receita médicaForma farmacêutica: Solução, 10 mg/mlSubstância ativa: furosemideRequer receita médicaForma farmacêutica: Comprimidos, 40 mgSubstância ativa: furosemideRequer receita médica
Alternativas a Furosemid Laboraturios Basi noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Furosemid Laboraturios Basi em Espanha
Alternativa a Furosemid Laboraturios Basi em Ukraine
Médicos online para Furosemid Laboraturios Basi
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Furosemid Laboraturios Basi – sujeita a avaliação médica e regras locais.










