
TISSEEL SOLUCIONES PARA ADHESIVO TISULAR

Cómo usar TISSEEL SOLUCIONES PARA ADHESIVO TISULAR
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
TISSEEL Soluciones para adhesivo tisular
Fibrinógeno humano, trombina humana, aprotinina sintética, cloruro de calcio dihidrato
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es TISSEEL y para qué se utiliza
- Qué necesita saber antes de empezar a usar TISSEEL
- Cómo usar TISSEEL
- Posibles efectos adversos
- Conservación de TISSEEL
- Contenido del envase e información adicional
1. Qué es TISSEEL y para qué se utiliza
Qué esTISSEEL
TISSEEL es un adhesivo de tejidos de dos componentes que consta de dos soluciones, la solución de proteína sellante y la solución de trombina. TISSEEL contiene fibrinógeno y trombina. Son dos proteínas sanguíneas importantes para la coagulación de la sangre. Cuando estas proteínas se mezclan durante la aplicación, forman un coágulo en el lugar de aplicación.
El coágulo producido por TISSEEL es muy similar al coágulo que se produce de forma natural. Se degrada del mismo modo que un coágulo endógeno (del propio cuerpo) y no deja residuos. Se añade una proteína sintética (aprotinina sintética) para aumentar la duración del coágulo y evitar su degradación prematura.
Para qué se utilizaTISSEEL
TISSEEL se utiliza como tratamiento complementario cuando los métodos quirúrgicos convencionales parecen ser insuficientes:
- para mejorar la hemostasia
- como sellante de tejidos, para mejorar la cicatrización de heridas o sellar suturas en cirugía vascular y en el tracto gastrointestinal
- para adherir tejidos, p. ej., para pegar injertos cutáneos.
TISSEEL es también efectivo en pacientes que reciben tratamiento con el anticoagulante heparina.
2. Qué necesita saber antes de empezar a usar TISSEEL
No use TISSEEL:
- si es alérgico a los principios activos o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- en hemorragia arterial o venosa intensa. La administración única de TISSEEL no está indicado en esta situación
- TISSEEL no se debe inyectar en vasos sanguíneos (venas o arterias). Como TISSEEL forma un coágulo en el lugar de administración, la inyección en un vaso sanguíneo puede producir la formación de coágulos sanguíneos. Si estos coágulos se liberan al flujo sanguíneo pueden provocar complicaciones potencialmente mortales
- TISSEEL no está indicado para reemplazar las suturas de la piel realizadas para cerrar una herida quirúrgica.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar TISSEEL.
Tenga especial cuidado con TISSEEL porque pueden producirse reacciones de hipersensibilidad alérgica.
Entre los primeros síntomas de una reacción alérgica pueden incluirse:
- enrojecimiento transitorio de la piel
- picor
- ronchas
- náuseas, vómitos
- malestar general
- escalofríos
- opresión en el pecho
- hinchazón de labios y lengua
- dificultades para respirar/disnea
- caída de la tensión arterial
- aumento o disminución de la frecuencia del pulso
Si aparecen estos síntomas, debe interrumpirse la aplicación inmediatamente. Los síntomas graves requieren un tratamiento urgente de inmediato.
- TISSEEL contiene una proteína sintética conocida como aprotinina. Aunque esta proteína se aplique solo en cantidades pequeñas y solo en la superficie de la herida, existe un riesgo de reacción alérgica grave. El riesgo parece aumentar en pacientes que antes han recibido TISSEEL o aprotinina, incluso si fue bien tolerada durante la aplicación anterior. Por tanto, cualquier uso de aprotinina o de productos que contengan aprotinina debe incluirse en su historial médico. Debido a que la aprotinina sintética es estructuralmente idéntica a la aprotinina bovina, el uso de TISSEEL en pacientes con alergia a proteínas bovinas se debe evaluar cuidadosamente
- pueden producirse complicaciones potencialmente mortales si se liberan coágulos sanguíneos al flujo sanguíneo a causa de la inyección accidental en un vaso sanguíneo.
- La aplicación intravascular puede aumentar la probabilidad y la gravedad de las reacciones de hipersensibilidad aguda en pacientes susceptibles. En particular, durante la cirugía coronaria el médico debe tener especial cuidado de no inyectar TISSEEL en un vaso sanguíneo. Es igualmente importante evitar la inyección en la mucosa nasal ya que se pueden producir coágulos sanguíneos en la zona de la arteria oftálmica
- en caso de inyección en el tejido hay un riesgo de daño tisular local
- para evitar el sellado de tejidos en zonas no deseadas. Por tanto, antes de la administración, se debe tener cuidado de cubrir todas las partes del cuerpo que no sean la zona que se va a tratar
- la formación de un coágulo de fibrina excesivamente grueso puede afectar negativamente a la eficacia del producto y al proceso de cicatrización de la herida. Por tanto, TISSEEL se debe aplicar en capa fina.
Se debe tener precaución al aplicar un adhesivo tisular de fibrina utilizando gas presurizado.
Se han producido muy raramente casos de embolia gaseosa (aire o gas) (introducción de aire en la circulación sanguínea que puede ser grave o poner en peligro la vida) como consecuencia del uso de equipos pulverizadores con reguladores de presión para aplicar los adhesivos tisulares de fibrina. Estos casos parecen estar relacionados con el uso del equipo de pulverización a presiones superiores a las recomendadas y/o a una distancia muy próxima a la superficie tisular. El riesgo parece ser mayor cuando los adhesivos tisulares de fibrina se pulverizan con aire, en comparación con CO2y, por lo tanto, no se pueden excluir con TISSEEL cuando se pulveriza durante una intervención quirúrgica de una herida abierta.
Los equipos pulverizadores y la punta aplicadora incluyen instrucciones de uso que recomiendan los intervalos de presión y la distancia a la que se debe pulverizar desde la superficie tisular.
TISSEEL se debe administrar exactamente como se especifica en las instrucciones y sólo con los equipos recomendados para este producto.
Siempre que se pulverice TISSEEL, se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígeno yel nivel de CO2 al final de la espiración, para detectar una posible embolia gaseosa.
Cuando se administran medicamentos derivados de plasma o sangre humano, hay que llevar a cabo ciertas medidas para evitar que las infecciones pasen a los pacientes. Tales medidas incluyen:
- una cuidadosa selección de los donantes, para asegurar que se excluyen a aquellos que están en riesgo de ser portadores de enfermedades infecciosas
- análisis de marcadores específicos de infecciones/virus en las donaciones individuales y en las mezclas de plasma
- inclusión de etapas en el proceso de fabricación que puedan eliminar / inactivar virus.
A pesar de estas medidas, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de la infección no se puede excluir totalmente. Esto también se refiere a virus emergentes o de naturaleza desconocida u otros tipos de infecciones.
Estas medidas tomadas se consideran efectivas para virus envueltos como el virus de la inmunodeficiencia humana (VIH), virus de hepatitis B y virus de la hepatitis C y para el virus no envuelto de la hepatitis A. Las medidas tomadas pueden tener un valor limitado frente a virus no envueltos, como por ejemplo, el parvovirus B19. La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para individuos cuyo sistema inmune está deprimido o para pacientes con algún tipo de anemia (por ejemplo enfermedad drepanocítica o anemia hemolítica).
Su médico puede recomendarle que considere la vacunación frente a hepatitis A y B si se le administran de forma regular o repetida sellantes de fibrina derivados de plasma humano.
Se recomienda encarecidamente que, cada vez que se administre una dosis de TISSEEL se deje constancia del nombre del medicamento y número de lote administrado con el fin de mantener un registro de los lotes utilizados.
Otros medicamentosyTISSEEL
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento, incluso los adquiridos sin receta.
No se conocen interacciones con otros medicamentos.
Como sucede con productos parecidos o soluciones de trombina, el producto puede estropearse si entra en contacto con soluciones que contienen alcohol, yodo o metales pesados (p. ej., soluciones antisépticas). Se debe tener cuidado de eliminar esas sustancias en la medida de lo posible antes de aplicar el producto.
Para información sobre las preparaciones que contienen celulosa oxidada, ver Instrucciones de manipulación y preparación.
Uso de TISSEEL con alimentos y bebidas
Pregunte a su médico. Su médico decidirá si puede comer o beber antes de la aplicación de TISSEEL.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Su médico decidirá si puede usar TISSEEL durante el embarazo o la lactancia.
Conducción y uso de máquinas
TISSEEL no afecta a su capacidad para conducir o utilizar máquinas.
Tisseel contiene polisorbato 80
El polisorbato 80 puede causar irritaciones de la piel localizadas como dermatitis de contacto.
3. Cómo usar TISSEEL
El uso de TISSEEL se limita a cirujanos experimentados que hayan sido debidamente formados acerca del uso de TISSEEL.
Antes de aplicar TISSEEL es necesario secar la superficie de la herida utilizando para ello una técnica estándar (por ejemplo, aplicación intermitente de compresas, torundas, el uso de dispositivos de succión).
No se debe utilizar aire o gas presurizado para secar la zona.
TISSEEL solo debe pulverizarse sobre zonas de aplicación que estén visibles.
Al aplicar TISSEEL con un equipo pulverizador, asegúrese de utilizar una presión y una distancia al tejido que estén dentro del intervalo recomendado por el fabricante del modo siguiente:
Presión, distancia y equipos recomendados para la aplicación por pulverización de TISSEEL | |||||
Procedimiento quirúrgico | Equipo pulverizador que se debe utilizar | Puntas aplicadoras que se deben utilizar | Regulador de presión que se debe utilizar | Distancia del tejido de destino recomendada | Presión de pulverización recomendada |
Herida abierta | Equipo pulverizador TISSEEL/Artiss | n.a. | EasySpray | 10-15 cm | 1,5-2,0 bares(21,5-28,5 psi). |
Equipo pulverizador TISSEEL/Artiss, envase de 10 | n.a. | EasySpray | |||
Procedimientos laparoscópicos o mínimamente invasivos | n.a. | Aplicador Duplospray MIS 20 cm | Regulador Duplospray MIS 1,5 bares | 2-5 cm | 1,2-1,5 bares (18-22 psi) |
Aplicador Duplospray MIS 30 cm | |||||
Aplicador Duplospray MIS 40 cm | |||||
Aplicador endoscópico Spray Set 360 con Snaplock | |||||
Aplicador endoscópico Spray Set 360 con anclaje | |||||
Punta remplazable |
Siempre que se pulverice TISSEEL, y debido a que cabe la posibilidad de que se produzca una embolia gaseosa (aire o gas), se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígenoy el nivel de CO2al final de la espiración (ver sección 2).
La dosis que se debe administrar dependerá siempre de sus requisitos individuales.
La dosis depende de una serie de factores como el tipo de intervención quirúrgica, el tamaño de la superficie afectada, el método de aplicación y el número de aplicaciones. Su médico decidirá la cantidad adecuada y aplicará la suficiente para formar una capa fina sobre la lesión. Si la cantidad parece no ser suficiente, la aplicación puede repetirse.
Al aplicar TISSEEL, la coagulación se produce rápidamente. Debe evitarse la aplicación de una nueva capa a una ya existente de TISSEEL, ya que esta nueva capa no se adherirá a la ya existente.
Debe evitarse la aplicación separada del componente de proteína sellante y del componente de trombina.
En los ensayos clínicos, se administraron dosis individuales de 4 a 20 ml.Puede que sea necesario aplicar volúmenes mayores en algunos procedimientos (p. ej., lesiones hepáticas o sellado de grandes superficies quemadas).
Como guía para el sellado de superficies, 1 envase de TISSEEL de 2 ml (1 ml de solución de proteína sellante más 1 ml de solución de trombina) será suficiente, como mínimo, para una superficie de 10 cm2.
Al aplicar TISSEEL con un equipo pulverizador, la misma cantidad será suficiente para cubrir áreas considerablemente mayores.
Para evitar la excesiva formación de tejido de granulación y para asegurar la degradación gradual del adhesivo tisular de fibrina, solo debe aplicarse una capa lo más fina posible de TISSEEL.
Para garantizar una mezcla adecuada del componente de proteína sellante y del componente de trombina, se deben expulsar y desechar las primeras gotas del producto de la cánula de aplicación inmediatamente antes de su uso.
Si usa más TISSEELdel que debe
TISSEEL solo se aplica durante intervenciones quirúrgicas. El médico determinará la cantidad necesaria. No se conocen casos de sobredosis.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Niños
No se ha establecido la seguridad y eficacia del producto en niños.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
En pacientes tratados con adhesivo tisular de fibrina, pueden aparecer reacciones de hipersensibilidad o reacciones alérgicas. Aunque son raras, pueden ser graves.
Los primeros síntomas de una reacción alérgica pueden incluir:
- enrojecimiento transitorio de la piel (“sofocos”)
- picor
- ronchas
- náuseas, vómitos
- dolor de cabeza
- adormecimiento
- inquietud
- ardor y picor en el lugar de aplicación
- cosquilleo
- escalofríos
- opresión en el pecho
- hinchazón de labios, lengua, garganta (que puede dar como resultado dificultad para respirar y/o tragar)
- dificultad para respirar
- tensión arterial baja
- aumento o disminución de la frecuencia del pulso
- pérdida de conciencia por una caída en la tensión arterial
En casos aislados, estas reacciones pueden progresar a reacciones alérgicas graves (anafilaxia). Estas reacciones pueden ocurrir especialmente si la preparación se aplica de forma repetida o si se administra a pacientes que han mostrado previamente hipersensibilidad a la aprotinina o a cualquier otro componente del producto.
Incluso si se toleró bien un tratamiento repetido con TISSEEL, una administración posterior de TISSEEL o una perfusión de aprotinina puede dar lugar a reacciones alérgicas (anafilácticas) graves.
El equipo médico que le trate será consciente del riesgo de este tipo de reacción y detendrá la aplicación de TISSEEL inmediatamente al aparecer los primeros síntomas de hipersensibilidad. En caso de síntomas graves puede ser necesario adoptar medidas de urgencia.
La inyección de TISSEEL en tejidos blandos puede dañar estos de forma local.
La inyección de TISSEEL en vasos sanguíneos (venas o arterias) puede provocar la formación de coágulos (trombosis).
Como TISSEEL se fabrica a partir de plasma procedente de donaciones de sangre, el riesgo de infecciones no se puede excluir totalmente. No obstante, los fabricantes adoptan numerosas medidas para reducir este riesgo (ver sección 2).
Raramente pueden producirse anticuerpos frente a los componentes del adhesivo tisular de fibrina.
Los siguientes efectos adversos se han observado durante el tratamiento con TISSEEL:
Los efectos adversos se han evaluado utilizando las siguientes categorías de frecuencia:
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas
Frecuentes: pueden afectar hasta 1 de cada 10 personas
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
Raros: pueden afectar hasta 1 de cada 1.000 personas
Muy raros: pueden afectar hasta 1 de cada 10.000 personas
Frecuencia no conocida: no puede estimarse a partir de los datos disponibles.
Áreas generales | Efecto adverso | Frecuencia |
Infecciones y enfermedades parasitarias | Infección postquirúrgica de la herida | Frecuentes |
Trastornos de la sangre y del sistema linfático | Aumento de los productos de degradación de la fibrina | Poco frecuentes |
Trastornos del sistema inmunológico | Reacciones de hipersensibilidad | Poco frecuentes |
Reacciones alérgicas (anafilácticas) | Poco frecuentes | |
Shock anafiláctico | Poco frecuentes | |
Sensación de cosquilleo, escozor o entumecimiento de la piel | Poco frecuentes | |
Opresión en el pecho | Poco frecuentes | |
Dificultad para respirar | Poco frecuentes | |
Picor | Poco frecuentes | |
Enrojecimiento de la piel | Poco frecuentes | |
Trastornos del sistema nervioso | Alteraciones sensoriales | Frecuentes |
Trastornos cardiacos | Aumento o disminución de la frecuencia del pulso | Poco frecuentes |
Trastornos vasculares | Trombosis venosa axilar | Frecuentes |
Caída de la tensión arterial | Raros | |
Cardenales | Poco frecuentes | |
Burbujas de aire en el sistema vascular* | Frecuencia no conocida | |
Coágulo de sangre en los vasos sanguíneos | Poco frecuentes | |
Oclusión de una arteria en el cerebro | Poco frecuentes | |
Trastornos respiratorios y torácicos | Disnea | Poco frecuentes |
Trastornos gastrointestinales | Náuseas | Poco frecuentes |
Obstrucción intestinal | Poco frecuentes | |
Trastornos de la piel y del tejido subcutáneo | Erupción cutánea | Frecuentes |
Ronchas | Poco frecuentes | |
Alteración de la cicatrización | Poco frecuentes | |
Trastornos musculoesqueléticos y del tejido conjuntivo | Dolor en las extremidades | Frecuentes |
Trastornos generales y alteraciones en el lugar de administración | Dolor | Frecuentes |
Aumento de la temperatura corporal | Frecuentes | |
Enrojecimiento de la piel | Poco frecuentes | |
Hinchazón por la acumulación de líquido en los tejidos corporales (edema) | Poco frecuentes | |
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | Dolor causado por el procedimiento | Poco frecuentes |
Acumulación de linfa u otros líquidos corporales transparentes cerca de la zona de la operación (seroma) | Muy frecuentes | |
Rápida hinchazón de la dermis, tejido subcutáneo, mucosa y submucosa (angioedema) | Poco frecuentes |
*Se han producido casos de introducción de burbujas de gas o aire en el sistema vascular cuando se aplican sellantes de fibrina con equipos pulverizadores que utilizan gas o aire a presión; se cree que la causa de éste efecto es el uso inapropiado del equipo de pulverización (p. ej., a presiones superiores a las recomendadas y a una distancia muy próxima a la superficie tisular).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de TISSEEL
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD”.
Conservar y transportar congelado (< -20 °C) sin interrupción hasta su aplicación.
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
Conservación después de la descongelación:
El producto sin abrir, descongelado a temperatura ambiente, se puede conservar hasta 72 horas a temperatura ambiente controlada (no superior a 25 °C).
¡Una vez descongelada, la solución no se debe volver a congelar o refrigerar!
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deTISSEEL
TISSEEL contiene dos componentes:
Componente 1: Solución de proteína sellante
Los principios activos en 1 ml de solución de proteína sellante son: fibrinógeno humano, 91 mg/ml; aprotinina sintética, 3000 UIC/ml.
Los demás componentes son: albúmina humana, L-histidina, niacinamida, polisorbato 80 (Tween 80), citrato de sodio dihidrato, agua para preparaciones inyectables.
Componente 2: Solución de trombina
Los principios activos en 1 ml de solución de trombina son: trombina humana 500 UI/ml; cloruro de calcio dihidrato 40 μmol/ml.
Los demás componentes son: albúmina humana, cloruro de sodio, agua para preparaciones inyectables.
Después de la mezcla | 1 ml | 2 ml | 4 ml | 10 ml |
Componente 1: Solución de proteína sellante Fibrinógeno humano (como proteína coagulable) Aprotinina sintética | 45,5 mg 1500 UIC | 91 mg 3000 UIC | 182 mg 6000 UIC | 455 mg 15000 UIC |
Componente 2: Solución de trombina Trombina humana Cloruro de calcio dihidrato | 250 UI 20 μmol | 500 UI 40 μmol | 1000 UI 80 μmol | 2500 UI 200 μmol |
TISSEEL contiene 0,6–5 UI/ml de factor XIII humano que se aisla del plasma junto con el fibrinógeno humano.
Aspectodel productoy contenido del envase
Soluciones para adhesivo tisular.
La solución de proteína sellante y la solución de trombina se suministran en una jeringa de plástico para un solo uso.
Las soluciones congeladas son de incoloras a amarillo pálido y opalescente.
Después de la descongelación: los líquidos son de incoloros a amarillo pálido .
TISSEEL se suministra en el siguiente envase:
Contenido del envase con la Jeringa PRIMA:
- 1ml, 2ml o 5ml de solución de proteína sellante y 1ml, 2ml o 5ml de solución de trombina contenidas en una jeringa de doble cámara precargada (polipropileno) cerrada con un tapón de rosca, empaquetadas en dos bolsas y con un dispositivo con dos piezas de unión y 4 cánulas de aplicación.
Contenido del envase con la Jeringa AST:
- 1ml, 2ml o 5ml de solución de proteína sellante y 1ml, 2ml o 5ml de solución de trombina contenidas en una jeringa de doble cámara precargada (polipropileno) cerrada con un tapón de rosca, empaquetadas en dos bolsas y con un dispositivo con dos piezas de unión, 4 cánulas de aplicación y un émbolo de pistón doble.
Tamaños de envase:
TISSEEL está disponible en los siguientes tamaños de envase: 1 x 2 ml (1 ml + 1 ml), 1 x 4 ml (2 ml + 2 ml) y 1 x 10 ml (5 ml + 5 ml).
Las soluciones están congeladas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación:
Titular de la autorización de comercialización:
BAXTER, S.L.
Pouet de Camilo, 2
46394 Ribarroja del Turia (Valencia)
Responsable de la fabricación:
Takeda Manufacturing Austria AG,
Industriestrasse 67,
1221 Vienna, Austria
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Austria:TISSEEL - Lösungen für einen Gewebekleber
Bulgaria:T???? - ???????? ?? ??????? ??????
República Checa:TISSEEL - roztoky pro lepidlo
Francia:TISSEEL –solutions pour colle
Alemania:TISSEEL 2ml
TISSEEL 4ml
TISSEEL 10ml
Grecia:TISSEEL - Διαλ?ματα για στεγανοποιητικ?
Malta:TISSEEL – Solutions for sealant
Noruega:TISSEEL
Polonia:TISSEEL - klej tkankowy
República Eslovaca:TISSEEL – fibrinové lepidlo
España:TISSEEL – soluciones para adhesivo tisular
Fecha de la última revisión de este prospecto: agosto 2020
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)
Esta información está destinada únicamente a profesionales del sector sanitario (envase final: jeringa PRIMA):
General
- Antes de la administración de TISSEEL, se deben cubrir todas las partes del cuerpo fuera del área que se va a tratar, para prevenir la adhesión de tejidos en zonas no deseadas.
- Para evitar la adhesión de TISSEEL a guantes e instrumentos quirúrgicos, se deben humedecer éstos con una solución de cloruro sódico antes de que se produzca el contacto.
- La guía para el sellado de superficies es: un envase de TISSEEL 2 ml (1 ml de solución de proteína sellante más 1 ml de solución de trombina) es suficiente para una superficie de al menos 10 cm2.
- La dosis necesaria dependerá del tamaño de la superficie que se debe sellar.
- NO aplicar los dos componentes de TISSEEL por separado. Ambos componentes se deben aplicar juntos.
- NO exponer TISSEEL a temperaturas superiores a 37 °C y NO calentar en microondas.
- NO descongelar el producto sosteniéndolo con las manos.
- NO utilizar TISSEEL hasta que se haya descongelado totalmente y calentado a 33 °C-37 °C.
- Los tapones protectores de la jeringa se deben retirar solo cuando la descongelación y el calentamiento se hayan completado. Para facilitar la extracción del tapón de la jeringa, éste se debe balancear moviéndolo hacia delante y hacia atrás, y a continuación retirar el tapón protector de la jeringa.
- Expulsar todo el aire de la jeringa y conectar la boquilla de unión y la cánula de aplicación.
Instrucciones de manipulación y preparación
Tanto la solución de proteína sellante como la solución de trombina están contenidas en una jeringa lista para usar. El producto está envasado en dos bolsas estériles bajo condiciones asépticas. La bolsa interior y su contenido son estériles siempre que la bolsa exterior esté intacta. Utilizando una técnica estéril, transferir la bolsa interior estéril y su contenido al campo estéril.
La jeringa lista para usar se puede descongelar Y calentar mediante uno de los siguientes métodos:
- Descongelación/calentamiento rápido (baño de agua estéril),método recomendado
- Descongelación/calentamiento en un baño de agua no estéril
- Descongelación/calentamiento en un incubador
- La jeringa lista para usar también se puede descongelar y guardar a temperatura ambiente (no superior a 25 ºC) hasta 72 horas. Es necesario calentarla antes de su utilización.
- Descongelación/calentamiento rápido (baño de agua estéril), método recomendado
Se recomienda descongelar y calentar los dos componentes del adhesivo tisular utilizando un baño de agua estéril a una temperatura de 33–37 °C.
- El baño de agua no debe exceder los 37 °C. Para controlar el rango de temperatura especificado, se debe monitorizar la temperatura del agua utilizando un termómetro y cambiar el agua cuando sea necesario.
- Si se utiliza el baño de agua estéril para la descongelación y calentamiento, retire la jeringa precargada de las bolsas antes de introducirla en el baño de agua estéril.
Instrucciones:
Colocar la bolsa interior en el campo estéril, sacar la jeringa lista para usar de la bolsa interior y colocarla directamente en el baño de agua estéril. Asegurar que el contenido de la jeringa lista para usar queda totalmente sumergido en el agua.
Tabla 1: Jeringa PRIMA: Tiempos de descongelación y calentamiento mínimos utilizando un baño de agua estéril
Tamaño del envase | Tiempos de descongelación/calentamiento mínimosBaño de agua estéril de 33 °C a 37 °CProducto retirado de las bolsas |
2 ml | 5 minutos |
4 ml | 5 minutos |
10 ml | 10 minutos |
- Descongelación/calentamiento en un baño de agua no estéril
Instrucciones:
Dejar la jeringa lista para usar dentro de ambas bolsas y colocarla en un baño de agua fuera del campo estéril durante un período de tiempo adecuado (ver Tabla 2). Asegurar que las bolsas permanezcan sumergidas en el agua durante todo el periodo de descongelación. Después de la descongelación, retirar las bolsas del baño de agua, secar la bolsa exterior y colocar la bolsa interior con la jeringa lista para usar en el campo estéril.
Tabla 2: Jeringa PRIMA: Tiempos de descongelación y calentamiento mínimos utilizando un baño de agua no estéril
Tamaño del envase | Tiempos de descongelación/calentamiento mínimos Baño de agua no estéril de 33 °C a 37 °CProducto en bolsas |
2 ml | 15 minutos |
4 ml | 20 minutos |
10 ml | 35 minutos |
- Descongelación/calentamiento en un incubador
Instrucciones:
Dejar la jeringa lista para usar dentro de ambas bolsas y colocarla en un incubador fuera del campo estéril durante un período de tiempo adecuado (ver Tabla 3). Una vez descongelada/calentada, retirar las bolsas del incubador, retirar la bolsa exterior y colocar la bolsa interior con la jeringa lista para usar en el campo estéril.
Tabla 3: Jeringa PRIMA: Tiempos de descongelación y calentamiento mínimos en incubador
Tamaño del envase | Tiempos de descongelación/calentamiento mínimos de 33 °C a 37 °C en incubadorProducto en bolsas |
2 ml | 40 minutos |
4 ml | 50 minutos |
10 ml | 90 minutos |
- Descongelación a temperatura ambiente (no superior a 25 °C) ANTES de calentar
Instrucciones:
Dejar la jeringa lista para usar dentro de ambas bolsas y descongelarla a temperatura ambiente fuera del campo estéril durante un período de tiempo adecuado (ver Tabla 4). Una vez descongelada, calentarla en la bolsa exterior en un incubador con el fin de calentar el producto para poder usarlo.
Tabla 4: Jeringa PRIMA: Tiempos de descongelación mínimos a temperatura ambiente fuera del campo estéril y tiempos de calentamiento adicional en incubador de 33 °C a 37 °C
Tamaño del envase | Tiempos de descongelación mínimos del producto a temperatura ambiente (no superior a 25 °C)Producto en bolsas | Tiempos de calentamiento previo a su utilización a 33 °C hasta un máximo de 37 °C en incubador tras la descongelación a TAProducto en bolsas |
2 ml | 80 minutos+11 minutos | |
4 ml | 90 minutos + 13 minutos | |
10 ml | 160 minutos + 25 minutos |
Tras la descongelación a temperatura ambiente, el producto se debe utilizar en un plazo máximo de 72 horas después de sacarlo del frigorífico.
Estabilidad después de la descongelación
Después de la descongelacióny el calentamiento(a temperaturas entre 33 °C y 37 °C, métodos 1, 2 y 3), se ha demostrado la estabilidad química y física del producto durante 12 horas a 33-37 °C.
En el caso del producto descongeladoa temperatura ambiente, en la bolsa sin abrir (método 4), se ha demostrado la estabilidad química y física del producto durante 72 horas a temperaturas no superiores a 25ºC. Calentar a 33-37 °C inmediatamente antes del uso.
Desde un punto de vista microbiológico, a menos que el método de apertura/descongelación excluya el riesgo de contaminación microbiana, el producto debe ser utilizado inmediatamente, después de haber sido calentado de 33ºC a 37ºC.
De no usarse inmediatamente, los tiempos y condiciones de almacenamiento durante su uso son responsabilidad del usuario.
No volver a congelar o refrigerar una vez que se haya iniciado la descongelación.
Manipulación después de la descongelación/antes de la aplicación
Para conseguir una mezcla óptima de las dos soluciones y la solidificación óptima del adhesivo tisular de fibrina, mantenerlos dos componentes del adhesivo tisulara 33-37 °C hasta la aplicación.
Las soluciones de proteína sellante y de trombina deben ser transparentes o ligeramente opalescentes. No utilizar soluciones que estén turbias o tengan depósitos. El producto descongelado debe inspeccionarse visualmente antes de su uso para descartar la presencia de partículas y decoloración o cualquier variación de su apariencia. Si observa alguna de estas circunstancias, las soluciones se deben desechar.
La solución de proteína sellante descongelada debe ser un líquido ligeramente viscoso. Si la solución tiene la consistencia de un gel solidificado, se debe asumir que se ha desnaturalizado (posiblemente debido a la interrupción de la cadena de conservación en frío o por exceso de calor durante el calentamiento). En este caso, TISSEEL NO se debe utilizar de ninguna manera.
- Sacar la jeringa de las bolsas poco antes de utilizarla.
- Utilizar TISSEEL solo cuando se haya descongelado y calentado totalmente (consistencia líquida).
- Retirar el tapón protector de la jeringa inmediatamente antes de la aplicación.
Para facilitar la extracción del tapón de la jeringa, este se debe balancear moviéndolo hacia delante y hacia atrás, y a continuación retirar el tapón protector de la jeringa.
Administracióncon jeringa PRIMA:
Para su aplicación, la jeringa de doble cámara lista para usar con las soluciones de proteína sellante y de trombina se tiene que conectar a una boquilla de unión y a una cánula de aplicación que se proporcionan en el equipo de dispositivos de aplicación. La pieza que une en el extremo los émbolos de la jeringa de doble cámara lista para usar, garantiza que volúmenes iguales de los dos componentes del adhesivo tisular saldrán a través de la boquilla de unión hacia la cánula de aplicación donde se mezclarán antes de su aplicación.
Instrucciones de funcionamiento de la jeringa PRIMA:
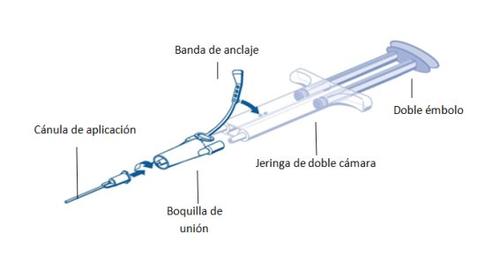
- Expulsar todo el aire de la jeringa antes de conectar ningún dispositivo de aplicación.
- Alinear la boquilla de unión y anclar al lateral de la jeringa en el orificio de la banda de anclaje.
- Conectar las boquillas de la jeringa de doble cámara lista para usar, a la boquilla de unión asegurándose de que ambas están firmemente sujetas.
- Asegurar la boquilla de unión fijando la banda de anclaje a la jeringa de doble cámara lista para usar.
- Si la banda de anclaje se desgarra, utilizar la boquilla de unión de repuesto proporcionada en el equipo.
- Si no hay ninguna boquilla de unión de repuesto disponible, todavía es posible utilizar el sistema si se tiene cuidado de que la conexión sea segura y a prueba de fugas.
- NO expulsar el aire que quede dentro de la boquilla de unión.
- Conectar una cánula de aplicación a la boquilla de unión.
- NO expulsar el aire que quede dentro de la boquilla de unión y dentro de la cánula de aplicación hasta que se inicie la aplicación, ya que esto puede obstruir la abertura de la cánula.
Administración
Antes de aplicar TISSEEL es necesario secar la superficie de la herida utilizando para ello una técnica estándar (por ejemplo, aplicación intermitente de compresas, torundas, el uso de dispositivos de succión). No utilizar aire ni gas presurizado para secar la zona.
- Aplicar la mezcla de solución de proteína sellante-solución de trombina sobre la superficie o superficies de las partes que se van a sellar presionando lentamente la parte posterior del émbolo común.
- En los procedimientos quirúrgicos que requieran el uso de volúmenes mínimos de adhesivo tisular de fibrina, es recomendable expulsar y desechar las primeras gotas del producto.
- Después de aplicar TISSEEL, esperar al menos 2 minutos para conseguir una polimerización suficiente.
Nota:Si la aplicación de los componentes del adhesivo tisular de fibrina se interrumpe, se pueden producir coágulos en la cánula. En este caso, sustituir inmediatamente la cánula de aplicación por una nueva antes de reanudar la aplicación. Si las aberturas de la boquilla de unión se obstruyen, utilizar la boquilla de unión adicional proporcionada en el envase.
Después de mezclar los componentes del adhesivo tisular, el adhesivo tisular de fibrina empieza a asentarse en unos segundos debido a la alta concentración de trombina (500 UI/ml).
El adhesivo tisular de fibrina también se puede aplicar con otros accesorios suministrados por BAXTER que son especialmente adecuados para, p. ej., uso endoscópico, cirugía mínimamente invasiva o aplicación en áreas grandes o de difícil acceso. Cuando se utilizan estos dispositivos de aplicación, deben seguirse atentamente sus instrucciones de uso.
No deben utilizarse preparaciones que contengan celulosa oxidada con TISSEEL, porque el pH bajo interfiere en la actividad de la trombina.
En ciertas aplicaciones se utiliza material biocompatible, como láminas de colágeno, como material de soporte o para reforzar.
Aplicación por pulverización
Al aplicar TISSEEL con un equipo pulverizador, se debe asegurar de que la presión y la distancia al tejido se encuentran dentro de los intervalos recomendados por el fabricante, según se indica a continuación:
Presión, distancia y equipos recomendados para la aplicación por pulverización de TISSEEL | |||||
Procedimiento quirúrgico | Equipo pulverizador que se debe utilizar | Puntas aplicadoras que se deben utilizar | Regulador de presión que se debe utilizar | Distancia del tejido de destino recomendada | Presión de pulverización recomendada |
Herida abierta | Equipo pulverizador TISSEEL/Artiss | n.a. | EasySpray | 10-15 cm | 1,5-2,0 bares(21,5-28,5 psi). |
Equipo pulverizador TISSEEL/Artiss, envase de 10 | n.a. | EasySpray | |||
Procedimientos laparoscópicos o mínimamente invasivos | n.a. | Aplicador Duplospray MIS 20 cm | Regulador Duplospray MIS 1,5 bares | 2-5 cm | 1,2-1,5 bares (18-22 psi) |
Aplicador Duplospray MIS 30 cm | |||||
Aplicador Duplospray MIS 40 cm | |||||
Aplicador endoscópico Spray Set 360 con Snaplock | |||||
Aplicador endoscópico Spray Set 360 con anclaje | |||||
Punta remplazable |
Siempre que se pulverice TISSEEL, y debido a que cabe la posibilidad de que se produzca una embolia gaseosa (aire o gas), se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígeno y el nivel de CO2al final de la espiración(ver sección 2).
Para la aplicación de TISSEEL en espacios torácicos y abdominales cerrados se recomienda el sistema aplicador y regulador DuploSpray MIS. Consulte el manual de instrucciones del dispositivo DuploSpray MIS.
Eliminación
La eliminación del medicamento no utilizado y de los materiales de desecho, se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a TISSEEL SOLUCIONES PARA ADHESIVO TISULARForma farmacéutica: ADHESIVO TISULAR, en función de las necesidades clínicas del pacientPrincipio activo: combinationsFabricante: Baxter S.L.Requiere recetaForma farmacéutica: ADHESIVO TISULAR, 50-90 mg/ml 800-1200 UIPrincipio activo: combinationsFabricante: Omrix BiopharmaceuticalsRequiere recetaForma farmacéutica: ADHESIVO TISULAR, -Principio activo: combinationsFabricante: Corza Medical GmbhRequiere receta
Médicos online para TISSEEL SOLUCIONES PARA ADHESIVO TISULAR
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de TISSEEL SOLUCIONES PARA ADHESIVO TISULAR, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















