

Rivastigmine Mylan

Zapytaj lekarza o receptę na Rivastigmine Mylan

Jak stosować Rivastigmine Mylan
Ulotka dołączona do opakowania: informacja dla użytkownika
Rivastigmine Mylan, 4,6 mg/24 h, system transdermalny, plaster
Rivastigmine Mylan, 9,5 mg/24 h, system transdermalny, plaster
Rywastygmina
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Rivastigmine Mylan i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Rivastigmine Mylan
- 3. Jak stosować lek Rivastigmine Mylan
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Rivastigmine Mylan
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Rivastigmine Mylan i w jakim celu się go stosuje
Substancją czynną leku Rivastigmine Mylan jest rywastygmina.
Rywastygmina należy do grupy substancji zwanych inhibitorami cholinesterazy. U pacjentów
z otępieniem typu alzheimerowskiego dochodzi do zmniejszenia liczby komórek nerwowych
w mózgu, co powoduje zmniejszenie stężenia wytwarzanej przez nie acetylocholiny, będącej
neuroprzekaźnikiem (substancją umożliwiającą komunikowanie się komórek nerwowych między
sobą). Działanie rywastygminy polega na blokowaniu enzymów powodujących rozpad acetylocholiny:
acetylocholinesterazy i butyrylocholinesterazy. Blokując działanie tych enzymów rywastygmina
umożliwia zwiększenie stężenia acetylocholiny w mózgu, co pomaga w łagodzeniu objawów choroby
Alzheimera.
Lek Rivastigmine Mylan jest stosowany w leczeniu dorosłych pacjentów z łagodnym do
umiarkowanie ciężkiego otępieniem typu alzheimerowskiego, postępującą chorobą mózgu, która
stopniowo zaburza pamięć, zdolności intelektualne i zachowanie.
2. Informacje ważne przed zastosowaniem leku Rivastigmine Mylan
Kiedy nie stosować leku Rivastigmine Mylan
- jeśli pacjent ma uczulenie na rywastygminę (substancję czynną leku Rivastigmine Mylan) lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6);
- jeśli u pacjenta występuje reakcja alergiczna na podobne leki (pochodne karbaminianu);
- jeśli u pacjenta występuje reakcja skórna wykraczająca poza obszar skóry zajmowany przez plaster, jeśli nasiliła się reakcja miejscowa (np. wystąpiły pęcherze, zaostrzenie stanu zapalnego skóry, opuchnięcie) lub jeśli zmiany te nie ustąpiły w ciągu 48 godzin po zdjęciu plastra.
Jeśli taka sytuacja dotyczy pacjenta, należy poinformować o tym lekarza i nie nalepiać plastra
Rivastigmine Mylan.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Rivastigmine Mylan należy omówić to z lekarzem lub
farmaceutą jeśli:
- u pacjenta występują lub kiedykolwiek występowały choroby serca takiej jak nieregularny lub wolny rytm pracy serca, wydłużenie odstępu QT, wydłużenie odstępu QT stwierdzane w rodzinie, torsade de pointes, lub niski poziom potasu lub magnezu we krwi;
- u pacjenta występuje niewydolność serca;
- pacjent w przeszłości miał zawał serca;
- u pacjenta występuje lub kiedykolwiek występowało zmniejszone stężenie potasu lub magnezu we krwi;
- u pacjenta kiedykolwiek występował czynny wrzód żołądka;
- u pacjenta występują lub kiedykolwiek występowały trudności w oddawaniu moczu;
- u pacjenta występują lub kiedykolwiek występowały napady padaczkowe;
- u pacjenta występuje lub kiedykolwiek występowała astma lub ciężka choroba układu oddechowego;
- u pacjenta występuje drżenie mięśniowe;
- pacjent ma małą masę ciała;
- u pacjenta występują reakcje ze strony żołądka i jelit, takie jak nudności (mdłości), wymioty i biegunka. Pacjent może się odwodnić (tracąc zbyt dużo płynu), jeśli wymioty czy biegunka utrzymują się przez dłuższy czas;
- u pacjenta występują zaburzenia czynności wątroby.
Jeśli którakolwiek z tych sytuacji dotyczy pacjenta, potrzebna może być dokładniejsza obserwacja
pacjenta przez lekarza w czasie stosowania tego leku.
Dzieci i młodzież
Stosowanie leku Rivastigmine Mylan u dzieci i młodzieży nie jest właściwe w leczeniu choroby
Alzheimera.
Lek Rivastigmine Mylan a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować, również tych, które
wydawane są bez recepty.
Lek Rivastigmine Mylan może nasilać działanie niektórych leków obniżających ciśnienie krwi, np.
„beta-adrenolityków”, takich jak atenolol, „antagonistów kanałów wapniowych”, np. amlodypiny,
nifedypiny, „leków antyarytmicznych”, np. sotalolu, amiodaronu, glikozydów naparstnicy oraz
pilokarpiny (stosowanej w leczeniu jaskry). Może to prowadzić do omdleń.
Należy zachować ostrożność, gdy Rivastigmine Mylan jest stosowany razem z innymi lekami, które
mogą wpływać na rytm serca lub układ przewodzący serca (wydłużenie odstępu QT).
Jeśli pacjent stosuje którykolwiek z poniższych leków, lekarz może przeprowadzać regularne badania
serca, aby upewnić się, że działa ono prawidłowo:
- leki stosowane w leczeniu zaburzeń psychicznych, znane jako „leki przeciwpsychotyczne", np. chloropromazyna, lewopromazyna, sulpiryd, amisulpryd, tiapryd, weralipryd, pimozyd, haloperydol, droperydol,
- cyzapryd (stosowany w leczeniu niestrawności),
- citalopram (stosowany w leczeniu depresji),
- difemanil (stosowany w leczeniu wrzodu trawiennego),
- halofantryna (stosowana w leczeniu malarii),
- mizolastyna (stosowana w leczeniu alergii),
- metadon (lek łagodzący ból, stosowany także u osób uzależnionych od heroiny),
- erytromycyna i.v., pentamidyna, moksyfloksacyna (antybiotyki).
Rivastigmine Mylan może wpływać na działanie leków przeciwcholinergicznych, z których niektóre
są stosowane w łagodzeniu skurczów żołądka (np. dicyklomina), w leczeniu choroby Parkinsona
(np. amantadyna), w leczeniu nadwrażliwości pęcherza moczowego (np. oksybutynina, tolterodyna)
lub w zapobieganiu chorobie lokomocyjnej (np. difenhydramina, skopolamina lub meklizyna).
Leku Rivastigmine Mylan system transdermalny nie należy stosować jednocześnie z
metoklopramidem (lekiem używanym w łagodzeniu lub zapobieganiu nudnościom i wymiotom).
Jednoczesne przyjmowanie tych dwóch leków może spowodować takie zaburzenia, jak sztywność
kończyn i drżenie dłoni.
Jeśli pacjent ma być poddany operacji w czasie leczenia lekiem Rivastigmine Mylan, powinien
powiedzieć o tym lekarzowi, ponieważ może być konieczne zaprzestanie jego stosowania, gdyż może
on nasilać działanie niektórych środków zwiotczających mięśnie, podawanych w trakcie znieczulenia.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmacety przed zastosowaniem tego leku.
Jeśli pacjentka jest w ciąży, należy dokonać oceny korzyści ze stosowania leku Rivastigmine Mylan
względem możliwych działań leku na nienarodzone dziecko. Lek Rivastigmine Mylan nie powinien
być stosowany w czasie ciąży, jeśli nie jest to bezwzględnie konieczne.
Podczas stosowania leku Rivastigmine Mylan, nie należy karmić piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Lekarz poinformuje pacjenta, czy jego stan pozwala na bezpieczne prowadzenie pojazdów i obsługę
maszyn. Lek Rivastigmine Mylan może powodować omdlenia lub silne splątanie. Jeśli pacjent czuje
się słabo lub jest zdezorientowany, nie powinien prowadzić pojazdów, obsługiwać maszyn ani
wykonywać innych zadań wymagających koncentracji.
3. Jak stosować lek Rivastigmine Mylan
Ten lek należy zawsze stosować dokładnie tak, jak zalecił lekarz lub farmaceuta. W razie wątpliwości
należy zwrócić się do lekarza lub farmaceuty.
UWAGA:
- Przed naklejeniem JEDNEGO nowego plastra, poprzedni plaster należy usunąć.
- Stosować tylko jeden plaster leku Rivastigmine Mylan na dobę.
- Nie należy ciąć plastra na mniejsze kawałki.
- Należy mocno docisnąć plaster wewnętrzną stroną dłoni i przytrzymać przez co najmniej
30 sekund.
- Należy unikać dotykania oczu po nałożeniu plastra.
Jak rozpoczynać leczenie
Lekarz poinformuje pacjenta, które plastry leku Rivastigmine Mylan są najlepsze w danym przypadku.
- Leczenie zazwyczaj rozpoczyna się od leku Rivastigmine Mylan 4,6 mg/24 h.
- Zalecana, zazwyczaj stosowana dawka dobowa leku Rivastigmine Mylan to 9,5 mg/24 h. Jeśli stan pacjenta nie poprawi się po co najmniej 6 miesiącach, lekarz prowadzący może rozważyć zwiększenie dawki do 13,3 mg/24 h (nie można uzyskać dawki 13,3 mg/24 h z tego produktu). W przypadku chorób wymagających zastosowania takiej dawki, należy zapytać o radę farmaceutę.
- Należy nalepiać tylko jeden plaster na raz i należy zmieniać go na nowy co 24 godziny.
Podczas leczenia lekarz może dostosować dawkę leku do potrzeb danego pacjenta.
Jeśli pacjent nie nalepiał plastra przez trzy dni lub więcej, nie powinien nalepiać kolejnego plastra
zanim nie porozmawia o tym z lekarzem, ponieważ może być bardziej narażony na wystąpienie
działań niepożądanych. Leczenie można wznowić stosując tę samą dawkę, jeśli przerwa w leczeniu
nie przekraczała trzech dni. W przeciwnym razie lekarz może zalecić kontynuowanie leczenia dawką
4,6 mg/24 h leku Rivastigmine Mylan.
Gdzie nalepiać plaster leku Rivastigmine Mylan
- Przed nalepieniem plastra należy upewnić się, że skóra w miejscu planowanego naklejenia jest czysta, sucha i nieowłosiona, oczyszczona z pudru, olejków, kremów nawilżających lub płynów, które mogłyby uniemożliwiać właściwe przylepienie plastra, wolna od skaleczeń, wysypki i (lub) podrażnień,
- Należy ostrożnie usunąć wszelkie nalepione plastry przed naklejeniem nowego.Nalepienie kilku plastrów na skórę może narazić pacjenta na przyjęcie nadmiernej ilości leku, co może okazać się niebezpieczne.
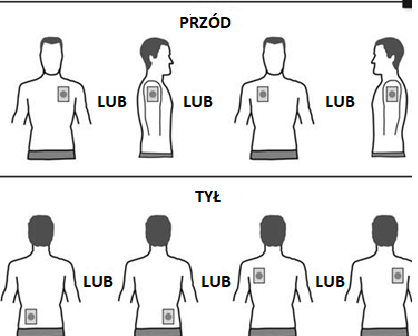
- Należy nalepiać JEDENplaster na dobę na TYLKO JEDNOz następujących miejsc, jak pokazano na rysunkach:
- górna część lewego ramienia lubgórna część prawego ramienia
- górna część klatki piersiowej po lewej stronie lubpo prawej stronie (należy unikaćnalepiania plastrów na piersi)
- górna część pleców po lewej stronie lubpo prawej stronie
- dolna część pleców po lewej stronie lubpo prawej stronie
Po 24 godzinach należy zdjąć stary plaster przed przyklejeniem JEDNEGO nowego plastra na TYLKO JEDNO z pokazanych miejsc.
Zmieniając plaster, należy usunąć plaster z dnia poprzedniego, zanim nalepi się nowy plaster w innym
miejscu (na przykład jednego dnia po prawej stronie ciała, a drugiego – po lewej, jednego dnia na
klatce piersiowej lub w górnej części ciała, a drugiego w dolnej części pleców). Nie należy nalepiać
plastra w tym samym miejscu przed upływem 14 dni.
Jak pacjent powinien przylepiać plastry Rivastigmine Mylan
Lek Rivastigmine Mylan ma postać cienkich, jasnobrązowych plastrów z tworzywa sztucznego
przylepianych na skórę. Każdy plaster znajduje się w szczelnie zamkniętej saszetce ochronnej. Nie
należy otwierać saszetki ani wyjmować plastra z saszetki, aż do chwili jego przylepiania na skórę.
Ostrożnie zdjąć plaster przed nałożeniem nowego.
Pacjenci rozpoczynający leczenie (po raz pierwszy) oraz
pacjenci wznawiający po przerwie leczenie rywastygminą,
powinni rozpoczynać od czynności pokazanych na drugim
rysunku.
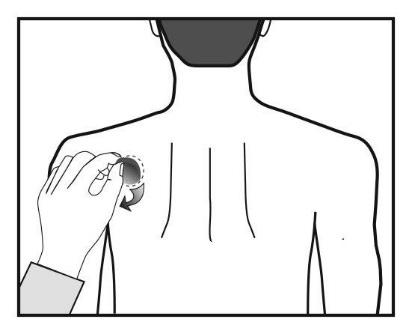
Każdy plaster znajduje się w szczelnie zamkniętej saszetce
ochronnej. Saszetkę należy otworzyć tuż przed użyciem plastra.
Należy przeciąć saszetkę w obu miejscach oznakowanych
nożyczkami, lecz nie dalej niż do wskazanej linii. Przedrzeć
saszetkę w celu jej otwarcia. Nie przecinać saszetki na całej
długości, aby uniknąć uszkodzenia plastra.
Wyjąć plaster z saszetki.
Zdjąć zabezpieczenie (cielistej barwy) z górnej strony plastra
i wyrzucić.
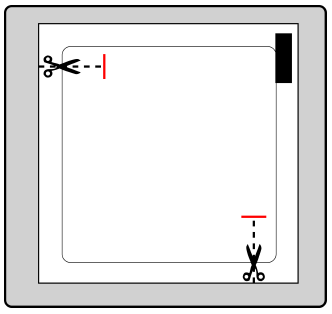
Strona klejąca plastra jest zabezpieczona warstwą ochronną.
Należy zdjąć jedną część warstwy ochronnej, nie dotykając strony
klejącej plastra.
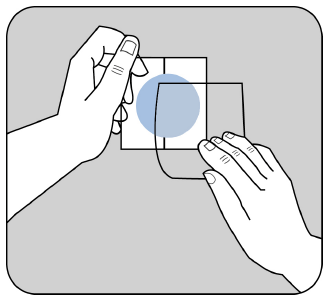
Przyłożyć stronę klejącą plastra do górnej lub dolnej części
pleców, górnej części ramienia lub do klatki piersiowej,
a następnie usunąć drugą część warstwy ochronnej.
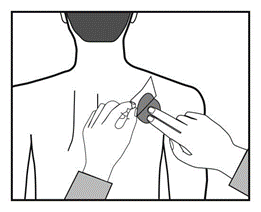
Przycisnąć plaster mocno dłonią przez co najmniej 30 sekund,
upewniając się, że jego brzegi dobrze przylegają do skóry.
Można teraz podpisać długopisem plaster, np. nazwą dnia tygodnia.
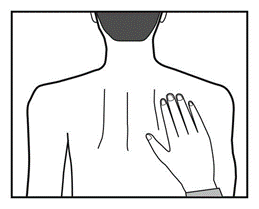
Plaster należy nosić stale, aż do czasu jego zmiany na nowy. Pacjent może wypróbować różne miejsca
przylepienia nowego plastra (wybierając z wskazanych powyżej), by wybrać najbardziej dogodne i nie
narażone na zdarcie przez odzież.
Jak pacjent powinien zdejmować plaster Rivastigmine Mylan
Należy delikatnie pociągnąć za jeden brzeg plastra i powoli odkleić go od skóry. Jeśli na skórze
pozostaną resztki kleju, można je usunąć przemywając to miejsce ciepłą wodą i łagodnym mydłem lub
oliwką dziecięcą. Nie należy stosować alkoholu ani innych rozpuszczalników (zmywacza do paznokci
i innych środków).
Mycie rąk
Po zdjęciu lub założeniu plastra należy umyć ręce wodą z mydłem. W razie kontaktu leku z oczami
lub zaczerwienienia oczu po kontakcie z plastrem, natychmiast przemyć oczy dużą ilością wody,
a jeśli objawy nie ustąpią, należy zgłosić się do lekarza.
Czy pacjent może stosować plastry Rivastigmine Mylan podczas kąpieli, pływania lub na słońcu?
- Kąpiel, pływanie bądź kąpiel pod prysznicem nie powinny mieć wpływu na działanie plastra. Należy upewnić się, że podczas wykonywania tych czynności nie dojdzie do obluzowania się plastra.
- Nie należy narażać plastra na dłuższe działanie wszelkich zewnętrznych źródeł ciepła (np. nadmierne działanie promieni słonecznych, sauna, solarium).
Jak postępować w razie odklejenia się plastra
Jeśli plaster sam się odklei, należy nalepić nowy na resztę dnia, a następnie zmienić go o zwykłej
porze kolejnego dnia.
Kiedy i jak długo pacjent powinien stosować plastry Rivastigmine Mylan
- Aby leczenie przyniosło efekty należy nalepiać nowy plaster codziennie, najlepiej o tej samej porze każdego dnia.
- Należy nalepiać tylko jeden plaster Rivastigmine Mylan na raz i co 24 godziny zmieniać go na nowy.
Zastosowanie większej niż zalecana dawki leku Rivastigmine Mylan
Jeśli pacjent przez przypadek nalepi więcej niż jeden plaster, należy zdjąć wszystkie plastry,
a następnie poinformować lekarza o przypadkowym nalepieniu więcej niż jednego plastra. Pacjent
może wymagać pomocy lekarskiej.
U niektórych osób, które przez przypadek zastosowały zbyt dużo rywastygminy, wystąpiło
zmniejszenie wielkości źrenic (zwężenie źrenic), zaczerwienienie skóry i uczucie gorąca (uderzenia
gorąca), ból brzucha, nudności, wymioty, biegunka, wolne bicie serca, nagłe trudności z oddychaniem
(skurcz oskrzeli), zwiększona produkcja śluzu, zwiększona potliwość, niekontrolowanie czynności
fizjologicznych, płacz, niskie ciśnienie krwi, zwiększone wydzielanie śliny, zawroty głowy, drżenie,
ból głowy, senność, splątanie, wysokie ciśnienie krwi, omamy i brak energii. W ciężkich przypadkach
obserwowano osłabienie mięśni, skurcze mięśni, drgawki i zwolnienie lub zatrzymanie oddechu.
Pominięcie zastosowania leku Rivastigmine Mylan
Jeśli pacjent stwierdził, że zapomniał nalepić plaster, powinien natychmiastto zrobić. Następny
plaster można nalepić o zwykłej porze następnego dnia. Nie należy nalepiać dwóch plastrów w celu
uzupełnienia pominiętej dawki leku.
Przerwanie stosowania leku Rivastigmine Mylan
W razie przerwania stosowania leku, należy poinformować o tym lekarza lub farmaceutę.
Jeżeli pacjent nie zastosuje plastra przez trzy dni lub więcej, nie powinien stosować nowego przed
konsultacją z lekarzem, ponieważ bardziej prawdopodobne jest wystąpienie działań niepożądanych.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku, należy zwrócić
się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Działania niepożądane pojawiają się częściej w początkowym okresie stosowania leku lub w okresie
zwiększania dawki. Działania niepożądane zazwyczaj powoli ustępują, w miarę jak organizm
przystosowuje się do leczenia.
W razie wystąpienia jednego z wymienionych działań niepożądanych należy zdjąć plaster i natychmiast powiedzieć o tym lekarzowi, ponieważ działania te mogą być ciężkie:
- drgawki
- zmiany rytmu serca, które mogą być obserwowane jako bardzo szybkie bicie serca lub uczucie brakujących uderzeń serca
- wrzody żołądka (u pacjenta może wystąpić ból brzucha a wymioty mogą zawierać świeżą krew lub wyglądać jakby zawierały fusy po kawie)
- zapalenie trzustki - objawy to silny ból w górnej części brzucha, często z nudnościami lub wymiotami
- silne uczucie splatania, co może być połączone z widzeniem, słyszeniem lub odczuwaniem rzeczy, które nie istnieją (omamy), utratą kontaktu z rzeczywistością (urojenia) oraz zwiększoną lub zmniejszoną aktywnością (delirium)
- zaburzenia czynności wątroby (u pacjenta może wystąpić zażółcenie skóry, białek oczu, nieprawidłowe ciemnienie moczu lub nudności z niewiadomej przyczyny, wymioty, zmęczenie i utrata apetytu)
Inne działania niepożadane:
Częste(mogą dotyczyć 1 na 10 pacjentów):
- ból głowy
- brak lub utrata apetytu, zmniejszenie masy ciała
- uczucie niepokoju, depresja, zawroty głowy
- omdlenia
- nudności, wymioty, biegunka, niestrawność/zgaga, ból brzucha
- pobudzenie, zmęczenie, ogólne osłabienie, gorączka
- wysypka skórna i skórne reakcje alergiczne takie jak reakcje podobne do egzemy, zaczerwienienie, swędzenie, obrzęk i podrażnienie
- zakażenie moczu (może występować ból podczas oddawania moczu lub częstsze niż normalnie oddawanie moczu)
- nietrzymanie moczu (niezdolność do trzymania moczu)
Niezbyt częste(mogą dotyczyć 1 na 100 pacjentów):
- problemy z sercem, takie jak wolne bicie serca
- odwodnienie (utrata zbyt dużej ilości płynów)
- nadpobudliwość (wysoki poziom aktywności, niepokój)
- agresja
Rzadkie(mogą dotyczyć 1 na 1000 pacjentów):
- omdlenia
Bardzo rzadkie(mogą dotyczyć 1 na 10 000 pacjentów):
- sztywność ramion lub nóg, niepokój, skurcze mięśni, drżenie, takie jak drżenie rąk
Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych):
- reakcja alergiczna, taka jak pęcherze lub stan zapalny skóry, świąd, pokrzywka lub zaczerwienienie
- nasilenie objawów choroby Parkinsona - takich jak drżenie, sztywność, senność i szuranie nogami
- szybkie bicie serca
- wysokie ciśnienie krwi
- zmiany w wynikach badań czynności wątroby
- uczucie niepokoju
- widzenie lub słyszenie rzeczy, które nie istnieją (omamy)
- koszmary senne
Inne działania niepożądane obserwowane podczas stosowania rywastygminy w postaci kapsułek lub roztworu doustnego, które mogą wystąpić przy stosowaniu plastrów:
Częste(mogą dotyczyć 1 na 10 pacjentów):
- ogólne złe samopoczucie
- uczucie splątania
- wzmożona potliwość
Rzadkie(mogą dotyczyć 1 na 1000 pacjentów):
- choroba wrzodowa jelit
- ból w klatce piersiowej - może być spowodowany skurczem naczyń serca
Bardzo rzadkie(mogą dotyczyć 1 na 10 000 pacjentów):
- krwawienie z przewodu pokarmowego - objawiające się jako krew w stolcu lub w wymiotach
Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych):
- Gwałtowne wymioty, które mogą prowadzić do pęknięcia przełyku
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądanie można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu
działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa
stosowania leku.
5. Jak przechowywać lek Rivastigmine Mylan
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku i saszetce po
„Termin ważności (EXP)”. Termin ważności oznacza ostatni dzień podanego miesiąca.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Przed użyciem plaster należy przechowywać w saszetce.
Nie należy stosować plastra, który jest uszkodzony lub nosi ślady otwierania.
Po zdjęciu plastra należy złożyć go na pół powierzchnią przylepną do środka i mocno ścisnąć. Należy
włożyć zużyty plaster do saszetki, a następnie wyrzucić w miejsce niedostępne dla dzieci. Po zdjęciu
plastra nie należy dotykać palcami oczu przed umyciem rąk wodą z mydłem.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Rivastigmine Mylan
- Substancją czynną leku jest rywastygmina.
- Rivastigmine Mylan 4,6 mg/24 h systemy transdermalne: z każdego plastra uwalnia się 4,6 mg rywastygminy przez 24 godziny. Plaster ma powierzchnię 4,6 cm i zawiera 6,9 mg rywastygminy.
- Rivastigmine Mylan 9,5 mg/24 h systemy transdermalne: z każdego plastra uwalnia się 9,5 mg rywastygminy przez 24 godziny. Plaster ma powierzchnię 9,2 cm i zawiera 13,8 mg rywastygminy.
- Pozostałe składniki to: Kopolimer akrylanu 2-etyloheksylu i octanu winylu Poliizobuten o średniej masie cząsteczkowej Poliizobuten o dużej masie cząsteczkowej Krzemionka koloidalna bezwodna Parafina ciekła lekka
Warstwa zewnętrzna:
Polietylen/żywica termoplastyczna/Aluminium pokryta poliestrem
Warstwa zabezpieczająca (usuwalna):
Poliester pokryty polimerem fluorowym
Pomarańczowy tusz
Jak wygląda lek Rivastigmine Mylan i co zawiera opakowanie
Każdy system transdermalny jest cienkim plastrem. Na zewnętrznej, jasnobrązowej warstwie
pokrywającej znajduje się napis wydrukowany pomarańczową farbą:
- “RIV-TDS 4.6 mg/24 h”
- “RIV-TDS 9.5 mg/24 h”
Każdy plaster znajduje się w osobnej, szczelnie zamkniętej saszetce. Plastry są dostępne
w opakowaniach zawierających 7 lub 30 saszetek oraz w opakowaniach zbiorczych zawierających 60
lub 90 saszetek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny
Viatris Limited
Damastown Industrial Park
Mulhuddart, Dublin 15
DUBLIN
Irlandia
Wytwórca
McDermott Laboratories Ltd. T/A Gerard Laboratories T/A Mylan Dublin
35/36 Baldoyle Industrial Estate
Grange Road, Dublin 13
Irlandia
Mylan Hungary Kft
H-2900 Komárom
Mylan utca 1
Węgry
Luye Pharma AG
Am Windfeld 35, 83714 Miesbach,
Niemcy
W celu uzyskania bardziej szczegółowych informacji na temat leku oraz jego nazw w krajach
członkowskich Europejskiego Obszaru Gospodarczego należy zwrócić się do przedstawiciela
podmiotu odpowiedzialnego:
Viatris Healthcare Sp. z o.o.
Tel: +48 22 546 64 00
Data ostatniej aktualizacji ulotki: maj 2024
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterLuye Pharma AG McDermott Laboratories Limited t/a Gerard Laboratories t/a Mylan Dublin Mylan Hungary Kft.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Rivastigmine MylanPostać farmaceutyczna: System, 4,6 mg/24 hSubstancja czynna: rivastigmineProducent: Luye Pharma AGWymaga receptyPostać farmaceutyczna: System, 9,5 mg/24 hSubstancja czynna: rivastigmineProducent: Luye Pharma AGWymaga receptyPostać farmaceutyczna: System, 4,6 mg/24 hSubstancja czynna: rivastigmineWymaga recepty
Odpowiedniki Rivastigmine Mylan w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Rivastigmine Mylan – Spain
Odpowiednik Rivastigmine Mylan – Ukraine
Lekarze online w sprawie Rivastigmine Mylan
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Rivastigmine Mylan – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.











