

Pharmavate

Zapytaj lekarza o receptę na Pharmavate

Jak stosować Pharmavate
Ulotka dołączona do opakowania: informacja dla użytkownika
Pharmavate, 50 j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Ludzki VIII czynnik krzepnięcia krwi Pharmavate, 100j.m./ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Ludzki VIII czynnik krzepnięcia krwi
Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- Należy zwrócić się do lekarza, farmaceuty lub pielęgniarki w razie jakichkolwiek dalszych wątpliwości.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli nasili się którykolwiek z objawów niepożądanych lub wystąpią jakiekolwiek objawy niepożądane, w tym niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce.
Spis treści ulotki:
- 1. Co to jest lek Pharmavate i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Pharmavate
- 3. Jak stosować lek Pharmavate
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Pharmavate
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Pharmavate i w jakim celu się go stosuje
Pharmavate należy do grupy leków nazywanych czynnikami krzepnięcia i zawiera ludzki VIII czynnik
krzepnięcia. Jest to specjalne białko, które zwiększa zdolność krwi do krzepnięcia.
Pharmavate stosuje się w leczeniu i profilaktyce krwawień u chorych na hemofilię A. Jest to stan, w
którym jest przedłużone krwawienie w stosunku do oczekiwanego. Wynika ono z wrodzonego
niedoboru VIII czynnika krzepnięcia we krwi.
2. Informacje ważne przed zastosowaniem leku Pharmavate
Stanowczo zaleca się, aby przy każdorazowym podaniu pacjentowi dawki Pharmavate zapisać nazwę
i numer serii produktu w celu zachowania informacji o użytej serii.
Lekarz może zalecić rozważenie szczepienia przeciw wirusowemu zapaleniu wątroby typu A i B w
przypadku regularnego lub powtarzanego otrzymywania produktów czynnika VIII pochodzenia
ludzkiego.
Kiedy nie stosować leku Pharmavate
- jeśli pacjent ma uczulenie na ludzki VIII czynnik krzepnięcia krwi lub którykolwiek z pozostałych składników tego leku (wymienione w punkcie 6).
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem przyjmowania Pharmavate należy zwrócić się do lekarza, farmaceuty lub
pielęgniarki.
Pharmavate zawiera śladowe ilości innych ludzkich białek. Każdy lek, który zawiera białka i który jest
wstrzyknięty do żyły (podany dożylnie) może wywoływać reakcje alergiczne (patrz punkt 4. Możliwe
działania niepożądane).
Tworzenie inhibitorów (przeciwciał) jest znanym powikłaniem, które może występować w trakcie
leczenia wszystkimi lekami zawierającymi czynnik VIII. Inhibitory te, zwłaszcza przy wysokich
stężeniach, przerywają prawidłowe leczenie i pacjent będzie uważnie monitorowany pod kątem
wytwarzania tych inhibitorów. Jeżeli krwawienie u pacjenta nie jest prawidłowo kontrolowane przy
użyciu leku Pharmavate, należy natychmiast powiedzieć o tym lekarzowi.
Informacje odnośnie krwi i osocza użytych do wytwarzania Pharmavate
Podczas wytwarzania leków z ludzkiej krwi lub osocza, podejmowane są określone środki działania,
mające na celu zapobieganie przenoszeniu zakażeń na pacjentów. Obejmują one staranny dobór dawców
krwi i osocza, aby zapewnić wykluczenie dawców mogących być nosicielami zakażeń,
jak również badania wszystkich pobranych próbek i puli osocza, w celu wykrycia obecności
wirusów/zakażeń. Wytwórcy tych produktów wdrożyli do procesu przetwarzania krwi lub osocza etapy
mające na celu inaktywację lub usunięcie wirusów. Mimo tych działań, w przypadku podawania leków
przygotowanych z ludzkiej krwi lub osocza, nie można całkowicie wykluczyć możliwości przeniesienia
zakażenia. Dotyczy to również nieznanych lub pojawiających się od niedawna wirusów, lub innych
rodzajów infekcji.
Podejmowane środki są uważane za skuteczne wobec wirusów otoczkowych, takich jak wirus ludzkiego
niedoboru odporności (HIV), wirus zapalenia wątroby typu B (HBV) i wirus zapalenia wątroby typu C
(HCV) oraz bezotoczkowego wirusa zapalenia wątroby typu A (HAV). Zastosowane metody mogą mieć
ograniczoną skuteczność w stosunku do wirusów bezotoczkowych takich jak parwowirus B19.
Zakażenie parwowirusem B19 może być groźne dla kobiet w ciąży (zakażenie dziecka) oraz u osób,
których układ odpornościowy jest stłumiony lub, które chorują na niektóre rodzaje niedokrwistości (np.
niedokrwistość sierpowatokrwinkową lub nieprawidłowy rozpad krwinek czerwonych).
Inne leki i Pharmavate
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych obecnie lub
ostatnio, a także o lekach, które pacjent planuje przyjmować, również tych, które wydawane są bez
recepty.
Nie są znane interakcje ludzkiego VIII czynnika krzepnięcia z innymi produktami leczniczymi.
Jednakże nie należy mieszać Pharmavate z innymi lekami podczas infuzji.
Ciąża i karmienie piersią
W ciąży i w okresie karmienia piersią lub gdy istnieje podejrzenie, że kobieta jest w ciąży, lub gdy
planuje ciążę, przed zastosowaniem tego leku należy poradzić się lekarza lub farmaceuty.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie obserwowano wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Lek Pharmavate zawiera:
W przypadku fiolki 250 j.m. produkt zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, to znaczy, że
lek uznaje się za „wolny od sodu”.
W przypadku fiolki 500 j.m. i 1000 j.m. produkt zawiera maksymalnie 1,75 mmol sodu (40 mg) na
dawkę. Odpowiada to 2% maksymalnej zalecanej dobowej dawki sodu u osób dorosłych. Należy to
uwzględnić u pacjentów stosujących dietę z kontrolowaną zawartością sodu.
3. Jak stosować lek Pharmavate
Pharmavate powinien być podawany dożylnie po rekonstytucji w załączonym rozpuszczalniku.
Leczenie należy rozpoczynać pod nadzorem medycznym.
Dawkowanie w zapobieganiu krwawieniom:
W długoterminowej profilaktyce krwawień u pacjentów z ciężką postacią hemofilii A powinno podawać
się czynnik VIII w dawce 20 do 40 j.m. na kilogram masy ciała w odstępach 2 do 3 dni.
Dawkę należy dostosować do odpowiedzi klinicznej. W niektórych przypadkach konieczne może być
podawanie leku w krótszych odstępach czasu lub w większych dawkach.
Obliczanie dawki:
Pharmavate należy zawsze stosować zgodnie z zaleceniami lekarza. W przypadku wątpliwości należy
ponownie skontaktować się z lekarzem lub farmaceutą.
Aktywność czynnika VIII w osoczu odpowiada zawartości czynnika VIII w osoczu. Jest wyrażona albo
procentowo (w stosunku do prawidłowego osocza ludzkiego) albo w jednostkach międzynarodowych
(j.m.). Dawka czynnika VIII jest wyrażona w j.m.
Jedna Jednostka Międzynarodowa (j.m.) aktywności czynnika VIII jest równoważna ilości czynnika
VIII w 1 ml prawidłowego osocza ludzkiego. 1 j.m. czynnika VIII na kilogram masy ciała podwyższa
aktywność osoczowego czynnika VIII o 1,5% - 2% normalnej aktywności. Aby obliczyć należną dawkę,
należy określić aktywność czynnika VIII w osoczu pacjenta. To pozwoli na określenie o ile aktywność
powinna być zwiększona. Należy skonsultować się z lekarzem w przypadku niepewności o ile powinna
być zwiększona aktywność czynnika VIII w osoczu i jak obliczyć należną dawkę.
Wymagana dawka jest obliczana przy pomocy następującego wzoru:
wymagana ilość jednostek = masa ciała (kg) x wymagany wzrost aktywności czynnika VIII
(%) ( j.m./dl) x 0,5
Ilość, jaka powinna być podana oraz częstość podawania produktu powinny być zawsze dostosowane
do skuteczności klinicznej u indywidualnego pacjenta.
W następujących przypadkach krwawień aktywność czynnika VIII nie powinna obniżać się poniżej
podanego poziomu aktywności osoczowej (w % wartości normalnych) w danym okresie.
Następująca tabela może być pomocna przy ustalaniu dawek w przypadkach krwawień lub zabiegów
chirurgicznych:
| Nasilenie krwawienia / Rodzaj procedury chirurgicznej | Wymagany poziom czynnika VIII (%) (j.m./dl) | Częstość podawania (godziny)/ Długość trwania terapii (dni) |
| Krwawienie | ||
| Wczesne krwawienie do stawów, mięśni lub z jamy ustnej | 20-40 | Powtarzać co 12 do 24 godzin. Co najmniej 1 dzień aż do ustąpienia bólu spowodowanego przez krwawienie lub zagojenia rany. |
| Bardziej nasilone krwawienie do stawów, mięśni lub krwiak | 30-60 | Powtarzać infuzję co 12 do 24 godzin przez 3- 4 dni lub więcej aż do momentu ustąpienia bólu i powrotu czynności. |
| Krwawienia zagrażające życiu | 60-100 | Powtarzać infuzję co 8 do 24 godzin aż do momentu ustąpienia zagrożenia. |
| Operacje | ||
| Mniejsze Włączając ekstrakcję zęba | 30-60 | Co 24 godziny, przez przynajmniej 1 dzień, aż do zagojenia. |
| Większe | 80-100 (przed- i pooperacyjne) | Powtarzać infuzję co 8 do 24 godzin aż do momentu odpowiedniego zagojenia rany, potem kontynuować terapię przez co najmniej 7 kolejnych dni w celu utrzymania aktywności czynnika VIII na poziomie 30% do 60%. |
Dawka i częstotliwość podawania Pharmavate będą ustalone przez lekarza.
Odpowiedź na czynnik VIII może różnić się u poszczególnych pacjentów. Dlatego w trakcie leczenia
zalecane jest oznaczanie poziomów czynnika VIII w celu ustalenia odpowiedniej dawki i częstości
podawania infuzji.
Stosowanie u dzieci
W badaniach klinicznych nie stwierdzono żadnych specjalnych wymagań dotyczących dawkowania u
dzieci. Dawkowanie jest takie samo u dorosłych i u dzieci, zarówno w ramach leczenia, jak i
profilaktyki.
Instrukcja stosowania w domu
- Należy przeczytać wszystkie instrukcje i dokładnie ich przestrzegać!
- Nie stosować produktu Pharmavate po upływie terminu ważności zamieszczonego na etykiecie.
- Podczas opisanej poniżej procedury należy zachować warunki jałowe!
- Roztwór w strzykawce powinien być przejrzysty lub lekko perłowy, błyszczący. Nie wstrzykiwać roztworów, które są mętne lub zawierają cząstki stałe.
- Przygotowany roztwór zużyć niezwłocznie w celu zapobiegnięcia skażeniu mikrobiologicznemu.
- Używać wyłącznie dostarczonego zestawu do wstrzykiwań. Stosowanie innego sprzętu do wstrzykiwań/infuzji może powodować dodatkowe zagrożenia i niepowodzenie leczenia.
Instrukcja przygotowania roztworu z użyciem systemu Mix2Vial :
- 1. Nie używać produktu bezpośrednio po wyjęciu z lodówki. Pozostawić rozpuszczalnik i proszek w zamkniętych fiolkach aż do uzyskania temperatury pokojowej.
- 2. Usunąć wieczka z obu fiolek i wyczyścić gumowe korki jednym z dołączonych wacików nasączonych alkoholem.
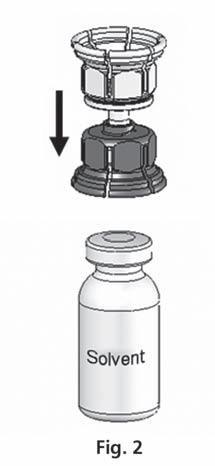
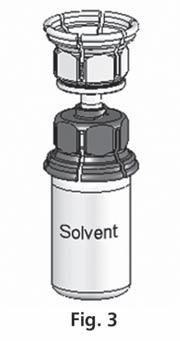
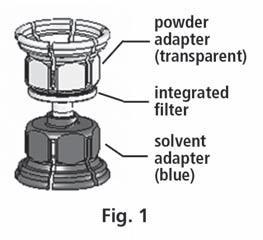
- 3. System Mix2vial™ jest przedstawiony na ryc. 1. Umieścić fiolkę z rozpuszczalnikiem na płaskiej powierzchni i mocno przytrzymać. Wziąć system Mix2Vial™ i obrócić. Umieścić niebieską część Mix2Vial™ na górze fiolki z rozpuszczalnikiem i mocno wcisnąć aż do zatrzaśnięcia (ryc. 2 + 3).
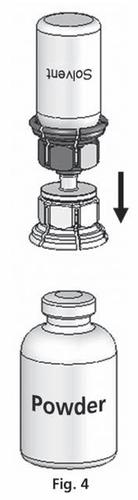
- 4. Umieścić fiolkę z proszkiem na płaskiej powierzchni i mocno przytrzymać. Wziąć fiolkę z rozpuszczalnikiem z podłączonym systemem Mix2Vial™ i obrócić ją do góry dnem. Umieścić przezroczystą część zestawu na górze fiolki z proszkiem i mocno wcisnąć aż do zatrzaśnięcia (ryc. 4). Rozpuszczalnik przepływa automatycznie do fiolki z proszkiem.
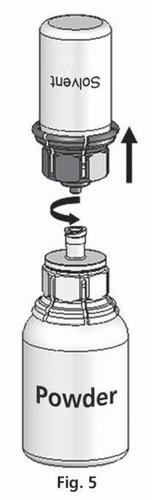
- 5. Z jednocześnie podłączonymi obiema fiolkami delikatnie obracać fiolką z proszkiem do czasu rozpuszczenia produktu. Rozpuszczanie jest zakończone w mniej niż 10 minut w temperaturze pokojowej. Podczas przygotowania może powstać nieznaczna piana. Rozkręcić Mix2Vial™ na dwie części (ryc. 5). Piana zniknie.
Wyrzucić pustą fiolkę z rozpuszczalnikiem z niebieską częścią
Mix2Vial™.
Instrukcja wykonywania wstrzyknięcia:
Jako środek ostrożności należy przed wstrzyknięciem i w czasie wstrzyknięcia zbadać tętno.
W przypadku znacznego zwiększenia częstotliwości tętna należy zmniejszyć szybkość wstrzykiwania
lub przerwać podawanie leku na krótki czas.
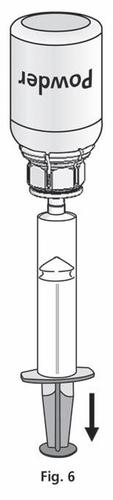
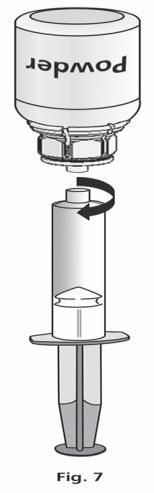
- 1. Podłączyć strzykawkę do przezroczystej części Mix2Vial™. Obrócić fiolkę do góry dnem i pobrać roztwór do strzykawki (ryc. 6). Roztwór w strzykawce powinien być przejrzysty lub lekko perłowy, błyszczący. Po przeniesieniu roztworu mocno przytrzymać tłok strzykawki (trzymając go skierowanym do dołu) i wyjąć strzykawkę z Mix2Vial™ (ryc. 7). Wyrzucić Mix2Vial™ i pustą fiolkę.
- 2. Oczyścić wybrane miejsce wstrzyknięcia jednym z dołączonych wacików nasączonych alkoholem.
- 3. Podłączyć dostarczoną igłę do wstrzykiwań do strzykawki.
- 4. Wprowadzić igłę do wybranej żyły. W przypadku użycia opaski uciskowej w celu uwidocznienia żyły należy rozluźnić opaskę przed rozpoczęciem wstrzykiwania produktu Pharmavate. Krew nie może przedostać się do strzykawki z powodu ryzyka wytworzenia się skrzepów fibryny.
- 5. Roztwór wstrzykiwać powoli do żyły, nie szybciej niż 2-3 ml na minutę.
W przypadku używania więcej niż jednej fiolki proszku Pharmavate w trakcie jednego podania możliwe
jest ponowne zastosowanie tej samej igły i strzykawki. Zestaw Mix2Vial™ jest przeznaczony wyłącznie
do jednorazowego użycia.
Instrukcja przygotowania roztworu z użyciem zestawu transferowego (1 igła dwustronna i 1 igła filtrująca):
- 1. Nie używać produktu bezpośrednio po wyjęciu z lodówki. Należy ogrzać proszek i rozpuszczalnik w zamkniętych fiolkach do uzyskania temperatury pokojowej. Taką temperaturę należy utrzymywać podczas przygotowywania. Jeśli do ogrzewania używana jest wanna do kąpieli, należy zwrócić uwagę, aby woda nie stykała się z gumowymi zatyczkami (bez lateksu) lub z kapslami fiolek. Temperatura łaźni wodnej nie powinna przekraczać + 37°C.
- 2. Usunąć wieczka z fiolki z proszkiem oraz z fiolki z rozpuszczalnikiem (rys. 1) i wyczyścić gumowe korki jednym z dołączonych wacików nasączonych alkoholem (rys. 2).
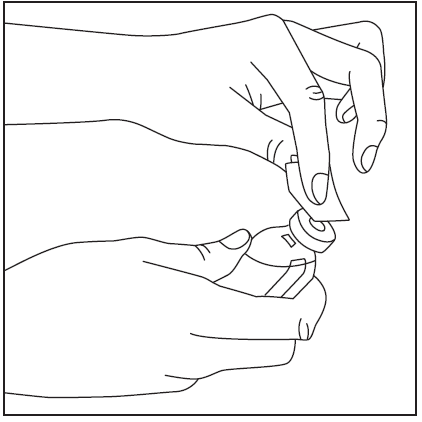
rys.1
rys.2
rys.1
rys.2
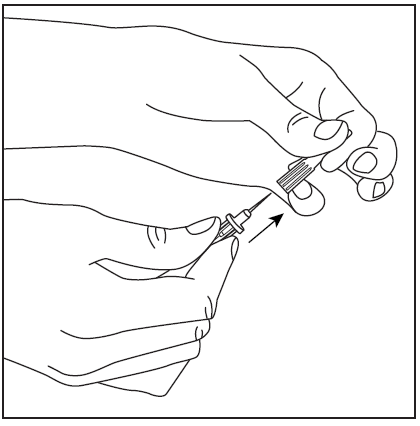
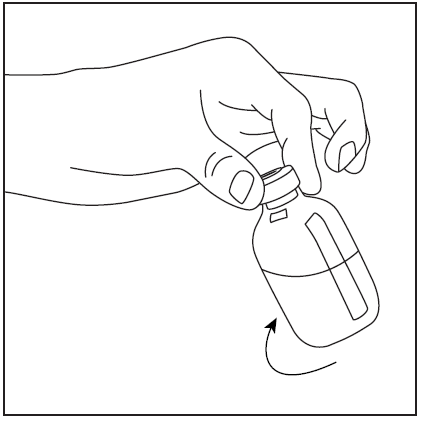
- 3. Zdjąć osłonę ochronną z krótkiego końca igły dwustronnej (rys. 3), upewniając się, aby nie dotknąć odkrytej końcówki igły. Następnie przekłuć środek gumowego korka fiolki z rozpuszczalnikiem z igłą w pionie (rys. 4). W celu całkowitego wycofania płynu z fiolki z rozpuszczalnikiem, igłę należy wprowadzić do korka gumowego w taki sposób, aby wnikał do korka i był widoczny w fiolce.
rys. 4
rys.3
rys.4
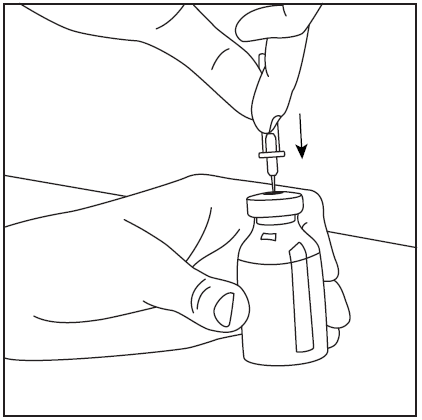
- 4. Zdjąć osłonę ochronną z drugiej, dłuższej końcówki igły dwustronnej, upewniając się, aby nie dotknąć odkrytej końcówki igły (rys. 5). Wziąć fiolkę z rozpuszczalnikiem oraz wprowadzoną igłą do góry dnem powyżej fiolki z proszkiem i szybko przebić igłą środek gumowego korka fiolki z proszkiem (rys. 6). Próżnia wewnątrz fiolki powoduje przepływ rozpuszczalnika do fiolki z proszkiem.
rys.6
rys.5
rys.6
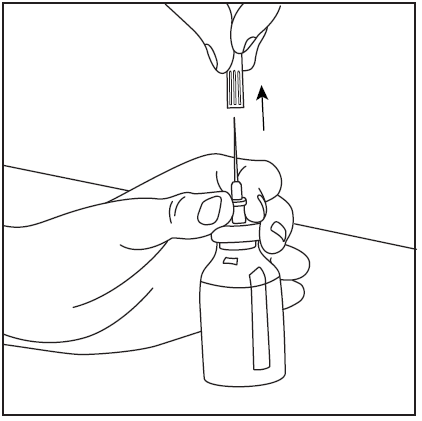
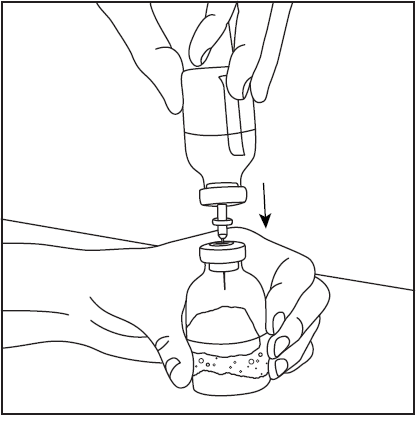
- 5. Wyjąć igłę dwustronną wraz z pustą fiolką po rozpuszczalniku (rys. 7), następnie powoli obracać fiolkę z proszkiem i rozpuszczalnikiem do czasu rozpuszczenia produktu. Pharmavate rozpuszcza się szybko w temperaturze pokojowej do klarownego roztworu (rys. 8).
rys.8
rys.7
rys.8
Instrukcja wykonywania wstrzyknięcia:
Jako środek ostrożności należy przed wstrzyknięciem i w czasie wstrzyknięcia zbadać tętno.
W przypadku znacznego zwiększenia częstotliwości tętna należy zmniejszyć szybkość wstrzykiwania
lub przerwać podawanie leku.
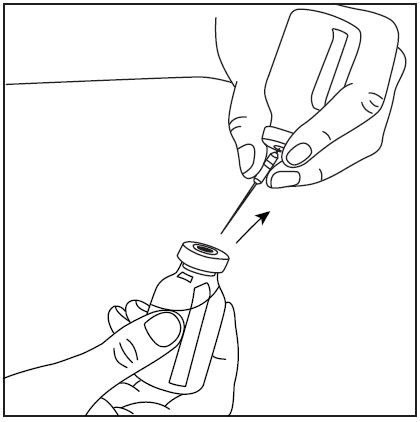
- 1. Po przygotowaniu proszku w sposób opisany powyżej, zdjąć osłonę ochronną z igły filtracyjnej i przekłuć gumowy korek fiolki z przygotowanym koncentratem.
- 2. Zdjąć nasadkę igły filtrującej i dołączyć strzykawkę.
- 3. Odwrócić fiolkę z dołączoną strzykawką do góry dnem i pobrać roztwór do strzykawki.
- 4. Oczyścić wybrane miejsce wstrzyknięcia jednym z dołączonych wacików nasączonym alkoholem.
- 5. Zdjąć igłę filtrującą ze strzykawki i dołączyć igłę do infuzji do strzykawki.
- 6. Wstrzyknąć roztwór do żyły, nie szybciej niż 2-3 ml na minutę.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami.
Pacjenci stosujący więcej niż jedną fiolkę koncentratu Pharmavate mogą użyć do wstrzyknięcia tej
samej igły do infuzji i strzykawki, ale igła filtrująca jest przeznaczona tylko do jednorazowego użytku.
Podczas pobierania roztworu do strzykawki zawsze należy używać igły filtrującej.
Zastosowanie większej niż zalecana dawki leku Pharmavate
Nie obserwowano objawów przedawkowania ludzkiego VIII czynnika krzepnięcia. Jednak zaleca się
nie przekraczać zalecanej dawki.
Pominięcie przyjęcia leku Pharmavate
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki. Należy niewzłocznie
przejść do kolejnej dawki i kontynuować dawkowanie zgodnie z zaleceniem lekarza lub farmaceuty.
Należy skontaktować się z lekarzem lub farmaceutą w przypadku innych pytań dotyczących stosowania
tego produktu.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Pomimo, że występują rzadko(mogą występować u 1 osoby na 1000), obserwowano występowanie
reakcji nadwrażliwości lub alergicznych u pacjentów leczonych produktami zawierającymi czynnik
VIII.
Należy skontaktować się z lekarzem, jeśli wystąpią następujące objawy:
wymioty, uczucie pieczenia i parzącego bólu w miejscu infuzji, uczucie ucisku w klatce piersiowej,
dreszcze, tachykardia, nudności, uczucie mrowienia, zaczerwienienie, ból głowy, pokrzywka, spadek
ciśnienia krwi, wysypka, niepokój, obrzęk twarzy, ust, jamy ustnej, języka lub gardła, który może
prowadzić do utrudnienia w połykaniu lub oddychaniu (obrzęk naczynioruchowy), zmęczenie (letarg),
świszczący oddech.
Bardzo rzadko(mogą występować u 1 osoby na 10 000) nadwrażliwość może prowadzić do
wystąpienia zagrażającej życiu reakcji alergicznej nazywanej anafilaksją, która może obejmować
wstrząs, jak również część lub wszystkie objawy opisane powyżej. W takim przypadku należy
natychmiast skontaktować się z lekarzem lub wezwać pogotowie ratunkowe.
Inne rzadkie działania niepożądane (mogą występować u 1 osoby na 1000)
Gorączka
W przypadku dzieci nieleczonych wcześniej lekami zawierającymi czynnik VIII, przeciwciała
blokujące (patrz punkt 2) mogą powstawać bardzo często (więcej niż 1 na 10 pacjentów). Jednak
u pacjentów, którzy wcześniej byli leczeni czynnikiem VIII (ponad 150 dni leczenia) ryzyko jest niezbyt
częste (mniej niż 1 na 100 pacjentów). Jeżeli tak się stanie, leki pacjenta mogą przestać działać
prawidłowo i u pacjenta może wystąpić utrzymujące się krwawienie. Jeżeli tak się stanie, należy
natychmiast skontaktować się z lekarzem.
Informacje związane z bezpieczeństwem wirusowym, patrz punkt 2. (Należy zachować szczególną
ostrożność stosując Pharmavate).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych
Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i
Produktów Biobójczych
Al. Jerozolimskie 181C
PL - 02-222 Warszawa
tel.: +48 22 49 21 301
faks: +48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Pharmavate
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności podanego na etykiecie. Termin ważności odnosi
się do ostatniego dnia podanego miesiąca.
Przechowywać w temperaturze poniżej 25˚C.
Nie zamrażać.
Przechowywać w opakowaniu zewnętrznym w celu ochrony przed światłem.
Roztwór po rekonstytucji należy zużyć natychmiast i tylko w trakcie jednego podania.
Nie stosować tego leku, jeśli zauważy się, że roztwór jest mętny lub niecałkowicie rozpuszczony.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Pharmavate
Substancją czynnąleku jest ludzki VIII czynnik krzepnięcia krwi.
Objętość i stężenia
| Wielkość fiolki z proszkiem Pharmavate® (j.m. czynnika VIII) | Wielkość fiolki z rozpuszczalnikiem (do dodania do fiolki z proszkiem Pharmavate®) (ml) | Nominalne stężenie roztworu po rekonstytucji (j.m. czynnika VIII/ml) |
| 250 j.m. | 5 | 50 |
| 500 j.m. | 10 | 50 |
| 1 000 j.m. | 10 | 100 |
Pozostałe składniki to:
Dla proszku: sodu cytrynian, sodu chlorek, wapnia chlorek, glicyna
Dla rozpuszczalnika: woda do wstrzykiwań
Jak wygląda lek Pharmavate i co zawiera opakowanie
Pharmavate występuje w postaci proszku i rozpuszczalnika do sporządzania roztworu do wstrzykiwań.
Biały lub jasnożółty proszek, lub krucha masa.
Rozpuszczalnik jest czystym, bezbarwnym płynem.
3 dostępne wielkości opakowań różnią się zawartością VIII czynnika krzepnięcia i rozpuszczalnika:
- 250 j.m./fiolkę: po rekonstytucji w 5 ml moc wynosi 50 j.m./ml
- 500 j.m./fiolkę: po rekonstytucji w 10 ml moc wynosi 50 j.m./ml
- 1000 j.m./fiolkę: po rekonstytucji w 10 ml moc wynosi 100 j.m./ml
Wszystkie wielkości opakowań zawierają:
1 system do transferu Mix2Vial , 1 strzykawkę jednorazowego użytku, 1 igłę do wstrzykiwań
i 2 waciki nasączone alkoholem
lub
1 zestaw do transferu (1 igła dwustronna i 1 igła filtrująca), 1 strzykawkę jednorazowego użytku,
1 igłę do wstrzykiwań i 2 waciki nasączone alkoholem.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny
Octapharma (IP) SPRL
Route de Lennik 451
1070 Anderlecht
Belgia
Wytwórca
Octapharma Pharmazeutika Produktionsges.m.b.H
Oberlaaer Str. 235
1100 Wiedeń
Austria
Octapharma S.A.S
72 Rue du Maréchal Foch
67380 Lingolsheim
Francja
Octapharma AB
112 75 Stockholm
Szwecja
Data ostatniej aktualizacji ulotki: 01.01.2025
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterOctapharma AB Octapharma Pharmazeutika Produktionsges.m.g.H. Octapharma S.A.S.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki PharmavatePostać farmaceutyczna: Proszek, 1000 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 2000 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 250 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga recepty
Odpowiedniki Pharmavate w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Pharmavate – Hiszpania
Odpowiednik Pharmavate – Ukraina
Lekarze online w sprawie Pharmavate
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Pharmavate – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














