
REFACTO AF 2000 UI, POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar REFACTO AF 2000 UI, POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
ReFacto AF 250 UI polvo y disolvente para solución inyectable
ReFacto AF 500 UI polvo y disolvente para solución inyectable
ReFacto AF 1000 UI polvo y disolvente para solución inyectable
ReFacto AF 2000 UI polvo y disolvente para solución inyectable
moroctocog alfa (factor de coagulación VIII humano recombinante)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es ReFacto AF y para qué se utiliza
- Qué necesita saber antes de empezar a usar ReFacto AF
- Cómo usar ReFacto AF
- Posibles efectos adversos
- Conservación de ReFacto AF
- Contenido del envase e información adicional
1. Qué es ReFacto AF y para qué se utiliza
ReFacto AF contiene el principio activo moroctocog alfa, factor de coagulación VIII humano. El factor VIII es necesario para que la sangre forme coágulos y detenga las hemorragias. En los pacientes con hemofilia A (deficiencia del factor VIII de nacimiento) no está presente o no actúa adecuadamente.
ReFacto AF se utiliza para el tratamiento y la prevención (profilaxis) de episodios hemorrágicos en adultos y niños de todas las edades (incluidos recién nacidos) con hemofilia A.
2. Qué necesita saber antes de empezar a usar ReFacto AF
No use ReFacto AF
- si es alérgico a moroctocog alfa o a alguno de los demás componentes de este medicamento (incluidos en la sección 6);
- si es alérgico a las proteínas de hámster.
Consulte a su médico si tiene dudas.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar ReFacto AF
- si sufre reacciones alérgicas. Algunos de los signos de las reacciones alérgicas son dificultad para respirar, falta de aliento, hinchazón, urticaria, picores, opresión torácica, silbidos al respirar y tensión arterial baja. La anafilaxia es una reacción alérgica grave que produce dificultad para tragar o para respirar, enrojecimiento o hinchazón de las manos, de la cara o de ambas. Si se presenta alguno de esos síntomas, interrumpa la perfusión inmediatamente y póngase en contacto con su médico o busque asistencia médica de urgencias inmediata. En casos de reacciones alérgicas graves se debe plantear tratamiento alternativo.
- la formación de inhibidores (anticuerpos) es una complicación conocida que puede producirse durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, especialmente en niveles elevados, impiden que el tratamiento funcione correctamente, por lo que se les supervisará cuidadosamente a usted o a su hijo por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se está controlando con ReFacto AF, consulte a su médico inmediatamente.
- si su hemorragia no se detiene como cabría esperar póngase en contacto con su médico o busque asistencia médica de urgencia inmediatamente.
Otros medicamentos y ReFacto AF
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
La influencia de ReFacto AF sobre la capacidad para conducir y utilizar máquinas es nula.
ReFacto AF contiene sodio
Tras la reconstitución, ReFacto AF contiene 1,27 mmol (o 29 mg) de sodio (componente principal de la sal de mesa/para cocinar) por vial. Esto equivale al 1,5% de la ingesta diaria máxima de sodio recomendada para un adulto. Según su peso corporal y su dosis de ReFacto AF, podría recibir múltiples viales. Esto se debe tener en cuenta si usted sigue una dieta baja en sal.
3. Cómo usar ReFacto AF
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
El tratamiento con ReFacto AF debe ser iniciado por un médico con experiencia en el tratamiento de pacientes con hemofilia A. Su médico decidirá la dosis de ReFacto AF que debe recibir. Esta dosis y su duración dependerán de sus necesidades individuales de tratamiento sustitutivo con factor VIII. ReFacto AF se administra mediante inyección en una vena y dicha inyección dura varios minutos. Las inyecciones de ReFacto AF pueden ser administradas por los pacientes o por sus cuidadores, siempre que hayan recibido la formación adecuada.
Durante su tratamiento su médico puede modificar la dosis de ReFacto AF que usted recibe.
Consulte con su médico antes de viajar. Cuando viaje debe llevar su producto de factor VIII en cantidad suficiente para el tratamiento previsto.
Se recomienda que cada vez que se administre ReFacto AF registre el nombre que figura en el envase y el número de lote del producto. Puede pegar una de las etiquetas despegables que se encuentran en el vial para documentar el número del lote en su diario o para notificar cualquier efecto secundario.
Reconstitución y administración
Las instrucciones facilitadas a continuación son una guía para la reconstitución y administración de ReFacto AF. Los pacientes deben seguir las instrucciones de reconstitución y administración específicas indicadas por sus médicos.
Para la reconstitución utilice sólo la jeringa precargada que se encuentra en el envase. Para la administración se pueden utilizar otras jeringas estériles desechables.
ReFacto AF se administra por perfusión intravenosa (IV) después de reconstituir el polvo liofilizado para inyección con la jeringa de disolvente suministrada, [una solución inyectable de cloruro sódico de 9 mg/ml (0,9%)]. No se debe mezclar ReFacto AF con otras soluciones para perfusión.
Lávese siempre las manos antes de realizar la reconstitución y administración. Durante el procedimiento de reconstitución debe seguirse una técnica aséptica (es decir, limpia y libre de gérmenes).
Reconstitución:
- Espere a que el vial liofilizado de ReFacto AF y la jeringa precargada del disolvente alcancen la temperatura ambiente.
- Retire el tapón de cierre de plástico del vial de ReFacto AF para que quede visible la parte central del tapón de goma.
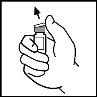
- Limpie la parte superior del vial con la toallita empapada en alcohol que se proporciona o con otra solución antiséptica, y espere a que se seque. Después de limpiarlo no toque el tapón de goma con la mano ni deje que éste toque ninguna superficie.
- Despegue la tapa del envase del adaptador del vial de plástico transparente. No saque el adaptador del envase.
- Coloque el vial en una superficie plana. Mientras sujeta el envase del adaptador, coloque el adaptador del vial sobre el vial y presione con firmeza sobre el envase hasta que el adaptador encaje en la parte superior del vial y el punzón del adaptador penetre en el tapón del vial.
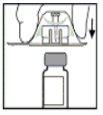
- Retire el envase del adaptador y deseche el envase.
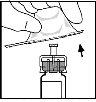
- Acople la varilla del émbolo a la jeringa de disolvente insertando la varilla en la apertura del tapón de la jeringa, presionándola y girándola con firmeza hasta que esté asentada en el tapón.
- Retire la punta del tapón de plástico de la jeringa de disolvente rompiendo la perforación de la tapa. Esto se consigue doblando la tapa hacia arriba y hacia abajo hasta que se rompa la perforación. No toque el interior de la tapa ni la punta de la jeringa. Puede ser necesario volver a colocar la tapa (si no se administra de inmediato el ReFacto AF reconstituido), por lo que debe colocarse a un lado sobre su parte superior.
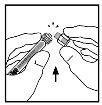
- Coloque el vial sobre una superficie plana. Conecte la jeringa de disolvente al adaptador del vial insertando la punta de la jeringa en la apertura del adaptador mientras se presiona y gira con firmeza en el sentido de las agujas del reloj hasta que queda fija la conexión.
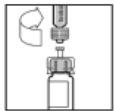
- Empuje lentamente la varilla del émbolo para inyectar todo el disolvente en el vial de ReFacto AF.
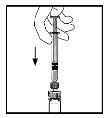
- Con la jeringa aún conectada al adaptador, gire suavementeel vial hasta disolver el polvo.

- Inspeccione visualmente la solución final en cuanto a la presencia de partículas antes de la administración. La solución tendrá un aspecto de transparente a ligeramente opalescente y será incolora.
Nota: Si usa más de un vial de ReFacto AF por perfusión, cada vial debe reconstituirse siguiendo las instrucciones anteriores. La jeringa de disolvente debe ser retirada, dejando el adaptador del vial colocado en su sitio y puede utilizarse otra jeringa grande con cierre luer para extraer los contenidos reconstituidos de cada uno de los viales individuales.
- Asegúrese de que la varilla del émbolo de la jeringa está aún totalmente introducida, dé la vuelta al vial y vuelva a poner lentamente toda la solución en la jeringa a través del adaptador del vial.
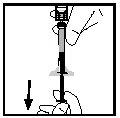
- Separe la jeringa del adaptador del vial tirando de la jeringa y girándola en el sentido contrario al de las agujas del reloj. Deseche el vial con el adaptador.
Nota: Si no se usa inmediatamente la solución, se ha de colocar nuevamente la tapa de la jeringa cuidadosamente. No tocar la punta de la jeringa ni el interior de la tapa.
ReFacto AF debe utilizarse inmediatamente, o en las 3 horas siguientes a su reconstitución. Antes de la administración, la solución reconstituida puede conservarse a temperatura ambiente.
Administración (Perfusión Intravenosa):
ReFacto AF debe administrarse utilizando el sistema de perfusión suministrado en este envase y la jeringa precargada de disolvente que se suministra o una jeringa de plástico estéril desechable con cierre luer.
- Acople la jeringa a la conexión luer del sistema de perfusión.
- Aplique un torniquete y prepare el sitio de inyección limpiando bien la piel con una de las toallitas con alcohol que se suministran.
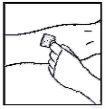
- Inserte la aguja del sistema de perfusión en la vena, siguiendo las instrucciones de su médico, y retire el torniquete. Elimine el aire que pueda haber en el sistema de perfusión aspirándolo a la jeringa. Se debe inyectar por vía intravenosa el producto reconstituido en varios minutos. Su médico puede cambiarle la velocidad de perfusión recomendada para que sea más cómoda.
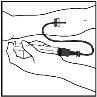
Deseche la solución no utilizada, el vial(es) vacío(s) y las agujas y jeringas utilizadas en un recipiente adecuado para eliminar desechos médicos, ya que estos materiales pueden dañar a otros si no se eliminan adecuadamente.
Si usa más ReFacto AF del que debe
Consulte a su médico o farmacéutico.
Si interrumpe el tratamiento con ReFacto AF
No deje de utilizar ReFacto AF sin consultar con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Reacciones alérgicas
Si aparecen reacciones alérgicas(anafilácticas) súbitas, graves, debe detenerse inmediatamentela infusión. Debe consultar a su médico inmediatamentesi usted presenta alguno de los siguientes síntomas tempranos de reacciones alérgicas:
- erupción, habón urticarial, ronchas, picor generalizado
- hinchazón de labios y lengua
- dificultad para respirar, silbidos al respirar, opresión en el pecho
- sensación general de malestar
- mareo y pérdida de consciencia
Los síntomas graves, como la dificultad para respirar y el desmayo (o el casi desmayo), precisan de un rápido tratamiento de emergencia. Las reacciones alérgicas (anafilácticas) súbitas, graves son poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
Desarrollo de inhibidores
En los niños que no han recibido tratamiento previo con medicamentos compuestos por factor VIII, pueden producirse anticuerpos inhibidores (ver sección 2) muy frecuentemente (más de 1 de cada 10 pacientes); sin embargo, en los pacientes que han recibido tratamiento previo con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto sucede, los medicamentos que toman usted o su hijo pueden dejar de funcionar correctamente y usted o su hijo pueden sufrir una hemorragia persistente. En ese caso, contacte con su médico inmediatamente.
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 pacientes)
- desarrollo de inhibidores en pacientes que nunca habían sido tratados previamente con productos de factor VIII
- dolor de cabeza
- tos
- dolor articular
- fiebre
Efectos adversos frecuentes(pueden afectar hasta 1 de cada 10 pacientes)
- hemorragia
- mareo
- pérdida del apetito, diarrea, vómitos, dolor de estómago, náuseas
- urticaria, erupción cutánea, picor
- dolor muscular
- escalofríos, reacción relacionada con la localización del catéter
- algunos análisis de sangre pueden mostrar un incremento de anticuerpos contra el factor VIII
Efectos adversos poco frecuentes(pueden afectar hasta 1 de cada 100 pacientes)
- desarrollo de inhibidores en pacientes que habían sido tratados previamente con productos de factor VIII (menos de 1 de cada 100 pacientes)
- reacción alérgica grave
- entumecimiento, somnolencia, alteración del gusto
- dolor en el pecho, latidos cardíacos rápidos, palpitaciones
- presión arterial baja, dolor y enrojecimiento de las venas relacionado con la presencia de coágulos de sangre, rubefacción
- dificultad para respirar
- sudoración excesiva
- debilidad, reacción en el lugar de la inyección (incluido el dolor)
- ligero aumento de las enzimas cardiacas
- aumento de las enzimas hepáticas, aumento de la bilirrubina
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de ReFacto AF
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase exterior y en la etiqueta del vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar refrigerado (2°C-8°C). No congelar para evitar que se dañe la jeringa precargada que contiene el disolvente.
Para su comodidad, el medicamento se puede retirar de dicho almacenamiento y conservar a temperatura ambiente (hasta 25ºC) durante un único período de 3 meses como máximo. Al final de este periodo de almacenamiento a temperatura ambiente el producto no debe volver a refrigerarse, sino debe ser utilizado o desechado. Anote en el envase exterior la fecha en la que se retira el ReFacto AF de la nevera y se pone a temperatura ambiente (hasta 25ºC). Mantenga el vial dentro del envase exterior para protegerlo de la luz.
El producto reconstituido debe utilizarse en las 3 horas siguientes a la reconstitución.
La solución será de clara a ligeramente opalescente e incolora. No utilizar este medicamento si aprecia que es turbia o contiene partículas visibles.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de ReFacto AF
- El principio activo es moroctocog alfa (factor VIII de coagulación recombinante). Cada vial de ReFacto AF contiene nominalmente 250, 500, 1000 o 2000 UI de moroctocog alfa.
- Los demás componentes son sacarosa, dihidrato de cloruro cálcico, L-histidina, polisorbato 80 y cloruro sódico (ver sección 2 “ReFacto AF contiene sodio”). También se suministra un disolvente [solución inyectable de cloruro sódico de 9 mg/ml (0,9%)] para la reconstitución.
- Después de la reconstitución con el disolvente [solución de cloruro sódico de 9 mg/ml (0,9%)], cada vial contiene 62,5; 125; 250 o 500 UI, respectivamente (según la potencia de moroctocog alfa, es decir, 250, 500, 1000 o 2000 UI) de moroctocog alfa por 1 ml de solución preparada para inyección.
Aspecto del producto y contenido del envase
ReFacto AF es un vial de vidrio con polvo para inyección y un disolvente suministrado en una jeringa precargada.
El contenido del envase es:
- un vial de 250, 500, 1000 o 2000 UI de polvo de moroctocog alfa
- una jeringa precargada de disolvente, 4 ml de solución estéril inyectable de cloruro sódico de 9 mg/ml (0,9%), con una varilla de émbolo
- un dispositivo estéril de adaptación al vial para reconstitución
- un sistema de perfusión estéril
- dos toallitas con alcohol
- esparadrapo
- una gasa
Titular de la autorización de comercialización
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Bélgica
Responsable de la fabricación
Wyeth Farma S.A
Autovía del Norte A-1 Km 23
Desvío Algete Km 1
28700 San Sebastián de los Reyes
Madrid
España
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
België/Belgique/Belgien Luxembourg/Luxemburg Pfizer NV/SA Tél/Tel: +32 (0)2 554 62 11 | Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel: +370 5 251 4000 |
???????? ??????? ?????????? ????, ???? ???????? ???.: +359 2 970 4333 | Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
Ceská republika Pfizer, spol. s r.o. Tel: +420 283 004 111 | Malta Vivian Corporation Ltd. Tel: +356 21344610 |
Danmark Pfizer ApS Tlf.: +45 44 20 11 00 | Nederland Pfizer bv Tel: +31 (0)800 63 34 636 |
Deutschland PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Norge Pfizer AS Tlf: +47 67 52 61 00 |
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 | Österreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
Ελλ?δα Pfizer Ελλ?ς Α.Ε Τηλ: +30 210 6785800 | Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
España Pfizer S.L. Tel: +34 91 490 99 00 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
France Pfizer Tél: +33 (0)1 58 07 34 40 | România Pfizer Romania S.R.L. Tel: +40 (0) 21 207 28 00 |
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 | Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400 |
Ireland Pfizer Healthcare Ireland Unlimited Company Tel: 1800 633 363 (toll free) Tel: +44 (0)1304 616161 | Slovenská republika Pfizer Luxembourg SARL, organizacná zložka Tel: + 421 2 3355 5500 |
Ísland Icepharma hf. Sími: +354 540 8000 | Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 | Sverige Pfizer AB Tel: + 46 (0)8 550 520 00 |
Κ?προς Pfizer Ελλ?ς Α.Ε. (Cyprus Branch) Τηλ: +357 22817690 | |
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 670 35 775 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a REFACTO AF 2000 UI, POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere recetaForma farmacéutica: INYECTABLE, 1.500 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere recetaForma farmacéutica: INYECTABLE, 1000 UI - tras reconstitución en 2 ml de agua para inyectables la dosis es de 500 UI/mlPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere receta
Médicos online para REFACTO AF 2000 UI, POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de REFACTO AF 2000 UI, POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















