

Beriate 2000

Zapytaj lekarza o receptę na Beriate 2000

Jak stosować Beriate 2000
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA
UŻYTKOWNIKA
Beriate
Beriate 250, 250 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań /
do infuzji
Beriate 500, 500 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań /
do infuzji
Beriate 1000, 1000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań /
do infuzji
Beriate 2000, 2000 j.m. Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań /
do infuzji
Ludzki VIII czynnik krzepnięcia
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Beriate i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Beriate
- 3. Jak stosować lek Beriate
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Beriate
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Beriate i w jakim celu się go stosuje
Co to jest Beriate?
Beriate składa się z proszku i rozpuszczalnika. Przygotowany roztwór służy do podawania
dożylnego w postaci wstrzykiwań lub infuzji.
Beriate jest produkowany z ludzkiego osocza (płynna część krwi) i zawiera ludzki VIII czynnik
krzepnięcia. Jest stosowany do profilaktyki i leczenia krwawień spowodowanych brakiem VIII
czynnika (hemofilia typu A) we krwi. Może być także stosowany w leczeniu nabytego
niedoboru VIII czynnika krzepnięcia.
W jakim celu stosuje się Beriate?
Czynnik VIII jest związany z procesem krzepnięcia krwi. Brak VIII czynnika powoduje, iż
krew nie krzepnie tak szybko jak powinna i w związku z tym występuje zwiększona tendencja
do krwawień. Uzupełnienie VIII czynnika za pomocą leku Beriate czasowo usprawnia
mechanizmy krzepnięcia krwi.
2. Informacje ważne przed zastosowaniem leku Beriate
Następujące części zawierają informacje, które należy wziąć pod uwagę przed zastosowaniem
Beriate.
Kiedy nie stosować leku Beriate
- Jeśli pacjent ma uczulenie (alergię) na substancję czynną (ludzki VIII czynnik krzepnięcia) lub którykolwiek ze składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Identyfikowalność
Szczególnie zaleca się, aby przy każdym podaniu pacjentowi Beriate odnotować w dzienniku
leczenia datę podania leku, numer serii oraz wstrzykniętą objętość.
Przed rozpoczęciem stosowania Beriate należy omówić to z lekarzem lub farmaceutą.
- Możliwe są reakcje nadwrażliwości typu alergicznego. Pacjenci powinni być poinformowani przez lekarza o wczesnych objawach reakcji nadwrażliwości,takich jak pokrzywka, uogólniona wysypka skórna, ucisk w klatce piersiowej, świszczący oddech, spadek ciśnienia krwi i anafilaksja (ciężka reakcja alergiczna powodująca poważne trudności w oddychaniu lub zawroty głowy). W razie wystąpienia takich objawów,pacjenci powinni natychmiast odstawić produkt i skontaktować się z lekarzemprowadzącym.
- Tworzenie inhibitorów(przeciwciał) jest znanym powikłaniem, które może występować w trakcie leczenia wszystkimi lekami zawierającymi czynnik VIII. Inhibitory te, zwłaszcza przy wysokich stężeniach, przerywają prawidłowe leczenie i pacjent będzie uważnie monitorowany pod kątem wytwarzania tych inhibitorów. Jeżeli krwawienie u pacjenta nie jest prawidłowo kontrolowane przy użyciu leku Beriate, należy natychmiast powiedzieć o tym lekarzowi.
- W przypadku istniejącej choroby serca lub ryzyka jej wystąpienia należy powiedzieć o tym lekarzowi lub farmaceucie.
- Jeżeli do podawania Beriate wymagane jest urządzenie do centralnego dostępu żylnego (ang. central venous access device, CVAD), lekarz powinien uwzględnić ryzyko wystąpienia powikłań związanych z CVAD, w tym zakażeń miejscowych, pojawienia się bakterii we krwi (bakteriemii) i tworzenia się skrzepów w naczyniach krwionośnych (zakrzepicy) w miejscu wprowadzenia cewnika.
Lekarz powinien starannie rozważyć korzyści wynikające z leczenia lekiem Beriate w stosunku
do ryzyka wystąpienia tych komplikacji.
Bezpieczeństwo stosowania pod względem możliwości przeniesienia wirusów
W przypadku leków wytwarzanych z ludzkiej krwi lub osocza podejmowane są odpowiednie
środki zapobiegawcze przed przeniesieniem zakażenia na pacjentów.
Na środki te składa się dokładny dobór dawców krwi i osocza w celu wykluczenia nosicieli
chorób zakaźnych oraz badanie każdej donacji i puli osocza pod kątem wirusów / zakażeń.
Wytwórcy tych produktów włączają również do procesu produkcyjnego procedury, które
inaktywują lub usuwają wirusy lub inne patogeny. Pomimo zastosowania tych środków, przy
podawaniu leków pochodzących z ludzkiej krwi lub osocza, nie można całkowicie wykluczyć
możliwości przeniesienia czynników zakaźnych. Dotyczy to również nieznanych lub nowo
poznanych wirusów i innych rodzajów zakażeń.
Stosowane środki zabezpieczające są uważane za skuteczne wobec wirusów otoczkowych,
takich jak ludzki wirus niedoboru odporności (HIV, wirus wywołujący AIDS), wirus zapalenia
wątroby typu B i C (zapalenie wątroby) oraz wobec wirusów bezotoczkowych, takich jak wirus
zapalenia wątroby typu A i parwowirus B19.
W przypadku regularnego lub wielokrotnego otrzymywania produktów pochodzących
z ludzkiego osocza (np. czynnika VIII), lekarz może zalecić szczepienie przeciwko zapaleniu
wątroby typu A i B.
Lek Beriate a inne leki
- Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować.
- Beriate nie należy mieszać z innymi produktami medycznymi, rozcieńczalnikami i rozpuszczalnikami, poza zalecanymi przez wytwórcę (patrz punkt 6).
Ciąża, karmienie piersią i wpływ na płodność
- Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
- Lek Beriate należy stosować w okresie ciąży i karmienia piersią tylko w uzasadnionych wskazaniach.
- Dane dotyczące wpływu na płodność nie są dostępne.
Prowadzenie pojazdów i obsługiwanie maszyn
Lek Beriate nie upośledza zdolności prowadzenia pojazdów i obsługiwania maszyn.
Beriate zawiera sód
Beriate 250 j.m. i 500 j.m. zawiera mniej niż 1 mmol sodu (23 mg) na fiolkę, więc można uznać
iż jest zasadniczo „wolny od sodu”.
Beriate 1000 j.m. i 2000 j.m. zawiera 27,55 mg sodu (główny składnik soli kuchennej) na każdą
fiolkę. Jest to równoważne z 1,4% zalecanej maksymalnej dziennej dawki sodu dla osoby
dorosłej.
3. Jak stosować lek Beriate
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza lub farmaceuty. W razie
wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Leczenie hemofilii A należy rozpocząć i prowadzić pod nadzorem lekarza mającego
doświadczenie w leczeniu tego typu schorzeń.
Zalecana dawka
Potrzebna ilość czynnika VIII oraz czas trwania leczenia zależą od kilku czynników, takich jak
masa ciała, nasilenie choroby, miejsce i intensywność krwawienia lub konieczność
zapobieżenia krwawieniu podczas zabiegu operacyjnego lub badania.
Jeżeli zalecone zostało stosowanie leku Beriate w domu, lekarz powinien poinformować
pacjenta o tym, w jaki sposób należy wstrzykiwać lek i jaką jego ilość stosować.
Należy przestrzegać zaleceń otrzymanych od lekarza lub pielęgniarki z ośrodka leczenia
hemofilii.
Stosowanie u dzieci i młodzieży
Dawkę określa się na podstawie masy ciała, stosując tę samą zasadę jak dla dorosłych.
Zastosowanie większej niż zalecana dawki leku Beriate
Nie odnotowano żadnych objawów przedawkowania FVIII.
Pominięcie zastosowania dawki Beriate
Kolejną dawkę należy zastosować natychmiast i kontynuować przyjmowanie w regularnych
odstępach zgodnie z zaleceniami lekarza. Nie należy stosować dawki podwójnej w celu
uzupełnienia pominiętej dawki.
Odtwarzanie i sposób podawania Zalecenia ogólne:
- Proszek powinien zostać zmieszany (zrekonstytuowany) z rozpuszczalnikiem (częścią płynną) i pobrany z fiolki w warunkach aseptycznych.
- Odtworzony roztwór powinien być przezroczysty lub lekko opalizujący tj. może połyskiwać, gdy jest obserwowany pod światło. Czasami w fiolce mogą pojawić się pojedyncze kłaczki lub cząstki. Filtr będący częścią urządzenia Mix2Vial usuwa cząstki stałe. Filtracja nie ma wpływu na obliczanie dawki. Przed podaniem, po przefiltrowaniu i pobraniu produktu do strzykawki (patrz poniżej) roztwór powinien zostać sprawdzony wzrokowo w celu wykluczenia obecności małych cząstek i przebarwień. Nie używać roztworu, jeśli jest mętny lub zawiera osad albo cząsteczki w strzykawce.
- Po przeniesieniu do strzykawki produkt należy natychmiast zużyć. Nie należy przechowywać produktu w strzykawce.
- Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami i zaleceniami lekarza.
Rekonstytucja:
Nie otwierając fiolek ogrzać proszek Beriate oraz rozpuszczalnik do temperatury pokojowej
lub temperatury ciała. Można to osiągnąć zarówno przez pozostawienie fiolek na około godzinę
w temperaturze pokojowej lub trzymając przez kilka minut w dłoniach.
NIE poddawać fiolek bezpośredniemu działaniu źródeł ciepła. Fiolek nie wolno ogrzewać do
temperatury wyższej niż temperatura ciała (37ºC).
Ostrożnie usunąć wieczka zabezpieczające z fiolek z proszkiem i z rozpuszczalnikiem,
przetrzeć powierzchnię gumowych korków wacikiem nasączonym alkoholem i zostawić do
wyschnięcia przed otwarciem opakowania z Mix2Vial, a następnie postępować zgodnie
z poniższą instrukcją.
- 1. Otworzyć opakowanie Mix2Vial poprzez usunięcie wieczka. Niewyjmować Mix2Vial z blistra!
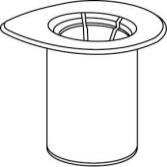
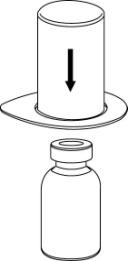
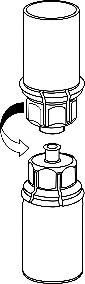
- 2. Umieścić fiolkę z rozpuszczalnikiemna równej i czystej powierzchni i mocno przytrzymać. Nie wyjmować zestawu Mix2Vial z blistra. Naciskając końcówką niebieskiego łącznika pionowow dółprzebić korek fiolki z rozpuszczalnikiem.
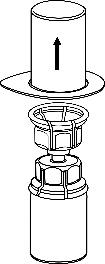
- 3. Ostrożnie zdjąć blister z zestawu Mix2Vial przytrzymując krawędź i pociągając pionowodo góry. Należy zwrócić uwagę, aby zdjąć jedynie blister, a nie cały zestaw Mix2Vial.
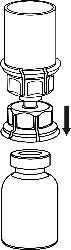
4 .Postawić fiolkę z produktem na równej i twardej powierzchni.
Odwrócić do góry dnem fiolkę z rozpuszczalnikiem i dołączonym
do niej zestawem Mix2Vial i naciskając końcówką
przezroczystego łącznikapionowow dółprzebić korek fiolki z
produktem. Rozpuszczalnik samoczynnie spłynie do fiolki
z produktem.
- 5. Jedną ręką chwycić fiolkę z produktem leczniczym przyłączoną do zestawu Mix2Vial, drugą zaś ręką uchwycić fiolkę z rozpuszczalnikiem także przyłączoną do zestawu Mix2Vial i ostrożnie rozkręcić zestaw na dwie części, przekręcając przeciwnie do ruchu wskazówek zegara. Usunąć fiolkę po rozpuszczalniku z przyłączonym do niej niebieskim łącznikiem zestawu Mix2Vial.
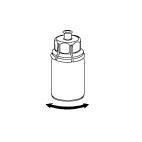
- 6. Doprowadzić do pełnego rozpuszczenia substancji, delikatnie poruszając ruchem obrotowym fiolkę z produktem z przyłączonym przezroczystym łącznikiem. Nie wstrząsać.
7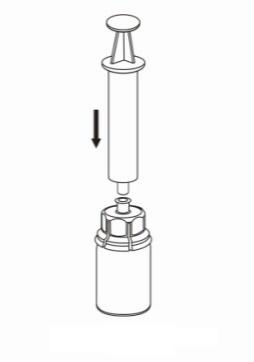 |
|
Pobieranie i podawanie:
- 8. Przytrzymując wciśnięty tłok strzykawki, odwrócić cały zestaw do góry dnem i napełniać strzykawkę roztworem, powoli odciągając tłok strzykawki.
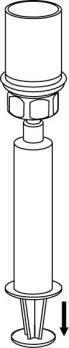
- 9. Roztwór znajduje się teraz w strzykawce. Mocno trzymając cylinder strzykawki (z tłokiem strzykawki skierowanym ku dołowi), odłączyć przezroczysty łącznik zestawu Mix2 Vial od strzykawki, przekręcając przeciwnie do ruchu wskazówek zegara.
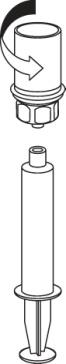
Wprowadzić igłę do żyły używając załączonego zestawu do wkłuć dożylnych. Pozwolić, by
krew wpłynęła do końca rurki. Dołączyć strzykawkę do gwintowanego, mocującego końca
zestawu do wkłucia dożylnego. Zgodnie z zaleceniami lekarza należy powoli wstrzykiwać
zrekonstytuowany roztwór dożylnie. Szybkość wstrzyknięcia lub infuzji nie powinna
przekraczać 2 ml na minutę. Należy zwrócić uwagę, aby krew nie dostała się do strzykawki
zawierającej produkt.
Jeżeli konieczne jest podanie większej objętości, można to również zrobić za pomocą infuzji.
W tym celu należy przenieść produkt po rekonstytucji do zatwierdzonego do użycia zestawu
infuzyjnego. Infuzję należy przeprowadzić zgodnie z zaleceniami lekarza.
Należy zwrócić uwagę na wystąpienie jakiegokolwiek działania niepożądanego. Jeżeli takie
działanie może być związane z podawaniem Beriate, wstrzykiwanie lub infuzja powinna zostać
przerwana (patrz także punkt 2).
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy
zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one
wystąpią.
Jeżeli wystąpi jakikolwiek z następujących objawów należy natychmiast powiadomić lekarza lub pogotowie ratunkowe, lub oddział leczenia hemofilii w najbliższym szpitalu:
- Objawy obrzęku naczynioruchowego, takie jak
- obrzęk twarzy, języka lub krtani
- trudności w połykaniu
- pokrzywka i trudności w oddychaniu Powyższe działania niepożądane obserwowano bardzo rzadko (mogą występować u mniej niż 1 na 10 000 pacjentów) i w niektórych przypadkach mogą one prowadzić do ciężkich reakcji alergicznych (anafilaksji), ze wstrząsem włącznie.
- Ustanie skuteczności leczenia (utrzymujące się krwawienia). W przypadku dzieci nieleczonych wcześniej lekami zawierającymi czynnik VIII, przeciwciała blokujące ( patrz punkt 2) mogą powstawać bardzo często (więcej niż 1 na 10 pacjentów). Jednak u pacjentów, którzy wcześniej byli leczeni czynnikiem VIII ( ponad 150 dni leczenia), ryzyko jest niezbyt częste (mniej niż 1 na 100 pacjentów). Jeżeli tak się stanie, leki pacjenta mogą przestać działać prawidłowo i u pacjenta może wystąpić utrzymujące się krwawienie. Jeżeli tak się stanie, należy natychmiast skontaktować się z lekarzem.
Inne działania niepożądane:
- Reakcje alergiczne (nadwrażliwości), wśród których mogą wystąpić:
- pieczenie i kłucie w miejscu wstrzyknięcia lub infuzji
- dreszcze, napady gorąca, uogólniona wysypka skórna, bąble
- ból głowy
- spadek ciśnienia krwi, niepokój, przyspieszenie rytmu serca, ucisk w klatce piersiowej, świszczący oddech
- uczucie zmęczenia (letarg)
- nudności, wymioty
- mrowienie Powyższe działania niepożądane obserwowano bardzo rzadko i w niektórych przypadkach mogą one prowadzić do ciężkich reakcji alergicznych (anafilaksji), ze wstrząsem włącznie.
- Bardzo rzadko obserwowano podwyższenie temperatury ciała.
Działania niepożądane u dzieci i młodzieży
Częstość, rodzaj i nasilenie reakcji niepożądanych u dzieci są porównywalne, jak u dorosłych
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane
niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie lub pielęgniarce.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Beriate
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i pudełku
po skrócie (EXP). Termin ważności oznacza ostatni dzień danego miesiąca.
Numer serii jest zapisany na etykiecie i pudełku po skrócie (Lot).
- Przechowywać w lodówce (2ºC - 8ºC ).
- W czasie trwania okresu ważności Beriate może być przechowywany w temperaturze nie wyższej niż 25ºC przez łączny okres 1 miesiąca. Poszczególne okresy przechowywania w temperaturze pokojowej powinny być odnotowywane w dokumentacji dotyczącej leczenia tak, aby łączny okres przechowywania w tej temperaturze nie przekroczył jednego miesiąca.
- Beriate nie zawiera środka konserwującego i pożądane jest jego podanie natychmiast po rekonstytucji.
- Jeżeli produkt po rekonstytucji nie zostanie podany natychmiast, jego okres przechowywania we fiolce nie powinien przekroczyć 8 godzin w temperaturze pokojowej. Po przeniesieniu do strzykawki produkt należy natychmiast zużyć.
- Nie zamrażać.
- Przechowywać pojemnik w opakowaniu zewnętrznym w celu ochrony przed światłem.
- Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
6. Zawartość opakowania i inne informacje
Co zawiera lek Beriate Substancją czynną leku jest:
Beriate jest dostępny w postaci proszku (zawierającego nominalnie 250 j.m., 500 j.m., 1000
j.m. lub 2000 j.m. ludzkiego VIII czynnika krzepnięcia na fiolkę) oraz części płynnej
(rozpuszczalnika). Roztwór po rekonstytucji służy do wstrzykiwań lub infuzji.
Beriate 250/500/1000 zrekonstytuowany przy pomocy 2,5 ml, 5 ml i 10 ml wody do
wstrzykiwań, odpowiednio, zawiera około 100 j.m./ml ludzkiego VIII czynnika krzepnięcia.
Beriate 2000 należy odtworzyć 10 ml wody do wstrzykiwań, a powstały w ten sposób roztwór
zawiera około 200 j.m./ml ludzkiego VIII czynnika krzepnięcia.
Pozostałe składniki to:
Glicyna, wapnia chlorek, sodu wodorotlenek (w niewielkich ilościach) do ustalenia pH,
sacharoza, sodu chlorek. Rozpuszczalnik:woda do wstrzykiwań 2,5 ml, 5 ml i 10 ml,
odpowiednio.
Jak wygląda lek Beriate i co zawiera opakowanie
Beriate dostępny jest w postaci białego proszku i jest dostarczany wraz z wodą do wstrzykiwań.
Roztwór po rekonstytucji powinien być przezroczysty do lekko opalizującego, tj. może
połyskiwać trzymany pod światło, ale nie może zawierać żadnych widocznych cząstek.
Dostępne opakowania
Opakowanie z 250 j.m. zawierające:
1 fiolka z proszkiem
1 fiolka z wodą do wstrzykiwań po 2,5 ml
1 system do transferu 20/20 z filtrem
Zestaw do podawania (opakowanie wewnętrzne):
1 strzykawka jednorazowego użytku o pojemności 5 ml
1 zestaw do wkłucia
2 waciki nasączone alkoholem
1 niejałowy plaster
Opakowanie z produktem leczniczym w dawce 500 j.m. zawierające:
1 fiolka z proszkiem
1 fiolka z wodą do wstrzykiwań po 5 ml
1 system do transferu 20/20 z filtrem
Zestaw do podawania (opakowanie wewnętrzne):
1 strzykawka jednorazowego użytku o pojemności 5 ml
1 zestaw do wkłucia
2 waciki nasączone alkoholem
1 niejałowy plaster.
Opakowanie z produktem leczniczym w dawce 1000 j.m. zawierające:
1 fiolka z proszkiem
1 fiolka z wodą do wstrzykiwań po 10 ml
1 system do transferu 20/20 z filtrem
Zestaw do podawania (opakowanie wewnętrzne):
1 strzykawka jednorazowego użytku o pojemności 10 ml
1 zestaw do wkłucia
2 waciki nasączone alkoholem
1 niejałowy plaster.
Opakowanie z produktem leczniczym w dawce 2000 j.m. zawierające:
1 fiolka z proszkiem
1 fiolka z wodą do wstrzykiwań po 10 ml
1 system do transferu 20/20 z filtrem
Zestaw do podawania (opakowanie wewnętrzne):
1 strzykawka jednorazowego użytku o pojemności 10 ml
1 zestaw do wkłucia
2 waciki nasączone alkoholem
1 niejałowy plaster.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
CSL Behring GmbH
Emil-von-Behring-Str. 76
35041 Marburg
Niemcy
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich
Europejskiego Obszaru Gospodarczego pod nazwą
Austria:
Beriate 100 I.E./ml Pulver und Lösungsmittel zur Herstellung einer Injektions- oder
Infusionslösung (250 I.E., 500 I.E., 1000 I.E.)
Beriate 200 I.E./ml Pulver und Lösungsmittel zur Herstellung einer Injektions- oder
Infusionslösung (2000 I.E.)
Bułgaria:
Beriate 250 IU Powder and solvent for solution for injection or infusion
Beriate 500 IU Powder and solvent for solution for injection or infusion
Beriate 1000 IU Powder and solvent for solution for injection or infusion
Beriate 2000 IU Powder and solvent for solution for injection or infusion
Chorwacja:
Beriate 250 IU prašak i otapalo za otopinu za injekciju ili infuziju
Beriate 500 IU prašak i otapalo za otopinu za injekciju ili infuziju
Beriate 1000 IU prašak i otapalo za otopinu za injekciju ili infuziju
Beriate 2000 IU prašak i otapalo za otopinu za injekciju ili infuziju
Czechy:
Beriate 250 IU, Beriate 500 IU, Beriate 1000 IU, Beriate 2000 IU
Estonia:
Beriate
Łotwa:
Beriate 250 SV pulveris un šķīdinātājs injekciju vai infūziju šķīduma pagatavošanai
Beriate 500 SV pulveris un šķīdinātājs injekciju vai infūziju šķīduma pagatavošanai
Beriate 1000 SV pulveris un šķīdinātājs injekciju vai infūziju šķīduma pagatavošanai
Beriate 2000 SV pulveris un šķīdinātājs injekciju vai infūziju šķīduma pagatavošanai
Litwa:
Beriate® 250 TV milteliai ir tirpiklis injekciniam ar infuziniam tirpalui
Beriate® 500 TV milteliai ir tirpiklis injekciniam ar infuziniam tirpalui
Beriate® 1000 TV milteliai ir tirpiklis injekciniam ar infuziniam tirpalui
Beriate® 2000 TV milteliai ir tirpiklis injekciniam ar infuziniam tirpalui
Niemcy:
Beriate 250, Beriate 500, Beriate 1000, Beriate 2000
Węgry:
Presentations of Beriate 250, 500 and 1000:
BERIATE 100 NE/ml por és oldószer oldatos injekcióhoz vagy infúzióhoz
Presentation 2000:
BERIATE 200 NE/ml por és oldószer oldatos injekcióhoz vagy infúzióhoz
Włochy:
Beriate
Polska:
Beriate 250
Beriate 500
Beriate 1000
Beriate 2000
Portugalia:
Beriate
Rumunia:
Beriate 250 pulbere şi solvent pentru soluţie injectabilă/perfuzabilă
Beriate 500 pulbere şi solvent pentru soluţie injectabilă/perfuzabilă
Beriate 1000 pulbere şi solvent pentru soluţie injectabilă/perfuzabilă
Beriate 2000 pulbere şi solvent pentru soluţie injectabilă/perfuzabilă
Hiszpania:
Beriate 250 UI polvo y disolvente para solución inyectable o perfusión
Beriate 500 UI polvo y disolvente para solución inyectable o perfusión
Beriate 1000 UI polvo y disolvente para solución inyectable o perfusión
Beriate 2000 UI polvo y disolvente para solución inyectable o perfusión
Słowacja:
Beriate 250 IU
Beriate 500 IU
Beriate 1000 IU
Beriate 2000 IU
Słowenia:
Beriate 250 i.e. prašek in vehikel za raztopino za injiciranje/infundiranje
Beriate 500 i.e. prašek in vehikel za raztopino za injiciranje/infundiranje
Beriate 1000 i.e. prašek in vehikel za raztopino za injiciranje/infundiranje
Beriate 2000 i.e. prašek in vehikel za raztopino za injiciranje/infundiranje
Data ostatniej aktualizacji ulotki: wrzesień 2021
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Dawkowanie
Monitorowanie leczenia
W czasie leczenia należy właściwie oznaczyć poziomy VIII czynnika w celu odmierzenia
właściwej dawki, która ma być podana pacjentowi oraz częstotliwości powtarzanych wlewów.
Reakcje poszczególnych pacjentów na VIII czynnik mogą być zróżnicowane, z uwagi na różne
poziomy odzysku oraz różne czasy półtrwania. Dawkowanie w oparciu o masę ciała może
wymagać dostosowania w przypadku pacjentów z nadwagą lub niedowagą. Szczególnie w
przypadku poważniejszych zabiegów chirurgicznych niezbędne jest dokładne monitorowanie
terapii substytucyjnej poprzez kontrolę procesu krzepnięcia (poziom aktywności VIII czynnika
w osoczu).
Pacjenci powinni być obserwowani pod kątem pojawienia się u nich inhibitorów VIII czynnika.
Patrz także punkt 2.
Liczba podawanych pacjentowi jednostek VIII czynnika wyrażona jest w jednostkach
międzynarodowych (j.m.), które odnoszą się do aktualnych standardów WHO dla koncentratu
produktów VIII czynnika krzepnięcia. Aktywność VIII czynnika krzepnięcia w osoczu jest
wyrażana jako odsetek (w odniesieniu do normalnego osocza ludzkiego) lub najlepiej w j.m.
(w odniesieniu do międzynarodowych standardów zawartości czynnika VIII w osoczu).
Jedna jednostka międzynarodowa aktywności czynnika VIII jest równa aktywności czynnika
VIII zawartego w 1 ml normalnego osocza ludzkiego.
Leczenie na żądanie
Przeliczanie wymaganego dawkowania czynnika VIII opiera się na empirycznym stwierdzeniu,
że 1 j.m. czynnika VIII na kg masy ciała zwiększa aktywność VIII osoczowego czynnika o
około 2% zwykłej aktywności (2 j.m./dl). Wymagane dawkowanie przeliczane jest przy użyciu
następującego wzoru:
Wymagana liczba jednostek = masa ciała [kg] x pożądany wzrost poziomu
VIII czynnika [% lub j.m./dl] x 0,5.
Dawka produktu oraz częstotliwość jego podawania powinna zawsze być indywidualnie
dobrana w zależności od efektywności klinicznej u poszczególnych pacjentów.
W razie wystąpienia następujących przypadków krwawienia, aktywność czynnika VIII nie
powinna spaść poniżej podanych wartości dla aktywności w osoczu (w % normy lub j.m./dl)
w odpowiadającym okresie czasu. Poniższa tabela przedstawia możliwe dawkowanie
w przypadkach krwawień i przy zabiegach chirurgicznych:
| Rodzaj krwawienia/ zabiegu chirurgicznego | Wymagany poziom czynnika VIII (% lub j.m./dl) | Częstotliwość dawkowania (godziny) / czas trwania leczenia (dni) |
| Krwawienia | ||
| Niewielki wylew do stawów, krwawienie z mięśnia lub jamy ustnej | 20-40 | Powtarzać co 12 do 24 godzin, co najmniej przez 1 dzień, do czasu ustąpienia bólu i ustania krwawienia lub wyleczenia. |
| Większy wylew do stawów, wylew do mięśnia lub krwiak | 30-60 | Powtarzać wlew co 12-24 godziny przez 3 do 4 dni lub więcej, do czasu ustąpienia bólu i ostrej dysfunkcji. |
| Krwotoki zagrażające życiu | 60-100 | Powtarzać wlew co 8 do 24 godzin, do czasu ustąpienia zagrożenia. |
| Zabiegi chirurgiczne | ||
| Niewielkie zabiegi chirurgiczne z ekstrakcją zęba włącznie | 30-60 | Co 24 godziny, co najmniej przez 1 dzień, do czasu wyleczenia. |
| Znaczne zabiegi chirurgiczne | 80-100 (przed i pooperacyjnie) | Powtarzać wlew co 8 – 24 godzin do odpowiedniego zagojenia rany, następnie terapeutycznie przez co najmniej 7 dni w celu utrzymania aktywności VIII czynnika wynoszącej 30% - 60% (30-60 j.m./dl, co odpowiada 0,30-0,60 j.m./ml). |
Profilaktyka
W długoterminowym postępowaniu profilaktycznym przeciw krwawieniom u chorych na
ciężką postać hemofilii typu A, podaje się zwykle od 20 do 40 j.m. czynnika VIII na kilogram
masy ciała w odstępach co 2 do 3 dni. W niektórych przypadkach, w szczególności u pacjentów
w młodym wieku, konieczne jest częstsze podawanie tego czynnika lub zastosowanie
większych dawek.
Dzieci i młodzież
Dawkowanie u dzieci uzależnione jest od masy ciała, w związku z tym wielkość dawki ustalana
jest na tej samej zasadzie, co u dorosłych. Częstość podawania powinna być zawsze ustalana
indywidualnie, w zależności od efektywności klinicznej. Opisywane są przypadki leczenia
dzieci młodszych niż w wieku 6 lat.
Informacje dotyczące właściwości farmakologicznych VWF
Oprócz swojej roli białka ochronnego dla VIII czynnika, czynnik von Willebranda pośredniczy
w adhezji płytek w miejscu urazu naczynia i odgrywa rolę w agregacji płytek.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterCSL Behring GmbH
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Beriate 2000Postać farmaceutyczna: Proszek, 1000 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 250 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 500 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga recepty
Odpowiedniki Beriate 2000 w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Beriate 2000 – Hiszpania
Odpowiednik Beriate 2000 – Ukraina
Lekarze online w sprawie Beriate 2000
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Beriate 2000 – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














