
Octanine F 1000

Zapytaj lekarza o receptę na Octanine F 1000

Jak stosować Octanine F 1000
Ulotka dołączona do opakowania: informacja dla użytkownika
OCTANINE F 500/OCTANINE F 1000, 500 j.m. / 1000 j.m., proszek
i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Ludzki IX czynnik krzepnięcia krwi
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek OCTANINE F i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku OCTANINE F
- 3. Jak stosować lek OCTANINE F
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek OCTANINE F
- 6. Zawartość opakowania i inne informacje
1. Co to jest OCTANINE F i w jakim celu się go stosuje
OCTANINE F należy do grupy leków nazywanych czynnikami krzepnięcia i zawiera
ludzki IX czynnik krzepnięcia krwi. Jest to specjalne białko, które zwiększa zdolność
krwi do krzepnięcia.
OCTANINE F jest stosowany w leczeniu i profilaktyce krwawień u pacjentów
z zaburzeniem krwawienia (hemofilią B). Jest to stan medyczny, w którym jest
przedłużone krwawienie w stosunku do oczekiwanego. Wynika ono z wrodzonego
niedoboru ilości IX czynnika krzepnięcia we krwi.
OCTANINE F jest dostarczany jako proszek i rozpuszczalnik do sporządzania
roztworu do wstrzykiwań. Po rozpuszczeniu jest podawany dożylnie (wstrzykiwany
do żyły).
2. Informacje ważne przed zastosowaniem leku OCTANINE F
Kiedy nie stosować leku OCTANINE F:
- jeśli pacjent ma uczulenie na ludzki IX czynnik krzepnięcia krwi lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6),
- jeśli u pacjenta występowała małopłytkowość wywołana heparyną typu II, która polega na spadku ilości płytek krwi po podaniu heparyny. Płytki krwi są komórkami krwi, które pomagają zatrzymać krwawienie. Heparynę stosuje się w celu zapobiegania zakrzepom krwi.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku OCTANINE F należy omówić to z lekarzem lub
farmaceutą.
- Wszystkie leki zawierające białko podawane dożylnie mogą wywołać reakcję nadwrażliwości typu alergicznego. OCTANINE F zawiera bardzo małe ilości innych białek niż czynnik IX i heparyna. Do wczesnych objawów reakcji nadwrażliwości należą:
- pokrzywka,
- wysypka (pokrzywka)
- uczucie ucisku w klatce piersiowej,
- świszczący oddech,
- spadek ciśnienia krwi,
- ostra, ciężka reakcja alergiczna (anafilaksja w przypadku, gdy jakiekolwiek lub wszystkie z wymienionych objawów rozwijają się szybko i są nasilone).
W przypadku wystąpienia powyższych objawów należy natychmiast wstrzymać
wstrzykiwanie i skontaktować się z lekarzem prowadzącym. W przypadku
wstrząsu anafilaktycznego lekarz musi jak najszybciej rozpocząć zalecane
leczenie.
- Zaleca się odpowiednie szczepienia przeciw wirusowemu zapaleniu wątroby typu A i B w przypadku regularnego lub powtarzanego stosowania produktów zawierających czynnik IX krzepnięcia krwi uzyskany z ludzkiego osocza.
- Znane jest zjawisko powstawania inhibitorów (przeciwciał neutralizujących) czynnika IX, wytwarzanych przez komórki immunologiczne u pacjentów z hemofilią B. Inhibitory mogą nasilać ryzyko wystąpienia wstrząsu anafilaktycznego (ciężkich reakcji alergicznych). Dlatego zaleca się wykonanie testów na obecność inhibitora u pacjentów z reakcjami alergicznymi. Pacjenci z inhibitorami czynnika IX są narażeni na wyższe ryzyko wystąpienia anafilaksji po zastosowaniu czynnika IX. Dlatego pierwsze podanie czynnika IX, zgodnie z decyzją lekarza prowadzącego, powinno być przeprowadzone pod nadzorem medycznym w miejscu, gdzie można zapewnić odpowiednią pomoc w razie wystąpienia reakcji alergicznych.
- Podczas stosowania koncentratów białkowych zawierających czynnik IX może dochodzić do zaczopowania naczyń krwionośnych przez zakrzepy. Z powodu tego ryzyka, które jest wyższe w przypadku produktów słabo oczyszczonych, pacjenci powinni być monitorowani w kierunku występowania objawów zakrzepów krwi po podawaniu produktów zawierających czynnik IX w przypadku:
- występowania objawów fibrynolizy (rozpuszczania skrzepliny),
- pacjentów z rozsianym wykrzepianiem śródnaczyniowym (rozsiane krzepnięcie krwi w naczyniach krwionośnych),
- pacjentów ze zdiagnozowanymi chorobami wątroby,
- istnieją udokumentowane czynniki ryzyka sercowo-naczyniowego
- pacjentów po przebytych niedawno zabiegach operacyjnych,
- pacjentów ze zwiększonym ryzykiem występowania zakrzepów lub rozsianego wykrzepiania śródnaczyniowego.
W przypadku występowania któregokolwiek z powyższych zaburzeń u danego
pacjenta, lekarz zadecyduje o podaniu OCTANINE F po ocenie potencjalnych
korzyści wynikających z leczenia w stosunku do ryzyka związanego
z zastosowaniem leku.
- Po powtórnym leczeniu z użyciem produktów ludzkiego IX czynnika krzepnięcia krwi, pacjenci powinni być monitorowani w kierunku rozwoju przeciwciał neutralizujących (inhibitorów), których ilość określa się w jednostkach Bethesda (BU), używając odpowiednich testów biologicznych.
Zabezpieczenie leków wytwarzanych z krwi przed przeniesieniem zakażeń
wirusowych
o W przypadku leków wytwarzanych z ludzkiej krwi lub osocza stosuje się
odpowiednie metody zapobiegające przenoszeniu zakażeń na pacjentów.
Obejmują one: ścisłą selekcję dawców krwi i osocza w celu wyeliminowania
nosicieli zakażeń, badanie poszczególnych donacji i puli osocza w kierunku
specyficznych markerów wirusowych. Wytwórcy tych leków włączają również do
procesu produkcji metody mające na celu inaktywację lub usuwanie wirusów.
Pomimo tego, w przypadku podawania leków otrzymywanych z ludzkiej krwi lub
osocza, nie można całkowicie wykluczyć przeniesienia czynnika zakaźnego.
Dotyczy to także nieznanych lub nowo pojawiających się wirusów oraz innych
typów zakażeń.
o Metody te są uznawane jako skuteczne wobec wirusów otoczkowych, takich jak
wirus nabytego braku odporności (HIV), wirus zakażenia wątroby typu B (HBV)
i wirus zakażenia wątroby typu C (HCV) oraz bezotoczkowego wirusa zakażenia
wątroby typu A (HAV). Zastosowane metody mogą mieć ograniczoną
skuteczność w stosunku do wirusów bezotoczkowych takich jak parwowirus B19.
Zakażenie parwowirusem B19 może być groźne u kobiet w ciąży (zakażenie
płodu) oraz u pacjentów z niedoborami odporności oraz pewnymi typami
niedokrwistości (np. w niedokrwistości sierpowatokrwinkowej lub niedokrwistości
hemolitycznej).
Stanowczo zaleca się, aby przy każdorazowym podaniu dawki OCTANINE F
zapisać nazwę i numer serii produktu w celu zachowania zapisu użytych serii.
Dzieci
W przypadku podawania OCTANINE F noworodkom, należy je ściśle monitorować
w kierunku występowania objawów rozsianego wykrzepiania śródnaczyniowego.
OCTANINE F a inne leki
- Nie są znane interakcje ludzkiego IX czynnika krzepnięcia krwi z innymi lekami.
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych
przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje
przyjmować.
Ciąża i karmienie piersią
Nie ma doświadczenia w stosowaniu czynnika IX podczas ciąży i karmienia piersią.
Dlatego czynnik IX powinien być stosowany podczas ciąży i karmienia piersią, gdy
jest to ściśle wskazane.
Przed zastosowaniem jakiegokolwiek leku należy poradzić się lekarza lub
farmaceuty.
Lek OCTANINE F zawiera sód
Produkt leczniczy zawiera do 69 mg sodu (głównego składnika soli kuchennej)
w jednej fiolce OCTANINE F 500 j.m., co stanowi równowartość 3,45% zalecanej
maksymalnej dobowej dawki dla osób dorosłych oraz
do 138 mg sodu w jednej fiolce OCTANINE F 1000 j.m., co stanowi równowartość
6,9% maksymalnej dobowej dawki 2 g sodu u osób dorosłych.
Należy to uwzględnić u pacjentów na diecie z ograniczeniem sodu.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie zaobserwowano wpływu na zdolność prowadzenia pojazdów mechanicznych
i obsługiwania maszyn.
3. Jak stosować lek OCTANINE F
OCTANINE F należy zawsze stosować zgodnie z zaleceniami lekarza. W razie
wątpliwości należy zwrócić się do lekarza lub farmaceuty.
OCTANINE F powinien być podany dożylnie (wstrzyknięty do żyły) po rozpuszczeniu
w załączonym rozpuszczalniku.
Należy używać tylko załączonego zestawu do infuzji. Użycie innych zestawów do
wstrzykiwań/infuzji może powodować dodatkowe ryzyko i niepowodzenie leczenia.
Leczenie powinno być rozpoczęte pod nadzorem lekarza doświadczonego
w leczeniu hemofilii B. Dawkowanie OCTANINE F oraz długość trwania terapii zależy
od stopnia niedoboru czynnika IX. Jest zależne także od miejsca i rozległości
krwawienia oraz stanu klinicznego pacjenta.
Obliczenie dawki:
Dawka i częstotliwość podawania OCTANINE F będzie ustalona przez lekarza.
Liczba jednostek podawanego czynnika IX jest wyrażona w jednostkach
międzynarodowych (j.m.). Aktywność czynnika IX w osoczu odpowiada zawartości
czynnika IX w osoczu. Może być wyrażona procentowo (w stosunku do prawidłowego
osocza ludzkiego) lub w jednostkach międzynarodowych (w stosunku do
miedzynarodowego standardu dla czynnika IX w osoczu krwi).
Jedna jednostka międzynarodowa (j.m.) aktywności czynnika IX odpowiada ilości
czynnika IX w 1 ml prawidłowego osocza ludzkiego. Obliczenie wymaganej dawki
czynnika IX jest oparte na doświadczeniach empirycznych dowodzących, iż
1 jednostka międzynarodowa (j.m.) czynnika IX na kilogram masy ciała podwyższa
aktywność osoczowego czynnika IX o 1% normalnej aktywności. Aby obliczyć
należną dawkę, należy określić aktywność czynnika IX w osoczu pacjenta. To
pozwoli na określenie o ile aktywność powinna być zwiększona.
Wymagana dawka jest obliczana przy pomocy następującego wzoru:
Wymagana liczba jednostek = masa ciała (kg) x wymagany wzrost aktywności czynnika IX (%) (j.m./dl) x 0,8
Dawka jaka powinna być podana oraz częstość podawania leku powinny być zawsze
uzależnione od skuteczności klinicznej u indywidualnego pacjenta. Leki zawierające
czynnik IX rzadko wymagają podawania częściej niż jeden raz dziennie.
Odpowiedź na czynnik IX może różnić się u poszczególnych pacjentów, dlatego
należy oznaczać poziom czynnika podczas leczenia w celu ustalenia podawanej
dawki i częstości wykonywania infuzji. Zwłaszcza w przypadku większych zabiegów
chirurgicznych niezbędne jest monitorowanie aktywności czynnika IX w osoczu
podczas leczenia substytucyjnego.
Profilaktyka krwawień:
W długoterminowej profilaktyce krwawień u pacjentów z ciężką postacią hemofilii B
powinno podawać się czynnik IX w dawce 20 do 40 j.m. na kilogram masy ciała dwa
razy w tygodniu. Dawka powinna być dostosowana do indywidualnej odpowiedzi na
leczenie. W niektórych przypadkach, zwłaszcza u pacjentów młodszych, niezbędne
może być podawanie leku w krótszych odstępach czasu lub też w większych
dawkach.
Stosowanie u dzieci:
W przeprowadzonym badaniu klinicznym u dzieci poniżej 6 roku życia, średnia
dzienna dawka wynosiła 40 j.m./kg masy ciała.
Brak zahamowania krwawienia ze względu na obecność inhibitorów:
Jeżeli nie można osiągnąć pożądanej aktywności czynnika IX po wstrzyknięciu lub
krwawienie nie ustępuje po wstrzyknięciu odpowiedniej dawki, należy powiadomić
o tym lekarza. W takim przypadku lekarz zaleci wykonanie badań w celu wykrycia
inhibitorów (przeciwciał) czynnika IX. Inhibitory mogą powodować obniżenie
aktywności czynnika IX. W takim przypadku może być konieczne wybranie innej
metody leczenia. Zadecyduje o tym lekarz, jeżeli dalsze leczenie będzie konieczne.
Zastosowanie większej niż zalecana dawki leku OCTANINE F
Nie są znane żadne objawy przedawkowania ludzkiego IX czynnika krzepnięcia.
Jednakże nie należy przekraczać zalecanej dawki.
Instrukcja odnośnie leczenia w domu znajduje się w pudełku opakowania ze sprzętem.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie
u każdego one wystąpią.
- Reakcje nadwrażliwości lub alergiczne nie były obserwowane często u pacjentów leczonych produktami zawierającymi czynnik IX. Należały do nich:
odruchowy skurcz naczyń krwionośnych (spazmy) z obrzękiem twarzy, jamy
ustnej i gardła,
parzący i pieczący ból w miejscu infuzji,
dreszcze,
zaczerwienienie twarzy,
wysypka,
ból głowy,
pokrzywka,
spadek ciśnienia tętniczego,
uczucie zmęczenia,
nudności,
niepokój,
szybkie bicie serca,
uczucie ucisku w klatce piersiowej,
uczucie mrowienia,
wymioty,
świszczący oddech.
W niektórych przypadkach reakcje te mogą prowadzić do ciężkiej reakcji zwanej
anafilaksją, włączając wystąpienie wstrząsu. Te reakcje są głównie związane
z rozwojem inhibitorów czynnika IX. Należy poinformować lekarza w przypadku
wystąpienia którejkolwiek z wymienionych objawów.
- U pacjentów z hemofilią B mogą pojawić się przeciwciała neutralizujące (inhibitory) przeciwko czynnikowi IX. Te przeciwciała mogą odpowiadać za obniżoną skuteczność leczenia. Lekarz powinien przedyskutować to z pacjentem i określić dalsze leczenie, jeżeli będzie konieczne. Przeprowadzono badanie kliniczne u 25 dzieci z hemofilią B, z których 6 nie było wcześniej leczonych. Nie zaobserwowano powstawania inhibitorów w trakcie trwania badania. Tolerancja na wszystkie wstrzyknięcia określana była jako „bardzo dobra” i „dobra”.
- Niektórzy pacjenci z hemofilią B z inhibitorami czynnika IX, u których zastosowano indukcję tolerancji immunologicznej, rozwinęli zespół nefrotyczny (ciężkie schorzenie nerek).
- Gorączka może pojawiać się w rzadkich przypadkach.
- Produkty zawierające czynnik IX o niskiej czystości mogą w rzadkich przypadkach prowadzić do rozwoju zakrzepów w naczyniach krwionośnych. Może to prowadzić do następujących powikłań:
zawału mięśnia sercowego,
zespołu rozsianego wykrzepiania śródnaczyniowego (DIC),
zakrzepów w żyłach (zakrzepicy żylnej),
zakrzepów w płucach (zatorowości płucnej).
Te powikłania występują częściej w przypadku użycia produktów czynnika IX
o niskiej czystości i pojawiają się rzadko w przypadku stosowania produktów
o wysokiej czystości takich jak OCTANINE F.
- Heparyna zawarta w produkcie może powodować nagły spadek liczby płytek krwi poniżej 100 000/µl lub o 50% w stosunku do liczby wyjściowej. Jest to reakcja alergiczna nazywana „małopłytkowością wywołaną prze heparynę typu II”. W rzadkich przypadkach u pacjentów bez wcześniejszej nadwrażliwości na heparynę, ten spadek ilości płytek krwi może pojawić się pomiędzy 6 a 14 dniem od rozpoczęcia leczenia. U pacjentów z wcześniejszą nadwrażliwością na heparynę zmiana ta może pojawić się po kilku godzinach od rozpoczęcia leczenia. Ten poważny spadek płytek krwi może powodować lub być związany z:
zakrzepami krwi w tętnicach i żyłach,
zamknięciem światła naczynia krwionośnego przez zakrzep występujący
w innym miejscu,
ciężkim zaburzeniem krzepnięcia zwanym koagulopatią ze zużycia
czynników krzepliwości,
martwicą skóry w miejscu wstrzyknięcia,
krwawieniem punkcikowatym,
siniaczeniem,
smolistymi stolcami.
W przypadku pojawienia się tych reakcji alergicnych należy bezwłocznie przerwać wstrzykiwanie OCTANINE F i nie stosować w przyszłości leków
zawierających heparynę.Ze względu na ten rzadko pojawiający się wpływ
heparyny na płytki krwi, liczba płytek krwi u pacjenta powinna być często
kontrolowana, zwłaszcza przy rozpoczynaniu leczenia.
Informacje związane z ochroną przeciwko przenoszonym czynnikom zakaźnym,
patrz punkt 2 (należy stosować szczególną ostrożność stosując OCTANINE F).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane
niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie lub
pielęgniarce. Działania niepożądane można zgłaszać bezpośrednio do
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Al. Jerozolimskie 181C
- 02 - 222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: [email protected]
Działanie niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji
na temat bezpieczeństwa stosowania leku.
5. Jak przechowywać lek OCTANINE F
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie przechowywać w temperaturze powyżej 25˚C.
Nie zamrażać.
Przechowywać fiolkę w opakowaniu zewętrznym w celu ochrony przed światłem.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie
i pudełku. Termin ważności oznacza ostatni dzień podanego miesiąca.
Zaleca się zużyć rekonstytuowany produkt natychmiast, nie później niż w ciągu
8 godzin przechowywania w temperaturze pokojowej (25°C).
Lek OCTANINE F należy zużyć tylko podczas jednego podania. Nie stosować tego
leku, jeśli zauważy się, że roztwory są mętne lub niecałkowicie rozpuszczone.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki.
Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa. Takie
postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek OCTANINE F
Substancją czynnąleku jest ludzki IX czynnik krzepnięcia krwi.
Pozostałe składnikito: heparyna, sodu chlorek, sodu cytrynian, argininy
chlorowodorek i lizyny chlorowodorek.
Jak wygląda lek OCTANINE F i co zawiera opakowanie
OCTANINE F występuje w 2 wielkościach opakowań o nastepujacych mocach:
- OCTANINE F 500 występuje w postaci proszku i rozpuszczalnika do sporządzania roztworu do wstrzykiwań zawierającego nominalnie 500 j.m. ludzkiego czynnika krzepnięcia IX w fiolce.
Po rekonstytucji w 5 ml wody do wstrzykiwań produkt zawiera około 100 j.m./ml
ludzkiego IX czynnika krzepnięcia.
- OCTANINE F 1000 występuje w postaci proszku i rozpuszczalnika do sporządzania roztworu do wstrzykiwań zawierającego nominalnie 1000 j.m. ludzkiego czynnika krzepnięcia IX w fiolce.
Po rekonstytucji w 10 ml wody do wstrzykiwań produkt zawiera około 100 j.m./ml
ludzkiego IX czynnika krzepnięcia.
Produkt OCTANINE F jest wytwarzany z osocza pochodzenia ludzkiego.
Aktywność (w j.m.) oznaczana jest przy pomocy jednostopniowego testu krzepnięcia,
zgodnie z Farmakopeą Europejską, w porównaniu do międzynarodowego wzorca
Światowej Organizacji Zdrowia (WHO). Aktywność swoista leku OCTANINE F wynosi
około 100 j.m./mg białka.
Opis opakowania:
OCTANINE F jest sprzedawany w postaci opakowania zawierającego dwa pudełka
połączone plastikową taśmą.
Jedno pudełko zawiera fiolkę z proszkiem do sporządzania roztworu do wstrzykiwań
i ulotkę dla pacjenta.
Drugie pudełko zawiera fiolkę z rozpuszczalnikiem (woda do wstrzykiwań); 5 ml dla
OCTANINE F 500 lub 10 ml dla OCTANINE F 1000.
Opakowanie zawiera również następujące wyroby medyczne:
- 1 opakowanie ze sprzętem do wstrzyknięcia dożylnego (1 zestaw do transferu, 1 zestaw do infuzji, 1 strzykawka jednorazowego użytku),
- 2 waciki nasączone alkoholem.
Podmiot odpowiedzialny i wytwórca
W celu uzyskania bardziej szczegółowych informacji dotyczących tego leku należy
zwrócić się do miejscowego przedstawiciela podmiotu odpowiedzialnego.
Octapharma (IP) SPRL
Allée de la Recherche 65
1070 Anderlecht
Belgia
Wytwórca:
Octapharma S.A.S
70-72 Rue du Maréchal Foch
67380 Lingolsheim
Francja
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235
1100 Vienna
Austria
Data ostatniej aktualizacji ulotki: Marzec 2021
Instrukcja stosowania w domu
Należy przeczytać wszystkie instrukcje i dokładnie ich przestrzegać!
Podczas opisanej poniżej procedury należy zachować warunki jałowe!
Nie stosować produktu OCTANINE F po upływie terminu ważności zamieszczonego na etykiecie.
Przed podaniem należy sprawdzić wzrokowo, czy przygotowany roztwór produktu nie zawiera cząsteczek stałych ani przebarwień.
Roztwór powinien być przejrzysty lub lekko opalizujący. Nie stosować roztworów, które są mętne lub zawierają cząstki stałe.
Przygotowany roztwór zużyć niezwłocznie w celu zapobiegnięcia skażeniu mikrobiologicznemu.
Używać wyłącznie dostarczonego zestawu do infuzji. Stosowanie innego sprzętu do wstrzykiwań/infuzji może powodować dodatkowe zagrożenia i niepowodzenie leczenia.
Instrukcja przygotowania roztworu:
- 1. Nie używać produktu bezpośrednio po wyjęciu z lodówki. Pozostawić rozpuszczalnik i proszek w zamkniętych fiolkach aż do uzyskania temperatury pokojowej.
- 2. Usunąć wieczka z obu fiolek i wyczyścić gumowe korki jednym z dołączonych wacików nasączonych alkoholem.
- 3. Zestaw do transferu jest przedstawiony na ryc. 1. Umieścić fiolkę z rozpuszczalnikiem na płaskiej powierzchni i mocno przytrzymać. Wziąć zestaw do transferu i obrócić do góry dnem. Umieścić niebieską część zestawu do transferu na górze fiolki z rozpuszczalnikiem i mocno wcisnąć aż do zatrzaśnięcia (ryc. 2 + 3). Nie obracać podczas podłączania.
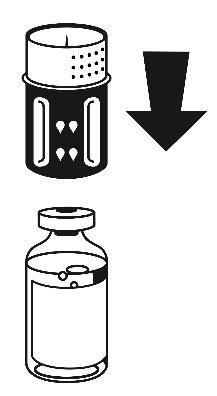
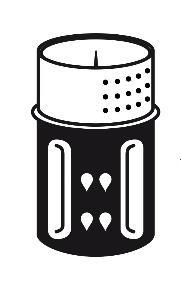
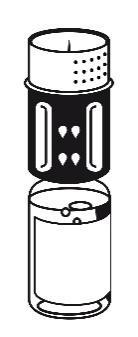
- 4. Umieścić fiolkę z proszkiem na płaskiej powierzchni i mocno
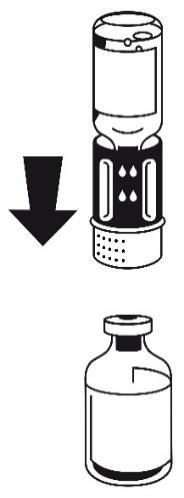
ryc. 1
ryc. 2
ryc. 3
przytrzymać. Wziąć fiolkę z rozpuszczalnikiem
z podłączonym zestawem do transferu i obrócić ją do góry
dnem. Umieścić białą część zestawu na górze fiolki z
proszkiem i mocno wcisnąć aż do zatrzaśnięcia (ryc. 4). Nie
obracać podczas podłączania. Rozpuszczalnik przepływa
automatycznie do fiolki z proszkiem.
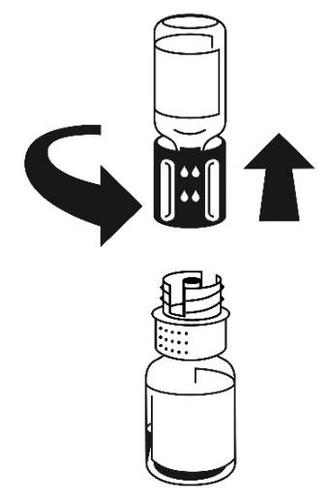
- 5. Mając nadal podłączone obie fiolki, delikatnie obracać fiolkę z proszkiem do czasu rozpuszczenia produktu. Rozpuszczanie nastąpi w czasie krótszym niż 10 minut w temperaturze pokojowej. Podczas przygotowania może powstać nieznaczna piana. Rozkręcić zestaw do transferu na dwie części (ryc. 5). Piana zniknie.
Wyrzucić pustą fiolkę z rozpuszczalnikiem razem z niebieską
częścią zestawu do transferu.
Instrukcja wykonywania wstrzyknięcia:
Jako środek ostrożności należy przed wstrzyknięciem i w czasie wstrzyknięcia
zbadać tętno. W przypadku znacznego zwiększenia częstości tętna należy
zmniejszyć szybkość wstrzykiwania lub przerwać podawanie leku na krótki czas.
- 1. Podłączyć strzykawkę do białej części zestawu do transferu. Obrócić fiolkę do góry dnem i pobrać roztwór do strzykawki (ryc. 6).
Roztwór w strzykawce powinien być przejrzysty lub lekko opalizujący.
Po przeniesieniu roztworu mocno przytrzymać tłok strzykawki (trzymając go
skierowanym do dołu) i wyjąć strzykawkę z zestawu do transferu (ryc. 7). Wyrzucić
pustą fiolkę razem z białą częścią zestawu do transferu.
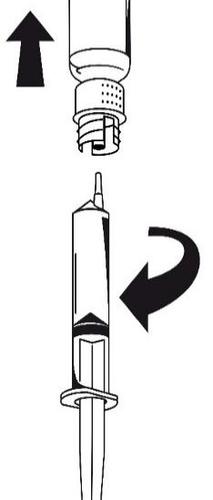
- 2. Oczyścić wybrane miejsce wstrzyknięcia jednym z dołączonych wacików nasączonych alkoholem.
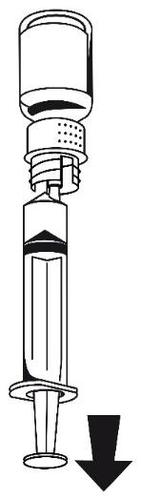
- 3. Podłączyć dostarczony zestaw do infuzji do strzykawki.
- 4. Wprowadzić igłę do wybranej żyły. W przypadku użycia opaski uciskowej w celu uwidocznienia żyły należy rozluźnić opaskę przed rozpoczęciem wstrzykiwania produktu OCTANINE F. Krew nie może przedostać się do strzykawki z powodu ryzyka wytworzenia się skrzepów fibryny.
- 5. Roztwór wstrzykiwać powoli do żyły, nie szybciej niż 2–3 ml na minutę.
W przypadku używania więcej niż jednej fiolki proszku OCTANINE F do jednego
cyklu leczenia możliwe jest ponowne zastosowanie tej samej igły i strzykawki.
Zestaw do transferu jest przeznaczony wyłącznie do jednorazowego użycia.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterOctapharma Pharmazeutika Produktionsgesellschaft mbH (OPG) Octapharma S.A.S.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Octanine F 1000Postać farmaceutyczna: Proszek, 1000 j.m./fiolkęSubstancja czynna: coagulation factor IXProducent: LFB-Biomedicaments LFB-BiomedicamentsWymaga receptyPostać farmaceutyczna: Proszek, 250 j.m./fiolkęSubstancja czynna: coagulation factor IXProducent: LFB-Biomedicaments LFB-BiomedicamentsWymaga receptyPostać farmaceutyczna: Proszek, 500 j.m./fiolkęSubstancja czynna: coagulation factor IXProducent: LFB-Biomedicaments LFB-BiomedicamentsWymaga recepty
Odpowiedniki Octanine F 1000 w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Octanine F 1000 – Hiszpania
Odpowiednik Octanine F 1000 – Ukraina
Lekarze online w sprawie Octanine F 1000
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Octanine F 1000 – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














