
Haemoctin 500

Zapytaj lekarza o receptę na Haemoctin 500

Jak stosować Haemoctin 500
Ulotka dołączona do opakowania: informacja dla użytkownika
Haemoctin 250
Haemoctin 500
Haemoctin 1000
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Ludzki VIII czynnik krzepnięcia krwi
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Haemoctin i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Haemoctin
- 3. Jak stosować lek Haemoctin
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Haemoctin
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Haemoctin i w jakim celu się go stosuje
Haemoctin jest lekiem wytwarzanym z osocza ludzkiego. Zawiera VIII czynnik krzepnięcia konieczny
do prawidłowego procesu krzepnięcia krwi. Po rozpuszczeniu proszku w wodzie do wstrzykiwań
roztwór jest gotowy do wstrzyknięcia dożylnego.
Lek Haemoctin jest stosowany w leczeniu i profilaktyce krwawień u pacjentów z hemofilią A
(wrodzonym niedoborem czynnika VIII).
Lek Haemoctin nie zawiera czynnika von Willebranda w ilościach skutecznych farmakologicznie, w
związku z tym nie jest przeznaczony do leczenia choroby von Willebranda.
2. Informacje ważne przed zastosowaniem leku Haemoctin
Kiedy nie stosować leku Haemoctin
- jeśli pacjent ma uczulenie na substancję czynną lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6). Reakcja alergiczna może obejmować wysypkę, świąd, trudności z oddychaniem lub obrzęk twarzy, warg, gardła lub języka.
Ostrzeżenia i środki ostrożności
Tworzenie inhibitorów (przeciwciał) jest znanym powikłaniem, które może występować w trakcie
leczenia wszystkimi lekami zawierającymi czynnik VIII. Inhibitory te, zwłaszcza przy wysokich
stężeniach, przerywają prawidłowe leczenie i pacjent będzie uważnie monitorowany pod kątem
wytwarzania tych inhibitorów. Jeżeli krwawienie u pacjenta nie jest prawidłowo kontrolowane przy
użyciu leku Haemoctin, należy natychmiast powiedzieć o tym lekarzowi.
Jeśli u pacjenta występują istniejące czynniki ryzyka chorób sercowo-naczyniowych, leczenie lekiem
Haemoctin może zwiększać ryzyko sercowo-naczyniowe. W razie wątpliwości należy omówić to z
lekarzem.
Powikłania wynikające z wprowadzenia cewnika naczyniowego: Jeśli wymagane jest urządzenie do
centralnego dostępu dożylnego (ang. central venous access device, CVAD), należy uwzględnić ryzyko
wystąpienia powikłań związanych z CVAD, w tym zakażeń miejscowych, bakteriemii i zakrzepicy w
miejscu wprowadzenia cewnika.
Bezpieczeństwo wirusologiczne
Gdy produkty lecznicze wytwarzane są z ludzkiej krwi lub osocza, podejmowane są określone
działania, aby zapobiec przenoszeniu zakażeń na pacjentów. Obejmują one:
- staranny dobór dawców krwi i osocza, aby zapewnić wykluczenie dawców, którzy mogą być nosicielami zakażeń,
- badania wszystkich pobranych próbek i puli osocza w celu wykrycia obecności wirusów/zakażeń,
- wdrożenie do procesu przetwarzania krwi lub osocza etapów mających na celu inaktywację lub usunięcie wirusów. Mimo tych działań, w przypadku podawania leków przygotowanych z ludzkiej krwi lub osocza, nie można całkowicie wykluczyć możliwości przeniesienia zakażenia. Dotyczy to również nieznanych lub nowo odkrytych wirusów lub innych rodzajów infekcji.
Podejmowane działania są uważane za skuteczne wobec wirusów otoczkowych, takich jak wirus
ludzkiego niedoboru odporności (HIV), wirus zapalenia wątroby typu B i wirus zapalenia wątroby
typu C, jak i bezotoczkowego wirusa zapalenia wątroby typu A. Podjęte działania mogą mieć
ograniczoną skuteczność wobec wirusów bezotoczkowych, takich jak parwowirus B19. Zakażenie
parwowirusem B19 może być groźne dla kobiet w ciąży (zakażenie płodu) i dla osób, których układ
odpornościowy jest osłabiony lub z niektórymi typami niedokrwistości (np. sierpowatą lub
hemolityczną).
Lekarz prowadzący może zalecić rozważenie przez pacjenta szczepienia przeciw wirusowi zapalenia
wątroby typu A i B, jeśli pacjent regularnie/wielokrotnie przyjmuje produkty zawierające czynnik VIII
wytwarzany z osocza ludzkiego.
Zdecydowanie zaleca się, aby w każdym przypadku otrzymywania dawki leku Haemoctin odnotować
nazwę i numer serii leku, aby ustalić w przyszłości stosowane serie leku.
Dzieci i młodzież
Ostrzeżenia i środki ostrożności dotyczące stosowania wymienione dla dorosłych należy uwzględnić
również dla dzieci i młodzieży.
Lek Haemoctin a inne leki
Należy powiedzieć lekarzowi o wszystkich lekach stosowanych przez pacjenta obecnie lub ostatnio, a
także o lekach, które pacjent planuje stosować.
Interakcje między lekiem Haemoctin i innymi produktami leczniczymi nie były zgłaszane.
Ciąża, karmienie piersią i wpływ na płodność
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza przed zastosowaniem tego leku.
Z powodu rzadkiego występowania hemofilii A u kobiet brak jest dostępnych doświadczeń
dotyczących stosowania czynnika VIII w czasie ciąży lub karmienia piersią. Nie przeprowadzono
doświadczeń na zwierzętach w czasie ciąży i karmienia.
Prowadzenie pojazdów i obsługiwanie maszyn
Lek Haemoctin nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i
obsługiwania maszyn.
Lek Haemoctin zawiera sód
Haemoctin 250 zawiera maksymalnie 16,1 mg (0,70 mmol) sodu (głównego składnika soli kuchennej)
w każdej fiolce. Odpowiada to 0,81 % maksymalnej zalecanej dobowej dawki sodu w diecie u osób
dorosłych.
Haemoctin 500/1000 zawiera maksymalnie 32,2 mg (1,40 mmol) sodu (głównego składnika soli
kuchennej) w każdej fiolce. Odpowiada to 1,61 % maksymalnej zalecanej dobowej dawki sodu
w diecie u osób dorosłych.
3. Jak stosować lek Haemoctin
Lek Haemoctin jest przeznaczony do podania dożylnego (wstrzyknięcie do żyły). Leczenie powinno
być pod nadzorem lekarza mającego doświadczenie w leczeniu hemofilii A. Lek Haemoctin należy
zawsze stosować zgodnie z zaleceniami lekarza. W przypadku wątpliwości należy ponownie
skontaktować się z lekarzem.
Dawka oraz czas leczenia zależą od stopnia niedoboru czynnika VIII, od umiejscowienia i rozległości
krwawienia oraz stanu klinicznego pacjenta. Lekarz ustali dawkę odpowiednią dla pacjenta.
Należy zapewnić sterylne warunki pracy podczas wszystkich etapów procedury.
Ryc. 1a
Ryc. 1b
Ryc. 1c
Ryc. 2
Ryc. 3



Ryc. 4
Ryc. 5
Ryc. 6
Ryc. 7
Ryc. 8





Rozpuszczanie koncentratu:
- Doprowadzić rozpuszczalnik (wodę do wstrzykiwań) i produkt do temperatury pokojowej w nieotwartych fiolkach. W przypadku stosowania łaźni wodnej do ogrzewania należy bardzo uważać, aby nie doszło do kontaktu wody z wieczkami lub korkami fiolek. W przeciwnym razie może dojść do skażenia leku.
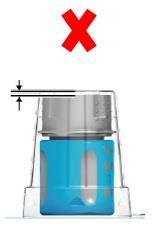
- Bardzo ważnedla właściwego zastosowania systemu transferowego: przed otwarciem należy upewnić się, że biała dolna część systemu transferowego jest osadzona bezpośrednio na podłożu blistra (ryc. 1a: dobrze / ryc. 1b: źle). Jeśli źle: wcisnąć system transferowy do dołu w blister, aż biała dolna część systemu transferowego będzie osadzona bezpośrednio na podłożu blistra (ryc. 1c).
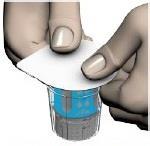
- Zdjąć wieczka z fiolki z rozpuszczalnikiem i fiolki z produktem, tak aby odsłonić środkowe części gumowych korków (ryc. 2). Oczyścić gumowe korki fiolek produktu i rozpuszczalnika środkiem dezynfekującym.
- Ściągnąć górę opakowania systemu transferowego (ryc. 3).
- Fiolkę z rozpuszczalnikiem umieścić na równej powierzchni. Umieścić niebieską część systemu transferowego w blistrze prosto na pionowo stojącej fiolce zawierającej rozpuszczalnik (ryc. 4). Nie przekręcać systemu transferowego!
- Ściągnąć pozostałą część blistra z systemu transferowego. Nie ściskać blistra! Teraz następuje odsłonięcie białej części systemu transferowego (ryc. 5).
- Fiolkę z produktem umieścić na równej powierzchni.
- Obrócić połączony system transferowy i fiolkę z rozpuszczalnikiem do góry dnem. Wcisnąć kolec białej części adaptera pionowo w dół przez korek fiolki z produktem (ryc. 6). Próżnia w fiolce z produktem powoduje przedostanie się rozpuszczalnika do fiolki z produktem.
- Delikatne kołysanie fiolki z produktem pomaga w rozpuszczeniu proszku. Nie wstrząsać energicznie, należy unikać powstania piany! Roztwór jest przejrzysty lub lekko opalizujący.
- Następnie odkręcić niebieską część systemu transferowego razem z fiolką z rozpuszczalnikiem w kierunku przeciwnym do ruchu wskazówek zegara (ryc. 7). Wyrzucić fiolkę z rozpuszczalnikiem z podłączoną niebieską częścią systemu transferowego. Teraz widoczne jest złącze luer-lock.
Gotowy do użycia roztwór należy zużyć niezwłocznie po rozpuszczeniu. Nie używać roztworów,
które są mętne lub zawierają cząstki stałe.
Wstrzyknięcie:
- Po rozpuszczeniu proszku w sposób opisany powyżej należy przykręcić załączoną strzykawkę do złącza luer-lock fiolki z produktem z białą częścią systemu transferowego (ryc. 8). Umożliwi to łatwe pobranie rozpuszczonego leku do strzykawki. Oddzielny filtr nie jest konieczny, ponieważ system transferowy jest wyposażony w zintegrowany filtr.
- Ostrożnie odłączyć fiolkę z białą częścią systemu transferowego od strzykawki. Powoli wstrzyknąć dożylnie produkt przy użyciu załączonej igły motylkowej. Zalecane jest, aby nie podawać więcej niż 2-3 ml/minutę.
- Po użyciu igły motylkowej można ją zabezpieczyć wieczkiem ochronnym.
Zastosowanie większej niż zalecana dawki leku Haemoctin
Jeśli pacjent uważa, że otrzymał zbyt dużą dawkę leku Haemoctin, powinien zwrócić się do lekarza,
który podejmie decyzję o dalszym leczeniu.
Pominięcie zastosowania leku Haemoctin
W takim przypadku lekarz prowadzący podejmie decyzję, czy konieczne jest dalsze leczenie.
Przerwanie stosowania leku Haemoctin
Nie należy przerywać stosowania leku Haemoctin bez konsultacji z lekarzem.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
W przypadku zaobserwowania któregokolwiek z poniższych objawów należy niezwłocznie powiadomić lekarza:
- zaczerwienienie skóry,
- uczucie pieczenia i kłucia w miejscu wstrzyknięcia,
- dreszcze,
- nagłe zaczerwienienie twarzy,
- ból głowy,
- pokrzywka,
- niedociśnienie,
- ospałość,
- nudności,
- niepokój ruchowy,
- częstoskurcz,
- ucisk w klatce piersiowej,
- mrowienie,
- wymioty,
- świszczący oddech. Może to być reakcja alergiczna lub ciężka reakcja alergiczna (wstrząs anafilaktyczny) lub reakcja nadwrażliwości.
Następujące działania niepożądane obserwowano podczas stosowania leku Haemoctin
Nieznana: częstość nie może być określona na podstawie dostępnych danych
- wstrząs (anafilaktyczny), reakcja alergiczna
- zaczerwienienie skóry, świąd, pokrzywka
W przypadku dzieci nieleczonych wcześniej lekami zawierającymi czynnik VIII, przeciwciała
blokujące (patrz punkt 2) mogą powstawać bardzo często (więcej niż 1 na 10 pacjentów). Jednak u
pacjentów, którzy wcześniej byli leczeni czynnikiem VIII (ponad 150 dni leczenia), ryzyko jest
niezbyt częste (mniej niż 1 na 100 pacjentów). Jeżeli tak się stanie, leki pacjenta mogą przestać działać
prawidłowo i u pacjenta może wystąpić utrzymujące się krwawienie. Jeżeli tak się stanie, należy
natychmiast skontaktować się z lekarzem
Działania niepożądane u dzieci i młodzieży
Z wyjątkiem wytwarzania się inhibitorów (przeciwciał) przewiduje się, że działania niepożądane u
dzieci są takie same jak u dorosłych.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Al. Jerozolimskie 181C
02 222 Warszawa
Tel.: +48 22 49 21 301
Faks: +48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Haemoctin
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Przechowywać fiolki w opakowaniu zewnętrznym w celu ochrony przed światłem.
Nie przechowywać w temperaturze powyżej 25˚C. Nie zamrażać.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie fiolki i
opakowaniu zewnętrznym po: Termin ważności.
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć zgodnie z lokalnymi
przepisami. Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki.
Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże
chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Haemoctin
- Substancją czynną leku jest: ludzki VIII czynnik krzepnięcia.
- Pozostałe składniki to: glicyna, sodu chlorek, sodu cytrynian i wapnia chlorek.
- Fiolka z rozpuszczalnikiem zawiera wodę do wstrzykiwań.
Jak wygląda lek Haemoctin i co zawiera opakowanie
Lek Haemoctin jest dostarczany w postaci liofilizowanego proszku (liofilizat). Woda do wstrzykiwań
służy jako rozpuszczalnik. Rozpuszczony produkt jest przejrzysty lub lekko opalizujący.
Haemoctin 250 zawiera 1 fiolkę z 250 j.m. i 1 fiolkę z 5 ml wody do wstrzykiwań (50 j.m./ml)
Haemoctin 500 zawiera 1 fiolkę z 500 j.m. i 1 fiolkę z 5 ml wody do wstrzykiwań (100 j.m./ml)
Haemoctin 1000 zawiera 1 fiolkę z 1000 j.m. i 1 fiolkę z 5 ml wody do wstrzykiwań (200 j.m./ml)
Każde opakowanie zawiera
- jedną strzykawkę jednorazowego użytku
- jeden system transferowy z zintegrowanym filtrem
- jedną igłę motylkową
Podmiot odpowiedzialny i wytwórca:
Biotest Pharma GmbH
Landsteinerstrasse 5
63303 Dreieich
Niemcy
Tel.: +49 6103 801-0
Faks: +49 6103 801-150
Email: [email protected]
Data ostatniej aktualizacji ulotki: 12/2022.
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Monitorowanie leczenia
Aby ustalić dawkę, jaka ma być podana i częstotliwość powtarzanych infuzji, podczas leczenia zaleca
się odpowiednie oznaczanie poziomów czynnika VIII. Poszczególni pacjenci mogą różnić się pod
względem odpowiedzi na czynnik VIII, wykazując zróżnicowane wartości czasu półtrwania i różne
poziomy odzysku. Dawka oparta na masie ciała może wymagać dostosowania u pacjentów
z niedowagą lub nadwagą. Zwłaszcza w przypadku dużych zabiegów chirurgicznych niezbędne jest
precyzyjne kontrolowanie leczenia substytucyjnego poprzez badanie krzepnięcia (aktywność
czynnika VIII w osoczu).
W przypadku stosowania jednostopniowego testu krzepnięcia in vitroopartego na czasie częściowej
tromboplastyny po aktywacji (aPTT) w celu oznaczenia aktywności czynnika VIII w próbkach krwi
pacjentów, zarówno rodzaj odczynnika aPTT jak i wzorzec odniesienia, używane w teście, mogą mieć
istotny wpływ na wyniki oznaczeń poziomu aktywności czynnika VIII w osoczu. Mogą również
występować znaczne różnice między wynikami jednostopniowego testu krzepnięcia opartego na aPTT
a wynikami testu chromogennego zgodnie z Farmakopeą Europejską. Jest to szczególnie ważne
w przypadku zmiany laboratorium i (lub) odczynników stosowanych w teście.
Dawkowanie
Dawka oraz czas leczenia substytucyjnego zależą od stopnia niedoboru czynnika VIII, od
umiejscowienia i rozległości krwawienia oraz stanu klinicznego pacjenta.
Ilość podawanych jednostek czynnika VIII wyraża się w jednostkach międzynarodowych (j.m.),
odnoszących się do aktualnego standardu koncentratu WHO dla produktów zawierających
czynnik VIII. Aktywność czynnika VIII w osoczu wyraża się albo w postaci procentowej (w
odniesieniu do normalnego osocza ludzkiego) lub najlepiej w jednostkach międzynarodowych (w
odniesieniu do standardu międzynarodowego czynnika VIII w osoczu).
Jedna jednostka międzynarodowa (j.m.) aktywności czynnika VIII odpowiada ilości czynnika VIII w
jednym mililitrze normalnego osocza ludzkiego.
Leczenie na żądanie
Obliczenie wymaganej dawki czynnika VIII oparto na obserwacji empirycznej, że 1 jednostka
międzynarodowa (j.m.) czynnika VIII na 1 kg masy ciała powoduje wzrost aktywności czynnika VIII w
osoczu od 1 do 2% prawidłowej aktywności. Wymaganą dawkę ustala się w oparciu o następujący
wzór:
Wymagana liczba jednostek = masa ciała (kg) × żądany wzrost czynnika VIII (%) × 0,5
Wymaganą ilość do podania oraz częstotliwość podawania należy zawsze dostosowywać do
skuteczności klinicznej w poszczególnych przypadkach.
W przypadku następujących rodzajów krwawienia aktywność czynnika VIII w odpowiednim okresie
nie powinna obniżyć się poniżej podanego poziomu aktywności w osoczu (w % normy). W celu
ustalenia dawki w zależności od rodzaju krwawienia i zabiegu chirurgicznego można posłużyć się
następującą tabelą:
Stopień krwawienia /
Rodzaj zabiegu chirurgicznego
Wymagany poziom
VIII czynnika krzepnięcia (%)
Częstotliwość dawek (godziny) /
Czas trwania terapii (dni)
Krwawienie
Wczesne krwawienie do stawów,
mięśni lub krwawienie z jamy
ustnej
- 20 - 40 Powtarzać co 12-24 godzin. Co najmniej 1 dzień, aż do ustąpienia bólu spowodowanego przez krwawienie bądź do zagojenia rany. Bardziej nasilone krwawienie do stawów, mięśni lub krwiak
- 30 - 60 Powtarzać co 12-24 godziny przez 3-4 dni lub dłużej do czasu ustąpienia bólu i ostrej niesprawności ruchowej. Krwawienia zagrażające życiu
- 60 - 100 Powtarzać co 8-24 godzin do ustąpienia zagrożenia.
Zabiegi chirurgiczne
Drobny zabieg chirurgiczny
w tym ekstrakcja zębów
- 30 - 60 Co 24 godziny, co najmniej 1 dzień, do czasu wygojenia. Duży zabieg chirurgiczny
- 80 - 100 (przed- i pooperacyjny) Powtarzać co 8-24 godziny do czasu uzyskania odpowiedniego wygojenia rany, a następnie kontynuować przez co najmniej 7 dni, aby utrzymać aktywność czynnika VIII na poziomie 30-60%.
Profilaktyka
W długookresowej profilaktyce krwawień u pacjentów z ciężką postacią hemofilii A zazwyczaj
stosowane dawki czynnika VIII wynoszą 20-40 j.m. na kg masy ciała w odstępach co 2-3 dni. W
niektórych przypadkach, zwłaszcza u młodszych pacjentów, mogą być konieczne krótsze odstępy
między kolejnymi dawkami lub wyższe dawki.
Sposób podawania:
Podanie dożylne. Zalecane jest, aby nie podawać więcej niż 2-3 ml/minutę.
Należy używać wyłącznie dostarczonego zestawu do infuzji, ponieważ adsorpcja czynnika VIII na
wewnętrznych powierzchniach niektórych zestawów infuzyjnych może prowadzić do niepowodzenia
terapii.
Nie wolno mieszać leku Haemoctin z innymi produktami leczniczymi.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterBiotest Pharma GmbH
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Haemoctin 500Postać farmaceutyczna: Proszek, 1000 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 2000 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga receptyPostać farmaceutyczna: Proszek, 250 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga recepty
Odpowiedniki Haemoctin 500 w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Haemoctin 500 – Hiszpania
Odpowiednik Haemoctin 500 – Ukraina
Lekarze online w sprawie Haemoctin 500
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Haemoctin 500 – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














