
Amiodaron Accord

Zapytaj lekarza o receptę na Amiodaron Accord

Jak stosować Amiodaron Accord
Ulotka dołączona do opakowania: informacja dla pacjenta
Amiodaron Accord, 30 mg/ml, koncentrat do sporządzania roztworu do wstrzykiwań/ do infuzji
Amiodaroni hydrochloridum
Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Amiodaron Accord i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Amiodaron Accord
- 3. Jak stosować lek Amiodaron Accord
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Amiodaron Accord
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Amiodaron Accord i w jakim celu się go stosuje
Lek Amiodaron Accord zawiera substancję czynną amiodaronu chlorowodorek, który należy do grupy
leków zwanych lekami przeciwarytmicznymi. Jego działanie polega na kontrolowaniu niemiarowego
bicia serca (zwanego arytmią).
Lek Amiodaron Accord jest stosowany w leczeniu pacjentów dorosłych z:
- poważnymi, objawowymi tachyarytmiami komorowymi;
- objawowymi zaburzeniami rytmu serca wymagającymi leczenia, z szybkim biciem serca pochodzenia przedsionkowego (tachyarytmiami nadkomorowymi), takimi jaki:
- częstoskurcz węzłowy przedsionkowo-komorowy,
- tachykardia nadkomorowa w zespole Wolffa-Parkinsona-White'a, kiedy serce bije niezwykle szybko, lub
- napadowe migotanie przedsionków (szybkie lub nierówne bicie serca).
Wskazanie to dotyczy pacjentów, którzy nie reagują na leczenie innymi lekami przeciwarytmicznymi
lub u których inne leki przeciwarytmiczne nie są wskazane.
Amiodaron Accord stosowany jest, gdy konieczne jest uzyskanie szybkiego działania leku lub jeśli
podanie doustne jest niemożliwe. Ten lek zostanie podany przez lekarza, a stan pacjenta będzie
kontrolowany w szpitalu lub pod nadzorem specjalisty.
2. Informacje ważne przed zastosowaniem leku Amiodaron Accord
Kiedy nie stosować leku Amiodaron Accord:
- jeśli pacjent ma uczulenie na amiodaron chlorowodorek, jod lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6);
- jeśli u pacjenta występują problemy z sercem, które mogą powodować spowolnienie rytmu serca (takie jak blok zatokowo-przedsionkowy lub bradykardia zatokowa);
- jeśli u pacjenta występują różne postaci zaburzeń przewodzenia (blok przedsionkowo-
komorowy dużego stopnia, blok dwu- lub trójwiązkowy lub choroba węzła zatokowego)
i pacjent nie ma wszczepionego rozrusznika serca;
- jeśli u pacjenta występuje niewydolność serca lub osłabienie mięśnia sercowego (kardiomiopatia);
- jeśli pacjent ma problemy z tarczycą lub miał problemy z tarczycą w przeszłości;
- jeśli pacjent ma ciężką niewydolność układu oddechowego, zapaść krążeniową lub ciężkie niedociśnienie tętnicze (bardzo niskie ciśnienie krwi);
- jeśli pacjent ma wcześniej istniejące wydłużenie odstępu QT (specjalna zmiana w EKG);
- jeśli pacjent ma małe stężenie potasu we krwi (hipokaliemia);
- jeśli u pacjenta w przeszłości występował obrzęk naczynioruchowy (pewna postać obrzęku skóry i błon śluzowych);
- jeśli pacjent przyjmuje jednocześnie inhibitory MAO (niektóre leki przeciwdepresyjne);
- jeśli pacjent przyjmuje inne leki, które mogą wywołać szczególną postać szybkiego bicia serca (typu torsade de pointes);
- jeśli pacjentka jest w ciąży, przypuszcza, że może być w ciąży lub karmi piersią (chyba, że lekarz uzna leczenie za bezwzględnie koniecznie).
Wszystkie powyższe przeciwwskazania nie mają zastosowania, jeśli amiodaron jest stosowany
w resuscytacji krążeniowo-oddechowej (jeśli u pacjenta doszło do zatrzymania krążenia i oddechu)
z powodu migotania komór odpornego na defibrylację.
Leku Amiodaron Accord nie wolno podawać wcześniakom, noworodkom ani dzieciom w wieku do
3 lat.
Nie stosować tego leku, jeśli którekolwiek z powyższych dotyczy pacjenta; należy porozmawiać z lekarzem lub pielęgniarką.
Ostrzeżenia i środki ostrożności
Amioradon Accord można podawać wyłącznie na oddziale intensywnej opieki i pod stałym nadzorem
(monitorowanie zapisu EKG i ciśnienia tętniczego).
Przed rozpoczęciem stosowania Amiodaron Accord należy omówić to z lekarzem, farmaceutą lub
pielęgniarką, jeżeli:
- pacjent ma łagodne do umiarkowanego niedociśnienie krwi,
- pacjent ma słabe serce lub niewydolność serca,
- pacjent ma problemy dotyczące tarczycy,
- pacjent ma problemy dotyczące wątroby,
- pacjent otrzymuje tlenoterapię w dużych dawkach lub ma inne problemy dotyczące płuc, w tym astmę,
- pacjent ma mieć operację ze znieczuleniem ogólnym,
- pacjent jest w podeszłym wieku,
- pacjent przyjmuje lek o nazwie sofosbuwir, stosowany w leczeniu wirusowego zapalenia wątroby typu C.
W przypadku zaburzeń rytmu serca (arytmii komorowych) rozpoczęcie podawania amiodaronu
wymaga bardzo dokładnego monitorowania pracy serca i może być przeprowadzone tylko wtedy, gdy
dostępny jest sprzęt z możliwością monitorowania kardiologicznego.
W trakcie długotrwałego leczenia (np. po przejściu na leczenie doustne) powinno się przeprowadzać
kontrole kardiologiczne w regularnych odstępach czasu.
Podczas leczenia amiodaronem może wystąpić spowolnienie rytmu serca (bradykardia). Zmniejszona
częstość rytmu serca może być bardziej wyraźna u pacjentów w wieku powyżej 65 lat. Leczenie
należy przerwać w przypadku ciężkiej bradykardii lub bloku serca.
Zdarzają się przypadki wystąpienia nowych arytmi lub nasilenia arytmii leczonych. Występują one
zwykle w wyniku połączenia z innymi lekami lub zaburzeń elektrolitowych (takich jak na przykład
zmiany stężenia potasu we krwi). W takich przypadkach należy rozwarzyć zaprzestanie leczenia tym
lekiem.
Należy zachować szczególną ostrożność w przypadku niedociśnienia, ciężkiej niewydolności
oddechowej, ciężkiej niewydolności serca lub niewyrównanej kardiomiopatii.
Jeśli pacjent przyjmuje obecnie lek zawierający sofosbuwir stosowany w leczeniu zapalenia wątroby
typu C powinien omówić to z lekarzem lub farmaceutą przed rozpoczęciem stosowania leku
Amiodaron Accord, ponieważ może to spowodować zagrażające życiu spowolnienie serca. Lekarz
prowadzący może rozważyć alternatywne metody leczenia. Jeśli konieczne jest leczenie amiodaronem
i sofosbuwirem, może być konieczne dodatkowe monitorowanie pracy serca.
Należy natychmiast poinformować lekarza, jeśli pacjent przyjmuje lek zawierający sofosbuwir
w leczeniu wirusowego zapalenia wątroby typu C i w trakcie leczenia występują:
- wolne lub nieregularne bicie serca lub zaburzenia rytmu serca;
- duszność lub nasilenie istniejącej duszności;
- ból w klatce piersiowej;
- zawroty głowy;
- kołatanie serca;
- prawie omdlenia lub omdlenia.
Podczas leczenia amiodaronem istnieje ryzyko wystąpienia ciężkich przypadków zapalnia płuc. Z tego
powodu, jeśli to możliwe, przed rozpoczęciem leczenia należy wykonać badanie rentgenowskie płuc
(klatki piersiowej) i badanie czynności płuc.
Niedawno zgłaszano przypadki toksycznego działania na wątrobę po podaniu dożylnym, które mogą
być spowodowane raczej przez rozpuszczalnik (polisorbat 80) niż przez sam lek.
Zarówno podczas podawania doustnego, jak i dożylnego mogą wystąpić zaburzenia czynności
wątroby (w przypadku podania dożylnego już w ciągu pierwszych 24 godzin). Dlatego dawkowanie
amiodaronu należy zmniejszyć lub przerwać leczenie, jeśli wzrost aktywności aminotransferaz
(związany z czynnością wątroby) przekroczy trzykrotność wartości referencyjnych.
Podczas leczenia lekarz może zdecydować o konieczności wykonania badań: prześwietlenia
rentgenowskiego klatki piersiowej (w celu wykluczenia powikłań ze strony układu oddechowego)
i badań krwi w celu oznaczenia aktywności aminotransferaz (przed rozpoczęciem leczenia i regularnie
w trakcie leczenia, aby sprawdzić, czy wątroba działa prawidłowo) oraz stężenie potasu we krwi.
Należy powiedzieć lekarzowi, jeśli wystąpią zaburzenia widzenia: niewyraźne widzenie, pogorszenie
widzenia, widzenie z kolorowymi aureolami, uczucie zamglonego widzenia. W przypadku
wystąpienia któregokolwiek z tych problemów, pacjent powinien mieć przeprowadzone pełne badanie
wzroku.
Znieczulenie ogólne
Zaleca się zachowanie ostrożności u pacjentów poddawanych znieczuleniu ogólnemu lub
otrzymujących tlenoterapię w dużych dawkach.
Potencjalnie ciężkie powikłania obserwowano po połączeniu ze znieczuleniem ogólnym. Przed
operacją należy poinformować anestezjologa, że pacjentowi podawany jest amiodaron.
Podczas leczenia mogą wystąpić zaburzenia skórne (ciężkie reakcje pęcherzowe), takie jak zespół
Stevensa-Johnsona lub toksyczne martwicze oddzielanie się naskórka, które mogą być bardzo
poważne lub nawet zagrażające życiu (patrz punkt 4.). Jeśli pojawią się przedmiotowe lub
podmiotowe objawy zespołu Stevensa-Johnsona lub toksycznego martwiczego oddzielania się
naskórka (postępująca wysypka skórna, często z pęcherzami lub owrzodzeniami na błonach
śluzowych), należy natychmiast przerwać leczenie amiodaronem.
Jeśli stężenie potasu jest niskie, należy je wyrównać przed rozpoczęciem leczenia amiodaronem.
Amiodaron zawiera jod i może zaburzać wychwyt jodu radioaktywnego. Nie wpływa to jednak na
interpretację wyników badań czynności tarczycy (wolne T , wolne T i TSH).
Tarczyca
Ze względu na ryzyko wystąpienia nadczynności lub niedoczynności tarczycy podczas leczenia
amiodaronem, przed rozpoczęciem leczenia należy wykonać badania czynności tarczycy.
Badania te należy regularnie powtarzać w trakcie leczenia i do około roku po zakończeniu leczenia,
a pacjentów badać pod kątem objawów nadczynności lub niedoczynności tarczycy.
Następujące objawy mogą wskazywać na dysfunkcję tarczycy:
Niedoczynność tarczycy:
Przyrost masy ciała, nadwrażliwość na zimno, zmęczenie, skrajne spowolnienie bicia serca
(bradykardia) wykraczające poza objawy, których można się spodziewać po zastosowaniu leku
Amiodaron Accord.
Nadczynność tarczycy:
Utrata masy ciała, szybkie bicie serca (tachykardia), drżenie mięśni, nerwowość, zwiększone pocenie
się i nietolerancja ciepła, nawrót arytmii lub dusznicy bolesnej, niewydolność serca.
Choroby nerwowo-mięśniowe
Amiodaron może powodować uszkodzenie nerwów obwodowych i (lub) mięśni (neuropatie
obwodowe i (lub) miopatie). Zwykle objawy te ustępują po kilku miesiącach od zaprzestania leczenia.
Jednak w pojedynczych przypadkach mogą nie być całkowicie odwracalne.
Należy chronić skórę przed słońcem
Należy unikać bezpośredniego kontaktu ze światłem słonecznym podczas stosowania tego leku i przez
kilka miesięcy po zakończeniu stosowania. Dotyczy to również promieniowania UV i solariów.
Wynika to z tego, że skóra będzie bardziej wrażliwa na słońce i niezastosowanie następujących
środków ostrożności może spowodować pieczenie, mrowienie lub silne pęcherze:
- należy się upewnić, że używany jest krem z filtrem o wysokim współczynniku ochrony przeciwsłonecznej,
- należy zawsze nosić czapkę i ubranie zakrywające ręce i nogi.
Pierwotna dysfunkcja przeszczepu (PGD, ang. Primary Graft Dysfunction) po przeszczepie serca
Jeśli pacjent jest na liście oczekujących na przeszczep serca i przyjmuje amiodaron, ma zwiększone
ryzyko powikłań zagrażających życiu (pierwotna dysfunkcja przeszczepu), dlatego lekarz może
zmienić leczenie przed przeszczepem. W przypadku wystąpienia tego powikłania, przeszczepione
serce przestaje działać prawidłowo w krótkim czasie po operacji przeszczepu serca, a w ciężkich
przypadkach może być to nieodwracalne.
Dzieci i młodzież
Nie ustalono bezpieczeństwa stosowania i skuteczności amiodaronu u dzieci, dlatego nie zaleca się
stosowania amiodaronu u tych pacjentów.
Lek Amiodaron Accord a inne leki
Ten lek może zmienić reakcję na działanie innych leków; w związku z tym należy poinformować
lekarza o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, w tym o lekach
dostępnych bez recepty. Lekarz zdecyduje, które leki należy odstawić lub czy zmienić sposób
dawkowania.
Ze względu na długi okres półtrwania amiodaronu interakcje z innymi lekami mogą również wystąpić
kilka miesięcy po zakończeniu leczenia amiodaronem.
Leki, które mogą wywoływać poważne zaburzenia rytmu serca typu torsades de pointes.
Leczenie w połączeniu z następującymi lekami wywołującymi zaburzenia rytmu serca typu torsades
de pointesjest przeciwwskazane:
- leki stosowane w celu kontrolowania nierównego rytmu serca, takie jak chinidyna, prokainamid, dyzopiramid, sotalol i bretylium;
- leki inne niż przeciwarytmiczne, takie jak winkamina (stosowana w celu zwiększenia ilości tlenu w mózgu);
- leki stosowane w zakażeniach (takie jak erytromycyna podawana we wstrzyknięciu dożylnym, kotrimoksazol, moksyfloksacyna lub pentamidyna);
- niektóre leki przeciwpsychotyczne (leki o działaniu uspokajającym i zmniejszające niepokój), takie jak chloropromazyna, lewomepromazyna, tiorydazyna, fluoperazyna, sulpiryd, tiapryd, pimozyd haloperydol, amisulpryd i sertindol;
- leki na inne choroby psychiczne (lit, leki przeciwdepresyjne, takie jak doksepina, maprotylina, amitryptylina);
- leki stosowane w przypadku kataru siennego, wysypki lub innych alergii nazywane lekami przeciwhistaminowymi, np. terfenadyna, astemizol, mizolastyna;
- leki przeciw malarii, takie jak chinina, meflochina, chlorochina, halofantryna;
- inhibitory MAO (niektóre leki przeciwdepresyjne).
Podawanie amiodaronu razem z lekami wydłużającymi odstęp QT (wydłużającymi bicie serca)
powinno opierać się na dokładnej ocenie ryzyka i korzyści dla każdego pacjenta, ponieważ ryzyko
wystąpienia poważnych zaburzeń rytmu serca typu torsades de pointesmoże być zwiększone. Należy
monitorować wydłużenie odstępu QT (badanie EKG).
Fluorochinolony: podczas leczenia amiodaronem należy również unikać stosowania określonego
rodzaju antybiotyków (fluorochinolonów).
Leki zmniejszające częstość rytmu serca lub powodujące zaburzenia automatyzmu lub przewodzenia:
nie zaleca się leczenia w połączeniu z beta-adrenolitykami i antagonistami kanału wapniowego
zmniejszającymi częstość rytmu serca (diltiazem i werapamil).
Nie zaleca się również leczenia w połączeniu z następującymi lekami:
Leki, które mogą wywoływać hipokaliemię:
- Drażniące środki przeczyszczające, które mogą powodować obniżenie stężenia potasu we krwi, a tym samym zwiększać ryzyko wystąpienia zaburzeń rytmu serca typu torsades de pointes. Należy stosować inne rodzaje środków przeczyszczających.
- Należy zachować szczególną ostrożność, gdy amiodaron stosowany jest jednocześnie z lekami moczopędnymi, które pojedynczo lub w połączeniu zmniejszają stężenie potasu we krwi, kortykosteroidami stosowanymi ogólnoustrojowo, tetrakozaktydem (stosowanym w diagnostyce problemów z nadnerczami i leczeniu wrzodziejącego zapalenia jelita grubego), amfoterycyną B podawaną dożylnie (antybiotyk).
Należy zachować szczególną ostrożność podczas łączenia amiodaronu z następującymi lekami. Może
być konieczne dostosowanie dawki innych leków przez lekarza:
- doustne leki rozrzedzające krew (przeciwzakrzepowe), np. warfaryna lub fenprokumon; amiodaron może nasilać działanie tych leków, co zwiększa ryzyko krwawienia,
- glikozyd naparstnicy, jak digoksyna (stosowana w leczeniu niewydolności serca),
- dabigatran (stosowany w zapobieganiu zakrzepom krwi),
- fenytoina (stosowana w padaczce),
- flekainid (stosowany w leczeniu zaburzeń rytmu serca),
- leki metabolizowane przez określony układ enzymatyczny (cytochrom P450 3A4)
- cyklosporyna (lek zapobiegający odrzuceniu przeszczepu)
- fentanyl (silny środek przeciwbólowy)
- niektóre leki obniżające stężenie cholesterolu (niektóre statyny, np. symwastatyna, atorwastatyna, lowastatyna)
- inne tego typu leki, np. takrolimus i syrolimus (zapobiegający odrzuceniu przeszczepu), lidokaina (środek miejscowo znieczulający), syldenafil (stosowany w leczeniu zaburzeń erekcji), midazolam i triazolam (tabletki nasenne), antybiotyki makrolidowe (klarytromycyna), ergotamina, dihydroergotamina (stosowana w migrenie) i kolchicyna (w leczeniu dny). Obserwowano potencjalnie ciężkie powikłania (zespół ostrej niewydolności oddechowej) występujące po jednoczesnym podaniu znieczulenia ogólnego.
Nie zaleca się jednoczesnego stosowania amiodaronu i schematu z sofosbuwirem, ponieważ może to
prowadzić do ciężkiej objawowej bradykardii (zagrażające życiu spowolnienie rytmu serca). Jeśli nie
można uniknąć jednoczesnego podawania, zaleca się monitorowanie pracy serca.
Amiodaron Accord z jedzeniem, piciem i alkoholem
Podczas stosowania tego leku nie należy pić soku grejpfrutowego, ponieważ może on zwiększyć
stężenie amiodaronu we krwi.
Ciąża, karmienie piersią i wpływ na płodność
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
- Lekarz przepisze Amiodaron Accord tylko w wyjątkowych przypadkach, gdy spodziewane korzyści z leczenia przewyższają potencjalne ryzyko podczas ciąży. Amiodaron można stosować w ciąży tylko w sytuacjach zagrażających życiu.
- Pacjentka nie powinna zachodzić w ciążę przez co najmniej sześć miesięcy po zakończeniu leczenia aby uniknąć narażenia dziecka na amiodaron podczas wczesnego okresu ciąży.
- Pacjentka nie powinna otrzymywać amiodaronu w okresie karmienia piersią. Jeśli pacjentka otrzymuje amiodaron w okresie karmienia piersią, należy przerwać karmienie piersią, ponieważ amiodaron przenika w znacznej ilości do mleka matki i może osiągnąć skuteczne stężenie u niemowląt.
- Po długotrwałym leczeniu mogą pojawić się zaburzenia czynności jąder.
Prowadzenie pojazdów i obsługiwanie maszyn
Amiodaronu chlorowodorek może wpływać na zdolność prowadzenia pojazdów i obsługiwania
maszyn. Leczenie tym lekiem wymaga regularnej kontroli lekarskiej. Ten lek, nawet stosowany
zgodnie z przeznaczeniem, może zmieniać czas reakcji do takiego stopnia, że może zaburzać zdolność
aktywnego uczestnictwa w ruchu drogowym, obsługi maszyn lub bezpiecznej pracy. Może to
wystąpić w szczególności przy rozpoczynaniu leczenia, zwiększaniu dawki, zmianie leku, a także
w połączeniu z alkoholem.
Amiodaron Accord zawiera alkohol benzylowy
Ten lek zawiera 200 mg alkoholu benzylowego w każdej 10 ml ampułko-strzykawce, co odpowiada
20 mg/ml. Alkohol benzylowy może powodować reakcje alergiczne. Pacjenci z zaburzeniami
czynności wątroby lub nerek oraz kobiety w ciąży lub karmiące piersią powinny zwrócić się do
lekarza lub farmaceuty, ponieważ duże ilości alkoholu benzylowego mogą gromadzić się w
organizmie i powodować działania niepożądane (zwane „kwasicą metaboliczną”). Alkohol benzylowy
jest powiązany z ryzykiem wystąpienia ciężkich działań niepożądanych, w tym problemów z
oddychaniem (zwanych „gasping syndrome”) u małych dzieci.
3. Jak stosować lek Amiodaron Accord
Lek musi być rozcieńczonyprzed podaniem.
Leczenie zostanie rozpoczęte wyłącznie pod nadzorem lekarza specjalisty. W przypadku wątpliwości
należy ponownie skonsultować się z lekarzem.
Bezpośrednie wstrzyknięcie dożylne w bolusie generalnie nie jest zalecane ze względu na ryzyko
ciężkiego niedociśnienia, zapaści sercowo-naczyniowej; dlatego, jeśli to możliwe, preferowane jest
podanie w infuzji dożylnej. Bezpośrednie wstrzyknięcie dożylne powinno być ograniczone do sytuacji
nagłych.
Lekarze lub pracownicy służby zdrowia muszą zapoznać się z „informacjami dla fachowego perso-
nelu medycznego” na końcu tej ulotki.
Dzieci i młodzież
Nie ustalono bezpieczeństwa stosowania i skuteczności amiodaronu u dzieci, dlatego nie zaleca się
stosowania amiodaronu u dzieci.
Ze względu na zawartość alkoholu benzylowego, ten lek nie jest przeznaczony do stosowania
u wcześniaków, noworodków, niemowląt i dzieci do 3 lat.
Pacjenci w podeszłym wieku
Tak jak w przypadku wszystkich pacjentów, ważne jest, aby stosować minimalną skuteczną dawkę.
Amiodaron może spowolnić bicie serca, co może być bardziej widoczne u pacjentów w podeszłym
wieku. Lekarz dokładnie obliczy, jaką dawkę amiodaronu pacjent powinien otrzymać i będzie
dokładniej monitorował tętno i czynność tarczycy.
Zastosowanie większej niż zalecana dawki leku Amiodaron Accord
Lekarz dokładnie obliczy, jaką dawkę leku Amiodaron Accord pacjent powinien otrzymać. Dlatego
jest mało prawdopodobne, aby lekarz, pielęgniarka lub farmaceuta podali pacjentowi zbyt dużą dawkę
tego leku. Jeśli jednak pacjent uważa, że otrzymał zbyt dużą lub zbyt małą dawkę leku Amiodaron
Accord, należy powiedzieć o tym lekarzowi, pielęgniarce lub farmaceucie.
Mogą wystąpić następujące objawy: zawroty głowy, omdlenie, wymioty, zmęczenie lub splątanie.
Nieprawidłowo wolne lub szybkie bicie serca. Zbyt duża dawka amiodaronu może uszkodzić serce
i wątrobę.
Pominięcie zastosowania leku Amiodaron Accord
Lekarz lub pielęgniarka otrzymają instrukcje dotyczące podawania tego leku. Jest mało
prawdopodobne, aby pacjent nie otrzymał przepisanego leku. Jeśli jednak pacjent podejrzewa, że
dawka leku została pominięta, powinien poinformować o tym lekarza lub pielęgniarkę.
Przerwanie stosowania leku Amiodaron Accord
Ważne jest, aby stosować lek Amiodaron Accord do czasu, gdy lekarz zdecyduje o jego odstawieniu.
W przypadku zaprzestania stosowania tego leku może powrócić nierówne bicie serca. Może być to
niebezpieczne.
W przypadku dalszych pytań dotyczących stosowania tego leku należy zwrócić się do lekarza lub
pielęgniarki.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Następujące niezwykle rzadkie działanie niepożądane może w pewnych warunkach poważnie
zagrażać życiu. Dlatego, należy natychmiast poinformować lekarza, jeśli takie zdarzenie wystąpi nagle
lub rozwinie się z nieoczekiwaną intensywnością:
Ciężka ostra reakcja nadwrażliwości (np. anafilaksja): w takim przypadku należy natychmiast
przerwać leczenie lekiem Amiodaron Accord i zastosować odpowiednie leczenie doraźne.
Działania niepożądane wynikające ze stosowania amiodaronu występują często, szczególnie dotyczą
serca, płuc i wątroby. Czasami objawy te są zależne od dawki i ustępują po jej zmniejszeniu.
Inne działania niepożądane
Obserwowane działania niepożądane przedstawiono zgodnie z częstością ich występowania: bardzo
często (mogą wystąpić u więcej niż 1 na 10 osób); często (mogą wystąpić u nie więcej niż 1 na 10
osób); niezbyt często (mogą wystąpić u nie więcej niż 1 na 100 osób); rzadko (mogą wystąpić u nie
więcej niż 1 na 1000 osób); bardzo rzadko (mogą wystąpić u nie więcej niż 1 na 10000 osób); częstość
nieznana (nie może być określona na podstawie dostępnych danych).
Zaburzenia krwi i układu chłonnego
- Bardzo rzadko:zmniejszenie liczby płytek krwi (trombocytopenia), niedokrwistość z powodu zwiększonego rozpadu czerwonych krwinek lub w wyniku zaburzeń tworzenia krwi.
- Częstość nieznana:może wystąpić większa niż zwykle liczba zakażeń. Może to być spowodowane zmniejszeniem liczby białych krwinek (neutropenia). Znaczne zmniejszenie liczby białych krwinek, co zwiększa prawdopodobieństwo wystąpienia zakażeń (agranulocytoza).
Zaburzenia serca
- Często:umiarkowanie wolne bicie serca (bradykardia), które zmienia się w zależności od podanej dawki.
- Niezbyt często:zaburzenia przewodzenia (blok zatokowo-przedsionkowy: blok serca z zaburzeniem przewodzenia z węzła zatokowego do przedsionka; blok przedsionkowo- komorowy: zaburzone przewodzenie między przedsionkami a komorami). W pojedynczych przypadkach obserwowano zatrzymanie akcji serca (asystolię) (patrz punkt 2 „Ostrzeżenia i środki ostrożności”). Początek lub nasilenie arytmii (zmiany rytmu serca), po której czasami następuje zatrzymanie akcji serca.
- Bardzo rzadko:znacznie spowolniona akcja serca (bradykardia) lub zatrzymanie czynności węzła zatokowego, głównie u pacjentów z dysfunkcją zatok i (lub) w wieku powyżej 65 lat.
- Częstość nieznana:zaburzenia rytmu typu torsades de pointes(szczególny rodzaj zaburzenia rytmu); opisano pojedyncze przypadki migotania lub trzepotania komór.
Zaburzenia endokrynologiczne
- Często:tarczyca produkuje więcej hormonu tarczycy niż organizm potrzebuje (nadczynność tarczycy) lub niewystarczająca ilość hormonu tarczycy (niedoczynność tarczycy). Zgłaszano ciężką nadczynność tarczycy (w pojedynczych przypadkach zakończoną zgonem).
- Bardzo rzadko:złe samopoczucie, splątanie lub osłabienie, nudności (uczucie potrzeby wymiotów), utrata apetytu, drażliwość. Może być to choroba znana jako „zespół nieprawidłowego wydzielania hormonu antydiuretycznego (SIADH)”.
Zaburzenia oka
- Bardzo często:mikrozłogi na przedniej powierzchni rogówki oka, które zwykle są ograniczone do obszaru poniżej źrenicy i mogą powodować zaburzenia widzenia (niewyraźne widzenie, widzenie kolorowych aureoli wokół źródła światła). Zwykle ustępują 6-12 miesięcy po
odstawieniu leku.
- Bardzo rzadko:zapalenie nerwu wzrokowego, które może prowadzić do ślepoty (patrz punkt 2 „Ostrzeżenia i środki ostrożności”).
Zaburzenia żołądkowo-jelitowe
- Bardzo często:nudności, wymioty, zaburzenia smaku na początku leczenia (podczas podawania dawki nasycającej), które ustępują po zmniejszeniu dawki.
- Niezbyt często:ból brzucha, wzdęcia, zaparcia, utrata apetytu.
- Częstość nieznana:nagłe zapalenie trzustki (ostre zapalenie trzustki).
Zaburzenia ogólne i stany w miejscu podania
- Często:w miejscu wstrzyknięcia może wystąpić ból, czerwone plamy (rumień), obrzęk skóry z powodu nagromadzenia płynu, zaczernienie (martwica), wyciek płynu (wynaczynienie), nagromadzenie płynu (naciek), stan zapalny, stwardnienie, zapalenie żył (zapalenie żył, zakrzepowe zapalenie żył), zapalenie tkanki łącznej, zakażenie, zmiany pigmentacji.
- Niezbyt często:zmęczenie
Zaburzenia wątroby i dróg żółciowych
- Bardzo często:izolowane i często umiarkowane zwiększenie aktywności aminotransferaz (związane z czynnością wątroby) na początku leczenia. Może powrócić do wartości prawidłowych po zmniejszeniu dawki leku lub nawet samoistnie.
- Często:ostre zaburzenia czynności wątroby z wysoką aktywnością aminotransferaz w surowicy i (lub) zażółceniem skóry (żółtaczka), w tym niewydolność wątroby, która może zagrażać życiu.
- Bardzo rzadko:przewlekła choroba wątroby (w pojedynczych przypadkach zakończona zgonem), marskość wątroby.
Zaburzenia układu immunologicznego
- Bardzo rzadko:ciężka reakcja alergiczna, która może zagrażać życiu (wstrząs anafilaktyczny).
- Częstość nieznana:obrzęk może również wystąpić z powodu gromadzenia się płynu pod skórą i błonami śluzowymi (obrzęk Quinckego).
Zaburzenia układu mięśniowo-szkieletowego
- Często:osłabienie mięśni.
- Częstość nieznana:ból pleców.
Zaburzenia nerek i dróg moczowych
- Rzadko:przejściowe zaburzenia czynności nerek.
Zaburzenia układu nerwowego
- Często:drżenie mięśni (drżenie pochodzenia pozapiramidowego), koszmary senne, zaburzenia snu.
- Niezbyt często:uszkodzenie nerwów obwodowych lub mięśni (obwodowe neuropatie czuciowe i (lub) miopatie), zwykle odwracalne po odstawieniu leku (patrz „Ostrzeżenia i środki ostrożności”), zawroty głowy, problemy z koordynacją, zaburzenia czucia (parestezje).
- Bardzo rzadko:łagodny wzrost ciśnienia wewnątrzczaszkowego, ataksja (niezborność) móżdzkowa, ból głowy.
Zaburzenia psychiczne
- Często:z mniejszenie popędu seksualnego .
- Częstość nieznana:stan splątania (majaczenie), widzenie, słyszenie lub odczuwanie rzeczy, których nie ma (omamy).
Zaburzenia układu rozrodczego
- Bardzo rzadko:zapalenie najądrza, zaburzenia erekcji.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
- Często:ze względu na toksyczne działanie amiodaronu na płuca, mogą wystąpić zapalenie płuc (atypowe zapalenie płuc jako wyraz reakcji nadwrażliwości [zapalenie płuc z nadwrażliwości], pęcherzykowe lub śródmiąższowe zapalenie płuc), proliferacja tkanki łącznej (zwłóknienie), zapalenie opłucnej lub zapalenie oskrzelików (zarostowe zapalenie oskrzelików z organizującym się zapaleniem płuc) (patrz punkt 2 „Ostrzeżenia i środki ostrożności”). Zgłaszano pojedyncze przypadki zakończone zgonem. Nieproduktywny kaszel i duszność są często pierwszymi oznakami wspomnianej toksyczności płucnej. Ponadto może wystąpić utrata masy ciała, gorączka i osłabienie.
- Bardzo rzadko:przeważnie bezpośrednio po zabiegu chirurgicznym obserwowano poważne powikłania oddechowe (zespół ostrej niewydolności oddechowej dorosłych), czasem kończące się zgonem (możliwa interakcja z tlenem o dużym stężeniu). Skurcz oskrzeli i (lub) duszność (bezdech) w przypadkach ciężkiej niewydolności oddechowej, głównie u pacjentów z astmą. Na ogół ustępują po zakończeniu leczenia.
Zaburzenia skóry i tkanki podskórnej
- Bardzo często:zwiększona wrażliwość na światło (fotouczulenie) ze zwiększoną skłonnością do oparzeń słonecznych, co może prowadzić do zaczerwienienia skóry i wysypki.
- Często:swędząca czerwona wysypka (wyprysk). Długotrwałe leczenie amiodaronem (po przejściu na terapię doustną) może powodować przebarwienia skóry o barwie czarnofioletowej do stalowoszarej (sinica rzekoma), szczególnie w miejscach narażonych na działanie promieni słonecznych. Przebarwienia będą powoli znikały w ciągu 1-4 lat od odstawienia leku.
- Bardzo rzadko:pocenie się, zaczerwienienie skóry po radioterapii, zapalenie komórek tłuszczowych pod skórą (rumień guzowaty), wysypki, zapalne zaczerwienienie i łuszczenie się skóry (złuszczające zapalenie skóry), przemijająca utrata włosów.
- Częstość nieznana:pokrzywka, podrażnienie i swędzenie skóry. Zagrażające życiu reakcje skórne charakteryzujące się wysypką, pęcherzami, złuszczaniem i bólem (toksyczne martwicze oddzielanie się naskórka (TEN) / zespół Stevensa-Johnsona (SJS), pęcherzowe zapalenie skóry, wysypka polekowa z eozynofilią i objawami uogólnionymi (DRESS).
Zaburzenia naczyniowe
- Często:obniżone ciśnienie krwi (niedociśnienie), zwykle umiarkowane i przemijające. W przypadku przedawkowania lub zbyt szybkiego wstrzyknięcia może wystąpić ciężkie niedociśnienie lub zapaść.
- Rzadko: zapalenie naczyń krwionośnych.
- Bardzo rzadko:uderzenia gorąca.
Urazy, zatrucia i powikłania po operacji
- Częstość nieznana:zagrażające życiu powikłanie po przeszczepie serca (pierwotna dysfunkcja przeszczepu), w którym przeszczepione serce przestaje działać prawidłowo (patrz punkt 2 „Ostrzeżenia i środki ostrożności”).
Badania diagnostyczne
- Bardzo rzadko:zwiększone stężenie kreatyniny we krwi.
Inne możliwe działania niepożądane
Rzadko mogą wystąpić reakcje nadwrażliwości na alkohol benzylowy.
Jeżeli wystąpią jakiekolwiek objawy niepożądane, należy powiedzieć o tym lekarzowi, farmaceucie
lub pielęgniarce. Dotyczy to również wszelkich możliwych objawów niepożądanych
niewymienionych w tej ulotce.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu
działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa
stosowania leku.
5. Jak przechowywać lek Amiodaron Accord
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku i ampułko-
strzykawce po EXP. Termin ważności oznacza ostatni dzień podanego miesiąca.
Nie przechowywać w temperaturze powyżej 25°C. Przechowywać ampułko-strzykawkę w
opakowaniu zewnętrznym w celu ochrony przed światłem.
Po rozcieńczeniu wykazano chemiczną i fizyczną stabilność roztworu przez 3 godziny, 48 godzin
i 15 minut w stężeniu odpowiednio 1,2 mg/ml, 2,4 mg/ml i 15 mg/ml w temperaturze 20-25°C.
Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast. Jeśli nie zostanie zużyty
natychmiast, za czas i warunki przechowywania przed użyciem odpowiada użytkownik.
Nie stosować tego leki w przypadku uszkodzenia pojemnika lub jeśli widoczne są cząstki/kryształki.
Tylko do jednorazowego użytku. Wszelkie niewykorzystane resztki leku należy usunąć.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Amiodaron Accord
- Substancją czynną jest amiodaronu chlorowodorku. Każdy ml roztworu zawiera 30 mg amiodaronu chlorowodorku. Każda ampułko-strzykawka o pojemności 10 ml zawiera 300 mg amiodaronu chlorowodorku.
- Pozostałe składniki to alkohol benzylowy, polisorbat 80 i woda do wstrzykiwań.
Jak wygląda lek Amiodaron Accord i co zawiera opakowanie
Amiodaron Accord to przejrzysty, bezbarwny do jasnożółtego roztwór umieszczony w bezbarwnej
ampułko-strzykawce.
Amiodaron Accord jest dostępny w opakowaniu zawierającym 1 ampułko-strzykawkę.
Podmiot odpowiedzialny
Accord Healthcare Polska Sp. z o.o.
ul. Taśmowa 7
02-677 Warszawa
tel: +48 22 577 28 00
Wytwórca/Importer
Accord Healthcare Polska Sp. z o.o.
ul. Lutomierska 50
95-200 Pabianice
Pharmadox Healthcare Limited
KW20A Kordin Industrial Park
Paola, PLA 3000
Malta
Laboratori Fundació Dau
C/ C, 12-14 Pol. Ind.
Zona Franca
08040 Barcelona
Hiszpania
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
| Nazwa kraju członkowskiego | Nazwa produktu leczniczego |
| Austria | Amiodarone Accord 30 mg/ml Konzentrat zur Herstellung einer Injektions- /Infusionslösung |
| Czechy | Amiodarone Accord |
| Dania | Amiodarone Accord |
| Finlandia | Amiodarone Accord |
| Hiszpania | Amiodarona Accord 30 mg/ml concentrado para solución inyectable y para perfusión |
| Irlandia | Amiodarone hydrochloride 30 mg/ml concentrate for solution for injection/infusion |
| Niemcy | Amiodaron Accord 30 mg/ml Konzentrat zur Herstellung einer Injektions- /Infusionslösung |
| Norwegia | Amiodarone Accord |
| Polska | Amiodaron Accord |
| Portugalia | Amiodarona Accord |
| Rumunia | Amiodaronă Accord 30 mg/ml concentrat pentru soluție injectabilă / perfuzabilă |
| Szwecja | Amiodarone Accord |
| Włochy | Amiodarone Accord |
Data ostatniej aktualizacji ulotki:
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego
Dawkowanie
W przypadku napadu lub leczenia początkowegomożliwe jest podanie leku we wstrzyknięciu
dożylnym lub infuzji dożylnej. Na ogół nie zaleca się wstrzyknięcia dożylnego. Jeśli to możliwe,
zalecana jest infuzja dożylna.
Infuzja dożylna
Dawka początkowa lub w przypadku napadu
Zazwyczaj zalecana dawka to 5 mg/kg masy ciała, podawana w infuzji dożylnej, trwającej od 20
minut do 2 godzin. Lek należy podawać w postaci roztworu rozcieńczonego w 250 ml 5% roztworu
dekstrozy 5%.
Działanie terapeutyczne pojawia się w ciągu kilku pierwszych minut i następnie stopniowo słabnie,
dlatego w celu jego przedłużenia należy kontynuować podawanie leku w infuzji podtrzymującej.
Dawka podtrzymująca
Do 1200 mg (10-20 mg/kg masy ciała) w infuzji w 250-500 ml dekstrozy 5% na dobę; szybkość
infuzji należy dostosować na podstawie odpowiedzi klinicznej.
Zmiana podawania dożylnego na doustne
Niezwłocznie po uzyskaniu właściwej reakcji należy równolegle rozpocząć leczenie doustne, podając
zazwyczaj stosowaną dawkę nasycającą. Amiodaron Accord należy odstawiać stopniowo.
Wstrzyknięcie dożylne (patrz „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania” w ChPL)
W sytuacjach nagłych lek można podać, według uznania lekarza, w powolnym dożylnym
wstrzyknięciu w dawce 150-300 mg (5 mg/kg masy ciała) w 10-20 ml dekstrozy 5%, trwającym co
najmniej 3 minuty. Nie należy tego powtarzać przez co najmniej 15 minut, nawet jeśli przy
pierwszym wstrzyknięciu nie została podana dawka maksymalna. Pacjentów otrzymujących
amiodaron w ten sposób należy bardzo dokładnie monitorować, np. w oddziale intensywnej terapii.
Resuscytacja krążeniowo-oddechowa w leczeniu migotania komór opornego na defibrylację
Dożylna dawka początkowa wynosi 300 mg (lub 5 mg/kg masy ciała) rozcieńczona w 20 ml
dekstrozy 5%, podana w szybkim wstrzyknięciu. Jeżeli migotanie komór nie ustąpi, można rozważać
podanie dodatkowej dawki 150 mg dożylnie (lub 2,5 mg/kg masy ciała).
Nie należy mieszać innych leków z amiodaronem w tej samej strzykawce.
Nie należy wstrzykiwać innych leków w ten sam dostęp żylny.
Jeżeli konieczne jest przedłużenie leczenia, należy to zrobić w postaci infuzji dożylnej.
W przypadku zatrucia i (lub) poważnych objawów konieczne jest natychmiastowe leczenie.
Ani amiodaronu chlorowodorku, ani jego metabolitów nie można usunąć za pomocą dializy.
Sposób podawania
Przed podaniem dożylnymamiodaron musi być rozcieńczonyzgodnie z instrukcją podaną
w punkcie 4.2 Charakterystyki Produktu Leczniczego.
W przypadku powolnych wstrzyknięć dożylnych(tylko w stanach nagłych) amiodaron musi być
dodatkowo rozcieńczony10 lub 20 ml 5% dekstrozy w zależności od podanej dawki i wskazania. Na
przykład: w przypadku resuscytacji krążeniowo-oddechowej, rozcieńczyć zawartość jednej
strzykawki (300 mg/10 ml) dodatkowo z 20 ml 5% dekstrozy (dalsze informacje, patrz punkty 4.2
i 4.4 ChPL).
Wyłącznie do jednorazowego użytku.
W infuzji należy używać jedynie 5% roztworu dekstrozy.
Aby uniknąć zapalenia żył, podczas infuzji ciągłej należy założyć centralny cewnik żylny.
Amiodaron Accord jest podawany tylko w celu rozpoczęcia leczenia, nie dłużej niż przez tydzień.
Amiodaron jest niekompatybilny z roztworem soli.
Amiodaron może prowadzić do uwalniania substancji zmiękczającej DEHP (ftalan dwu-2-
etyloheksylu) do roztworu w przypadku stosowania sprzętu medycznego zawierającego DEHP.
W celu zminimalizowania narażenia na DEHP należy podawać amiodaron w roztworze do infuzji
stosując zestawy niezawierające DEHP.
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w ulotce.
Instrukcje dotyczące przygotowania i podania leku
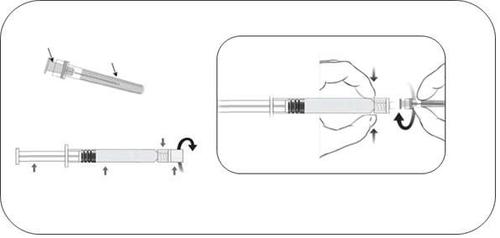
- Należy wyjąć szklaną ampułko-strzykawkę z opakowania i sprawdzić czy nie jest uszkodzona.
- Roztwory przeznaczone do podawania pozajelitowego należy przed podaniem obejrzeć, czy nie zawierają cząstek stałych lub nie są odbarwione.
- Należy odkręcić szklaną nasadkę ampułko-strzykawki poprzez przekręcenie jej w kierunku przeciwnym do ruchu wskazówek zegara (jak pokazano na rysunku 1).
- Należy przymocować igłę do ampułko-strzykawki poprzez delikatne przyłączenie nasadki igły do adaptera Luer Lock i obrócenie jej ćwierć obrotu w prawo, do chwili aż poczuje się zablokowanie igły (jak pokazano na rysunku 2).
- Należy ostrożnie zdjąć osłonkę igły, wyciągając ją prosto.
- Rozcieńczyć (patrz punkt 4.2 ChPL) roztworem 5% dekstrozy zgodnie z instrukcją dotyczącą podawania dożylnego.
Przed podaniem w infuzji dożylnej Amiodaron Accord musi być rozcieńczonyzgodnie z instrukcją
w 5% roztworze dekstrozy. Jedną ampułko-strzykawkę Amiodaron Accord należy rozcieńczyć
zgodnie z zaleceniami w 500 ml 5% roztworu dekstrozy, aby uzyskać stężenie 0,6 mg/ml amiodaronu
chlorowodorku.
Ze względu na stabilność roztworu, nie należy stosować stężeń poniżej 0,6 mg/ml i nie należy
dodawać innych produktów leczniczych do płynu infuzyjnego.
Usuwanie
Tylko do jednorazowego użytku.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyNie
- Producent
- ImporterAccord Healthcare Polska Sp. z o.o. Laboratori Fundació Dau Pharmadox Healthcare Ltd.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Amiodaron AccordPostać farmaceutyczna: Koncentrat, 50 mg/mlSubstancja czynna: amiodaroneProducent: hameln rds s.r.o. HBM Pharma s.r.o.Bez receptyPostać farmaceutyczna: Roztwór, 50 mg/mlSubstancja czynna: amiodaroneProducent: Krka, d.d., Novo mestoBez receptyPostać farmaceutyczna: Roztwór, 50 mg/mlSubstancja czynna: amiodaroneBez recepty
Odpowiedniki Amiodaron Accord w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Amiodaron Accord – Ukraina
Odpowiednik Amiodaron Accord – Hiszpania
Lekarze online w sprawie Amiodaron Accord
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Amiodaron Accord – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.










