TAKHZYRO 300 MG SOLUCION INYECTABLE

Cómo usar TAKHZYRO 300 MG SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
TAKHZYRO300mg solución inyectable en vial
lanadelumab
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es TAKHZYRO y para qué se utiliza
- Qué necesita saber antes de empezar a usar TAKHZYRO
- Cómo usar TAKHZYRO
- Posibles efectos adversos
- Conservación de TAKHZYRO
- Contenido del envase e información adicional
- Instrucciones de uso
1. Qué es TAKHZYRO y para qué se utiliza
TAKHZYRO contiene el principio activo lanadelumab.
Para qué se utiliza TAKHZYRO
TAKHZYRO es un medicamento que se utiliza en pacientes a partir de 2 años de edad con angioedema hereditario (AEH) para prevenir las crisis de angioedema.
Qué es el angioedema hereditario (AEH)
El AEH es una enfermedad hereditaria dentro de una misma familia. Cuando se tiene esta enfermedad, no hay en la sangre una cantidad suficiente de una proteína llamada «C1 inhibidor» o cuando el C1 inhibidor no funciona correctamente. Esto lleva a un exceso de «calicreína plasmática», lo que a su vez produce niveles más altos de «bradicinina» en el torrente sanguíneo. Demasiada bradicinina provoca síntomas de AEH, como hinchazón y dolor en:
- las manos y los pies
- la cara, los párpados, los labios o la lengua
- las cuerdas vocales (laringe), que puede hacer que le cueste respirar
- los genitales
Cómo actúa TAKHZYRO
TAKHZYRO es un tipo de proteína que bloquea la actividad de la calicreína plasmática, lo que ayuda a reducir la cantidad de bradicinina presente en el torrente sanguíneo y previene los síntomas del AEH.
2. Qué necesita saber antes de empezar a usar TAKHZYRO
No use TAKHZYRO
Si es alérgico al lanadelumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
- Consulte a su médico, farmacéutico o enfermero antes de empezar a usar TAKHZYRO.
- Si tiene una reacción alérgica grave a TAKHZYRO con síntomas como erupción, opresión en el pecho, silbidos al respirar o latidos cardiacos rápidos, informe a su médico, farmacéutico o enfermero inmediatamente.
Llevar un registro
Se recomienda encarecidamente que, cada vez que se administre una dosis de TAKHZYRO, apunte el nombre y el número de lote del medicamento, para que tenga un registro de los lotes utilizados.
Pruebas analíticas
Informe a su médico si está usando TAKHZYRO antes de someterse a pruebas analíticas para evaluar su coagulación sanguínea, ya que la presencia de TAKHZYRO en la sangre puede interferir con ciertas pruebas analíticas y dar lugar a resultados inexactos.
Niños y adolescentes
No se recomienda el uso de TAKHZYRO en niños menores de 2 años, ya que no se ha estudiado en este grupo de edad.
Otros medicamentos y TAKHZYRO
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
No se sabe que TAKHZYRO afecte a otros medicamentos ni que se vea afectado por otros medicamentos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar TAKHZYRO. La información sobre la seguridad del uso de TAKHZYRO durante el embarazo y la lactancia es limitada. Como medida de precaución, es preferible evitar el uso de lanadelumab durante el embarazo y la lactancia. El médico analizará con usted los riesgos y beneficios de recibir este medicamento.
Conducción y uso de máquinas
La influencia de este medicamento sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
TAKHZYRO contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial; esto es, esencialmente “exento de sodio”.
3. Cómo usar TAKHZYRO
TAKHZYRO se presenta en viales de un solo uso como solución lista para usar. Un médico con experiencia en la atención de pacientes con AEH iniciará y supervisará su tratamiento.
Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico, farmacéutico o enfermero. En caso de duda u otras preguntas sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
Cuánto TAKHZYRO utilizar
Para adultos y adolescentes de 12 años a menores de 18 años de edad:
- La dosis de inicio recomendada es de 300 mg de lanadelumab cada 2 semanas. Si no ha tenido ninguna crisis durante un periodo de tiempo prolongado, el médico puede modificarle la dosis a 300 mg de lanadelumab cada 4 semanas, en especial si su peso corporal es bajo.
- En pacientes con un peso corporal inferior a 40 kg, también puede considerarse una dosis de inicio de 150 mg de lanadelumab cada 2 semanas. Si no ha tenido crisis durante un periodo de tiempo prolongado, el médico puede cambiar la dosis a 150 mg de lanadelumab cada 4 semanas.
Para niños de 2 años a menores de 12 años de edad, la dosis de inicio recomendada se basa en el peso corporal:
Peso corporal (kg) | Dosis de inicio recomendada | Ajuste de dosis |
10 a menos de 20 kg | 150 mg de lanadelumab cada 4 semanas | Se puede considerar un aumento de la dosis a 150 mg de lanadelumab cada 3 semanas en pacientes con control insuficiente de los ataques |
20 a menos de 40 kg | 150 mg de lanadelumab cada 2 semanas | Se puede considerar reducir la dosis a 150 mg de lanadelumab cada 4 semanas en pacientes estables y sin crisis bajo tratamiento |
40 kg o más | 300 mg de lanadelumab cada 2 semanas | Se puede considerar reducir la dosis a 300 mg de lanadelumab cada 4 semanas en pacientes estables y sin crisis bajo tratamiento |
- En pacientes con un peso corporal de 20 a menos de 40 kg que no hayan tenido ninguna crisis durante un periodo de tiempo prolongado, el médico puede permitir que su hijo/a o el niño/a que está a su cuidado continúe recibiendo la misma dosis al llegar a los 12 años de edad.
Cómo inyectar TAKHZYRO
Si se auto inyecta TAKHZYRO o si se lo inyecta su cuidador, usted o su cuidador deben leer y seguir atentamente las instrucciones que aparecen en la sección7, «Instrucciones de uso».
- TAKHZYRO se inyecta bajo la piel («inyección subcutánea»).
- La inyección puede ser administrada por usted o un cuidador en pacientes a partir de 12 años de edad.
- La inyección puede ser administrada por un profesional sanitario o por un cuidador en pacientes de 2 años a menores de 12 años de edad.
- Un médico, farmacéutico o enfermero deberá enseñarle a preparar e inyectar TAKHZYRO correctamente antes de que lo utilice por primera vez. No se inyecte ni inyecte a otra persona hasta que le hayan enseñado a inyectarse el medicamento.
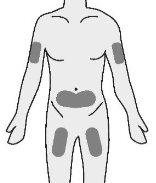
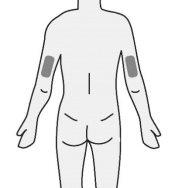
- Inserte la aguja en el tejido adiposo del estómago (abdomen), muslo o parte superior del brazo.
- Inyecte el medicamento en un lugar distinto cada vez.
- Use cada vial de TAKHZYRO solo una vez.
Si usa más TAKHZYRO del que debe
Informe a su médico, farmacéutico o enfermero si se ha administrado una dosis de TAKHZYRO mayor a la recomendada.
Si olvidó usar TAKHZYRO
Si se salta una dosis de TAKHZYRO, inyecte la dosis lo antes posible. La administración de las siguientes dosis puede requerir un ajuste según la frecuencia de dosificación deseada, asegurándose de:
- dejar pasar al menos 10 días entre una dosis y otra en pacientes con un régimen de dosificación cada 2 semanas,
- dejar pasar al menos 17 días entre una dosis y otra en pacientes con un régimen de dosificación cada 3 semanas,
- dejar pasar al menos 24 días entre una dosis y otra en pacientes con un régimen de dosificación cada 4 semanas.
Si no está seguro de cuándo inyectarse TAKHZYRO después de haberse saltado una dosis, pregunte a su médico, farmacéutico o enfermero.
Si interrumpe el tratamiento con TAKHZYRO
Es importante que siga inyectándose TAKHZYRO como se lo haya indicado el médico, incluso si se siente mejor.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si tiene una reacción alérgica grave a TAKHZYRO con síntomas como erupción, opresión en el pecho, silbidos al respirar o latidos cardiacos rápidos, informe a su médico, farmacéutico o enfermero inmediatamente.
Informe a su médico, farmacéutico o enfermero si nota alguno de los siguientes efectos adversos.
Muy frecuentes (pueden afectar a más de 1de cada 10personas):
- Reacciones en el lugar de administración de la inyección: los síntomas son dolor, enrojecimiento de la piel, cardenales, molestias, hinchazón, sangrado, picor, endurecimiento de la piel, hormigueo, calor y erupción.
Frecuentes (pueden afectar hasta 1de cada 10personas):
- Reacciones alérgicas, como picor, molestias y hormigueo en la lengua
- Mareos, sensación de desmayo
- Erupción cutánea abultada
- Dolor muscular
- Resultados de pruebas analíticas que muestran cambios en el hígado
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de TAKHZYRO
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 ?C y 8 ?C). No congelar. Conservar el vial en el embalaje exterior para protegerlo de la luz.
Los viales pueden conservarse por debajo de los 25 °C por un solo periodo de 14 días pero sin sobrepasar la fecha de caducidad.
Después de su conservación a temperatura ambiente, no volver a refrigerar TAKHZYRO para su conservación.
No utilice este medicamento si observa signos de deterioro, como partículas en el vial o un cambio de color en la solución para inyección.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de TAKHZYRO
- El principio activo es lanadelumab. Cada vial contiene 300 mg de lanadelumab en 2 ml solución.
- Los demás componentes son fosfato disódico dihidratado, ácido cítrico monohidratado, histidina, cloruro de sodio, polisorbato 80 y agua para preparaciones inyectables; ver sección 2 «TAKHZYRO contiene sodio».
Aspecto del producto y contenido del envase
TAKHZYRO se presenta en forma de solución inyectable transparente de incolora a amarillo pálido en un vial de vidrio.
TAKHZYRO está disponible como envase unitario que contiene un vial de 2 ml y como envases múltiples que contienen 2 o 6 cajas intermedias, de 1 vial cada una.
Es posible que no se comercialicen todos los tamaños de envases.
Cada envase contiene también los siguientes componentes:
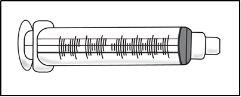
- Jeringa de 3 ml vacía
- Aguja de acceso al vial de calibre 18 con punta roma
- Aguja para administración (inyección) de 27 G x 13 mm con punta afilada
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
D02 HW68
Irlanda
Responsable de la fabricación
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
D02 HW68
Irlanda
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Takeda Belgium NV Tél/Tel: +32 2 464 06 11 | Lietuva Takeda, UAB Tel: +370 521 09 070 |
| Luxembourg/Luxemburg Takeda Belgium NV Tél/Tel: +32 2 464 06 11 |
Ceská republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel: + 420 234 722 722 | Magyarország Takeda Pharma Kft. Tel.: +36 1 270 7030 |
Danmark Takeda Pharma A/S Tlf: +45 46 77 10 10 | Malta Drugsales Ltd Tel: +356 21419070 |
Deutschland Takeda GmbH Tel: +49 (0)800 825 3325 | Nederland Takeda Nederland B.V. Tel: +31 20 203 5492 |
Eesti Takeda Pharma OÜ Tel: +372 6177 669 | Norge Takeda AS Tlf.: +47 800 800 30 |
Ελλ?δα Τakeda ΕΛΛΑΣ Α.Ε. Tηλ: +30 210 6387800 | Österreich Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
España Takeda Farmacéutica España, S.A. Tel: +34 917 90 42 22 | Polska Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
France Takeda France SAS Tél: + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Hrvatska Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | România Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Ireland Takeda Products Ireland Ltd Tel: 1800 937 970 | Slovenija Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 |
Ísland Vistor ehf. Sími: +354 535 7000 | Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel: +421 (2) 20 602 600 |
Italia Takeda Italia S.p.A. Tel: +39 06 502601 | Suomi/Finland Takeda Oy Puh/Tel: 0800 774 051 |
Κ?προς Proton Medical (Cyprus) Ltd Τηλ: +357 22866000 | Sverige Takeda Pharma AB Tel: 020 795 079 |
Latvija Takeda Latvia SIA Tel: +371 67840082 | United Kingdom (Northern Ireland) Takeda UK Ltd Tel: +44 (0) 3333 000 181 |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
- Instrucciones de uso
Asegúrese de leer, comprender y seguir las instrucciones paso a paso para inyectar TAKHZYRO. Contacte a su médico, farmacéutico o enfermero si tiene preguntas.
Además del vial, cada envase de TAKHZYRO contiene también:
|
|
Se utiliza para extraer la solución del vial a la jeringa. |
|
Se utiliza para inyectar bajo la piel (vía subcutánea). |
|
Utilice solamente las jeringas, agujas de acceso al vial con punta roma y agujas para inyección con punta afilada que vienen en este envase o que le haya recetado su médico.
Utilice una sola vez las jeringas, agujas de acceso al vial con punta roma y agujas para inyección con punta afilada. Coloque todas las jeringas y las agujas usadas en un contenedor para objetos punzocortantes.
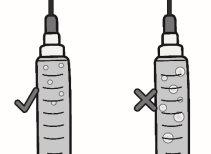
No utilice una jeringa, aguja de acceso al vial con punta roma ni aguja para inyección con punta afilada que parezca estar dañada.
También necesitará:
- Gasas con alcohol
- Un contenedor para objetos punzocortantes para colocar los viales, agujas y jeringas usados
Puede obtener estos artículos de su médico, farmacéutico o enfermero.
La inyección de TAKHZYRO puede resumirse en 5pasos:
- Preparación del vial de TAKHZYRO
- Acoplamiento a la jeringa de la aguja de acceso al vial con punta roma
- Transferencia de TAKHZYRO a la jeringa y cambio a la aguja de inyección con punta afilada
- Selección y preparación del lugar de inyección
- Inyección de TAKHZYRO
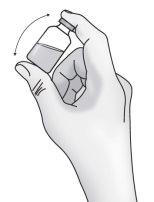
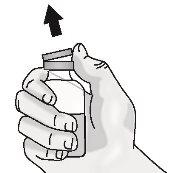
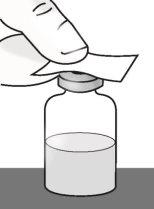
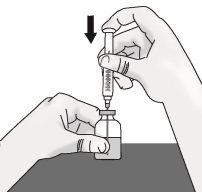
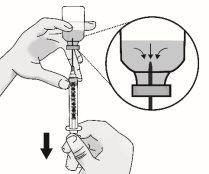
Paso1: Preparación del vial de TAKHZYRO
|
|
|
|
|
|
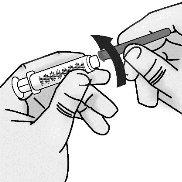
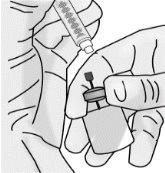
Paso2: Acoplamiento a la jeringa de la aguja de acceso al vial con punta roma
|
|
|
|
|
|
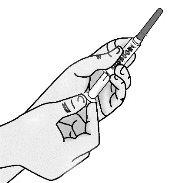
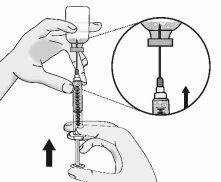
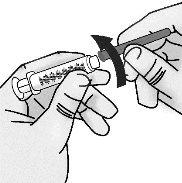
Paso3: Transferencia de TAKHZYRO a la jeringa y cambio a la aguja de inyección con punta afilada
|
|
|
|
|
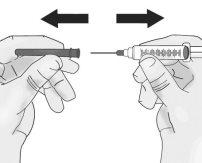
Presione el émbolo lentamente dejando que el aire vuelva al vial hasta que la solución llegue al extremo de la jeringa. Repita estos pasos hasta que se hayan eliminado las burbujas grandes. |
|
Vuelva a poner la jeringa en posición vertical. |
|
|
|
|
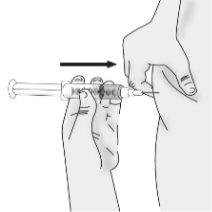
Paso4: Selección y preparación del lugar de inyección
|
|
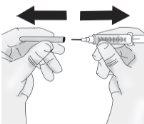
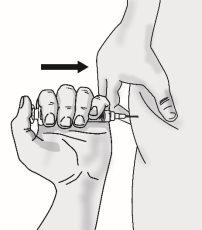
Paso5: Inyección de TAKHZYRO
|
|
|
|
|
|
|
|
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a TAKHZYRO 300 MG SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 150 mgPrincipio activo: LanadelumabRequiere recetaForma farmacéutica: INYECTABLE, 300 mgPrincipio activo: LanadelumabRequiere recetaForma farmacéutica: INYECTABLE, 200 mgPrincipio activo: Drugs used in hereditary angioedemaFabricante: Csl Behring GmbhRequiere receta
Médicos online para TAKHZYRO 300 MG SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de TAKHZYRO 300 MG SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes