
ISOPROTRACE 10 MICROGRAMOS EQUIPO DE REACTIVOS PARA PREPARACION RADIOFARMACEUTICA
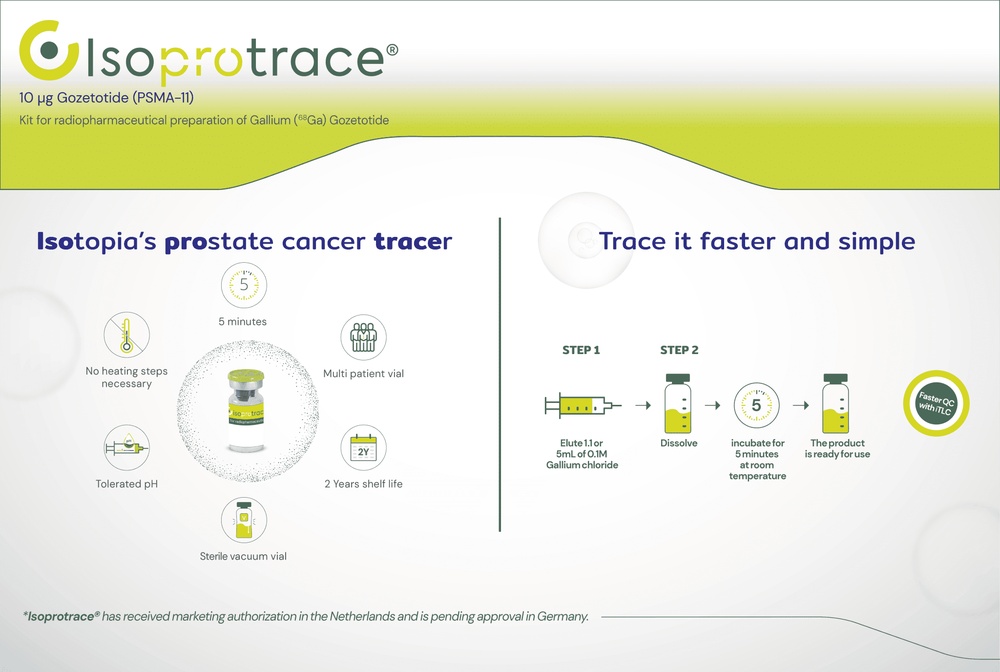

Cómo usar ISOPROTRACE 10 MICROGRAMOS EQUIPO DE REACTIVOS PARA PREPARACION RADIOFARMACEUTICA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Isoprotrace 10microgramos equipo de reactivos para preparación radiofarmacéutica
gozetotida
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico nuclear que supervisará el procedimiento.
- Si experimenta efectos adversos, consulte a su médico nuclear, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Isoprotrace y para qué se utiliza
- Qué necesita saber antes de que le administren Isoprotrace
- Cómo se administra Isoprotrace
- Posibles efectos adversos
- Conservación de Isoprotrace
- Contenido del envase e información adicional
1. Qué es Isoprotrace y para qué se utiliza
Este medicamento es un radiofármaco únicamente para uso diagnóstico.
Contiene una sustancia denominada gozetotida. Antes de poder utilizarlo, el polvo del vial se mezcla con una sustancia radiactiva llamada cloruro de galio (68Ga) para producir galio (68Ga)‑gozetotida (este procedimiento recibe el nombre de marcaje radiactivo).
Después del marcaje radiactivo con galio (68Ga), Isoprotrace se emplea en un tipo especial de técnica de diagnóstico por imágenes denominada tomografía por emisión de positrones (PET, por sus siglas en inglés) para detectar determinados tipos de células cancerosas que tienen una proteína llamada antígeno prostático específico de membrana (PSMA, por sus siglas en inglés) en pacientes:
- con cáncer de próstata con un riesgo elevado de que la enfermedad se extienda a otras partes del cuerpo y que sean aptos para recibir un tratamiento capaz de curar el cáncer
- que hayan recibido un tratamiento anterior para el cáncer de próstata y en quienes se sospeche que haya vuelto a aparecer el cáncer, teniendo en cuenta los resultados obtenidos en otras pruebas (p. ej., antígeno prostático específico [PSA]).
El uso de Isoprotrace implica recibir una pequeña cantidad de radiactividad. Su médico y el médico nuclear han considerado que el beneficio clínico que usted obtendrá del procedimiento con el radiofármaco supera el riesgo de la radiación.
2. Qué necesita saber antes de que le administren Isoprotrace
No le deben administrar Isoprotrace
- si es alérgico a gozetotida o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Antes de empezar a recibir Isoprotrace, hable con su médico nuclear si padece una enfermedad renal.
Antes de la administración de Isoprotrace
Debe beber mucha agua antes de comenzar el procedimiento para orinar muy frecuentemente durante las primeras horas tras su finalización para garantizar así que Isoprotrace se elimine de su cuerpo lo antes posible.
Niños y adolescentes
Isoprotrace no está indicado para su uso en niños y adolescentes menores de 18 años de edad. No se ha establecido la seguridad y eficacia de galio (68Ga)‑gozetotida en esta población de pacientes.
Embarazo y lactancia
Isoprotrace no está indicado para su uso en mujeres. Todos los radiofármacos, incluido Isoprotrace, pueden causar daño en el feto.
Conducción y uso de máquinas
Se considera improbable que Isoprotrace afecte la capacidad de conducir y utilizar máquinas.
Isoprotrace contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial; esto es, esencialmente «exento de sodio».
3. Cómo se administra Isoprotrace
Hay normas estrictas sobre el uso, manipulación y eliminación de radiofármacos. Isoprotrace se utilizará únicamente en áreas controladas especiales. Este producto sólo será manejado y administrado por personal formado y cualificado para usarlo de forma segura. Esas personas pondrán especial cuidado en el uso seguro de este producto y le informarán de sus acciones.
El médico nuclear que supervisa el procedimiento decidirá la cantidad de Isoprotrace que se debe usar en su caso. Esta será la cantidad mínima necesaria para obtener la información deseada.
La cantidad habitualmente recomendada para administrar a un adulto es de 111 a 259 MBq (megabequerelios, la unidad utilizada para expresar radiactividad).
Administración de Isoprotrace y realización del procedimiento
Tras el marcaje radiactivo, Isoprotrace se administra mediante una inyección intravenosa lenta. Una sola inyección es suficiente para realizar la prueba que su médico precisa.
Duración del procedimiento
Su médico nuclear le informará sobre la duración habitual del procedimiento.
Después de la administración de Isoprotrace, usted deberá
- seguir bebiendo agua en abundancia para mantenerse hidratado y orinar con la mayor frecuencia posible a fin de eliminar el medicamento de su organismo
- evitar el contacto directo con niños pequeños y mujeres embarazadas durante las primeras 6 horas posteriores a la inyección.
El médico nuclear le informará si es necesario que tome alguna precaución especial después de recibir este medicamento. Consulte con su médico nuclear si tiene alguna duda.
Si se le ha administrado más Isoprotrace del que debe
Es improbable que se produzca una sobredosis, ya que únicamente recibirá una sola dosis de Isoprotrace controlada con precisión por el médico nuclear que supervisa el procedimiento. Sin embargo, en caso de producirse una sobredosis, recibirá el tratamiento adecuado. Beber y orinar con frecuencia le ayudará a eliminar la radiactividad de su organismo con mayor rapidez.
Si tiene cualquier otra duda sobre el uso de Isoprotrace, pregunte al médico nuclear que supervisa el procedimiento.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Pueden producirse los siguientes efectos adversos:
Poco frecuentes (pueden afectar hasta a 1 de cada 100 personas):
- dolor de cabeza
- mareo
- sensación de hormigueo y entumecimiento de la piel
- sensación de somnolencia durante el día o problemas para conciliar el sueño por la noche
- náuseas
- diarrea
- dificultad para tragar
- erupción
- cansancio
- ardor, picor y dolor en el lugar de la inyección
La administración de este radiofármaco implica recibir una pequeña cantidad de radiación ionizante con un riesgo muy bajo de desarrollar cáncer y defectos hereditarios.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico de medicina nuclear, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Isoprotrace
Usted no tendrá que almacenar este medicamento. Este medicamento se almacena bajo la responsabilidad del especialista en unas instalaciones apropiadas. El almacenamiento de radiofármacos se realizará conforme a la normativa nacional sobre materiales radiactivos.
La siguiente información está destinada únicamente al especialista:
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y la etiqueta después de «CAD». La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (2 °C – 8 °C).
Tras la reconstitución y el marcaje radiactivo: conservar en posición vertical por debajo de 25 °C y usar en un plazo de 4 horas.
Desde un punto de vista microbiológico, a menos que el método de apertura, marcaje radiactivo o dilución excluya el riesgo de contaminación microbiana, el producto debe utilizarse inmediatamente. Si no se utiliza de inmediato, los tiempos y las condiciones de conservación en uso son responsabilidad del usuario.
6. Contenido del envase e información adicional
Composición de Isoprotrace
- El principio activo es gozetotida. Cada vial contiene 10 microgramos de gozetotida.
- Los demás excipientes son: gelatina hidrolizada, acetato sódico anhidro y cloruro sódico. Ver sección 2 “Isoprotrace contiene sodio”.
Tras el marcaje radiactivo, la solución obtenida contiene también, como excipiente, ácido clorhídrico.
Aspecto de Isoprotrace y contenido del envase
El envase contiene 5 viales de vidrio multidosis con un volumen de 10 ml en una caja de cartón. Cada vial contiene un polvo blanco o blanquecino.
La sustancia radiactiva no forma parte del equipo y deberá añadirse durante los pasos de preparación antes de la administración.
Titular de la autorización de comercialización
Billev Pharma ApS
Slotsmarken 10
2970 Hørsholm
Dinamarca
Responsable de la fabricación
Cilatus Manufacturing Services Limited
Pembroke House
28-32 Pembroke Street Upper
Dublin 2, D02 EK84
Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose alrepresentante localdel titular de la autorización de comercialización:
NUCLIBER, S.A.
N° Telf. +34 915062940
Fecha de la última revisión de este prospecto: 02/2025.
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales sanitarios:
La ficha técnica completa de Isoprotrace se incluye como documento separado en el envase del producto, con el fin de proporcionar a los profesionales sanitarios otra información científica y práctica adicional sobre la administración y el uso de este radiofármaco.
Por favor, consulte la ficha técnica.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a ISOPROTRACE 10 MICROGRAMOS EQUIPO DE REACTIVOS PARA PREPARACION RADIOFARMACEUTICAForma farmacéutica: RADIOFARMACO, 25 MICROGRAMOSPrincipio activo: gallium (68Ga) gozetotideFabricante: Telix InnovationsRequiere recetaForma farmacéutica: RADIOFARMACO, 25 MICROGRAMOSPrincipio activo: gallium (68Ga) gozetotideFabricante: Novartis Europharm LimitedRequiere recetaForma farmacéutica: INYECTABLE, 74 mbq iobenguano (123I)Principio activo: Iobenguano 123iFabricante: Ge Healthcare Bio-Sciences, S.A.U.Requiere receta
Médicos online para ISOPROTRACE 10 MICROGRAMOS EQUIPO DE REACTIVOS PARA PREPARACION RADIOFARMACEUTICA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de ISOPROTRACE 10 MICROGRAMOS EQUIPO DE REACTIVOS PARA PREPARACION RADIOFARMACEUTICA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes












