
IG VENA 50 G/L SOLUCION PARA PERFUSION

Cómo usar IG VENA 50 G/L SOLUCION PARA PERFUSION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Ig Vena 50 g/l, solución para perfusión
inmunoglobulina humana normal (IgIV)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Ig Vena y para qué se utiliza
- Qué necesita saber antes de empezar a usar Ig Vena
- Cómo usar Ig Vena
- Posibles efectos adversos
- Conservación de Ig Vena
- Contenido del envase e información adicional
1. Qué es Ig Vena y para qué se utiliza
Ig Vena es una solución de inmunoglobulina humana normal para administración intravenosa. Las inmunoglobulinas son anticuerpos humanos que también están presentes en la sangre.
Ig Vena se utiliza para:
Tratamiento en adultos, niños y adolescentes (0-18años) que carecen de suficientes anticuerpos (terapia de reemplazo) en los siguientes casos:
- Pacientes con deficiencia congénita en la producción de anticuerpos (síndromes de inmunodeficiencia primaria).
- Pacientes con deficiencia adquirida de producción de anticuerpos (inmunodeficiencias secundarias) que sufren infecciones graves o recurrentes debido a diferentes condiciones médicas (por ejemplo, enfermedades oncológicas o autoinmunes o debido al tratamiento consecuente de esas enfermedades). Estos pacientes han sido sometidos a un tratamiento con antibióticos que ha resultado ineficaz y no han tenido un aumento suficientemente significativo del título de anticuerpos IgG después de la vacunación (vacunas antineumocócicas con antígenos polisacáridos y polipéptidos) o tienen un nivel de IgG en la sangre de < 4 g/l.
Tratamiento en adultos, niños y adolescentes (0-18 años) con ciertas afeccionesinflamatorias(inmunomodulación)en los siguientes casos:
- Pacientes que no tienen suficientes plaquetas (Trombocitopenia Inmune Primaria, TIP), con alto riesgo de sufrir hemorragia o antes de someterse a una cirugía para corregir el recuento de plaquetas.
- Pacientes con el síndrome de Guillain Barré. Esta es una enfermedad aguda que se caracteriza por una inflamación de los nervios periféricos que causa debilidad muscular grave, principalmente en las piernas y extremidades superiores.
- Pacientes con enfermedad de Kawasaki (en combinación con ácido acetilsalicílico). Esta es una enfermedad aguda que afecta principalmente a los niños de corta edad y que se caracteriza por una inflamación de los vasos sanguíneos de todo el cuerpo.
- Pacientes con Polineuropatía Desmielinizante Inflamatoria Crónica (PDIC). Esta enfermedad crónica es un trastorno raro de los nervios periféricos que se caracteriza por un aumento gradual de la debilidad en las piernas y, en menor grado, en los brazos.
- Pacientes con Neuropatía Motora Multifocal (NMM). Se trata de una enfermedad rara que afecta a los nervios motores y que se caracteriza por una debilidad asimétrica y lentamente progresiva de las extremidades sin pérdida de sensibilidad.
2. Qué necesita saber antes de empezar a usar Ig Vena
No use Ig Vena
- Si es alérgico (hipersensible) a las inmunoglobulinas humanas o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- Si tiene anticuerpos contra las inmunoglobulinas de tipo IgA en la sangre, ya que la administración de un medicamento que contiene IgA puede causar una reacción alérgica grave.
Advertencias y precauciones
Consulte a su médico o enfermero antes de usar Ig Vena.
Su médico o profesional sanitario lo monitorizará de cerca y lo observará detenidamente durante el periodo de perfusión con Ig Vena para asegurarse de que no sufra reacciones adversas.
Ciertas reacciones adversas pueden ocurrir con mayor frecuencia:
- en caso de alta velocidad de perfusión;
- si tiene signos no controlados de infecciones no tratadas (por ejemplo, fiebre) o signos de inflamación crónica;
- si recibe inmunoglobulina humana normal por primera vez;
- en casos raros, al cambiar de producto de inmunoglobulina humana normal, o cuando ha transcurrido un largo periodo de tiempo desde la perfusión anterior.
- En ciertos casos, las inmunoglobulinas pueden aumentar el riesgo de infarto de miocardio, ictus, embolia pulmonar o trombosis venosa profunda, ya que incrementan la viscosidad de la sangre.
Por tanto, su médico tendrá especial precaución en los siguientes casos:
- si tiene sobrepeso,
- si tiene edad avanzada,
- si tiene diabetes,
- si padece presión arterial alta (hipertensión),
- si su volumen sanguíneo es muy bajo (hipovolemia),
- si tiene o ya tuvo problemas en los vasos sanguíneos (enfermedades vasculares),
- si padece una mayor tendencia a la formación de coágulos (trastornos trombóticos hereditarios o adquiridos),
- si padece episodios trombóticos,
- si padece una enfermedad que hace que su sangre se espese (viscosidad),
- si ha estado postrado en cama por un largo periodo de tiempo,
- si tiene o tuvo problemas con sus riñones o si está tomando medicamentos que pueden dañar sus riñones (medicamentos nefrotóxicos), ya que se han notificado casos de insuficiencia renal aguda. En caso de trastorno renal, su médico considerará la interrupción del tratamiento.
- Usted puede ser alérgico (hipersensible) a las inmunoglobulinas (anticuerpos) sin saberlo.
Esto puede ocurrir incluso si usted ha tomado anteriormente inmunoglobulinas humanas normales y las ha tolerado bien. Puede suceder especialmente si usted no tiene inmunoglobulinas del tipo IgA (deficiencia de IgA con anticuerpos anti-IgA). En estos casos raros pueden producirse reacciones alérgicas (hipersensibilidad) tales como una disminución repentina de la presión arterial o shock.
En caso de que se produzca una reacción adversa, su médico podrá decidir si reducir la velocidad de administración o detener la perfusión. Asimismo, su médico decidirá el tratamiento que requiere dependiendo de la naturaleza y gravedad del efecto adverso.
En caso de shock, deberá aplicarse el tratamiento médico estándar correspondiente. Por favor informe a su médico si padece de por lo menos una de las afecciones mencionadas anteriormente, su médico tendrá especial cuidado cuando le prescriba y administre Ig Vena.
Seguridad frente a los virus
Los medicamentos derivados de sangre o plasma humanos están sometidos a un número determinado de medidas de seguridad para prevenir la transmisión de infecciones a los pacientes. Estas incluyen una cuidadosa selección de donantes de sangre o plasma para asegurarse de excluir a aquellos que están en riesgo de ser portadores de infecciones, y el análisis de cada donación y mezclas de plasma para detectar signos de virus. Los fabricantes de estos medicamentos también incluyen medidas en el procesamiento de la sangre o del plasma para inactivar o eliminar los patógenos. A pesar de estas medidas, cuando se administran medicamentos elaborados a partir de sangre o plasma humanos, la posibilidad de transmitir una infección no puede descartarse totalmente. Esto también es válido para cualquier virus desconocido o emergente u otros tipos de infecciones.
Las medidas adoptadas se consideran efectivas para virus con envoltura como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB), el virus de la hepatitis C (VHC), y para el virus de la hepatitis A (VHA) sin envoltura.
Las medidas tomadas pueden tener un efecto limitado en los virus sin envoltura tales como el parvovirus B19.
Las inmunoglobulinas no se han asociado a infecciones por hepatitis A o parvovirus B19, posiblemente porque los anticuerpos frente a estas infecciones, como los contenidos en el medicamento, son protectores.
Es altamente recomendable que cada vez que reciba una dosis de Ig Vena se registre el nombre y el número de lote del producto para mantener un registro de los lotes utilizados.
Niños y adolescentes
Se ha observado glucosuria transitoria y leve (presencia de glucosa en la orina) sin signos clínicos después de la administración de Ig Vena en pacientes pediátricos. Este evento puede estar relacionado con la maltosa que contiene Ig Vena, ya que la maltosa se hidroliza a glucosa en los túbulos renales, la cual es reabsorbida y generalmente se excreta muy poco en la orina. La reabsorción de glucosa está determinada por la edad. El aumento transitorio de maltosa en el plasma puede exceder la capacidad renal de re-absorción de azúcares y dar resultados positivos en el ensayo de glucosa en orina.
Otros medicamentos e Ig Vena
Informe a su médico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
La inmunoglobulina humana normal para administración intravenosa no debe mezclarse con otros medicamentos ni con ningún otro producto de IgIV.
Vacunas con virus vivos atenuados
La administración de inmunoglobulina puede alterar la eficacia de las vacunas con virus vivos atenuados como sarampión, rubeola, paperas y varicela durante un periodo de al menos 6 semanas y hasta 3 meses. Después de la administración de este medicamento, se debe dejar pasar un intervalo de 3 meses antes de administrar vacunas con virus vivos atenuados. En el caso del sarampión, la alteración puede durar hasta 1 año. Por lo tanto, se deben controlar los niveles de anticuerpos en los pacientes que reciban la vacuna contra el sarampión.
Diuréticos de asa (un grupo de medicamentos que aumentan el flujo de orina)
Evitar el uso concomitante de diuréticos del asa.
Análisis de sangre
Ig Vena puede interferir en algunos análisis de sangre debido al incremento transitorio de varios de los anticuerpos transferidos de forma pasiva a la sangre después de la inyección de inmunoglobulina; este incremento de anticuerpos puede generar resultados engañosos en las pruebas serológicas. La transmisión pasiva de anticuerpos a antígenos eritrocitarios, por ejemplo, A, B, D (que determinan el grupo sanguíneo), puede interferir en algunas pruebas serológicas para detectar anticuerpos de glóbulos rojos, por ejemplo, la prueba de antiglobulina directa (prueba de Coombs directa, DAT).
Análisis de glucosa en la sangre
Algunos sistemas de análisis de glucosa en la sangre (por ejemplo, aquellos basados en la glucosa deshidrogenasa pirroloquinolinequinona (GDH-PQQ) o métodos de glucosa-colorante-oxidorreductasa) interpretan falsamente la maltosa (100 mg/ml) contenida en Ig Vena como glucosa. Esto puede resultar en lecturas falsamente elevadas de glucosa durante una perfusión y por un periodo de aproximadamente 15 horas después de finalizar la perfusión y, por consiguiente, en la administración inadecuada de insulina, causando hipoglicemia que puede poner en peligro la vida del paciente o incluso causar la muerte. Asimismo, es posible que los casos de hipoglucemia real no se traten si el estado hipoglucémico resulta enmascarado por lecturas de glucosa falsamente elevadas. Por tanto, cuando se administra Ig Vena u otros productos parenterales que contienen maltosa, la medición de glucosa en la sangre debe efectuarse empleando un método específico para glucosa. Se debe revisar detenidamente la información sobre el producto del sistema de medición de glucosa en la sangre, incluyendo el de las tiras reactivas, para determinar si el sistema es adecuado para su uso con productos parenterales que contienen maltosa. Si existe alguna duda, comuníquese con el fabricante del sistema de medición para determinar si el sistema es adecuado para su uso con productos parenterales que contienen maltosa.
Niños y adolescentes
Si bien no se han realizado estudios específicos de interacción en la población pediátrica, no deben esperarse diferencias entre niños y adultos.
Embarazo, lactancia y fertilidad
- Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Su médico decidirá si puede utilizar Ig Vena durante el embarazo o periodo de lactancia.
- No se han efectuado estudios clínicos con Ig Vena en mujeres embarazadas. Se ha demostrado que los productos con IgIV atraviesan la placenta, en mayor medida durante el tercer trimestre. Sin embargo, se han empleado medicamentos que contienen anticuerpos en mujeres embarazadas durante años, y se ha demostrado que no es de esperar efectos perjudiciales durante el embarazo ni en el feto o recién nacido.
- Si usted está en periodo de lactancia y recibe Ig Vena, los anticuerpos del medicamento pueden pasar a la leche materna. Por tanto, su bebé puede estar protegido de ciertas infecciones.
- La experiencia clínica con inmunoglobulinas indica que no deben esperarse efectos perjudiciales en la fertilidad.
Conducción y uso de máquinas
La capacidad para conducir y utilizar máquinas puede verse afectada por algunas reacciones adversas relacionadas con Ig Vena. Los pacientes que sufran reacciones adversas durante el tratamiento deben esperar a que estas desaparezcan para poder conducir o utilizar máquinas.
Ig Vena contiene maltosa y sodio
Este medicamento contiene 100 mg de maltosa por ml.
Este medicamento contiene 69 mg de sodio por litro. Los pacientes con una dieta baja en sodio deben tener esto en consideración.
3. Cómo usar Ig Vena
Ig Vena puede administrarse únicamente en hospitales o centros de salud por médicos o profesionales sanitarios.
La dosis y la pauta de tratamiento dependen de la indicación; el médico determinará la dosis y el tratamiento adecuados para usted.
Al inicio de la perfusión se le administrará Ig Vena a una velocidad de perfusión lenta. Si la tolera bien, su médico puede aumentar gradualmente la velocidad de perfusión.
Uso en niños y adolescentes
La posología en niños y adolescentes (0 a 18 años) no es diferente de la de los adultos, ya que la posología para cada indicación se calcula según el peso corporal y se ajusta a los resultados clínicos del paciente.
Si usa más Ig Vena del que debe
Si usa más Ig Vena del que debe, puede producirse una sobrecarga de líquidos y la sangre puede volverse demasiado espesa (hiperviscosidad); esto puede ocurrir especialmente en pacientes de riesgo, particularmente en pacientes de edad avanzada o pacientes con problemas cardiacos o renales.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los siguientes efectos adversos pueden producirse generalmente después del tratamiento con inmunoglobulinas:
- ocasionalmente se han comunicado escalofríos, dolor de cabeza, mareo, fiebre, vómitos, náuseas, reacciones alérgicas, artralgia (dolor de articulaciones), presión arterial baja y dolor de espalda moderado;
- casos aislados de reducción temporal en el número de eritrocitos en sangre (anemia hemolítica reversible/ hemólisis);
- raramente se ha comunicado una disminución repentina de la presión arterial y, en casos aislados, pueden producirse reacciones de hipersensibilidad (shock anafiláctico), incluso cuando el paciente no ha manifestado hipersensibilidad en administraciones anteriores;
- se han observado casos raros de reacciones cutáneas transitorias.
- se han notificado muy raramente eventos tromboembólicos (formación de coágulos) que pueden causar infarto de miocardio, ictus, obstrucción de las venas pulmonares (embolia pulmonar) y trombosis venosa profunda.
- casos de meningitis no infecciosa transitoria (meningitis aséptica reversible);
- se ha observado un incremento en el nivel de creatinina sérica en la sangre y/o insuficiencia renal aguda;
- casos de lesión pulmonar aguda relacionada con la transfusión (TRALI).
La lista a continuación incluye en orden decreciente de frecuencia los efectos adversos que han sido notificados luego de la administración de Ig Vena en ensayos clínicos y los notificados tras la comercialización del medicamento.
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
- Dolor de espalda
- Náuseas
- Debilidad generalizada, fatiga, fiebre
- Dolor muscular
- Cefalea, somnolencia
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
- Meningitis no infecciosa
- Destrucción y consiguiente falta de glóbulos rojos
- Reacciones alérgicas y shock alérgico potencialmente mortal
- Estado de confusión
- Ictus, mareo, temblor incontrolable, entumecimiento o sensación de hormigueo en la piel o en una extremidad
- Ataque al corazón, coloración azul o morada de la piel, taquicardia, bradicardia, ritmo cardiaco irregular
- Coágulos en las venas mayores y los vasos sanguíneos, presión arterial baja, presión arterial alta, palidez
- Coágulos en la arteria pulmonar principal, volumen anormal de líquido en los pulmones, dificultad para respirar con sibilancia o tos
- Vómitos, diarrea, dolor abdominal
- Hinchazón rápida de la piel, urticaria, enrojecimiento e inflamación de la piel, erupción cutánea, prurito, eccema, sudoración excesiva
- Dolor muscular y articular, dolor de espalda, dolor de cuello, rigidez musculoesquelética
- Insuficiencia renal repentina
- Inflamación de la vena en el punto de inyección, escalofríos, dolor o malestar en el pecho, hinchazón de la cara, sensación de malestar general
- Nivel elevado de creatinina en la sangre
Otros efectos adversos en niños y adolescentes
Se espera que la frecuencia, el tipo y la gravedad de las reacciones adversas en niños sea la misma que en adultos.
Se ha observado glucosuria transitoria y leve (presencia de glucosa en la orina) sin importancia clínica luego de la administración de Ig Vena en niños.
Para información sobre seguridad viral, ver la sección 2 “Antes de empezar a usar Ig Vena”.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ig Vena
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja exterior después de “EXP”. La fecha de caducidad es el último día del mes que se indica. Conservar en nevera (entre 2°C y 8°C).
Antes de usar, y dentro de la vida útil, el medicamento puede conservarse a temperatura ambiente, sin superar los 25°C, por un período máximo de 6 meses consecutivos.
Después de este período, el medicamento debe ser desechado. En cualquier caso, el medicamento ya no puede ser refrigerado si se conserva a temperatura ambiente.
Registre la fecha de inicio de conservación a temperatura ambiente en el embalaje externo
Una vez que el envase de la perfusión se haya abierto, se debe utilizar el contenido inmediatamente.
Mantener el vial en el embalaje exterior. No congelar.
No utilice este medicamento si observa que la solución es turbia, contiene sedimentos o ha cambiado de color.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Ig Vena
El principio activo es inmunoglobulina humana normal.
1 ml de solución contiene 50 mg de inmunoglobulina humana normal.
La solución contiene 50 g/l de proteínas humanas, de las cuales al menos el 95% es inmunoglobulina G (IgG).
Las subclases de IgG (IgG) tienen la siguiente distribución:
IgG1 62,1 %
IgG2 34,8 %
IgG3 2,5 %
IgG4 0,6 %
El contenido máximo de IgA es de 50 microgramos/ml.
Producido a partir de plasma de donantes humanos.
Los demás componentes son maltosa y agua para inyecciones.
Aspecto de Ig Vena y contenido del envase
Ig Vena es una solución para perfusión, suministrada en viales individuales de 20, 50, 100 o 200 ml, con colgador integrado (vial + colgador). La solución es transparente o ligeramente opalescente, incolora o de color amarillo pálido.
Tamaños de envases:
Presentaciones de envases individuales:
1 vial con 1 g/20 ml.
1 vial con 2,5 g/50 ml.
1 vial con 5 g/100 ml.
1 vial con 10 g/200 ml.
Presentaciones de envases múltiples:
Envase múltiple con 2 envases individuales de 1 vial con 10 g/200 ml
Envase múltiple con 3 envases individuales de 1 vial con 10 g/200 ml
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), ITALIA.
Responsable de la fabricación
Kedrion S.p.A., 55027 Bolognana, Gallicano (Lucca), ITALIA.
Este medicamento está autorizado en los Estados Miembros del EEE con los siguientes nombres:
Austria | Ig Vena 50 g/l Infusionslösung |
Alemania | Ig Vena 50 g/l Infusionslösung |
Grecia | Ig VENA |
Italia | Ig VENA |
Polonia | Ig VENA |
Portugal | Ig Vena |
España | Ig Vena |
Fecha de la última revisión de este prospecto:
La siguiente información está destinada únicamente a médicos o profesionales sanitarios:
Instrucciones para un uso correcto
- Ig Vena debe alcanzar la temperatura ambiente o corporal antes de su administración.
- Antes de su administración, la solución debe inspeccionarse visualmente para detectar la presencia de partículas en suspensión y cambios de color. No utilice soluciones turbias o con sedimentos.
- La inmunoglobulina humana normal debe administrarse por vía intravenosa a una velocidad inicial de 0,46 – 0,92 ml/kg/h (10 - 20 gotas por minuto) durante 20 - 30 minutos. En caso de reacción adversa, debe reducirse la velocidad de administración o suspenderse la perfusión. Si se tolera bien, la velocidad de administración puede aumentarse gradualmente a un máximo de 1,85 ml/kg/h (40 gotas/minuto).
- En pacientes con IDP que toleran la velocidad de perfusión de 0,92 ml/kg/h, la velocidad de administración puede aumentarse gradualmente a 2 ml/kg/h, 4 ml/kg/h, hasta un máximo de 6 ml/kg/h, cada 20-30 minutos y solo si el paciente tolera bien la perfusión.
- En general, la dosis y las velocidades de perfusión deben establecerse individualmente conforme a las necesidades del paciente. Dependiendo del peso corporal, de la dosis, y la aparición de reacciones adversas, el paciente tal vez no alcance la velocidad máxima de perfusión. En caso de reacciones adversas, la perfusión debe interrumpirse inmediatamente y reanudarse a la velocidad de perfusión adecuada para el paciente.
Poblaciones especiales
En pacientes pediátricos (0 a 18 años) y personas de edad avanzada (> 64 años de edad), la velocidad inicial de administración debe ser 0,46 – 0,92 ml/kg/h (10 - 20 gotas por minuto) durante 20 - 30 minutos. Si se tolera bien y dependiendo de las condiciones clínicas del paciente, la velocidad puede aumentarse gradualmente hasta un máximo de 1,85 ml/kg/h (40 gotas/minuto).
Instrucciones para el uso del colgador
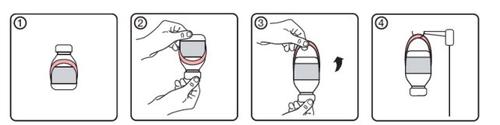
- Estado inicial del vial con etiqueta del colgador
- Poner el vial boca abajo
- Activar colgador desplegándolo de la etiqueta
- Colgar el vial en el soporte de perfusión
Precauciones especiales
Algunas reacciones adversas graves al producto pueden deberse a la velocidad de perfusión.
Con frecuencia, las posibles complicaciones pueden evitarse asegurándose de que:
- los pacientes no sean sensibles a la inmunoglobulina humana normal, inyectando al inicio lentamente elproducto (velocidad de administración 0,46 – 0,92 ml/kg/h);
- los pacientes sean monitorizados atentamente para detectar cualquier síntoma durante el periodo de perfusión. En particular, los pacientes tratados por primera vez con inmunoglobulina humana normal, los pacientes que han cambiado de producto IgIV, o cuando ha transcurrido un largo periodo de tiempo desde la perfusión anterior, deben monitorizarse durante la primera perfusión y durante la primera hora después de la primera perfusión a fin de detectar posibles reacciones adversas. Se debe observar al resto de pacientes al menos durante 20 minutos después de la administración.
En todos los pacientes, la administración de IgIV requiere:
- una hidratación adecuada antes de iniciar la perfusión de IgIV;
- monitorizar la diuresis;
- monitorizar los niveles de creatinina sérica;
- evitar el uso concomitante de diuréticos del asa.
En caso de reacción adversa, debe reducirse la velocidad de administración o suspenderse la perfusión.
El tratamiento necesario depende de la naturaleza e intensidad de la reacción adversa.
En caso de shock, se debe proceder de acuerdo con el tratamiento médico estándar.
Reacción a la perfusión
Determinadas reacciones adversas (por ejemplo, dolor de cabeza, rubor, escalofríos, mialgia, sibilancias, taquicardia, dolor lumbar, náuseas e hipotensión) pueden estar relacionadas con la velocidad de perfusión.
Debe respetarse estrictamente la velocidad de perfusión recomendada.
Los pacientes deben ser vigilados de cerca y observados cuidadosamente para detectar cualquier síntoma durante el período de perfusión.
Las reacciones adversas pueden ser más frecuentes:
- en pacientes que reciben inmunoglobulina humana normal por primera vez o, en casos raros, cuando se cambia el producto de inmunoglobulina humana normal o cuando ha transcurrido un intervalo prolongado desde la perfusión anterior.
- en pacientes con una infección no tratada o una inflamación crónica subyacente.
Niños y adolescentes
No se requieren medidas o monitoreo específicos para la población pediátrica.
Se espera que no haya diferencias en la población pediátrica (0 a 18 años).
Tromboembolismo
Existen evidencias clínicas que asocian la administración de IgIV con la aparición de eventos tromboembólicos como el infarto de miocardio, accidente cerebrovascular (incluyendo ictus), embolia pulmonar y trombosis venosa profunda que se suponen que están relacionados con el incremento relativo de la viscosidad sanguínea por el alto flujo de la inmunoglobulina en pacientes de riesgo. Se debe tener precaución al prescribir y administrar la IgIV en pacientes obesos y en pacientes con factores de riesgo preexistentes de eventos trombóticos (como edad avanzada, hipertensión, diabetes mellitus y con antecedentes de enfermedad vascular o eventos trombóticos, pacientes con trombofilia congénita o adquirida, pacientes con periodos prolongados de inmovilización, pacientes con hipovolemia grave y pacientes con enfermedades que incrementan la viscosidad de la sangre).
En pacientes con riesgo de sufrir reacciones adversas tromboembólicas, se deben administrar los productos de IgIV a la mínima velocidad de perfusión y dosis practicable.
Insuficiencia renal aguda
Se han notificado casos de insuficiencia renal aguda en pacientes que recibieron tratamiento con IgIV. En la mayoría de casos, se han identificado los factores de riesgo tales como insuficiencia renal preexistente, diabetes mellitus, hipovolemia, sobrepeso, tratamiento concomitante con fármacos nefrotóxicos o edad superior a 65 años.
Deben valorarse los parámetros renales antes de la administración de IgIV, especialmente en pacientes con un posible riesgo elevado de sufrir una insuficiencia renal aguda, y también en los intervalos apropiados. En pacientes con riesgo de sufrir una insuficiencia renal aguda, se deben administrar los productos de IgIV a la mínima velocidad de perfusión y dosis practicable.
En caso de insuficiencia renal, debe considerarse la suspensión del tratamiento con IgIV.
Mientras que los casos de disfunción renal y de insuficiencia renal aguda se han asociado con el uso de muchos de los productos de IgIV autorizados que contienen diversos excipientes como sacarosa, glucosa y maltosa, se ha observado que existe una acumulación de casos en aquellos que contienen sacarosa como estabilizante. En pacientes de riesgo debe considerarse el uso de productos de IgIV que no contengan tales excipientes.
Síndrome de meningitis aséptica (SMA)
Se ha notificado un síndrome de meningitis aséptica asociado con el tratamiento con IgIV.
El síndrome suele aparecer desde varias horas a 2 días después del tratamiento con IgIV. Los estudios del líquido cefalorraquídeo suelen revelar pleocitosis con varios miles de células por mm3, principalmente de la serie granulocítica, y niveles elevados de proteína con varios cientos de mg/dl.
El SMA suele ocurrir con más frecuencia asociado a tratamientos con altas dosis de IgIV (2 g/kg).
Los pacientes que muestren estos signos y síntomas, deben recibir una exploración neurológica exhaustiva, incluidos estudios del líquido cefalorraquídeo, para descartar otras causas de meningitis.
La interrupción del tratamiento con IgIV ha dado lugar a remisiones del SMA en varios días sin secuelas.
Anemia hemolítica
Los productos de IgIV pueden contener anticuerpos de grupos sanguíneos que pueden actuar como hemolisinas e inducir el recubrimiento in vivode los glóbulos rojos con inmunoglobulina, causando una reacción de antiglobulina directa positiva (test de Coombs) y, en raras ocasiones, hemólisis. La anemia hemolítica puede desarrollarse como consecuencia del tratamiento con IgIV debido al aumento del captación de glóbulos rojos. Deben vigilarse los signos y síntomas clínicos de hemólisis en los pacientes que reciben IgIV.
Neutropenia/Leucocitopenia
Después del tratamiento con IgIV se ha notificado un descenso transitorio en el número de neutrófilos y/o episodios de neutropenia, en ocasiones graves. Esto suele suceder en las horas o días posteriores a la administración de IgIV, y se resuelve de manera espontánea en unos 7 a 14 días.
Lesión pulmonar aguda producida por transfusión (Transfusion Related Acute Lung Injury - TRALI)
En ocasiones se ha notificado edema pulmonar agudo no cardiogénico [Lesión pulmonar aguda relacionada con la transfusión (TRALI)] en pacientes que han recibido IgIV. TRALI se caracteriza por una hipoxia grave, disnea, taquipnea, cianosis, fiebre e hipotensión. Los síntomas de TRALI generalmente se desarrollan durante o a las 6 horas tras la transfusión, normalmente a las 1-2 horas. Por lo tanto, se deben monitorizar los receptores de IgIV y la administración de IgIV deberá suspenderse inmediatamente en caso de reacciones adversas pulmonares. La TRALI es una afección potencialmente mortal que requiere tratamiento inmediato en una unidad de cuidados intensivos.
Este medicamento contiene 100 mg de maltosa por ml como excipiente. La interferencia de la maltosa en el análisis de glucosa en la sangre puede resultar en lecturas falsamente elevadas de glucosa y, en consecuencia, en la administración inapropiada de insulina, causando hipoglucemia que pone en peligro la vida del paciente y puede causar su muerte. Asimismo, casos reales de hipoglucemia podrían quedarse sin tratamiento si el estado de la hipoglucemia queda enmascarado por los falsos valores elevados de glucosa. Para más detalles, ver la sección “Análisis de glucosa en la sangre”.
Dosis recomendada
La terapia de reemplazo debe iniciarse y monitorizarse bajo la supervisión de un médico con experiencia en el tratamiento de inmunodeficiencias.
Posología
La dosis y el régimen de dosificación dependen de la indicación. Puede ser necesario individualizar la dosis para cada paciente en función de la respuesta clínica.
La dosis basada en el peso corporal puede requerir un ajuste en pacientes con bajo peso o sobrepeso.
Puede emplearse el siguiente régimen de dosificación como guía orientativa.
Terapia de reemplazo en síndromes de inmunodeficiencia primaria
El régimen de dosificación debe conseguir una concentración mínima de IgG (medida antes de la siguiente perfusión) de por lo menos 6 g/l o dentro del intervalo de referencia normal para la edad de la población. Se requieren de tres a seis meses desde el inicio del tratamiento para establecer el equilibrio (estado estacionario de IgG). La dosis inicial recomendada es de 0,4-0,8 g/kg en una única administración, seguida de al menos 0,2 g/kg cada tres o cuatro semanas. La dosis requerida para conseguir una concentración mínima de IgG de 6 g/l es de aproximadamente 0,2-0,8 g/kg/mes. El intervalo de dosificación cuando se ha alcanzado el estado estacionario varía de 3 a 4 semanas.
Las concentraciones mínimas de IgG deben medirse y evaluarse junto con la incidencia de la infección. Para reducir la tasa de infecciones bacterianas, puede ser necesario incrementar la dosis a fin de alcanzar concentraciones mínimas más altas.
Inmunodeficiencias secundarias
La dosis recomendada es de 0,2-0,4 g/kg cada tres o cuatro semanas.
Las concentraciones mínimas de IgG deben medirse y evaluarse junto con la incidencia de la infección. La dosis debe ajustarse según sea necesario para lograr una protección óptima contra las infecciones; puede ser necesario un aumento en pacientes con infección persistente; se puede considerar una disminución de la dosis cuando el paciente permanece libre de infección.
Trombocitopenia inmune primaria
Existen dos regímenes alternativos de tratamiento:
- 0,8 - 1 g/kg el primer día; esta dosis puede repetirse una vez en los 3 días siguientes;
- 0,4 g/kg administrados diariamente durante dos a cinco días.
El tratamiento puede repetirse en caso de recidiva.
Síndrome de Guillain-Barré
0,4 g/kg/día durante 5 días (posible repetición de la dosis en caso de recidiva).
Enfermedad de Kawasaki
Deben administrarse 2,0 g/kg como dosis única. Los pacientes deben recibir tratamiento concomitante con ácido acetilsalicílico.
Polineuropatía desmielinizante inflamatoria crónica (PDIC)
Dosis inicial: 2 g/kg en 2-5 días consecutivos.
Dosis de mantenimiento:
1 g/kg durante 1-2 días consecutivos cada 3 semanas.
Se debe evaluar el efecto del tratamiento después de cada ciclo. Si no se observa ningún efecto en el tratamiento después de 6 meses, se debe interrumpir el tratamiento.
Si el tratamiento es efectivo, el tratamiento a largo plazo quedará sujeto al criterio del médico en función de la respuesta del paciente y a la respuesta de mantenimiento. La dosificación y los intervalos pueden tener que ser adaptados según el curso individual de la enfermedad.
Neuropatía motora multifocal (NMM)
Dosis inicial: 2 g/kg administrados durante 2‑5 días consecutivos.
Dosis de mantenimiento: 1 g/kg cada 2 a 4 semanas o 2 g/kg cada 4 a 8 semanas.
El efecto del tratamiento debe ser evaluado después de cada ciclo. Si no se observa ningún efecto en el tratamiento después de 6 meses, se debe interrumpir el tratamiento.
Si el tratamiento es efectivo, el tratamiento a largo plazo quedará sujeto al criterio del médico en función de la respuesta del paciente y a la respuesta de mantenimiento. La dosificación y los intervalos pueden tener que ser adaptados según el curso individual de la enfermedad.
Las dosis recomendadas se resumen en la tabla siguiente:
Indicación | Dosis | Frecuencia de inyecciones |
Terapia de reemplazo: | ||
Síndromes de inmunodeficiencia primaria | Dosis inicial: 0,4 – 0,8 g/kg Dosis de mantenimiento: 0,2 – 0,8 g/kg | cada 3 – 4 semanas |
Inmunodeficiencias secundarias | 0,2 – 0,4 g/kg | cada 3 – 4 semanas |
Inmunomodulación: | ||
Trombocitopenia inmune primaria | 0,8 – 1 g/kg o 0,4 g/kg/d | el día 1, con posibilidad de repetir una vez en un plazo de 3 días durante 2 - 5 días |
Síndrome de Guillain-Barré | 0,4 g/kg/d | durante 5 días |
Enfermedad de Kawasaki | 2 g/kg | en una dosis, asociado a ácido acetilsalicílico |
Polineuropatía desmielinizante inflamatoria crónica (PDIC) | Dosis inicial: 2 g/kg Dosis de mantenimiento: 1 g/kg | en dosis divididas durante 2-5 días cada 3 semanas durante 1-2 días |
Neuropatía motora multifocal (NMM) | Dosis inicial: 2 g/kg Dosis de mantenimiento: 1 g/kg o 2 g/kg | durante 2-5 días consecutivos cada 2-4 semanas o cada 4-8 semanas durante 2-5 días |
Población pediátrica
La posología en niños y adolescentes (0 a 18 años) no es diferente de la de los adultos, puesto que la posología para cada indicación se calcula según el peso corporal y se ajusta a los resultados clínicos de las enfermedades mencionadas anteriormente.
Insuficiencia hepática
No se dispone de datos para que sea necesario un ajuste de la dosis.
Insuficiencia renal
No se necesita ajuste de la dosis, a menos que esté clínicamente justificado.
Pacientes de edad avanzada
No se necesita ajuste de la dosis, a menos que esté clínicamente justificado.
PDIC
Debido a que se trata de una enfermedad rara y, en consecuencia, al bajo número total de pacientes, solamente se dispone de experiencia limitada sobre el uso de inmunoglobulinas intravenosas en niños con PDIC; por tanto, solamente hay disponibles datos de la literatura. Sin embargo, los datos publicados son consistentes en mostrar que el tratamiento con IgIV es igualmente efectivo en adultos y niños, tal como es el caso para las indicaciones ya establecidas de IgIV.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a IG VENA 50 G/L SOLUCION PARA PERFUSIONForma farmacéutica: INYECTABLE PERFUSION, 100 mg/mlPrincipio activo: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: INYECTABLE PERFUSION, 100 mg/mlPrincipio activo: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: INYECTABLE PERFUSION, 100 mg/mlPrincipio activo: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requiere receta
Médicos online para IG VENA 50 G/L SOLUCION PARA PERFUSION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de IG VENA 50 G/L SOLUCION PARA PERFUSION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















